13.3: Mudando o equilíbrio - Princípio de Le Chatelier
- Page ID
- 185333
- Descreva as maneiras pelas quais um sistema de equilíbrio pode ser estressado
- Preveja a resposta de um equilíbrio estressado usando o princípio de Le Chatelier
Como vimos na seção anterior, as reações ocorrem em ambas as direções (os reagentes vão para os produtos e os produtos vão para os reagentes). Podemos dizer que uma reação está em equilíbrio se o quociente de reação (\(Q\)) for igual à constante de equilíbrio (K). Em seguida, abordamos o que acontece quando um sistema em equilíbrio é perturbado de forma que não\(Q\) seja mais igual\(K\) a. Se um sistema em equilíbrio é submetido a uma perturbação ou estresse (como uma mudança na concentração), a posição de equilíbrio muda. Como esse estresse afeta as concentrações dos reagentes e dos produtos, o valor de não\(Q\) será mais igual ao valor de\(K\). Para restabelecer o equilíbrio, o sistema mudará em direção aos produtos (se\(Q < K\)) ou aos reagentes (se\(Q > K\)) até\(Q\) retornar ao mesmo valor de\(K\).
Esse processo é descrito pelo princípio de Le Chatelier: Quando um sistema químico em equilíbrio é perturbado, ele retorna ao equilíbrio ao neutralizar a perturbação. Conforme descrito no parágrafo anterior, a perturbação causa uma mudança\(Q\); a reação mudará para se restabelecer\(Q = K\).
Prevendo a direção de uma reação reversível
O princípio de Le Chatelier pode ser usado para prever mudanças nas concentrações de equilíbrio quando um sistema que está em equilíbrio é submetido a um estresse. No entanto, se tivermos uma mistura de reagentes e produtos que ainda não atingiram o equilíbrio, as mudanças necessárias para alcançar o equilíbrio podem não ser tão óbvias. Nesse caso, podemos comparar os valores de Q e K do sistema para prever as mudanças.
Um sistema químico em equilíbrio pode ser temporariamente desequilibrado adicionando ou removendo um ou mais dos reagentes ou produtos. As concentrações dos reagentes e dos produtos passam então por mudanças adicionais para devolver o sistema ao equilíbrio.
A tensão no sistema na Figura\(\PageIndex{1}\) é a redução da concentração de equilíbrio do SCN − (diminuir a concentração de um dos reagentes faria com que Q fosse maior que K). Como consequência, o princípio de Le Chatelier nos leva a prever que a concentração de Fe (SCN) 2+ deve diminuir, aumentando a concentração de SCN − parcialmente de volta à sua concentração original e aumentando a concentração de Fe 3 + acima de sua inicial concentração de equilíbrio.
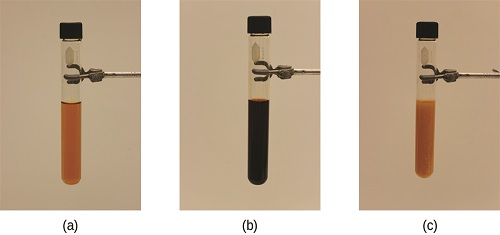
O efeito de uma mudança na concentração em um sistema em equilíbrio é ilustrado ainda mais pelo equilíbrio dessa reação química:
\[\ce{H}_{2(g)}+\ce{I}_{2(g)} \rightleftharpoons \ce{2HI}_{(g)} \label{13.4.1a} \]
\[K_c=\mathrm{50.0 \; at\; 400°C} \label{13.4.1b} \]
Os valores numéricos desse exemplo foram determinados experimentalmente. Uma mistura de gases a 400 °C com\(\mathrm{[H_2] = [I_2]} = 0.221\; M\) e\(\ce{[HI]} = 1.563 \;M\) está em equilíbrio; para esta mistura,\(Q_c = K_c = 50.0\). Se\(\ce{H_2}\) for introduzido no sistema tão rapidamente que sua concentração dobra antes de começar a reagir (nova\(\ce{[H_2]} = 0.442\; M\)), a reação mudará para que um novo equilíbrio seja alcançado, no qual
- \(\ce{[H_2]} = 0.374\; M\),
- \(\ce{[I_2]} = 0.153\; M\), e
- \(\ce{[HI]} = 1.692\; M\).
Isso dá:
\[Q_c=\mathrm{\dfrac{[HI]^2}{[H_2][I_2]}}=\dfrac{(1.692)^2}{(0.374)(0.153)}=50.0=K_c \label{13.4.2} \]
Enfatizamos esse sistema ao introduzir outros\(\ce{H_2}\). O estresse é aliviado quando a reação muda para a direita, consumindo parte (mas não todo) do excesso\(\ce{H_2}\), reduzindo a quantidade de não combinado\(\ce{I_2}\) e formando mais\(\ce{HI}\).
Efeito da mudança na pressão no equilíbrio
Às vezes, podemos mudar a posição de equilíbrio alterando a pressão de um sistema. No entanto, mudanças na pressão têm um efeito mensurável somente em sistemas nos quais gases estão envolvidos e somente quando a reação química produz uma mudança no número total de moléculas de gás no sistema. Uma maneira fácil de reconhecer esse sistema é procurar diferentes números de moles de gás nos lados do reagente e do produto do equilíbrio. Ao avaliar a pressão (bem como fatores relacionados, como volume), é importante lembrar que as constantes de equilíbrio são definidas em relação à concentração (para\(K_c\)) ou pressão parcial (para\(K_P\)). Algumas mudanças na pressão total, como a adição de um gás inerte que não faz parte do equilíbrio, mudarão a pressão total, mas não as pressões parciais dos gases na expressão constante de equilíbrio. Assim, a adição de um gás não envolvido no equilíbrio não perturbará o equilíbrio.
À medida que aumentamos a pressão de um sistema gasoso em equilíbrio, seja diminuindo o volume do sistema ou adicionando mais de um dos componentes da mistura de equilíbrio, introduzimos uma tensão aumentando as pressões parciais de um ou mais dos componentes. De acordo com o princípio de Le Chatelier, uma mudança no equilíbrio que reduz o número total de moléculas por unidade de volume será favorecida porque isso alivia o estresse. A reação inversa seria favorecida por uma diminuição na pressão.
Considere o que acontece quando aumentamos a pressão em um sistema no qual\(\ce{NO}\)\(\ce{O_2}\), e\(\ce{NO_2}\) estão em equilíbrio:
\[\ce{2NO (g) + O2(g) \rightleftharpoons 2NO2(g)} \label{13.4.3} \]
A formação de quantidades adicionais de\(\ce{NO2}\) diminui o número total de moléculas no sistema porque cada vez que duas moléculas se\(\ce{NO_2}\) formam, um total de três moléculas de\(\ce{NO}\) e\(\ce{O_2}\) são consumidas. Isso reduz a pressão total exercida pelo sistema e reduz, mas não alivia completamente, o estresse do aumento da pressão. Por outro lado, uma diminuição na pressão no sistema favorece a decomposição de\(\ce{NO_2}\)\(\ce{NO}\) e\(\ce{O_2}\), o que tende a restaurar a pressão.
Agora, considere esta reação:
\[\ce{N2 (g) + O2 (g) \rightleftharpoons 2NO (g)} \label{13.4.4} \]
Como não há alteração no número total de moléculas no sistema durante a reação, uma mudança na pressão não favorece nem a formação nem a decomposição do monóxido de nitrogênio gasoso.
Efeito da mudança de temperatura no equilíbrio
A mudança de concentração ou pressão perturba um equilíbrio porque o quociente de reação é afastado do valor de equilíbrio. Alterar a temperatura de um sistema em equilíbrio tem um efeito diferente: uma mudança na temperatura realmente altera o valor da constante de equilíbrio. No entanto, podemos prever qualitativamente o efeito da mudança de temperatura tratando-a como um estresse no sistema e aplicando o princípio de Le Chatelier.
Quando o hidrogênio reage com o iodo gasoso, o calor evolui.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g) } \;\;\ ΔH=\mathrm{−9.4\;kJ\;(exothermic)} \label{13.4.5} \]
Como essa reação é exotérmica, podemos escrevê-la com calor como um produto.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g)} + \text{heat} \label{13.4.6} \]
Aumentar a temperatura da reação aumenta a energia interna do sistema. Assim, aumentar a temperatura tem o efeito de aumentar a quantidade de um dos produtos dessa reação. A reação muda para a esquerda para aliviar o estresse, e há um aumento na concentração de\(\ce{H2}\) e\(\ce{I2}\) e uma redução na concentração de\(\ce{HI}\). Diminuir a temperatura desse sistema reduz a quantidade de energia presente, favorece a produção de calor e favorece a formação de iodeto de hidrogênio.
Quando mudamos a temperatura de um sistema em equilíbrio, a constante de equilíbrio da reação muda. Diminuir a temperatura no\(\ce{HI}\) sistema aumenta a constante de equilíbrio: No novo equilíbrio, a concentração de\(\ce{HI}\) aumentou e as concentrações de\(\ce{H2}\) e\(\ce{I2}\) diminuíram. O aumento da temperatura diminui o valor da constante de equilíbrio, de 67,5 a 357 °C para 50,0 a 400 °C.
A temperatura afeta o equilíbrio entre\(\ce{NO_2}\) e\(\ce{N_2O_4}\) nesta reação
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)}\;\;\; ΔH=\mathrm{57.20\; kJ} \label{13.4.7} \]
O valor positivo de ΔH nos diz que a reação é endotérmica e pode ser escrita
\[\text{heat}+\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.4.8} \]
Em temperaturas mais altas, a mistura gasosa tem uma cor marrom profunda, indicativa de uma quantidade significativa de\(\ce{NO_2}\) moléculas marrons. Se, no entanto, pressionarmos o sistema resfriando a mistura (retirando energia), o equilíbrio muda para a esquerda para fornecer parte da energia perdida pelo resfriamento. A concentração de incolor\(\ce{N_2O_4}\) aumenta e a concentração de marrom\(\ce{NO_2}\) diminui, fazendo com que a cor marrom desapareça.
Os catalisadores não afetam o equilíbrio
Como aprendemos durante nosso estudo de cinética, um catalisador pode acelerar a taxa de uma reação. Embora esse aumento na taxa de reação possa fazer com que um sistema alcance o equilíbrio mais rapidamente (acelerando as reações direta e reversa), um catalisador não tem efeito sobre o valor de uma constante de equilíbrio nem sobre as concentrações de equilíbrio.
A interação de mudanças na concentração ou pressão, temperatura e a falta de influência de um catalisador em um equilíbrio químico é ilustrada na síntese industrial de amônia a partir de nitrogênio e hidrogênio, de acordo com a equação
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.9} \]
Uma grande quantidade de amônia é fabricada por essa reação. A cada ano, a amônia está entre os 10 principais produtos químicos, em massa, fabricados no mundo. Cerca de 2 bilhões de libras são fabricadas nos Estados Unidos a cada ano. A amônia desempenha um papel vital em nossa economia global. É usado na produção de fertilizantes e é, por si só, um fertilizante importante para o cultivo de milho, algodão e outras culturas. Grandes quantidades de amônia são convertidas em ácido nítrico, que desempenha um papel importante na produção de fertilizantes, explosivos, plásticos, corantes e fibras, e também é usado na indústria siderúrgica.
Haber nasceu em Breslau, Prússia (atualmente Wroclaw, Polônia) em dezembro de 1868. Ele passou a estudar química e, enquanto estava na Universidade de Karlsruhe, desenvolveu o que mais tarde seria conhecido como o processo Haber: a formação catalítica de amônia a partir do hidrogênio e do nitrogênio atmosférico sob altas temperaturas e pressões.

Por este trabalho, Haber recebeu o Prêmio Nobel de Química de 1918 pela síntese de amônia a partir de seus elementos. O processo Haber foi um benefício para a agricultura, pois permitiu que a produção de fertilizantes não dependesse mais dos estoques de ração extraídos, como o nitrato de sódio.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \nonumber \]
Atualmente, a produção anual de fertilizantes nitrogenados sintéticos ultrapassa 100 milhões de toneladas e a produção de fertilizantes sintéticos aumentou o número de humanos que a terra arável pode sustentar de 1,9 pessoas por hectare em 1908 para 4,3 em 2008. A disponibilidade de nitrogênio é um forte fator limitante ao crescimento das plantas. Apesar de representar 78% do ar, o nitrogênio diatômico (\(\ce{N_2}\)) não está nutricionalmente disponível devido à enorme estabilidade da ligação tripla nitrogênio-nitrogênio. Para que as plantas usem o nitrogênio atmosférico, o nitrogênio deve ser convertido em uma forma mais biodisponível (essa conversão é chamada de fixação de nitrogênio).
Além de seu trabalho na produção de amônia, Haber também é lembrado pela história como um dos pais da guerra química. Durante a Primeira Guerra Mundial, ele desempenhou um papel importante no desenvolvimento de gases venenosos usados na guerra de trincheiras. Sobre seu papel nesses desenvolvimentos, Haber disse: “Em tempos de paz, um cientista pertence ao mundo, mas durante a guerra ele pertence ao seu país”. 1 Haber defendeu o uso da guerra de gás contra acusações de que era desumana, dizendo que morte era morte, por qualquer meio que fosse infligida. Ele é um exemplo dos dilemas éticos que os cientistas enfrentam em tempos de guerra e da natureza de dois gumes da espada da ciência.
Como o Haber, os produtos feitos de amônia podem ser multifacetados. Além de seu valor para a agricultura, os compostos de nitrogênio também podem ser usados para atingir fins destrutivos. O nitrato de amônio também tem sido usado em explosivos, incluindo dispositivos explosivos improvisados. O nitrato de amônio foi um dos componentes da bomba usada no ataque ao Edifício Federal Alfred P. Murrah, no centro de Oklahoma City, em 19 de abril de 1995.
Há muito se sabe que o nitrogênio e o hidrogênio reagem para formar amônia. No entanto, tornou-se possível fabricar amônia em quantidades úteis pela reação de nitrogênio e hidrogênio somente no início do século XX, após a compreensão dos fatores que influenciam seu equilíbrio.
Para ser prático, um processo industrial deve fornecer um grande rendimento do produto de forma relativamente rápida. Uma forma de aumentar o rendimento de amônia é aumentar a pressão no sistema em que N 2, H 2 e NH 3 estão em equilíbrio ou estão chegando ao equilíbrio.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.10} \]
A formação de quantidades adicionais de amônia reduz a pressão total exercida pelo sistema e reduz um pouco o estresse do aumento da pressão.
Embora o aumento da pressão de uma mistura de N 2, H 2 e NH 3 aumente o rendimento de amônia, em baixas temperaturas, a taxa de formação de amônia é lenta. Em temperatura ambiente, por exemplo, a reação é tão lenta que, se preparássemos uma mistura de N 2 e H 2, nenhuma quantidade detectável de amônia se formaria durante nossa vida. A formação de amônia a partir de hidrogênio e nitrogênio é um processo exotérmico:
\[\ce{N2(g) + 3H2(g) \rightarrow 2NH3(g)} \;\;\; ΔH=\mathrm{−92.2\; kJ} \label{13.4.11} \]
Assim, aumentar a temperatura para aumentar a taxa diminui o rendimento. Se baixarmos a temperatura para mudar o equilíbrio e favorecer a formação de mais amônia, o equilíbrio é alcançado mais lentamente devido à grande diminuição da taxa de reação com a diminuição da temperatura.
Parte da taxa de formação perdida ao operar em temperaturas mais baixas pode ser recuperada usando um catalisador. O efeito líquido do catalisador na reação é fazer com que o equilíbrio seja alcançado mais rapidamente. Na produção comercial de amônia, condições de cerca de 500 °C, 150 a 900 atm e a presença de um catalisador são usadas para oferecer o melhor compromisso entre a taxa, o rendimento e o custo do equipamento necessário para produzir e conter gases de alta pressão em altas temperaturas (Figura\(\PageIndex{2}\)).
Resumo
Sistemas em equilíbrio podem ser perturbados por mudanças na temperatura, concentração e, em alguns casos, volume e pressão; mudanças de volume e pressão perturbarão o equilíbrio se o número de moles de gás for diferente nos lados do reagente e do produto da reação. A resposta do sistema a esses distúrbios é descrita pelo princípio de Le Chatelier: O sistema responderá de uma forma que neutralize a perturbação. Nem todas as mudanças no sistema resultam em uma perturbação do equilíbrio. A adição de um catalisador afeta as taxas das reações, mas não altera o equilíbrio, e a alteração da pressão ou do volume não perturbará significativamente os sistemas sem gases ou com números iguais de moles de gás no lado do reagente e do produto.
| Perturbação | Mudança observada à medida que o equilíbrio é restaurado | Direção da mudança | Efeito em K |
|---|---|---|---|
| reagente adicionado | o reagente adicionado é parcialmente consumido | em direção a produtos | nenhum |
| produto adicionado | o produto adicionado é parcialmente consumido | em direção a reagentes | nenhum |
| diminuição no volume/aumento na pressão do gás | a pressão diminui | para um lado com menos moles de gás | nenhum |
| aumento no volume/diminuição na pressão do gás | aumentos de pressão | para o lado com mais moles de gás | nenhum |
| aumento de temperatura | o calor é absorvido | em direção a produtos endotérmicos, em direção a reagentes exotérmicos | trocas |
| diminuição da temperatura | o calor é liberado | em direção a reagentes endotérmicos, em direção a produtos exotérmicos | trocas |
Notas de pé
- Herrlich, P. “A responsabilidade do cientista: o que a história pode nos ensinar sobre como os cientistas devem lidar com pesquisas que têm o potencial de causar danos?” Relatórios EMBO 14 (2013): 759—764.
Glossário
- Princípio de Le Chatelier
- quando um sistema químico em equilíbrio é perturbado, ele retorna ao equilíbrio ao neutralizar a perturbação
- posição de equilíbrio
- concentrações ou pressões parciais dos componentes de uma reação em equilíbrio (comumente usado para descrever condições antes de uma perturbação)
- estresse
- mudança nas condições de uma reação que pode causar uma mudança no equilíbrio


