13.4: Cálculos de equilíbrio
- Page ID
- 185377
- Escreva equações representando mudanças na concentração e pressão para espécies químicas em sistemas de equilíbrio
- Use álgebra para realizar vários tipos de cálculos de equilíbrio
Sabemos que em equilíbrio, o valor do quociente de reação de qualquer reação é igual à sua constante de equilíbrio. Assim, podemos usar a expressão matemática para Q para determinar um número de quantidades associadas a uma reação em equilíbrio ou que se aproxima do equilíbrio. Embora tenhamos aprendido a identificar em qual direção uma reação mudará para alcançar o equilíbrio, queremos estender esse entendimento aos cálculos quantitativos. Fazemos isso avaliando as maneiras pelas quais as concentrações de produtos e reagentes mudam à medida que uma reação se aproxima do equilíbrio, tendo em mente as razões estequiométricas da reação. Essa abordagem algébrica para cálculos de equilíbrio será explorada nesta seção.
Mudanças nas concentrações ou pressões de reagentes e produtos ocorrem quando um sistema de reação se aproxima do equilíbrio. Nesta seção, veremos que podemos relacionar essas mudanças entre si usando os coeficientes na equação química balanceada que descreve o sistema. Usamos a decomposição da amônia como exemplo.
No aquecimento, a amônia se decompõe reversivelmente em nitrogênio e hidrogênio de acordo com esta equação:
\[\ce{2NH3}(g)⇌\ce{N2}(g)+\ce{3H2}(g) \nonumber \]
Se uma amostra de amônia se decompõe em um sistema fechado e a concentração de N 2 aumenta em 0,11 M, a mudança na concentração de N 2, Δ[ N 2], a concentração final menos a concentração inicial, é 0,11 M. A mudança é positiva porque a concentração de N 2 aumenta.
A mudança na concentração de H 2, Δ[ H 2], também é positiva — a concentração de H 2 aumenta à medida que a amônia se decompõe. A equação química nos diz que a mudança na concentração de H 2 é três vezes a mudança na concentração de N 2 porque para cada mol de N 2 produzido, 3 moles de H 2 são produzidos.
\[ \begin{align*} \ce{Δ[H2]} &=3×\ce{Δ[N2]} \\[4pt] &=3×(0.11\:M) \\[4pt] &=0.33\:M \end{align*} \nonumber \]
A mudança na concentração de NH 3, Δ[ NH 3], é o dobro de Δ[ N 2]; a equação indica que 2 moles de NH 3 devem se decompor para cada mol de N 2 formado. No entanto, a mudança na concentração de NH 3 é negativa porque a concentração de amônia diminui à medida que ela se decompõe.
\[ \begin{align*} Δ[\ce{NH3}] &=−2×Δ[\ce{N2}] \\[4pt] &=−2×(0.11\:M) \\[4pt] &=−0.22\:M \end{align*} \nonumber \]
Podemos relacionar essas relações diretamente com os coeficientes na equação.
\ [\ begin {align}
&\ phantom {Δ[ NH3}\ ce {2NH3} (g)
&&&&\ fantasma {Δ[ N2}\ ce {N2} (g)
&&+
&&\ fantasma {Δ[ H2]}\ ce {3H2} (g)\\
&Δ[\ ce {NH3}] =−2×Δ[\ ce {N2}] && && Δ[\ ce {N2}] =0,11\ :M && amp; && Δ[\ ce {H2}] =3×Δ[\ ce {N2}]
\ end {align}\ nonumber\]
Observe que todas as alterações em um lado das setas são do mesmo sinal e que todas as alterações no outro lado das setas são do sinal oposto.
Se não soubéssemos a magnitude da mudança na concentração de N 2, poderíamos representá-la pelo símbolo x.
As mudanças nas outras concentrações seriam então representadas como:
\(Δ[\ce{H2}]=3×Δ[\ce{N2}]=3x\)
Os coeficientes nos termos δ são idênticos aos da equação balanceada da reação.
\ (\ begin {alignat} {3}
&\ ce {2NH3} (g)\ :&&\ ce {N2} (g) +\ :&&\ ce {3H2} (g)\\
&−2x &&&x &&3x
\ end {alignat}\)
A maneira mais simples de encontrarmos os coeficientes para as mudanças de concentração em qualquer reação é usar os coeficientes na equação química balanceada. O sinal do coeficiente é positivo quando a concentração aumenta; é negativo quando a concentração diminui.
Complete as mudanças nas concentrações para cada uma das seguintes reações.
(a)\ (\ begin {alignat} {3}
&\ ce {C2H2} (g) +\ :&&\ ce {2Br2} (g)\ :&&\ ce {C2H2Br4} (g)\\
&x &&\ sublinhado {\ hspace {40px}} &&\ sublinhado {\ hspace {40px}}
\ end {alignat em}\)
(b)\ (\ begin {alignat} {3}
&\ ce {I2} (aq) +\ :&&\ ce {I-} (aq)\ :&&\ ce {I3-} (aq)\\
&\ sublinhado {\ hspace {40px}} &&\ sublinhado {\ hspace {40px}} &&x
\ end {alignat})
(c)\ (\ begin {alignat} {3}
&\ ce {C3H8} (g) +\ :&&\ ce {5O2} (g)\ :&&\ ce {3CO2} (g) +\ :&&\ ce {4H2O} (g)\\
&x &&\ underline {\ hspace {40px}} &&\ underline {\ hspace {40px}} &&\ underline {\ hspace {40px}}
\ end {alignat}\)
Solução SS
(a)\ (\ begin {alignat} {3}
&\ ce {C2H2} (g) +\ :&&\ ce {2Br2} (g)\ :&&\ ce {C2H2Br4} (g)\\
&x &&&2x &&&-x
\ end {alignat}\)
(b)\ (\ begin {alignat} {3}
&\ ce {I2} (aq) +\ :&&\ ce {I-} (aq)\ :&&\ ce {I3-} (aq)\\
&-x &&-x &&x
\ end {alignat}\)
(c)\ (\ begin {alignat} {3}
&\ ce {C3H8} (g) +\ :&&\ ce {5O2} (g)\ :&&\ ce {3CO2} (g) +\ :&&\ ce {4H2O} (g)\\
&x &&&5x &&-3x &&-4x
\ end {alignat})
Complete as mudanças nas concentrações para cada uma das seguintes reações:
(a)\ (\ begin {alignat} {3}
&\ ce {2SO2} (g) +\ :&&\ ce {O2} (g)\ :&&\ ce {2SO3} (g)\\
&\ sublinhado {\ hspace {40px}} &&x &&\ sublinhado {\ hspace {40px}}
\ end {alignat}\)
(b)\ (\ begin {alignat} {3}
&\ ce {C4H8} (g)\ :&&\ ce {2C2H4} (g)\\
&\ sublinhado {\ hspace {40px}} &&-2x
\ end {alignat}\)
(c)\ (\ begin {alignat} {3}
&\ ce {4NH3} (g) +\ :&&\ ce {7H2O} (g)\ :&&\ ce {4NO2} (g) +\ :&&\ ce {6H2O} (g)\\
&\ sublinhado {\ hspace {40px}} &&\ sublinhado\ hspace {40px}} &&\ underline {\ hspace {40px}} &&\ underline {\ hspace {40px}}
\ end { alinhar}\)
- Responda a um
-
2 x, x, −2 x
- Resposta b
-
x, −2 x
- Resposta c
-
4 x, 7 x, −4 x, −6 x ou −4 x, −7 x, 4 x, 6 x
Cálculos envolvendo concentrações de equilíbrio
Como o valor do quociente de reação de qualquer reação em equilíbrio é igual à sua constante de equilíbrio, podemos usar a expressão matemática para Q c (ou seja, a lei da ação de massa) para determinar um número de quantidades associadas a uma reação em equilíbrio. Pode ajudar se tivermos em mente que Q c = K c (em equilíbrio) em todas essas situações e que existem apenas três tipos básicos de cálculos:
- Cálculo de uma constante de equilíbrio. Se as concentrações de reagentes e produtos em equilíbrio forem conhecidas, o valor da constante de equilíbrio para a reação pode ser calculado.
- Cálculo das concentrações de equilíbrio faltantes. Se o valor da constante de equilíbrio e todas as concentrações de equilíbrio, exceto uma, forem conhecidos, a concentração restante poderá ser calculada.
- Cálculo das concentrações de equilíbrio a partir das concentrações iniciais. Se o valor da constante de equilíbrio e um conjunto de concentrações de reagentes e produtos que não estão em equilíbrio forem conhecidos, as concentrações em equilíbrio podem ser calculadas.
Uma lista semelhante pode ser gerada usando Q P, K P e pressão parcial. Analisaremos a solução de cada um desses casos em sequência.
Cálculo de uma constante de equilíbrio
Como a lei da ação em massa é a única equação que temos para descrever a relação entre K c e as concentrações de reagentes e produtos, qualquer problema que exija que resolvamos K c deve fornecer informações suficientes para determinar o reagente e concentrações do produto em equilíbrio. Armados com as concentrações, podemos resolver a equação de K c, pois será a única incógnita.
O exemplo nos\(\PageIndex{1}\) mostrou como determinar a constante de equilíbrio de uma reação se soubermos as concentrações de reagentes e produtos em equilíbrio. O exemplo a seguir mostra como usar a estequiometria da reação e uma combinação de concentrações iniciais e concentrações de equilíbrio para determinar uma constante de equilíbrio. Essa técnica, comumente chamada de tabela ICE — para I nitial, C Change e E equilibrium — será útil na solução de muitos problemas de equilíbrio. Um gráfico é gerado começando com a reação de equilíbrio em questão. Abaixo da reação, as concentrações iniciais dos reagentes e produtos são listadas — essas condições geralmente são fornecidas no problema e consideramos que nenhuma mudança em direção ao equilíbrio ocorreu. A próxima linha de dados é a mudança que ocorre à medida que o sistema muda em direção ao equilíbrio — não se esqueça de considerar a estequiometria da reação, conforme descrito na seção anterior deste capítulo. A última linha contém as concentrações quando o equilíbrio é alcançado.
As moléculas de iodo reagem reversivelmente com os íons iodeto para produzir íons triiodeto.
\[\ce{I2}(aq)+\ce{I-}(aq)⇌\ce{I3-}(aq) \nonumber \]
Se uma solução com as concentrações de I 2 e I − ambas iguais a 1.000 × 10 −3 M antes da reação fornece uma concentração de equilíbrio de I 2 de 6,61 × 10 −4 M, qual é a constante de equilíbrio para a reação?
Solução
Começaremos esse problema calculando as mudanças na concentração à medida que o sistema se equilibra. Em seguida, determinamos as concentrações de equilíbrio e, finalmente, a constante de equilíbrio. Primeiro, montamos uma tabela com as concentrações iniciais, as mudanças nas concentrações e as concentrações de equilíbrio usando − x como a mudança na concentração de I 2.
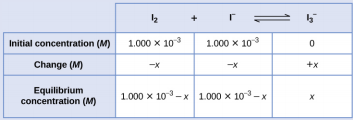
Como a concentração de equilíbrio de I 2 é dada, podemos resolver x. Em equilíbrio, a concentração de I 2 é 6,61 × 10 −4 M, de modo que
\(1.000×10^{−3}−x=6.61×10^{−4}\)
\(x=1.000×10^{−3}−6.61×10^{−4}\)
\(=3.39×10^{−4}\:M\)
Agora podemos preencher a tabela com as concentrações em equilíbrio.

Agora calculamos o valor da constante de equilíbrio.
\(K_c=Q_c=\ce{\dfrac{[I3- ]}{[I2][I- ]}}\)
\(=\dfrac{3.39×10^{−4}\:M}{(6.61×10^{−4}\:M)(6.61×10^{−4}\:M)}=776\)
O etanol e o ácido acético reagem e formam água e acetato de etila, o solvente responsável pelo odor de alguns removedores de esmalte.
\(\ce{C2H5OH + CH3CO2H ⇌ CH3CO2C2H5 + H2O}\)
Quando 1 mol de C 2 H 5 OH e CH 3 CO 2 H podem reagir em 1 L do solvente dioxano, o equilíbrio é estabelecido quando o\(\dfrac{1}{3}\) mol de cada um dos reagentes permanece. Calcule a constante de equilíbrio para a reação. (Nota: A água não é um solvente nessa reação.)
- Resposta
-
K c = 4
Cálculo de uma concentração de equilíbrio ausente
Se soubermos a constante de equilíbrio de uma reação e conhecermos as concentrações em equilíbrio de todos os reagentes e produtos, exceto um, podemos calcular a concentração que falta.
Os óxidos de nitrogênio são poluentes atmosféricos produzidos pela reação de nitrogênio e oxigênio em altas temperaturas. A 2000 °C, o valor da constante de equilíbrio para a reação,\(\ce{N2}(g)+\ce{O2}(g)⇌\ce{2NO}(g)\), é 4,1 × 10 −4. Encontre a concentração de NO (g) em uma mistura de equilíbrio com o ar a 1 atm de pressão nesta temperatura. No ar, [N 2] = 0,036 mol/L e [O 2] 0,0089 mol/L.
Solução
Recebemos todas as concentrações de equilíbrio, exceto a de NO. Assim, podemos resolver a falta de concentração de equilíbrio reorganizando a equação para a constante de equilíbrio.
\(K_c=Q_c=\ce{\dfrac{[NO]^2}{[N2][O2]}}\)
\(\ce{[NO]^2}=K_c\ce{[N2][O2]}\)
\(\ce{[NO]}=\sqrt{K_c\ce{[N2][O2]}}\)
\(=\sqrt{(4.1×10^{−4})(0.036)(0.0089)}\)
\(=\sqrt{1.31×10^{−7}}\)
\(=3.6×10^{−4}\)
Assim, [NO] é 3,6 × 10 −4 mol/L em equilíbrio nessas condições.
Podemos verificar nossa resposta substituindo todas as concentrações de equilíbrio na expressão pelo quociente de reação para ver se ele é igual à constante de equilíbrio.
\[ \begin{align*} Q_c=\ce{\dfrac{[NO]^2}{[N2][O2]}} \\[4pt] &=\dfrac{(3.6×10^{−4})^2}{(0.036)(0.0089)} \\[4pt] &=4.0×10^{−4}=K_c \end{align*} \nonumber \]
A resposta é verificada; nosso valor calculado fornece a constante de equilíbrio dentro do erro associado aos números significativos do problema.
A constante de equilíbrio para a reação de nitrogênio e hidrogênio para produzir amônia a uma determinada temperatura é 6,00 × 10 −2. Calcule a concentração de equilíbrio de amônia se as concentrações de equilíbrio de nitrogênio e hidrogênio forem 4,26 M e 2,09 M, respectivamente.
- Resposta
-
1,53 mol/L
Cálculo das mudanças na concentração
Se soubermos a constante de equilíbrio de uma reação e um conjunto de concentrações de reagentes e produtos que não estão em equilíbrio, podemos calcular as mudanças nas concentrações à medida que o sistema chega ao equilíbrio, bem como as novas concentrações em equilíbrio. O procedimento típico pode ser resumido em quatro etapas.
- Determine a direção em que a reação prossegue para atingir o equilíbrio.
- Escreva uma equação química balanceada para a reação.
- Se a direção na qual a reação deve prosseguir para atingir o equilíbrio não for óbvia, calcule Q c a partir das concentrações iniciais e compare com K c para determinar a direção da mudança.
- Determine as mudanças relativas necessárias para alcançar o equilíbrio e, em seguida, escreva as concentrações de equilíbrio em termos dessas mudanças.
- Defina as mudanças nas concentrações iniciais necessárias para que a reação alcance o equilíbrio. Geralmente, representamos a menor mudança com o símbolo x e expressamos as outras mudanças em termos da menor alteração.
- Defina as concentrações de equilíbrio que faltam em termos das concentrações iniciais e das mudanças na concentração determinadas em (a).
- Resolva a mudança e as concentrações de equilíbrio.
- Substitua as concentrações de equilíbrio na expressão pela constante de equilíbrio, resolva x e verifique quaisquer suposições usadas para encontrar x.
- Calcule as concentrações de equilíbrio.
- Verifique a aritmética.
- Verifique as concentrações de equilíbrio calculadas substituindo-as na expressão de equilíbrio e determinando se elas fornecem a constante de equilíbrio.
Às vezes, uma etapa específica pode variar de problema para problema — ela pode ser mais complexa em alguns problemas e menos complexa em outros. No entanto, todo cálculo das concentrações de equilíbrio a partir de um conjunto de concentrações iniciais envolverá essas etapas.
Ao resolver problemas de equilíbrio que envolvem mudanças na concentração, às vezes é conveniente montar uma tabela ICE, conforme descrito na seção anterior.
Sob certas condições, a constante de equilíbrio para a decomposição de pCl 5 (g) em pCl 3 (g) e Cl 2 (g) é 0,0211. Quais são as concentrações de equilíbrio de pCl 5, pCl 3 e Cl 2 se a concentração inicial de pCl 5 fosse 1,00 M?
Solução
Use o processo passo a passo descrito anteriormente.
- A equação balanceada para a decomposição de PCl 5 é
\(\ce{PCl5}(g)⇌\ce{PCl3}(g)+\ce{Cl2}(g)\)
Como não temos produtos inicialmente, Q c = 0 e a reação prosseguirá para a direita.
- Vamos representar o aumento na concentração de pCl 3 pelo símbolo x. As outras mudanças podem ser escritas em termos de x considerando os coeficientes na equação química.
\ (\ begin {alignat} {3}
&\ ce {PCl5} (g)\ :&&\ ce {PCl3} (g) +\ :&&\ ce {Cl2} (g)\\
&-x &&x &&x
\ end {alignat}\) -
As mudanças na concentração e as expressões para as concentrações de equilíbrio são:

Essa tabela tem duas colunas principais e quatro linhas. A primeira linha da primeira coluna não tem um título e, em seguida, tem o seguinte na primeira coluna: Concentração inicial (M), Mudança (M), Concentração de equilíbrio (M). A segunda coluna tem o cabeçalho “P C l subscrito 5 seta de equilíbrio P C l subscrito 3 mais C l subscrito 2”. Sob a segunda coluna, há um subgrupo de três linhas e três colunas. A primeira coluna tem o seguinte: 1,00, x negativo, 1,00 menos x. A segunda coluna tem o seguinte: 0, x positivo, 0 mais x é igual a x. A terceira coluna tem o seguinte: 0, positivo x, 0 mais x é igual a x. - Substituindo as concentrações de equilíbrio na equação da constante de equilíbrio fornece
\(K_c=\ce{\dfrac{[PCl3][Cl2]}{[PCl5]}}=0.0211\)\(=\dfrac{(x)(x)}{(1.00−x)}\)
Essa equação contém apenas uma variável, x, a mudança na concentração. Podemos escrever a equação como uma equação quadrática e resolver x usando a fórmula quadrática.
\(0.0211=\dfrac{(x)(x)}{(1.00−x)}\)\(0.0211(1.00−x)=x^2\)\(x^2+0.0211x−0.0211=0\)Uma equação na forma ax 2 + bx + c = 0 pode ser rearranjada para resolver x:
\(x=\dfrac{−b±\sqrt{b^2−4ac}}{2a}\)Nesse caso, a = 1, b = 0,0211 e c = −0,0211. Substituindo os valores apropriados por a, b e c resulta em:
\(x=\dfrac{−0.0211±\sqrt{(0.0211)^2−4(1)(−0.0211)}}{2(1)}\)\(=\dfrac{−0.0211±\sqrt{(4.45×10^{−4})+(8.44×10^{−2})}}{2}\)\(=\dfrac{−0.0211±0.291}{2}\)Conseqüentemente
\(x=\dfrac{−0.0211+0.291}{2}=0.135\)ou
\(x=\dfrac{−0.0211−0.291}{2}=−0.156\)As equações quadráticas geralmente têm duas soluções diferentes, uma que é fisicamente possível e outra fisicamente impossível (uma raiz estranha). Nesse caso, a segunda solução (−0,156) é fisicamente impossível porque sabemos que a mudança deve ser um número positivo (caso contrário, acabaríamos com valores negativos para as concentrações dos produtos). Assim, x = 0,135 M.
As concentrações de equilíbrio são
\(\ce{[PCl5]}=1.00−0.135=0.87\:M\)
\(\ce{[PCl3]}=x=0.135\:M\)
\(\ce{[Cl2]}=x=0.135\:M\) - A substituição na expressão de K c (para verificar o cálculo) dá
\(K_c=\ce{\dfrac{[PCl3][Cl2]}{[PCl5]}}=\dfrac{(0.135)(0.135)}{0.87}=0.021\)
A constante de equilíbrio calculada a partir das concentrações de equilíbrio é igual ao valor de K c dado no problema (quando arredondado para o número adequado de números significativos). Assim, a verificação das concentrações de equilíbrio calculadas.
O ácido acético, CH 3 CO 2 H, reage com o etanol, C 2 H 5 OH, para formar água e acetato de etila, CH 3 CO 2 C 2 H 5.
\[\ce{CH3CO2H + C2H5OH ⇌ CH3CO2C2H5 + H2O} \nonumber \]
A constante de equilíbrio para essa reação com dioxano como solvente é 4,0. Quais são as concentrações de equilíbrio quando uma mistura é 0,15 M em CH 3 CO 2 H, 0,15 M em C 2 H 5 OH, 0,40 M em CH 3 CO 2 C 2 H 5 e 0,40 M em H 2 O são misturados em dioxano suficiente para fazer 1,0 L de solução?
- Resposta
-
[CH 3 CO 2 H] = 0,36 M, [C 2 H 5 OH] = 0,36 M, [CH 3 CO 2 C 2 H 5] = 0,17 M, [H 2 O] = 0,17 M
Um frasco de 1,00 L é preenchido com 1,00 moles de H 2 e 2,00 moles de I 2. O valor da constante de equilíbrio para a reação de hidrogênio e iodo reagindo para formar iodeto de hidrogênio é 50,5 sob as condições dadas. Quais são as concentrações de equilíbrio de H 2, I 2 e HI em moles/L?
\[\ce{H2}(g)+\ce{I2}(g)\rightleftharpoons\ce{2HI}(g) \nonumber \]
- Resposta
-
[H 2] = 0,06 M, [I 2] = 1,06 M, [HI] = 1,88 M
Às vezes, é possível usar o insight químico para encontrar soluções para problemas de equilíbrio sem realmente resolver uma equação quadrática (ou mais complicada). Primeiro, no entanto, é útil verificar se o equilíbrio pode ser obtido a partir de dois extremos: todos (ou principalmente) reagentes e todos (ou principalmente) produtos.
Considere a ionização de 0,150 M HA, um ácido fraco.
A maneira mais óbvia de determinar as concentrações de equilíbrio seria começar apenas com reagentes. Isso poderia ser chamado de ponto de partida “todos os reagentes”. Usando x para a quantidade de ácido ionizado em equilíbrio, esta é a tabela e a solução ICE.

Configurar e resolver a equação quadrática fornece
Usando a raiz positiva (física), as concentrações de equilíbrio são
Uma maneira menos óbvia de resolver o problema seria supor que todo o HA se ioniza primeiro, depois o sistema chega ao equilíbrio. Isso poderia ser chamado de ponto de partida para “todos os produtos”. Supondo que todo o HA ionize dá
Usando-as como concentrações iniciais e “y” para representar a concentração de HA em equilíbrio, esta é a tabela ICE para esse ponto de partida.
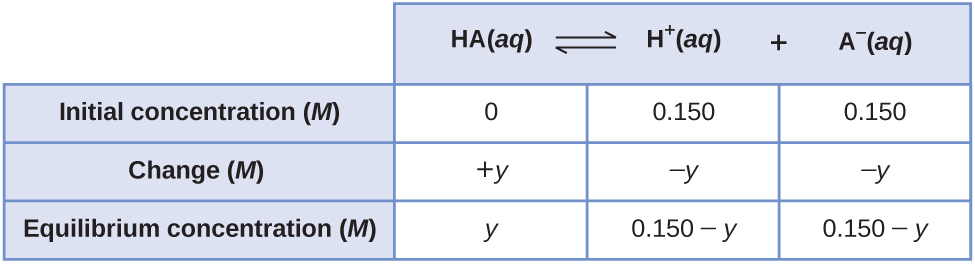
Configurar e resolver a equação quadrática fornece
Guarde alguns números extras significativos para minimizar os problemas de arredondamento.
O arredondamento de cada solução para três números significativos dá
O uso da raiz fisicamente significativa (0,140 M) fornece as concentrações de equilíbrio como
Assim, as duas abordagens fornecem os mesmos resultados (até três casas decimais) e mostram que os dois pontos de partida levam às mesmas condições de equilíbrio. O ponto de partida “todo o reagente” resultou em uma mudança relativamente pequena (x) porque o sistema estava próximo do equilíbrio, enquanto o ponto de partida “todo o produto” teve uma mudança relativamente grande (y) que era quase do tamanho das concentrações iniciais. Pode-se dizer que um sistema que começa “próximo” do equilíbrio exigirá apenas uma “pequena” mudança nas condições (x) para alcançar o equilíbrio.
Lembre-se de que um pequeno K c significa que muito pouco dos reagentes formam produtos e um grande K c significa que a maioria dos reagentes forma produtos. Se o sistema puder ser organizado de forma que comece “próximo” do equilíbrio, então se a mudança (x) for pequena em comparação com qualquer concentração inicial, ela poderá ser negligenciada. Pequeno geralmente é definido como resultando em um erro de menos de 5%. Os dois exemplos a seguir demonstram isso.
Quais são as concentrações em equilíbrio de uma solução de 0,15 M de HCN?
\[\ce{HCN}(aq)⇌\ce{H+}(aq)+\ce{CN-}(aq) \hspace{20px} K_c=4.9×10^{−10} \nonumber \]
Solução em
Usar “x” para representar a concentração de cada produto em equilíbrio fornece esta tabela ICE.
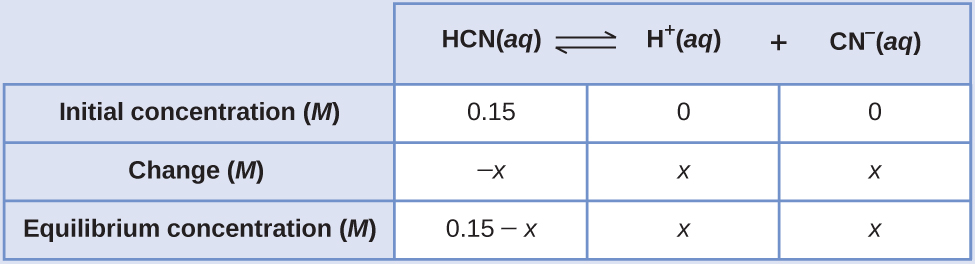
A solução exata pode ser obtida usando a fórmula quadrática com
\[K_c=\dfrac{(x)(x)}{0.15−x} \nonumber \]
dissolvendo
\[x^2+4.9×10^{−10}−7.35×10^{−11}=0 \nonumber \]
\[x=8.56×10^{−6}\:M\textrm{ (3 sig. figs.)}=8.6×10^{−6}\:M\textrm{ (2 sig. figs.)} \nonumber \]
Assim, [H +] = [CN —] = x = 8,6 × 10 —6 M e [HCN] = 0,15 — x = 0,15 M.
Nesse caso, a intuição química pode fornecer uma solução mais simples. A partir da constante de equilíbrio e das condições iniciais, x deve ser pequeno em comparação com 0,15 M. Mais formalmente, se\(x≪0.15\), então 0,15 — x ≈ 0,15. Se essa suposição for verdadeira, ela simplifica a obtenção de x
\[K_c=\dfrac{(x)(x)}{0.15−x}≈\dfrac{x^2}{0.15} \nonumber \]
\[4.9×10^{−10}=\dfrac{x^2}{0.15} \nonumber \]
\[x^2=(0.15)(4.9×10^{−10})=7.4×10^{−11} \nonumber \]
\[x=\sqrt{7.4×10^{−11}}=8.6×10^{−6}\:M \nonumber \]
Neste exemplo, resolver a equação exata (quadrática) e usar aproximações deu o mesmo resultado a dois números significativos. Embora na maioria das vezes a aproximação seja um pouco diferente da solução exata, desde que o erro seja menor que 5%, a solução aproximada é considerada válida. Nesse problema, os 5% se aplicam a IF (0,15 — x) ≈ 0,15 M, então se
\[\dfrac{x}{0.15}×100\%=\dfrac{8.6×10^{−6}}{0.15}×100\%=0.006\% \nonumber \]
é inferior a 5%, como neste caso, a suposição é válida. A solução aproximada é, portanto, uma solução válida.
Quais são as concentrações de equilíbrio em uma solução de 0,25 M NH 3?
Suponha que x seja muito menor que 0,25 M e calcule o erro em sua suposição.
- Resposta
-
\(\ce{[OH- ]}=\ce{[NH4+]}=0.0021\:M\); [NH 3] = 0,25 M, erro = 0,84%
O segundo exemplo exige que as informações originais sejam processadas um pouco, mas ainda assim podem ser resolvidas usando uma pequena aproximação x.
Os íons de cobre (II) formam um íon complexo na presença de amônia
\[\ce{Cu^2+}(aq)+\ce{4NH3}(aq)⇌\ce{Cu(NH3)4^2+}(aq) \hspace{20px} K_c=5.0×10^{13}=\ce{\dfrac{[Cu(NH3)4^2+]}{[Cu^2+(aq)][NH3]^4}} \nonumber \]
Se 0,010 mol Cu 2 + for adicionado a 1,00 L de uma solução que é 1,00 M NH 3, quais são as concentrações quando o sistema chega ao equilíbrio?
Solução A concentração inicial de cobre (II) é de 0,010 M. A constante de equilíbrio é muito grande, então seria melhor começar com o máximo de produto possível, porque “todos os produtos” estão muito mais próximos do equilíbrio do que “todos os reagentes”. Observe que Cu 2 + é o reagente limitante; se todos os 0,010 M dele reagirem para formar o produto, as concentrações seriam
\[\ce{[Cu^2+]}=0.010−0.010=0\:M \nonumber \]
\[\ce{[Cu(NH3)4^2+]}=0.010\:M \nonumber \]
\[\ce{[NH3]}=1.00−4×0.010=0.96\:M \nonumber \]
Usar esses valores “deslocados” como concentrações iniciais com x como a concentração livre de íons cobre (II) em equilíbrio fornece esta tabela ICE.

Como estamos começando perto do equilíbrio, x deve ser pequeno para que
Selecione a menor concentração para a regra dos 5%.
Isso é muito menos do que 5%, então as suposições são válidas. As concentrações em equilíbrio são
Começando com a quantidade máxima de produto, esse sistema estava próximo do equilíbrio e a mudança (x) era muito pequena. Com apenas uma pequena mudança necessária para chegar ao equilíbrio, a equação para x foi bastante simplificada e deu um resultado válido bem dentro do máximo de 5% de erro.
Quais são as concentrações de equilíbrio quando 0,25 mol de Ni 2 + é adicionado a 1,00 L de solução de 2,00 M NH 3?
\[\ce{Ni^2+}(aq)+\ce{6NH3}(aq)⇌\ce{Ni(NH3)6^2+}(aq) \nonumber \]
com\(K_c=5.5×10^8\).Com uma constante de equilíbrio tão grande, primeiro forme o máximo de produto possível e, em seguida, suponha que apenas uma pequena quantidade (x) do produto se desloque para a esquerda. Calcule o erro em sua suposição.
- Resposta
-
\(\ce{[Ni(NH3)6^2+]}=0.25\:M\), [NH 3] = 0,50 M, [Ni 2 +] = 2,9 × 10 —8 M, erro = 1,2 × 10 —5%
Resumo
As razões da taxa de mudança nas concentrações de uma reação são iguais às razões dos coeficientes na equação química balanceada. O sinal do coeficiente de X é positivo quando a concentração aumenta e negativo quando diminui. Aprendemos a abordar três tipos básicos de problemas de equilíbrio. Quando dadas as concentrações dos reagentes e produtos em equilíbrio, podemos resolver a constante de equilíbrio; quando dada a constante de equilíbrio e algumas das concentrações envolvidas, podemos resolver as concentrações ausentes; e quando dadas a constante de equilíbrio e as concentrações iniciais, podemos resolver as concentrações em equilíbrio.


