13.2: Constantes de equilíbrio
- Page ID
- 185376
- Derive quocientes de reação de equações químicas que representam reações homogêneas e heterogêneas
- Calcule valores de quocientes de reação e constantes de equilíbrio, usando concentrações e pressões
- Relacionar a magnitude de uma constante de equilíbrio com as propriedades do sistema químico
Agora que temos um símbolo (\(\rightleftharpoons\)) para designar reações reversíveis, precisaremos de uma forma de expressar matematicamente como as quantidades de reagentes e produtos afetam o equilíbrio do sistema. Uma equação geral para uma reação reversível pode ser escrita da seguinte forma:
\[m\ce{A}+n\ce{B}+ \rightleftharpoons x\ce{C}+y\ce{D} \label{13.3.1} \]
Podemos escrever o quociente de reação (\(Q\)) para essa equação. Quando avaliado usando concentrações, é chamado\(Q_c\). Usamos colchetes para indicar as concentrações molares de reagentes e produtos.
\[ Q_c=\dfrac{[\ce{C}]^x[\ce{D}]^y}{[\ce{A}]^m[\ce{B}]^n} \label{13.3.2} \]
O quociente de reação é igual às concentrações molares dos produtos da equação química (multiplicados juntos) sobre os reagentes (também multiplicados juntos), com cada concentração elevada à potência do coeficiente dessa substância na equação química balanceada. Por exemplo, o quociente de reação para a reação reversível
\[\ce{2NO}_{2(g)} \rightleftharpoons \ce{N_2O}_{4(g)} \label{13.3.3} \]
é dado por esta expressão:
\[Q_c=\ce{\dfrac{[N_2O_4]}{[NO_2]^2}} \label{13.3.4} \]
Escreva a expressão para o quociente de reação para cada uma das seguintes reações:
- \(\ce{3O}_{2(g)} \rightleftharpoons \ce{2O}_{3(g)}\)
- \(\ce{N}_{2(g)}+\ce{3H}_{2(g)} \rightleftharpoons \ce{2NH}_{3(g)}\)
- \(\ce{4NH}_{3(g)}+\ce{7O}_{2(g)} \rightleftharpoons \ce{4NO}_{2(g)}+\ce{6H_2O}_{(g)}\)
Solução
- \(Q_c=\dfrac{[\ce{O3}]^2}{[\ce{O2}]^3}\)
- \( Q_c=\dfrac{[\ce{NH3}]^2}{\ce{[N2][H2]}^3}\)
- \( Q_c=\dfrac{\ce{[NO2]^4[H2O]^6}}{\ce{[NH3]^4[O2]^7}}\)
Escreva a expressão para o quociente de reação para cada uma das seguintes reações:
- \( \ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g)\)
- \( \ce{C4H8}(g) \rightleftharpoons \ce{2C2H4}(g)\)
- \( \ce{2C4H10}(g)+\ce{13O2}(g) \rightleftharpoons \ce{8CO2}(g)+\ce{10H2O}(g)\)
- Responda a um
-
\( Q_c=\dfrac{[\ce{SO3}]^2}{\ce{[SO2]^2[O2]}}\)
- Resposta b
-
\( Q_c=\dfrac{[\ce{C2H4}]^2}{[\ce{C4H8}]}\)
- Resposta c
-
\( Q_c=\dfrac{\ce{[CO2]^8[H2O]^{10}}}{\ce{[C4H10]^2[O2]^{13}}}\)
O valor numérico de\(Q_c\) para uma determinada reação varia; depende das concentrações de produtos e reagentes presentes no momento em que\(Q_c\) é determinado. Quando reagentes puros são misturados,\(Q_c\) é inicialmente zero porque não há produtos presentes nesse momento. Conforme a reação prossegue, o valor de\(Q_c\) aumenta à medida que as concentrações dos produtos aumentam e as concentrações dos reagentes diminuem simultaneamente (Figura\(\PageIndex{1}\)). Quando a reação atinge o equilíbrio, o valor do quociente da reação não muda mais porque as concentrações não mudam mais.
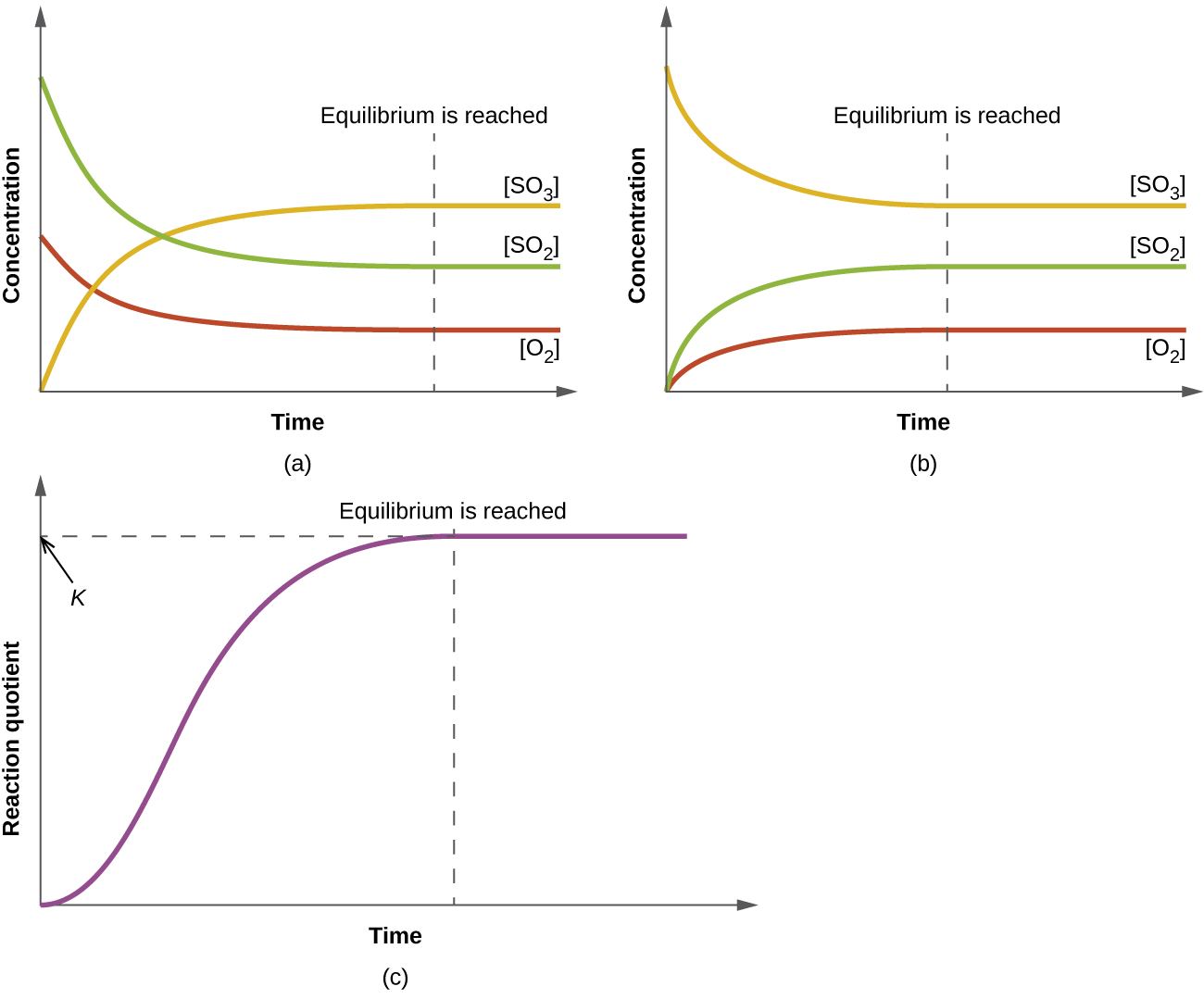
Quando uma mistura de reagentes e produtos de uma reação atinge o equilíbrio em uma determinada temperatura, seu quociente de reação sempre tem o mesmo valor. Esse valor é chamado de constante de equilíbrio (\(K\)) da reação nessa temperatura. Quanto ao quociente de reação, quando avaliado em termos de concentrações, é observado como\(K_c\).
O fato de um quociente de reação sempre assumir o mesmo valor em equilíbrio pode ser expresso como:
\[Q_c \textrm{ at equilibrium}=K_c=\dfrac{[\ce C]^x[\ce D]^y...}{[\ce A]^m[\ce B]^n...} \label{13.3.5} \]
Essa equação é uma declaração matemática da lei da ação de massa: Quando uma reação atinge o equilíbrio em uma determinada temperatura, o quociente de reação para a reação sempre tem o mesmo valor.
O dióxido de nitrogênio gasoso forma tetróxido de dinitrogênio de acordo com esta equação:
\[\ce{2NO}_{2(g)} \rightleftharpoons \ce{N_2O}_{4(g)} \nonumber \]
Quando 0,10 mol\(\ce{NO2}\) é adicionado a um frasco de 1,0 L a 25 °C, a concentração muda de forma que, em equilíbrio, [NO 2] = 0,016 M e [N 2 O 4] = 0,042 M.
- Qual é o valor do quociente de reação antes que qualquer reação ocorra?
- Qual é o valor da constante de equilíbrio para a reação?
Solução
- Antes de qualquer produto ser formado\(\mathrm{[NO_2]=\dfrac{0.10\:mol}{1.0\:L}}=0.10\:M\),, e [N 2 O 4] = 0 M. Assim,\[Q_c=\ce{\dfrac{[N2O4]}{[NO2]^2}}=\dfrac{0}{0.10^2}=0 \nonumber \]
- No equilíbrio, o valor da constante de equilíbrio é igual ao valor do quociente de reação. Em equilíbrio,\[K_c=Q_c=\ce{\dfrac{[N2O4]}{[NO2]^2}}=\dfrac{0.042}{0.016^2}=1.6\times 10^2. \nonumber \]
A constante de equilíbrio é 1,6 × 10 2.
Observe que a análise dimensional sugere que a unidade para esse\(K_c\) valor deve ser M −1. No entanto, é prática comum omitir unidades para\(K_c\) valores computados conforme descrito aqui, pois é a magnitude de uma constante de equilíbrio que retransmite informações úteis. Como será discutido mais adiante neste módulo, a abordagem rigorosa para calcular constantes de equilíbrio usa quantidades adimensionais derivadas de atividades em vez de concentrações molares e, portanto,\(K_c\) os valores são realmente sem unidades.
Para a reação
\[\ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g) \nonumber \]
as concentrações em equilíbrio são [SO 2] = 0,90 M, [O 2] = 0,35 M e [SO 3] = 1,1 M. Qual é o valor da constante de equilíbrio, K c?
- Resposta
-
K c = 4,3
A magnitude de uma constante de equilíbrio é uma medida do rendimento de uma reação quando ela atinge o equilíbrio. Um grande valor para\(K_c\) indica que o equilíbrio é alcançado somente após os reagentes terem sido amplamente convertidos em produtos. Um valor pequeno de\(K_c\) —muito menos de 1—indica que o equilíbrio é alcançado quando apenas uma pequena proporção dos reagentes é convertida em produtos.
Quando um valor de\(K_c\) é conhecido para uma reação, ele pode ser usado para prever mudanças direcionais quando comparado ao valor de\(Q_c\). Um sistema que não está em equilíbrio prosseguirá na direção que estabelece o equilíbrio. Os dados na Figura\(\PageIndex{2}\) ilustram isso. Quando aquecidas a uma temperatura consistente, 800 °C, diferentes misturas iniciais de\(\ce{CO}\)\(\ce{H_2O}\)\(\ce{CO_2}\),,, e\(\ce{H_2}\) reagem para alcançar composições aderentes ao mesmo equilíbrio (o valor de\(Q_c\) muda até ser igual ao valor de K c). Esse valor é 0,640, a constante de equilíbrio para a reação nessas condições.
\[\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g) \hspace{20px} K_c=0.640 \hspace{20px} \mathrm{T=800°C} \label{13.3.6} \]
É importante reconhecer que um equilíbrio pode ser estabelecido a partir de reagentes ou de produtos, ou de uma mistura de ambos. Por exemplo, o equilíbrio foi estabelecido a partir da Mistura 2 na Figura\(\PageIndex{2}\) quando os produtos da reação foram aquecidos em um recipiente fechado. De fato, uma técnica usada para determinar se uma reação está realmente em equilíbrio é abordar o equilíbrio começando com reagentes em um experimento e começando com produtos em outro. Se o mesmo valor do quociente de reação for observado quando as concentrações pararem de mudar em ambos os experimentos, então podemos ter certeza de que o sistema atingiu o equilíbrio.
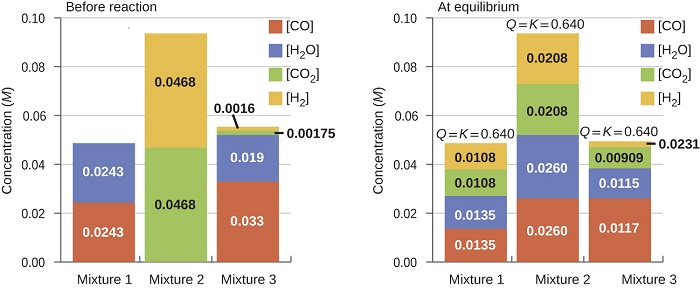
Aqui estão as concentrações iniciais de reagentes e produtos para três experimentos envolvendo essa reação:
\[\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g) \nonumber \]
com\(K_c=0.64 \). Determine em qual direção a reação prossegue à medida que se equilibra em cada um dos três experimentos mostrados.
| Reagentes/produtos | Experiência 1 | Experiência 2 | Experiência 3 |
|---|---|---|---|
| [COI] | 0,0203 M | 0,011 M | 0,0094 M |
| [H 2 OI] | 0,0203 M | 0,0011 M | 0,0025 M |
| [CO 2] i | 0,0040 M | 0,037 M | 0,0015 M |
| [H 2] é | 0,0040 M | 0,046 M | 0,0076 M |
Solução
Experiência 1:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.0040)(0.0040)}{(0.0203)(0.0203)}=0.039. \nonumber \]
Q c <\(K_c\) (0,039 < 0,64)
A reação mudará para a direita.
Experiência 2:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.037)(0.046)}{(0.011)(0.0011)}=1.4 \times 10^2 \nonumber \]
Q c >\(K_c\) (140 > 0,64)
A reação mudará para a esquerda.
Experiência 3:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.0015)(0.0076)}{(0.0094)(0.0025)}=0.48 \nonumber \]
Q c <\(K_c\) (0,48 < 0,64)
A reação mudará para a direita.
Calcule o quociente de reação e determine a direção na qual cada uma das seguintes reações alcançará o equilíbrio.
(a) Um frasco de 1,00 L contendo 0,0500 mol de NO (g), 0,0155 mol de Cl 2 (g) e 0,500 mol de NOCl:
\[\ce{2NO}(g)+\ce{Cl2}(g)⇌\ce{2NOCl}(g)\hspace{20px}K_c=4.6\times 10^4 \nonumber \]
(b) Um frasco de 5,0 L contendo 17 g de NH 3, 14 g de N 2 e 12 g de H 2:
\[\ce{N2}(g)+\ce{3H2}(g)⇌\ce{2NH3}(g)\hspace{20px}K_c=0.060 \nonumber \]
(c) Um frasco de 2,00 L contendo 230 g de SO 3 (g):
\[\ce{2SO3}(g)⇌\ce{2SO2}(g)+\ce{O2}(g)\hspace{20px}K_c=0.230 \nonumber \]
- Responda a um
-
\(Q_c\)= 6,45 × 10 3, muda para a direita.
- Resposta b
-
\(Q_c\)= 0,12, muda para a esquerda.
- Resposta c
-
\(Q_c\)= 0, muda para a direita
No exemplo\(\PageIndex{2}\), foi mencionado que a prática comum é omitir unidades ao avaliar quocientes de reação e constantes de equilíbrio. Deve-se ressaltar que o uso de concentrações nesses cálculos é uma abordagem conveniente, mas simplificada, que às vezes leva a resultados que aparentemente entram em conflito com a lei da ação em massa. Por exemplo, os equilíbrios envolvendo íons aquosos geralmente exibem constantes de equilíbrio que variam significativamente (não são constantes) em altas concentrações de solução. Isso pode ser evitado computando\(K_c\) valores usando as atividades dos reagentes e produtos no sistema de equilíbrio em vez de suas concentrações. A atividade de uma substância é uma medida de sua concentração efetiva sob condições especificadas. Embora uma discussão detalhada dessa quantidade importante esteja além do escopo de um texto introdutório, é necessário estar ciente de alguns aspectos importantes:
- As atividades são quantidades adimensionais (sem unidades) e, em essência, são concentrações “ajustadas”.
- Para soluções relativamente diluídas, a atividade de um soluto e sua concentração molar são aproximadamente iguais.
- As atividades para fases condensadas puras (sólidos e líquidos) são iguais a 1.
- As atividades para solventes em soluções diluídas são iguais a 1.
Como consequência desses dois últimos aspectos,\(Q_c\)\(K_c\) as expressões não contêm termos para sólidos, líquidos ou solventes em soluções diluídas (sendo numericamente iguais a 1, esses termos não têm efeito sobre o valor da expressão). Vários exemplos de equilíbrios que produzem tais expressões serão encontrados nesta seção.
Equilíbrio homogêneo
Um equilíbrio homogêneo é aquele em que todos os reagentes e produtos estão presentes em uma única solução (por definição, uma mistura homogênea). Neste capítulo, vamos nos concentrar nos dois tipos mais comuns de equilíbrios homogêneos: aqueles que ocorrem em soluções de fase líquida e aqueles envolvendo espécies exclusivamente gasosas. As reações entre solutos em soluções líquidas pertencem a um tipo de equilíbrio homogêneo. As espécies químicas envolvidas podem ser moléculas, íons ou uma mistura de ambos. Vários exemplos são fornecidos aqui:
Exemplo 1
\[\ce{C2H2}(aq)+\ce{2Br2}(aq) \rightleftharpoons \ce{C2H2Br4}(aq)\hspace{20px} \label{13.3.7a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[C2H2Br4]}{[C2H2][Br2]^2}} \label{13.3.7b} \]
Exemplo 2
\[\ce{I2}(aq)+\ce{I-}(aq) \rightleftharpoons \ce{I3-}(aq) \label{13.3.8b} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[I3- ]}{[I2][I- ]}} \label{13.3.8c} \]
Exemplo 3
\[\ce{Hg2^2+}(aq)+\ce{NO3-}(aq)+\ce{3H3O+}(aq) \rightleftharpoons \ce{2Hg^2+}(aq)+\ce{HNO2}(aq)+\ce{4H2O}(l) \label{13.3.9a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[Hg^2+]^2[HNO2]}{[Hg2^2+][NO3- ][H3O+]^3}} \label{13.3.9b} \]
Exemplo 4
\[\ce{HF}(aq)+\ce{H2O}(l) \rightleftharpoons \ce{H3O+}(aq)+\ce{F-}(aq) \label{13.3.10a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[H3O+][F- ]}{[HF]}} \label{13.3.10b} \]
Exemplo 5
\[\ce{NH3}(aq)+\ce{H2O}(l) \rightleftharpoons \ce{NH4+}(aq)+\ce{OH-}(aq) \label{13.3.11a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}} \label{13.3.11b} \]
Em cada um desses exemplos, o sistema de equilíbrio é uma solução aquosa, conforme indicado pelas anotações aq nas fórmulas do soluto. Como H 2 O (l) é o solvente para essas soluções, ele recebe uma atividade de 1 e, portanto, não aparece explicitamente como um termo na\(K_c\) expressão, conforme discutido anteriormente, mesmo que também possa aparecer como um reagente ou produto na equação química.
As reações nas quais todos os reagentes e produtos são gases representam uma segunda classe de equilíbrios homogêneos. Usamos concentrações molares nos exemplos a seguir, mas veremos em breve que pressões parciais dos gases também podem ser usadas:
Exemplo 1
\[\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g) \label{13.3.12a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[C2H4][H2]}{[C2H6]}} \label{13.3.12b} \]
Exemplo 2
\[\ce{3O2}(g) \rightleftharpoons \ce{2O3}(g) \label{13.3.13a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[O3]^2}{[O2]^3}} \label{13.3.13b} \]
Exemplo 3
\[\ce{N2}(g)+\ce{3H2}(g) \rightleftharpoons \ce{2NH3}(g) \label{13.3.14a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[NH3]^2}{[N2][H2]^3}} \label{13.3.14b} \]
Exemplo 4
\[\ce{C3H8}(g)+\ce{5O2}(g) \rightleftharpoons \ce{3CO2}(g)+\ce{4H2O}(g)\label{13.3.15a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[CO2]^3[H2O]^4}{[C3H8][O2]^5}}\label{13.3.15b} \]
Observe que a concentração de\(\ce{H_2O}_{(g)}\) foi incluída no último exemplo porque a água não é o solvente nessa reação em fase gasosa e sua concentração (e atividade) muda.
Sempre que gases estão envolvidos em uma reação, a pressão parcial de cada gás pode ser usada em vez de sua concentração na equação do quociente de reação porque a pressão parcial de um gás é diretamente proporcional à sua concentração em temperatura constante. Essa relação pode ser derivada da equação do gás ideal, onde M é a concentração molar do gás,\(\dfrac{n}{V}\).
\[\begin{align} PV&=nRT \label{13.3.16} \\[4pt] P &=\left(\dfrac{n}{V}\right)RT \label{13.3.17} \\[4pt] &=MRT \label{13.3.18} \end{align} \]
Assim, em temperatura constante, a pressão de um gás é diretamente proporcional à sua concentração. Usando as pressões parciais dos gases, podemos escrever o quociente de reação para o sistema
\[\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g) \label{13.3.19} \]
seguindo as mesmas diretrizes para derivar expressões baseadas em concentração:
\[Q_P=\dfrac{P_{\ce{C2H4}}P_{\ce{H2}}}{P_{\ce{C2H6}}} \label{13.3.20} \]
Nesta equação, usamos Q P para indicar um quociente de reação escrito com pressões parciais:\(P_{\ce{C2H6}}\) é a pressão parcial de C 2 H 6;\(P_{\ce{H2}}\), a pressão parcial de H 2; e\(P_{\ce{C2H6}}\), a pressão parcial de C 2 H 4. Em equilíbrio:
\[K_P=Q_P=\dfrac{P_{\ce{C2H4}}P_{\ce{H2}}}{P_{\ce{C2H6}}} \label{13.3.21} \]
O subscrito\(P\) no símbolo\(K_P\) designa uma constante de equilíbrio derivada usando pressões parciais em vez de concentrações. A constante de equilíbrio, K P, ainda é uma constante, mas seu valor numérico pode diferir da constante de equilíbrio encontrada para a mesma reação usando concentrações.
A conversão entre um valor para\(K_c\), uma constante de equilíbrio expressa em termos de concentrações e um valor para\(K_P\), uma constante de equilíbrio expressa em termos de pressões, é simples (um K ou Q sem um subscrito pode ser concentração ou pressão).
A equação relativa a\(K_c\) e\(K_P\) é derivada da seguinte forma. Para a reação em fase gasosa:
\[m\ce{A}+n\ce{B} \rightleftharpoons x\ce{C}+y\ce{D} \label{13.3.22} \]
com
\[ \begin{align} K_P &=\dfrac{(P_C)^x(P_D)^y}{(P_A)^m(P_B)^n} \label{13.3.23} \\[4pt] &=\dfrac{([\ce C]×RT)^x([\ce D]×RT)^y}{([\ce A]×RT)^m([\ce B]×RT)^n} \label{13.3.24} \\[4pt] &=\dfrac{[\ce C]^x[\ce D]^y}{[\ce A]^m[\ce B]^n}×\dfrac{(RT)^{x+y}}{(RT)^{m+n}} \label{13.3.25} \\[4pt] &=K_c(RT)^{(x+y)−(m+n)} \label{13.3.26} \\[4pt] &=K_c(RT)^{Δn} \label{13.3.27} \end{align} \]
A relação entre\(K_c\) e\(K_P\) é
\[ \color{red} K_P=K_c(RT)^{Δn} \label{13.3.28} \]
Nessa equação, Δn é a diferença entre a soma dos coeficientes dos produtos gasosos e a soma dos coeficientes dos reagentes gasosos na reação (a mudança em moles de gás entre os reagentes e os produtos). Para a reação em fase gasosa\(m\ce{A}+n\ce{B} \rightleftharpoons x\ce{C}+y\ce{D}\), temos
\[Δn=(x+y)−(m+n) \label{13.3.29} \]
Escreva as equações para a conversão de\(K_c\) em K P para cada uma das seguintes reações:
- \(\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g)\)
- \(\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g)\)
- \(\ce{N2}(g)+\ce{3H2}(g) \rightleftharpoons \ce{2NH3}(g)\)
- K c é igual a 0,28 para a seguinte reação a 900 °C:
\[\ce{CS2}(g)+\ce{4H2}(g) \rightleftharpoons \ce{CH4}(g)+\ce{2H2S}(g) \nonumber \]
O que é K P nessa temperatura?
Solução
(a) Δn = (2) − (1) = 1
K P =\(K_c\) (RT) Δn =\(K_c\) (RT) 1 =\(K_c\) (RT)
(b) Δn = (2) − (2) = 0
K P =\(K_c\) (RT) Δn =\(K_c\) (RT) 0 = K c
(c) Δn = (2) − (1 + 3) = −2
K P =\(K_c\) (RT) Δn =\(K_c\) (RT) −2 =\(\dfrac{K_c}{(RT)^2}\)
d) K P =\(K_c\) (RT) Δn = (0,28) [(0,0821) (1173)] −2 = 3,0 × 10 −5
Escreva as equações para a conversão de\(K_c\) em K P para cada uma das seguintes reações, que ocorrem na fase gasosa:
- \(\ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g)\)
- \(\ce{N2O4}(g) \rightleftharpoons \ce{2NO2}(g)\)
- \(\ce{C3H8}(g)+\ce{5O2}(g) \rightleftharpoons \ce{3CO2}(g)+\ce{4H2O}(g)\)
- A 227 °C, a seguinte reação tem\(K_c\) = 0,0952:
\[\ce{CH3OH}(g) \rightleftharpoons \ce{CO}(g)+\ce{2H2}(g) \nonumber \]
Qual seria o valor de K P nessa temperatura?
- Responda a um
-
K P =\(K_c\) (RT) −1
- Resposta b
-
K P =\(K_c\) (RT)
- Resposta c
-
K P =\(K_c\) (RT);
- Resposta d
-
160 ou 1,6 × 10 2
Equilíbrio heterogêneo
Um equilíbrio heterogêneo é um sistema no qual reagentes e produtos são encontrados em duas ou mais fases. As fases podem ser qualquer combinação de fases e soluções sólidas, líquidas ou gasosas. Ao lidar com esses equilíbrios, lembre-se de que sólidos e líquidos puros não aparecem em expressões constantes de equilíbrio (as atividades de sólidos puros, líquidos puros e solventes são 1).
Alguns equilíbrios heterogêneos envolvem mudanças químicas:
Exemplo 1
\[\ce{PbCl2}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{2Cl-}(aq) \label{13.3.30a} \]
com constante de equilíbrio associada
\[K_c=\ce{[Pb^2+][Cl- ]^2} \label{13.3.30b} \]
Exemplo 1
\[\ce{CaO}(s)+\ce{CO2}(g) \rightleftharpoons \ce{CaCO3}(s) \label{13.3.31a} \]
com constante de equilíbrio associada
\[K_c=\dfrac{1}{[\ce{CO2}]} \label{13.3.31b} \]
Exemplo 1
\[\ce{C}(s)+\ce{2S}(g) \rightleftharpoons \ce{CS2}(g) \label{13.3.32a} \]
com constante de equilíbrio associada
\[K_c=\ce{\dfrac{[CS2]}{[S]^2}} \label{13.3.32b} \]
Outros equilíbrios heterogêneos envolvem mudanças de fase, por exemplo, a evaporação do bromo líquido, conforme mostrado na seguinte equação:
\[\ce{Br2}(l) \rightleftharpoons \ce{Br2}(g) \label{13.3.33a} \]
com constante de equilíbrio associada
\[K_c=[\ce{Br2}] \label{13.3.33b} \]
Podemos escrever equações para quocientes de reação de equilíbrios heterogêneos que envolvem gases, usando pressões parciais em vez de concentrações. Dois exemplos são:
\[\ce{CaO}(s)+\ce{CO2}(g) \rightleftharpoons \ce{CaCO3}(s)\label{13.3.34a} \]
com constante de equilíbrio associada
\[K_P=\dfrac{1}{P_{\ce{CO2}}} \label{13.3.34b} \]
\[\ce{C}(s)+\ce{2S}(g) \rightleftharpoons \ce{CS2}(g)\label{13.3.35a} \]
com constante de equilíbrio associada
\[K_P=\dfrac{P_{\ce{CS2}}}{(P_{\ce S})^2} \label{13.3.35b} \]
Resumo
Para qualquer reação que esteja em equilíbrio, o quociente de reação Q é igual à constante de equilíbrio K para a reação. Se um reagente ou produto for um sólido puro, um líquido puro ou o solvente em uma solução diluída, a concentração desse componente não aparece na expressão da constante de equilíbrio. Em equilíbrio, os valores das concentrações dos reagentes e produtos são constantes. Seus valores particulares podem variar dependendo das condições, mas o valor do quociente de reação sempre será igual a K (K c ao usar concentrações ou K P ao usar pressões parciais).
Um equilíbrio homogêneo é um equilíbrio no qual todos os componentes estão na mesma fase. Um equilíbrio heterogêneo é um equilíbrio no qual os componentes estão em duas ou mais fases. Podemos decidir se uma reação está em equilíbrio comparando o quociente da reação com a constante de equilíbrio da reação.
Equações chave
- \(Q=\dfrac{[\ce C]^x[\ce D]^y}{[\ce A]^m[\ce B]^n}\hspace{20px}\textrm{where }m\ce A+n\ce B⇌x\ce C+y\ce D\)
- \(Q_P=\dfrac{(P_C)^x(P_D)^y}{(P_A)^m(P_B)^n}\hspace{20px}\textrm{where }m\ce A+n\ce B⇌x\ce C+y\ce D\)
- P = MRT
- K P =\(K_c\) (RT) Δn
Glossário
- constante de equilíbrio (K)
- valor do quociente de reação para um sistema em equilíbrio
- equilíbrios heterogêneos
- equilíbrios entre reagentes e produtos em diferentes fases
- equilíbrios homogêneos
- equilíbrios dentro de uma única fase
- K c
- constante de equilíbrio para reações com base em concentrações de reagentes e produtos
- K P
- constante de equilíbrio para reações em fase gasosa com base em pressões parciais de reagentes e produtos
- lei de ação em massa
- quando uma reação reversível atinge o equilíbrio em uma determinada temperatura, o quociente de reação permanece constante
- quociente de reação (Q)
- razão entre o produto das concentrações (ou pressões) molares dos produtos e a dos reagentes, sendo cada concentração (ou pressão) elevada à potência igual ao coeficiente na equação


