13.1: Equilíbrios químicos
- Page ID
- 185355
- Descreva a natureza dos sistemas de equilíbrio
- Explicar a natureza dinâmica de um equilíbrio químico
Uma reação química geralmente é escrita de uma forma que sugere que ela prossegue em uma direção, a direção na qual lemos, mas todas as reações químicas são reversíveis, e tanto a reação direta quanto a reversa ocorrem em um grau ou outro, dependendo das condições. Em um equilíbrio químico, as reações direta e reversa ocorrem em taxas iguais e as concentrações de produtos e reagentes permanecem constantes. Se executarmos uma reação em um sistema fechado para que os produtos não possam escapar, geralmente descobrimos que a reação não fornece um rendimento de 100% dos produtos. Em vez disso, alguns reagentes permanecem após as concentrações pararem de mudar. Nesse ponto, quando não há mais mudanças nas concentrações de reagentes e produtos, dizemos que a reação está em equilíbrio. Uma mistura de reagentes e produtos é encontrada em equilíbrio.
Por exemplo, quando colocamos uma amostra de tetróxido de dinitrogênio (\(N_2O_4\), um gás incolor) em um tubo de vidro, ele forma dióxido de nitrogênio (\(\ce{NO2}\), um gás marrom) pela reação
\[\ce{ N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.1} \]
A cor fica mais escura à medida que\(\ce{N2O4}\) é convertida em\(\ce{NO2}\). Quando o sistema atinge o equilíbrio, ambos\(\ce{N2O4}\)\(\ce{NO2}\) estão presentes (Figura\(\PageIndex{1}\)).
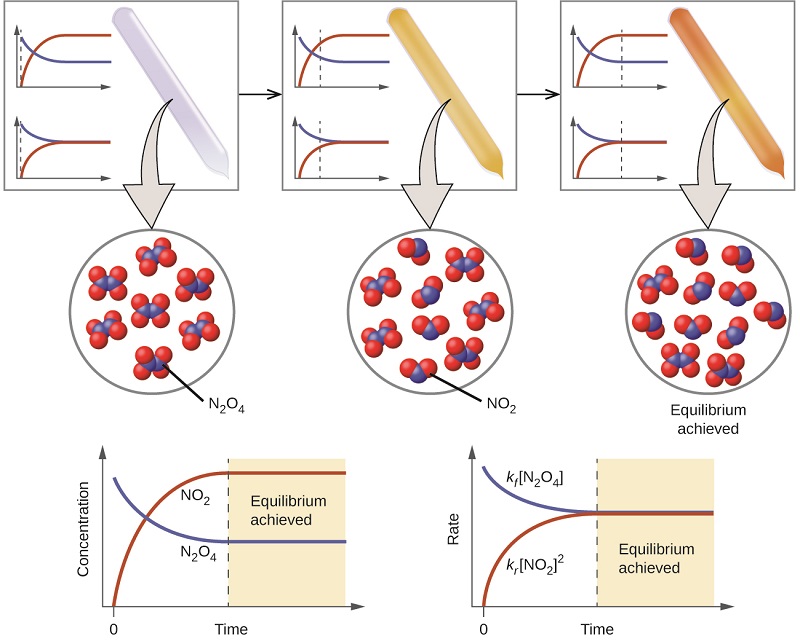
A formação de\(\ce{NO2}\) from\(\ce{N2O4}\) é uma reação reversível, que é identificada pela seta de equilíbrio (\(\rightleftharpoons\)). Todas as reações são reversíveis, mas muitas reações, para todos os fins práticos, prosseguem em uma direção até que os reagentes se esgotem e sejam revertidos somente sob certas condições. Essas reações são frequentemente representadas com uma seta unidirecional de reagentes a produtos. Muitas outras reações, como a formação de a\(\ce{NO2}\) partir de\(\ce{N2O4}\), são reversíveis sob condições mais fáceis de obter e, portanto, são denominadas como tal. Em uma reação reversível, os reagentes podem se combinar para formar produtos e os produtos podem reagir para formar os reagentes. Assim, não só pode se\(\ce{N2O4}\) decompor em forma\(\ce{NO2}\), mas o\(\ce{NO2}\) produzido pode reagir à forma\(\ce{N2O4}\). Assim que a reação direta produz alguma\(\ce{NO2}\), a reação inversa começa e\(\ce{NO2}\) começa a reagir para se formar\(\ce{N2O4}\). Em equilíbrio, as concentrações de\(\ce{N2O4}\) e\(\ce{NO2}\) não mudam mais porque a taxa de formação de\(\ce{NO2}\) é exatamente igual à taxa de consumo de\(\ce{NO2}\), e a taxa de formação de\(\ce{N2O4}\) é exatamente igual à taxa de consumo de\(\ce{N2O4}\). O equilíbrio químico é um processo dinâmico: assim como os nadadores e os banhistas, os números de cada um permanecem constantes, mas há um fluxo de ida e volta entre eles (Figura\(\PageIndex{2}\)).

Em um equilíbrio químico, as reações direta e reversa não param, mas continuam ocorrendo na mesma taxa, levando a concentrações constantes dos reagentes e dos produtos. Gráficos mostrando como as taxas e concentrações de reação mudam em relação ao tempo são mostrados na Figura\(\PageIndex{1}\).
Podemos detectar um estado de equilíbrio porque as concentrações de reagentes e produtos não parecem mudar. No entanto, é importante verificar se a ausência de mudança se deve ao equilíbrio e não a uma taxa de reação tão lenta que as mudanças na concentração são difíceis de detectar.
Usamos uma seta dupla ao escrever uma equação para uma reação reversível. Essa reação pode ou não estar em equilíbrio. Por exemplo, a Figura\(\PageIndex{1}\) mostra a reação:
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.2} \]
Quando queremos falar sobre um componente específico de uma reação reversível, usamos uma única seta. Por exemplo, no equilíbrio mostrado na Figura\(\PageIndex{1}\), a taxa da reação direta
\[\ce{2NO2(g) \rightarrow N2O4(g)} \label{13.2.3} \]
é igual à taxa da reação inversa
\[\ce{N2O4(g) \rightarrow 2NO2(g)} \label{13.2.4} \]
A conexão entre química e refrigerantes carbonatados remonta a 1767, quando Joseph Priestley (1733—1804; conhecido principalmente hoje por seu papel na descoberta e identificação do oxigênio) descobriu um método de infundir água com dióxido de carbono para produzir água gaseificada. Em 1772, Priestly publicou um artigo intitulado “Impregnando água com ar fixo”. O artigo descreve o gotejamento de óleo de vitríolo (hoje chamamos isso de ácido sulfúrico, mas que ótima maneira de descrever o ácido sulfúrico: “óleo de vitríolo” significa literalmente “maldade líquida”) no giz (carbonato de cálcio). O resultado\(CO_2\) cai no recipiente de água abaixo do recipiente no qual a reação inicial ocorre; a agitação ajuda a\(CO_2\) mistura gasosa na água líquida.
\[\ce{H2SO4(l) + CaCO3(s) \rightarrow CO2(g) + H2O (l) + CaSO4 (aq)} \nonumber \]
O dióxido de carbono é ligeiramente solúvel em água. Há uma reação de equilíbrio que ocorre quando o dióxido de carbono reage com a água para formar ácido carbônico (\(H_2CO_3\)). Como o ácido carbônico é um ácido fraco, ele pode se dissociar em prótons (\(H^+\)) e íons hidrogenocarbonato (\(HCO_3^−\)).
\[\ce{ CO2 (aq) + H2O(l) \rightleftharpoons H2CO3 (aq) \rightleftharpoons HCO3^{-} (aq) + H^{+} (aq)} \nonumber \]
Hoje,\(\ce{CO_2}\) pode ser pressurizado em refrigerantes, estabelecendo o equilíbrio mostrado acima. Depois de abrir o recipiente da bebida, no entanto, ocorre uma cascata de mudanças de equilíbrio. Primeiro, o\(\ce{CO_2}\) gás no espaço aéreo no topo da garrafa escapa, fazendo com que o equilíbrio entre a fase gasosa\(\ce{CO_2}\) e\(\ce{CO_2}\) a fase dissolvida ou aquosa mude, diminuindo a concentração de\(\ce{CO_2}\) no refrigerante. Menos\(\ce{CO_2}\) dissolvido no líquido leva à decomposição do ácido carbônico em dissolvido\(\ce{CO_2}\) e H 2 O. A baixa concentração de ácido carbônico causa uma mudança no equilíbrio final. Enquanto o refrigerante estiver em um recipiente aberto,\(\ce{CO_2}\) as bolhas saem da bebida, liberando o gás no ar (Figura\(\PageIndex{3}\)). Com a tampa da garrafa, as\(\ce{CO_2}\) reações não estão mais em equilíbrio e continuarão até que não restem mais reagentes. Isso resulta em um refrigerante com uma\(\ce{CO_2}\) concentração muito baixa, geralmente chamado de “plano”.

Vamos considerar a evaporação do bromo como um segundo exemplo de um sistema em equilíbrio.
\[\ce{Br2(l) \rightleftharpoons Br2(g)} \nonumber \]
Um equilíbrio pode ser estabelecido para uma mudança física, como essa transição de líquido para gás, bem como para uma reação química. A figura\(\PageIndex{4}\) mostra uma amostra de bromo líquido em equilíbrio com vapor de bromo em um recipiente fechado. Quando despejamos bromo líquido em uma garrafa vazia na qual não há vapor de bromo, parte do líquido evapora, a quantidade de líquido diminui e a quantidade de vapor aumenta. Se tamparmos a garrafa para que nenhum vapor escape, a quantidade de líquido e vapor acabará por parar de mudar e um equilíbrio entre o líquido e o vapor será estabelecido. Se a garrafa não fosse tampada, o vapor de bromo escaparia e nenhum equilíbrio seria alcançado.

Resumo
Uma reação está em equilíbrio quando as quantidades de reagentes ou produtos não mudam mais. O equilíbrio químico é um processo dinâmico, o que significa que a taxa de formação de produtos pela reação direta é igual à taxa na qual os produtos reformam reagentes pela reação inversa.
Glossário
- equilíbrio
- em reações químicas, o estado em que a conversão de reagentes em produtos e a conversão de produtos novamente em reagentes ocorrem simultaneamente na mesma taxa; estado de equilíbrio
- reação reversível
- reação química que pode prosseguir nas direções direta e reversa sob determinadas condições


