19.2: Distúrbios autoimunes
- Page ID
- 181333
Objetivos de
- Explique por que os transtornos autoimunes
- Forneça alguns exemplos de doenças autoimunes sistêmicas e específicas de órgãos
Em 1970, o artista Walt Kelly desenvolveu um pôster promovendo o Dia da Terra, com um personagem de Pogo, sua história em quadrinhos de jornal diário. No pôster, Pogo olha para uma floresta repleta de lixo e diz com ironia: “Encontramos o inimigo e ele somos nós”. Pogo não estava falando sobre o sistema imunológico humano, mas ele poderia muito bem estar. Embora o sistema imunológico proteja o corpo atacando “inimigos” invasores (patógenos), em alguns casos, o sistema imunológico pode identificar erroneamente as células do próprio corpo como inimigas, resultando em doenças autoimunes.
As doenças autoimunes são aquelas em que o corpo é atacado por sua própria resposta imune adaptativa específica. Em estados normais e saudáveis, o sistema imunológico induz tolerância, que é a falta de uma resposta anti-autoimune. No entanto, com a autoimunidade, há uma perda da tolerância imune, e os mecanismos responsáveis pelas doenças autoimunes incluem as reações de hipersensibilidade do tipo II, III e IV. As doenças autoimunes podem ter uma variedade de sintomas mistos que surgem e desaparecem, dificultando o diagnóstico.
As causas das doenças autoimunes são uma combinação da composição genética do indivíduo e do efeito das influências ambientais, como luz solar, infecções, medicamentos e produtos químicos ambientais. No entanto, a imprecisão dessa lista reflete nossa pouca compreensão da etiologia dessas doenças. Exceto em poucas doenças específicas, o (s) evento (s) de iniciação da maioria dos estados autoimunes não foi totalmente caracterizado.
Existem várias causas possíveis para a origem das doenças autoimunes e a autoimunidade provavelmente se deve a vários fatores. As evidências agora sugerem que as células T e B reguladoras desempenham um papel essencial na manutenção da tolerância e prevenção de respostas autoimunes. As células T reguladoras são especialmente importantes para inibir as células T autorreativas que não são eliminadas durante a seleção tímica e escapam do timo (veja Linfócitos T e Imunidade Celular). Além disso, o mimetismo antígeno entre antígenos patógenos e nossos próprios antígenos pode levar à reatividade cruzada e à autoimunidade. Os autoantígenos ocultos podem ficar expostos devido a traumas, interações medicamentosas ou estados de doença e desencadear uma resposta autoimune. Todos esses fatores podem contribuir para a autoimunidade. Em última análise, os danos aos tecidos e órgãos no estado de doença autoimune ocorrem como resultado de respostas inflamatórias que são inadequadas; portanto, o tratamento geralmente inclui medicamentos imunossupressores e corticosteroides.
Doenças autoimunes específicas de órgãos
Algumas doenças autoimunes são consideradas específicas de órgãos, o que significa que o sistema imunológico tem como alvo órgãos ou tecidos específicos. Exemplos de doenças autoimunes específicas de órgãos incluem doença celíaca, doença de Graves, tireoidite de Hashimoto, diabetes mellitus tipo I e doença de Addison.
Doença celíaca
A doença celíaca é em grande parte uma doença do intestino delgado, embora outros órgãos possam ser afetados. Pessoas na faixa dos 30 e 40 anos e crianças são as mais comumente afetadas, mas a doença celíaca pode começar em qualquer idade. Ela resulta de uma reação às proteínas, comumente chamadas de glúten, encontradas principalmente no trigo, cevada, centeio e alguns outros grãos. A doença tem várias causas genéticas (predisposições) e influências ambientais mal compreendidas. Quando exposto ao glúten, o corpo produz vários autoanticorpos e uma resposta inflamatória. A resposta inflamatória no intestino delgado leva à redução da profundidade das microvilosidades da mucosa, o que dificulta a absorção e pode levar à perda de peso e anemia. A doença também é caracterizada por diarreia e dor abdominal, sintomas que muitas vezes são diagnosticados erroneamente como síndrome do intestino irritável.
O diagnóstico da doença celíaca é realizado a partir de testes sorológicos para detectar a presença principalmente de anticorpos IgA contra componentes do glúten, da enzima transglutinaminase e de autoanticorpos contra o endomésio, um tecido conjuntivo que envolve as fibras musculares. Os testes sorológicos geralmente são acompanhados por endoscopia e biópsia da mucosa duodenal. Pesquisas de triagem sorológica descobriram que cerca de 1% dos indivíduos no Reino Unido são positivos, embora nem todos apresentem sintomas. 1 Esse reconhecimento precoce permite um monitoramento e prevenção mais cuidadosos de doenças graves.
A doença celíaca é tratada com a remoção completa dos alimentos que contêm glúten da dieta, o que resulta em melhora dos sintomas e redução do risco de complicações. Outras abordagens teóricas incluem a criação de grãos que não contêm os componentes imunologicamente reativos ou o desenvolvimento de suplementos dietéticos que contêm enzimas que quebram os componentes proteicos que causam a resposta imune. 2
Distúrbios da tireóide
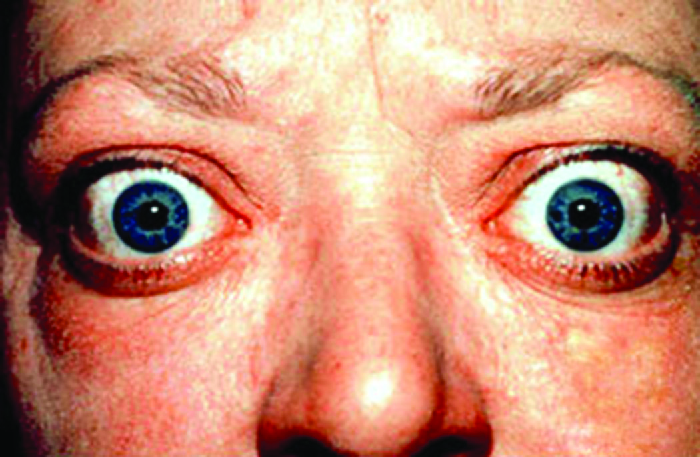
A doença de Graves é a causa mais comum de hipertireoidismo nos Estados Unidos. Os sintomas da doença de Graves resultam da produção de imunoglobulina estimuladora da tireoide (TSI), também chamada de anticorpo receptor de TSH. O TSI tem como alvo e se liga ao receptor do hormônio estimulador da tireoide (TSH), que é produzido naturalmente pela glândula pituitária. A TSI pode causar sintomas conflitantes porque pode estimular a tireoide a produzir muito hormônio tireoidiano ou bloquear totalmente a produção do hormônio tireoidiano, tornando o diagnóstico mais difícil. Os sinais e sintomas da doença de Graves incluem intolerância ao calor, batimentos cardíacos rápidos e irregulares, perda de peso, bócio (glândula tireoide inchada, que se projeta sob a pele da garganta [Figura\(\PageIndex{1}\)]) e exoftalmia (olhos esbugalhados), muitas vezes referida como oftalmopatia de Graves (Figura\(\PageIndex{2}\)).
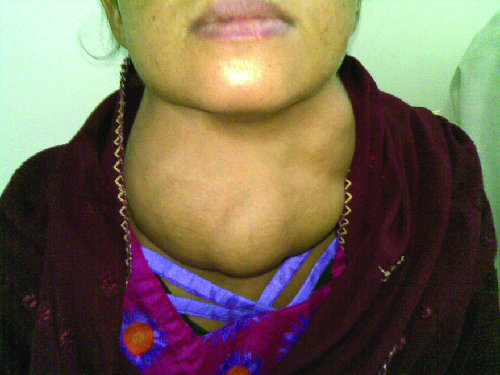
A causa mais comum de hipotireoidismo nos Estados Unidos é a tireoidite de Hashimoto, também chamada de tireoidite linfocítica crônica. Pacientes com tireoidite de Hashimoto geralmente desenvolvem um espectro de doenças diferentes porque têm maior probabilidade de desenvolver doenças autoimunes adicionais, como a doença de Addison (discutida posteriormente nesta seção), diabetes tipo 1, artrite reumatoide e doença celíaca. A tireoidite de Hashimoto é uma doença mediada por células T H 1 que ocorre quando a glândula tireoide é atacada por linfócitos citotóxicos, macrófagos e autoanticorpos. Essa resposta autoimune leva a vários sintomas que incluem bócio (Figura\(\PageIndex{1}\)), intolerância ao frio, fraqueza muscular, dores e rigidez nas articulações, depressão e perda de memória.
Diabetes tipo 1
O diabetes juvenil, ou diabetes mellitus tipo 1, geralmente é diagnosticado em crianças e adultos jovens. É uma doença autoimune dependente de células T caracterizada pela destruição seletiva das células β das ilhotas de Langerhans no pâncreas por células T CD8 mediadas por CD4 T H1, anticorpos anti-células β e atividade de macrófagos. Também há evidências de que infecções virais podem ter um papel potencializador ou inibitório no desenvolvimento do diabetes mellitus tipo 1 (DM1). A destruição das células β causa a falta de produção de insulina pelo pâncreas. Em T1D, a destruição das células β pode ocorrer ao longo de vários anos, mas os sintomas de hiperglicemia, aumento extremo da sede e da micção, perda de peso e fadiga extrema geralmente têm um início repentino, e o diagnóstico geralmente não ocorre até que a maioria das células β já tenha sido destruída.
Doença autoimune de Addison
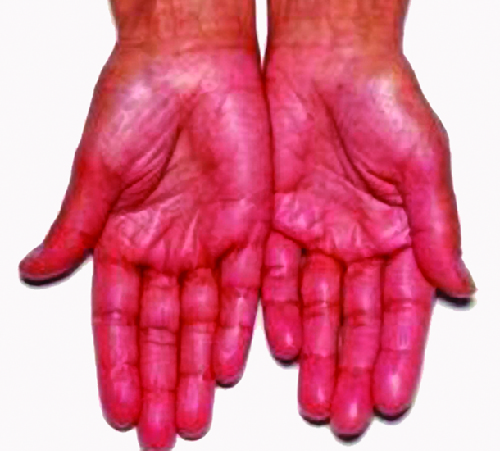
A destruição das glândulas supra-renais (as glândulas situadas acima dos rins que produzem glicocorticóides, mineralocorticóides e esteróides sexuais) é a causa da doença de Addison, também chamada de insuficiência adrenal primária (PAI). Hoje, até 80% dos casos da doença de Addison são diagnosticados como doença autoimune de Addison (AAD), que é causada por uma resposta autoimune aos tecidos adrenais, interrompendo a função adrenal. A interrupção da função adrenal causa comprometimento dos processos metabólicos que requerem níveis normais de hormônio esteróide, causando sinais e sintomas em todo o corpo. Há evidências de que tanto os mecanismos imunes humorais quanto os mediados por células T CD8 CD4 T H 1 são direcionados ao córtex adrenal na AAD. Também há evidências de que a resposta autoimune também está associada à destruição autoimune de outras glândulas endócrinas, como pâncreas e tireoide, condições coletivamente chamadas de síndromes poliendócrinas autoimunes (APS). Em até 80% dos pacientes com AAD, são produzidos anticorpos contra três enzimas envolvidas na síntese de esteróides: 21-hidroxilase (21-OH), 17α-hidroxilase e enzima de clivagem da cadeia lateral do colesterol. 3 O autoanticorpo mais comum encontrado no AAD é o 21-OH, e os anticorpos contra qualquer uma das principais enzimas para a produção de esteróides são diagnósticos para AAD. As células do córtex adrenal são direcionadas, destruídas e substituídas por tecido fibroso por inflamação imunomediada. Em alguns pacientes, pelo menos 90% do córtex adrenal é destruído antes que os sintomas se tornem diagnósticos.
Os sintomas da AAD incluem fraqueza, náuseas, diminuição do apetite, perda de peso, hiperpigmentação (Figura\(\PageIndex{3}\)), hipercalemia (níveis elevados de potássio no sangue), hiponatremia (diminuição dos níveis de sódio no sangue), hipoglicemia (diminuição dos níveis de açúcar no sangue), hipotensão (diminuição da pressão arterial), anemia, linfocitose (diminuição dos níveis de glóbulos brancos) e fadiga. Sob estresse extremo, como cirurgia, trauma acidental ou infecção, pacientes com DAA podem sofrer uma crise adrenal que faz com que o paciente vomite, sinta dor abdominal, cãibras nas costas ou nas pernas e até mesmo hipotensão grave, levando ao choque.
Exercício\(\PageIndex{1}\)
- Quais são os nomes das doenças autoimunes que interferem na função hormonal da glândula?
- Descreva como os mecanismos da doença de Graves e da tireoidite de Hashimoto diferem.
- Nomeie as células que são destruídas no diabetes mellitus tipo 1 e descreva o resultado.
Doenças autoimunes sistêmicas
Enquanto as doenças autoimunes específicas de órgãos têm como alvo órgãos ou tecidos específicos, as doenças autoimunes sistêmicas são mais generalizadas, atingindo vários órgãos ou tecidos em todo o corpo. Exemplos de doenças autoimunes sistêmicas incluem esclerose múltipla, miastenia gravis, psoríase, artrite reumatoide e lúpus eritematoso sistêmico.
Esclerose múltipla
A esclerose múltipla (EM) é uma doença autoimune do sistema nervoso central que afeta o cérebro e a medula espinhal. Lesões em vários locais do sistema nervoso central são uma característica da esclerose múltipla e são causadas pela infiltração de células imunes através da barreira hematoencefálica. As células imunes incluem células T que promovem inflamação, desmielinização e degeneração neuronal, que interrompem a sinalização neuronal. Os sintomas da EM incluem distúrbios visuais; fraqueza muscular; dificuldade de coordenação e equilíbrio; sensações como dormência, formigamento ou “alfinetes e agulhas”; e problemas cognitivos e de memória.
Miastenia gravis
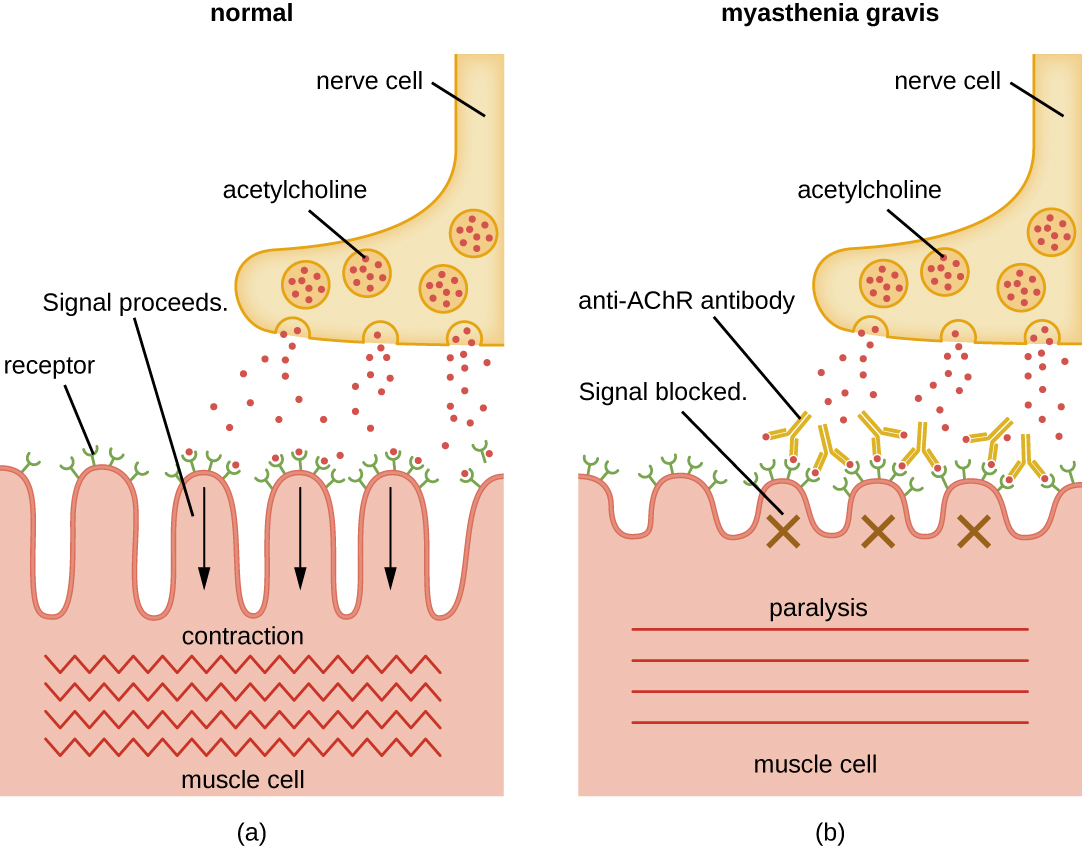
Autoanticorpos direcionados contra receptores de acetilcolina (AChRs) na fenda sináptica das junções neuromusculares levam à miastenia gravis (Figura\(\PageIndex{4}\)). Os anticorpos anti-ACHR são IgGs de alta afinidade e sua síntese requer células T CD4 ativadas para interagir e estimular as células B. Uma vez produzidos, os anticorpos anti-ACHR afetam a transmissão neuromuscular por pelo menos três mecanismos:
- Ligação e ativação do complemento na junção neuromuscular
- Endocitose acelerada por AChR de moléculas reticuladas por anticorpos
- Bloqueio funcional da AChR, que impede a ligação normal da acetilcolina e a ativação da AChR
Independentemente do mecanismo, o efeito do anti-ACHR é fraqueza muscular extrema e potencialmente morte por parada respiratória em casos graves.
Psoríase
A psoríase é uma doença de pele que causa coceira ou dor na pele grossa e vermelha com escamas prateadas nos cotovelos, joelhos, couro cabeludo, costas, rosto, palmas das mãos, pés e, às vezes, em outras áreas. Alguns indivíduos com psoríase também têm uma forma de artrite chamada artrite psoriática, na qual as articulações podem ficar inflamadas. A psoríase resulta da complexa interação entre queratinócitos, células dendríticas e células T e as citocinas produzidas por essas várias células. Em um processo chamado renovação celular, as células da pele que crescem profundamente na pele sobem à superfície. Normalmente, esse processo leva um mês. Na psoríase, como resultado da ativação de citocinas, a renovação celular ocorre em apenas alguns dias. As espessas manchas inflamadas da pele que são características da psoríase se desenvolvem porque as células da pele se elevam muito rápido.
Artrite reumatóide
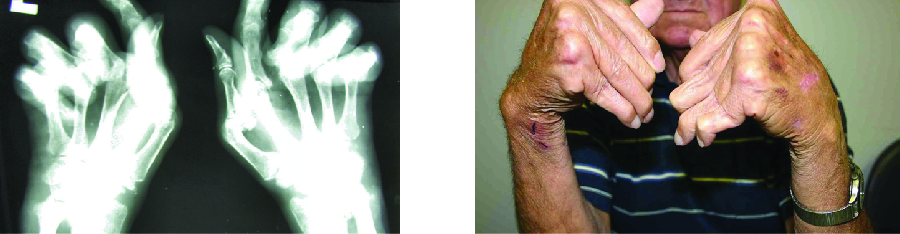
A doença inflamatória articular crônica mais comum é a artrite reumatoide (AR\(\PageIndex{5}\)) (Figura) e ainda é um grande desafio médico devido a questões não resolvidas relacionadas às causas ambientais e genéticas da doença. A AR envolve reações de hipersensibilidade do tipo III e a ativação de células T CD4, resultando na liberação crônica das citocinas inflamatórias IL-1, IL-6 e do fator de necrose tumoral α (TNF-α). As células T CD4 ativadas também estimulam a produção de anticorpos do fator reumatoide (RF) e anticorpos peptídicos citrulinados anticíclicos (anti-CCP) que formam complexos imunes. Níveis aumentados de proteínas de fase aguda, como a proteína C reativa (PCR), também são produzidos como parte do processo inflamatório e participam da fixação do complemento com os anticorpos nos imunocomplexos. A formação de complexos imunes e a reação aos fatores imunes causam um processo inflamatório nas articulações, principalmente nas mãos, pés e pernas. O diagnóstico da AR é baseado em níveis elevados de RF, anti-CCP, PCR quantitativa e na taxa de sedimentação de eritrócitos (ESR) (Westergren modificado). Além disso, radiografias, ultrassonografia ou ressonância magnética podem identificar danos nas articulações, como erosões, perda de osso dentro da articulação e estreitamento do espaço articular.
Lúpus eritematoso sistêmico
O dano e a patologia do lúpus eritematoso sistêmico (LES) são causados por reações de hipersensibilidade do tipo III. Os autoanticorpos produzidos no LES são direcionados contra proteínas nucleares e citoplasmáticas. Os anticorpos antinucleares (ANAs) estão presentes em mais de 95% dos pacientes com LES, 4 com autoanticorpos adicionais, incluindo DNA anti-dupla fita (ds-DNA) e anticorpos anti-Sm (anticorpos contra pequenas ribonucleoproteínas nucleares). Os anticorpos anti-DS-DNA e anti-Sm são exclusivos para pacientes com LES; portanto, sua presença está incluída nos critérios de classificação do LES. A interação celular com autoanticorpos leva à destruição nuclear e celular, com componentes liberados após a morte celular levando à formação de complexos imunes.
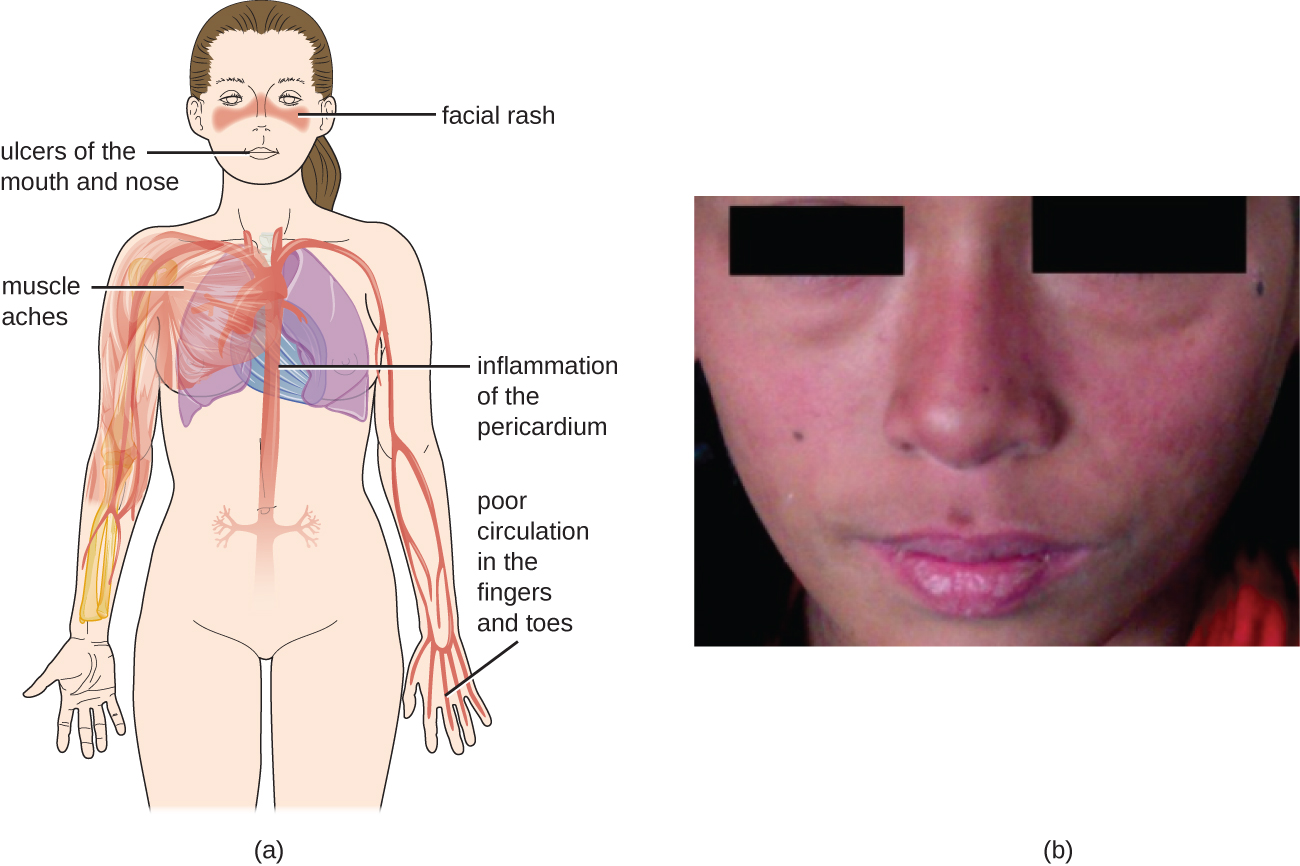
Como os autoanticorpos no LES podem atingir uma grande variedade de células, os sintomas do LES podem ocorrer em muitos locais do corpo. No entanto, os sintomas mais comuns incluem fadiga, febre sem outra causa, queda de cabelo e uma erupção cutânea sensível à luz solar com “borboleta” ou máscara de lobo (lúpus), encontrada em cerca de 50% das pessoas com LES (Figura\(\PageIndex{6}\)). A erupção cutânea é mais frequentemente observada nas bochechas e na ponte do nariz, mas pode ser generalizada. Outros sintomas podem aparecer dependendo das áreas afetadas. As articulações podem ser afetadas, causando artrite dos dedos, mãos, pulsos e joelhos. Os efeitos no cérebro e no sistema nervoso podem causar dores de cabeça, dormência, formigamento, convulsões, problemas de visão e alterações de personalidade. Também pode haver dor abdominal, náuseas, vômitos, arritmias, falta de ar e sangue no escarro. Os efeitos na pele podem levar a áreas adicionais de lesões cutâneas, e a vasoconstrição pode causar alterações de cor nos dedos quando estão frios (fenômeno de Raynaud). Os efeitos nos rins podem levar ao edema nas pernas e ao ganho de peso. O diagnóstico de LES depende da identificação de quatro dos 11 sintomas mais comuns e da produção confirmada de uma série de autoanticorpos exclusivos para o LES. Um teste positivo para ANAs por si só não é diagnóstico.
Exercício\(\PageIndex{2}\)
- Liste as formas pelas quais os anticorpos contribuem para a patogênese da miastenia gravis.
- Explique por que a artrite reumatoide é considerada uma hipersensibilidade do tipo III.
- Descreva os sintomas do lúpus eritematoso sistêmico e explique por que eles afetam tantas partes diferentes do corpo.
- O que é reconhecido como antígeno na miastenia gravis?
| Doença | Causa | Sinais e sintomas |
|---|---|---|
| Doença de Addison | Destruição de células da glândula adrenal por células T citotóxicas | Fraqueza, náuseas, hipotensão, fadiga; crise adrenal com dor intensa no abdômen, região lombar e pernas; colapso do sistema circulatório, insuficiência renal |
| Doença celíaca | Anticorpos contra o glúten se tornam autoanticorpos que atingem as células do intestino delgado. | Diarreia intensa, dor abdominal, anemia, desnutrição |
| Diabetes mellitus (tipo I) | Destruição citotóxica das células β produtoras de insulina do pâncreas | Hiperglicemia, aumento extremo da sede e micção, perda de peso, fadiga extrema |
| doença de Graves | Os autoanticorpos têm como alvo os receptores do hormônio estimulante da tireoide, resultando em superestimulação da tireoide | Hipertireoidismo com batimento cardíaco rápido e irregular, intolerância ao calor, perda de peso, bócio, exoftalmia |
| Tireoidite de Hashimoto | A glândula tireoide é atacada por células T citotóxicas, linfócitos, macrófagos e autoanticorpos | Tireoidite com bócio, intolerância ao frio, fraqueza muscular, dores e rigidez nas articulações, depressão, perda de memória |
| Esclerose múltipla (EM) | Destruição citotóxica de células T da bainha de mielina ao redor dos axônios nervosos no sistema nervoso central | Distúrbios visuais, fraqueza muscular, comprometimento da coordenação e do equilíbrio, dormência, sensação de formigamento ou “picadas”, comprometimento da função cognitiva e da memória |
| Miastenia gravis | Autoanticorpos direcionados contra receptores de acetilcolina dentro da junção neuromuscular | Fraqueza muscular extrema que eventualmente leva à parada respiratória fatal |
| Psoríase | A ativação de queratinócitos por citocinas causa renovação celular epidérmica rápida e excessiva | Manchas doloridas ou com coceira na pele grossa e vermelha com escamas prateadas; geralmente afeta cotovelos, joelhos, couro cabeludo, costas, rosto, palmas das mãos e pés |
| Artrite reumatoide | Autoanticorpos, complexos imunes, ativação do complemento, fagócitos e células T danificam as membranas e os ossos das articulações | Inflamação, dor e desfiguração das articulações, inflamação sistêmica crônica |
| Lúpus eritematoso sistêmico (LES) | Autoanticorpos direcionados contra moléculas nucleares e citoplasmáticas formam complexos imunes que se depositam nos tecidos. Células fagocíticas e ativação do complemento causam danos e inflamações nos tecidos | Fadiga, febre, dor e inchaço nas articulações, queda de cabelo, anemia, coagulação, erupção cutânea “borboleta” sensível à luz solar, lesões cutâneas, fotossensibilidade, diminuição da função renal, perda de memória, confusão, depressão |
Conceitos principais e resumo
- As doenças autoimunes resultam de uma quebra na tolerância imunológica. Os eventos reais de indução para estados autoimunes são amplamente desconhecidos.
- Algumas doenças autoimunes atacam órgãos específicos, enquanto outras são mais sistêmicas.
- As doenças autoimunes específicas de órgãos incluem doença celíaca, doença de Graves, tireoidite de Hashimoto, diabetes mellitus tipo I e doença de Addison.
- As doenças autoimunes sistêmicas incluem esclerose múltipla, miastenia gravis, psoríase, artrite reumatoide e lúpus eritematoso sistêmico.
- Os tratamentos para doenças autoimunes geralmente envolvem medicamentos anti-inflamatórios e imunossupressores.
Notas de pé
- 1 D.A. Van Heel, J. West. “Avanços recentes na doença celíaca.” Gut 55 nº 7 (2006) :1037—1046.
- 2 ibidem.
- 3 P. Martorell e cols.. “Autoimunidade na doença de Addison.” Revista Holandesa de Medicina 60 no. 7 (2002) :269—275.
- 4 C.C. Mok, C.S. Lau. “Patogênese do lúpus eritematoso sistêmico”. Jornal de Patologia Clínica 56 no. 7 (2003) :481—490.


