19.1: Hipersensibilidades
- Page ID
- 181316
Objetivos de
- Identifique e compare as características distintivas, os mecanismos e os principais exemplos de hipersensibilidades do tipo I, II, III e IV
Foco clínico: Parte 1
Kerry, uma piloto de avião de 40 anos, marcou uma consulta com seu médico de cuidados primários para discutir uma erupção cutânea que se desenvolve sempre que ela passa um tempo ao sol. Como ela explica ao médico, não parece uma queimadura solar. Ela toma cuidado para não passar muito tempo ao sol e usa protetor solar. Apesar dessas precauções, a erupção cutânea ainda aparece, manifestando-se como manchas vermelhas e salientes que ficam levemente escamosas. A erupção cutânea persiste por 7 a 10 dias de cada vez e parece desaparecer sozinha. Ultimamente, as erupções cutâneas também começaram a aparecer em suas bochechas e acima dos olhos, em ambos os lados da testa.
Exercício\(\PageIndex{1}\)
- Kerry está certa em se preocupar, ou ela deveria simplesmente ter mais cuidado com a exposição ao sol?
- Existem condições que podem ser causadas pela exposição ao sol que o médico de Kerry deveria considerar?
Em Defesas Adaptativas Específicas do Hospedeiro, discutimos os mecanismos pelos quais as defesas imunes adaptativas, tanto humorais quanto celulares, nos protegem de doenças infecciosas. No entanto, essas mesmas defesas imunológicas protetoras também podem ser responsáveis por reações indesejáveis chamadas reações de hipersensibilidade. As reações de hipersensibilidade são classificadas por seu mecanismo imunológico.
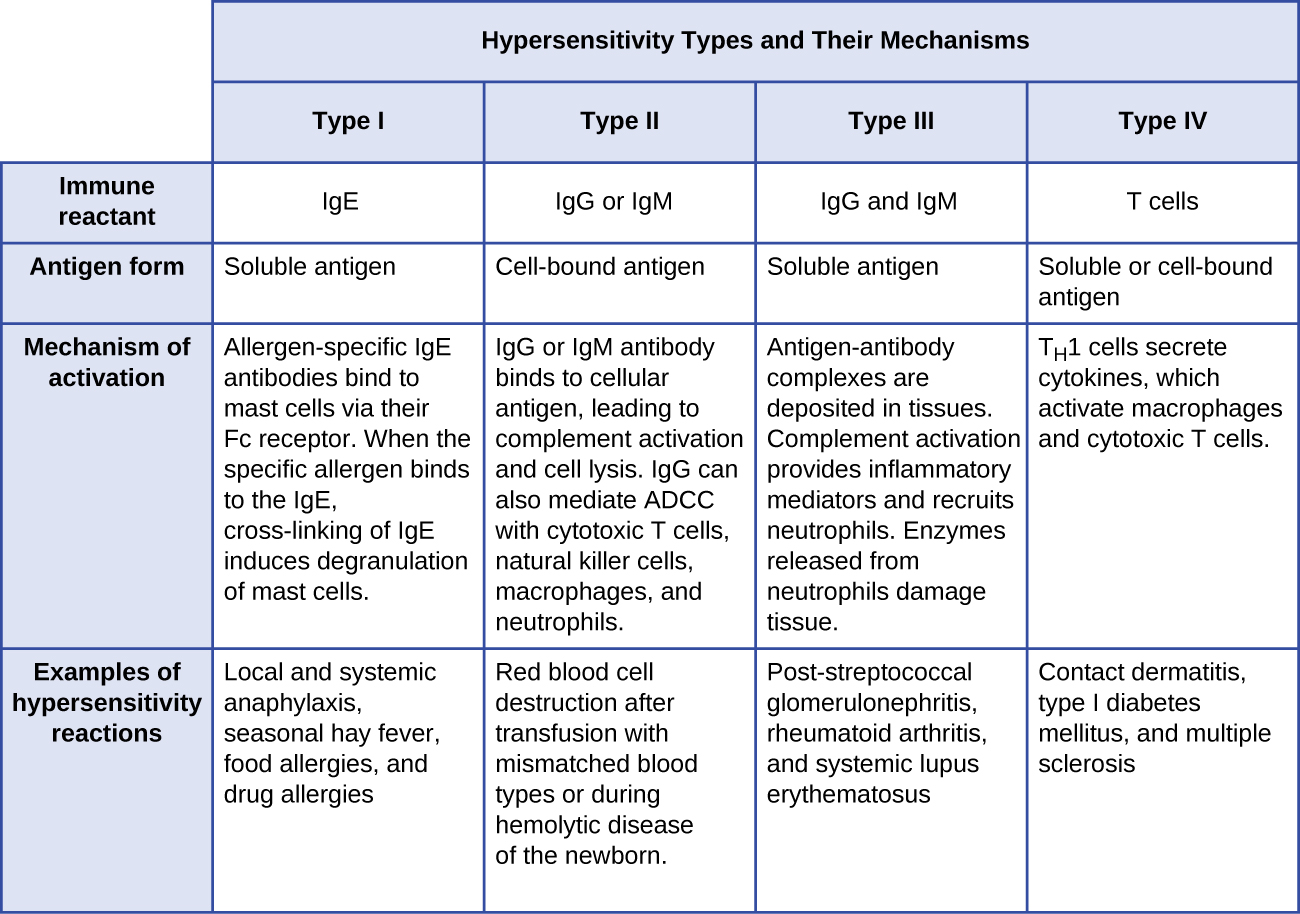
- As reações de hipersensibilidade do tipo I envolvem o anticorpo da imunoglobulina E (IgE) contra o antígeno solúvel, desencadeando a degranulação dos mastócitos.
- As reações de hipersensibilidade do tipo II envolvem anticorpos IgG e IgM direcionados contra antígenos celulares, levando a danos celulares mediados por outros efetores do sistema imunológico.
- As reações de hipersensibilidade do tipo III envolvem as interações de anticorpos IgG, IgM e, ocasionalmente, IgA 1 com antígeno para formar complexos imunes. O acúmulo de complexos imunes no tecido leva a danos nos tecidos mediados por outros efetores do sistema imunológico.
- As reações de hipersensibilidade do tipo IV são reações mediadas por células T que podem envolver danos nos tecidos mediados por macrófagos ativados e células T citotóxicas.
Hipersensibilidades do tipo I
Quando um indivíduo pré-sensibilizado é exposto a um alérgeno, isso pode levar a uma resposta imune rápida que ocorre quase imediatamente. Essa resposta é chamada de alergia e é classificada como hipersensibilidade do tipo I. Os alérgenos podem ser substâncias aparentemente inofensivas, como pêlos de animais, fungos ou pólen. Os alérgenos também podem ser substâncias consideradas inatamente mais perigosas, como veneno de insetos ou medicamentos terapêuticos. As intolerâncias alimentares também podem produzir reações alérgicas à medida que os indivíduos se tornam sensibilizados a alimentos como amendoim ou marisco (Figura\(\PageIndex{1}\)). Independentemente do alérgeno, a primeira exposição ativa uma resposta primária de anticorpos IgE que sensibiliza um indivíduo à reação de hipersensibilidade do tipo I após a exposição subsequente.
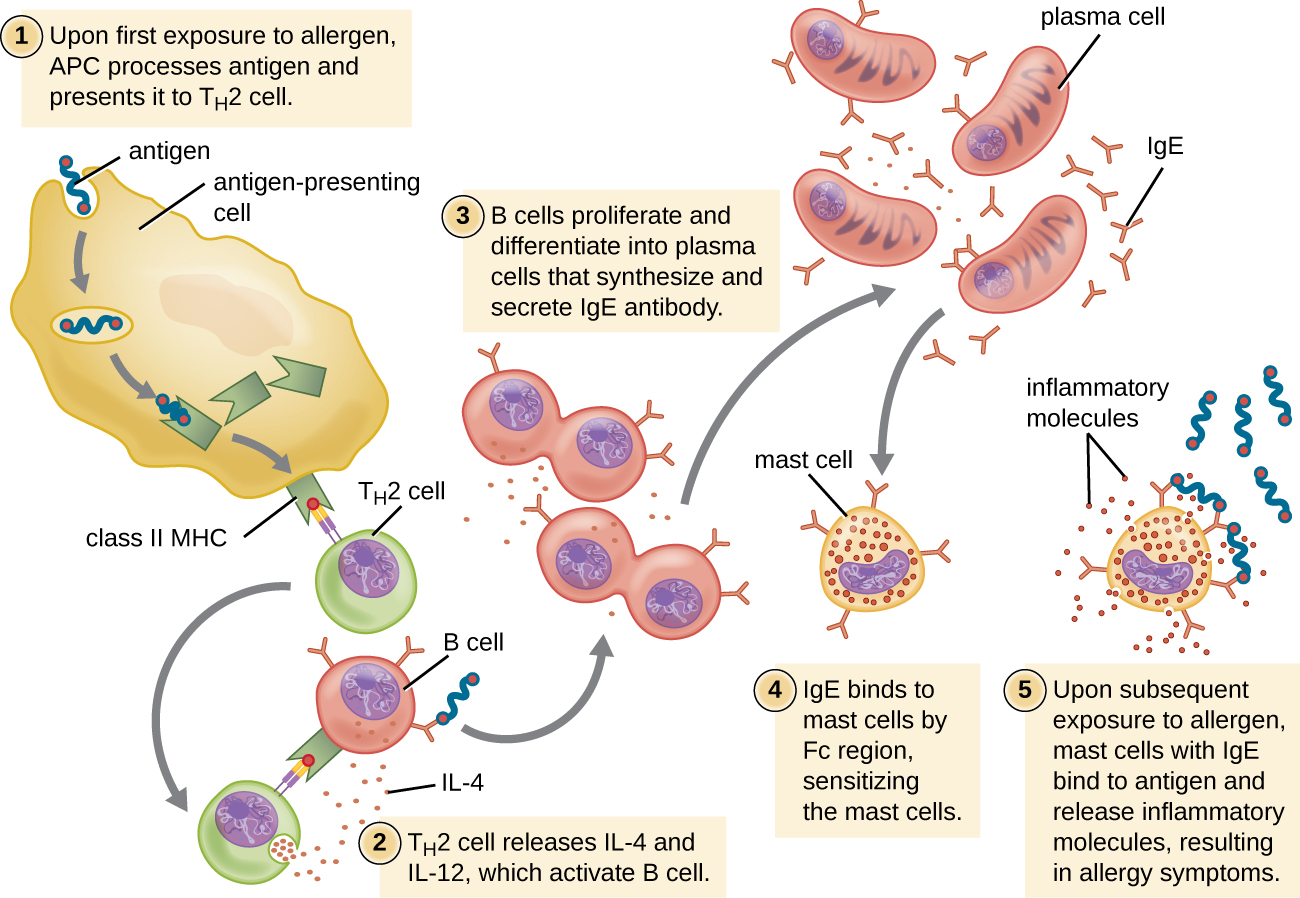
Para indivíduos suscetíveis, uma primeira exposição a um alérgeno ativa uma forte resposta das células T H 2 (Figura\(\PageIndex{2}\)). As citocinas interleucina (IL) -4 e IL-13 das células T H 2 ativam células B específicas para o mesmo alérgeno, resultando em proliferação clonal, diferenciação em células plasmáticas e mudança de classe de anticorpos da produção de IgM para a produção de IgE. As regiões cristalizáveis fragmentadas (Fc) dos anticorpos IgE se ligam a receptores específicos na superfície dos mastócitos em todo o corpo. Estima-se que cada mastócito possa se ligar a até 500.000 moléculas de IgE, com cada molécula de IgE tendo dois locais de ligação ao antígeno de fragmento específico para alérgenos (Fab) disponíveis para ligação ao alérgeno em exposições subsequentes. No momento em que isso ocorre, o alérgeno geralmente não está mais presente e não há reação alérgica, mas os mastócitos são preparados para uma exposição subsequente e o indivíduo é sensibilizado ao alérgeno.
Na exposição subsequente, os alérgenos se ligam a várias moléculas de IgE nos mastócitos, reticulando as moléculas de IgE. Em minutos, essa reticulação de IgE ativa os mastócitos e desencadeia a degranulação, uma reação na qual o conteúdo dos grânulos no mastócito é liberado no ambiente extracelular. Os componentes pré-formados que são liberados dos grânulos incluem histamina, serotonina e bradicinina (Tabela\(\PageIndex{1}\)). Os mastócitos ativados também liberam mediadores lipídicos recém-formados (leucotrienos e prostaglandinas do metabolismo do ácido araquadônico da membrana) e citocinas, como o fator de necrose tumoral (Tabela\(\PageIndex{2}\)).
| Componente granulado | Atividade |
|---|---|
| Heparina | Estimula a geração de bradicinina, que causa aumento da permeabilidade vascular, vasodilatação, constrição dos bronquíolos e aumento da secreção de muco |
| Histamina | Causa contração do músculo liso, aumenta a permeabilidade vascular, aumenta a formação de muco e lágrimas |
| Serotonina | Aumenta a permeabilidade vascular, causa vasodilatação e contração do músculo liso |
Os mediadores químicos liberados pelos mastócitos causam coletivamente a inflamação e os sinais e sintomas associados às reações de hipersensibilidade do tipo I. A histamina estimula a secreção de muco nas vias nasais e a formação de lágrimas nas glândulas lacrimais, promovendo o corrimento nasal e os olhos lacrimais das alergias. A interação da histamina com as terminações nervosas causa coceira e espirros. A vasodilatação causada por vários dos mediadores pode resultar em urticária, dores de cabeça, angioedema (inchaço que geralmente afeta os lábios, garganta e língua) e hipotensão (pressão arterial baixa). A constrição dos bronquíolos causada por alguns dos mediadores químicos causa chiado, dispneia (dificuldade em respirar), tosse e, em casos mais graves, cianose (cor azulada na pele ou nas membranas mucosas). O vômito pode resultar da estimulação do centro do vômito no cerebelo pela histamina e serotonina. A histamina também pode causar relaxamento da musculatura lisa intestinal e diarreia.
| Mediador químico | Atividade |
|---|---|
| Leucotieno | Causa contração muscular lisa e secreção de muco, aumenta a permeabilidade vascular |
| Prostaglandina | Causa contração e vasodilatação do músculo liso |
| TNF-α (citocina) | Causa inflamação e estimula a produção de citocinas por outros tipos celulares |
As reações de hipersensibilidade do tipo I podem ser localizadas ou sistêmicas. As reações de hipersensibilidade localizadas do tipo I incluem febre do feno, rinite, urticária e asma (Tabela\(\PageIndex{3}\)). As reações de hipersensibilidade sistêmica do tipo I são chamadas de anafilaxia ou choque anafilático. Embora a anafilaxia compartilhe muitos sintomas comuns às reações de hipersensibilidade localizadas do tipo I, o inchaço da língua e da traquéia, o bloqueio das vias aéreas, a queda perigosa da pressão arterial e o desenvolvimento de choque podem tornar a anafilaxia especialmente grave e potencialmente fatal. De fato, a morte pode ocorrer minutos após o início dos sinais e sintomas.
As reações de fase tardia nas hipersensibilidades do tipo I podem se desenvolver de 4 a 12 horas após a fase inicial e são mediadas por eosinófilos, neutrófilos e linfócitos que foram recrutados por fatores quimiotáticos liberados pelos mastócitos. A ativação dessas células recrutadas leva à liberação de mais mediadores químicos que causam danos nos tecidos e sintomas de fase tardia de inchaço e vermelhidão da pele, tosse, chiado e corrimento nasal.
Espera-se que indivíduos que possuem genes para características desadaptativas, como reações intensas de hipersensibilidade do tipo I a componentes do meio ambiente inofensivos, sofram um sucesso reprodutivo reduzido. Com esse tipo de pressão seletiva evolutiva, não se espera que tais características persistam em uma população. Isso sugere que as hipersensibilidades do tipo I podem ter uma função adaptativa. Há evidências de que a IgE produzida durante as reações de hipersensibilidade do tipo I é, na verdade, destinada a combater infecções por helmintos 2. Os helmintos são um dos poucos organismos que possuem proteínas que são alvo da IgE. Além disso, há evidências de que infecções por helmintos em tenra idade reduzem a probabilidade de hipersensibilidade do tipo I a substâncias inócuas mais tarde na vida. Portanto, pode ser que as alergias sejam uma consequência infeliz de uma forte seleção na linhagem de mamíferos ou mais cedo para uma defesa contra vermes parasitas.
| Nome comum | Causa | Sinais e sintomas |
|---|---|---|
| Asma induzida por alergia | Inalação de alérgenos | Constrição dos brônquios, dificuldade respiratória, tosse, calafrios, dores no corpo |
| Anafilaxia | Reação sistêmica aos alérgenos | Urticária, comichão, inchaço da língua e da garganta, náuseas, vômitos, pressão arterial baixa, choque |
| Febre do feno | Inalação de mofo ou pólen | Coriza, olhos lacrimejantes, espirros |
| Urticária | Alérgenos alimentares ou medicamentosos, picadas de insetos | Erupção cutânea elevada e irregular com coceira; inchaços podem convergir em grandes áreas elevadas |
Exercício\(\PageIndex{2}\)
- Quais são as células que causam uma reação de hipersensibilidade do tipo I?
- Descreva as diferenças entre as reações de hipersensibilidade tipo I de fase imediata e tardia.
- Liste os sinais e sintomas da anafilaxia.
A hipótese da higiene
Na maioria das sociedades modernas, a boa higiene está associada ao banho regular e a boa saúde à limpeza. Mas alguns estudos recentes sugerem que a associação entre saúde e vida limpa pode ser defeituosa. Alguns chegam ao ponto de sugerir que as crianças devem ser incentivadas a brincar na sujeira - ou até mesmo comer sujeira 3 - para o benefício de sua saúde. Essa recomendação é baseada na chamada hipótese de higiene, que propõe que a exposição infantil a antígenos de uma gama diversificada de micróbios leva a um melhor funcionamento do sistema imunológico mais tarde na vida.
A hipótese de higiene foi sugerida pela primeira vez em 1989 por David Strachan 4, que observou uma relação inversa entre o número de filhos mais velhos em uma família e a incidência da febre do feno. Embora a febre do feno em crianças tenha aumentado dramaticamente em meados do século XX, a incidência foi significativamente menor em famílias com mais filhos. Strachan propôs que a menor incidência de alergias em famílias numerosas poderia estar ligada a infecções adquiridas de irmãos mais velhos, sugerindo que essas infecções tornavam as crianças menos suscetíveis a alergias. Strachan também argumentou que as tendências para famílias menores e uma maior ênfase na limpeza no século XX diminuíram a exposição a patógenos e, portanto, levaram a maiores taxas gerais de alergias, asma e outros distúrbios imunológicos.
Outros pesquisadores observaram uma relação inversa entre a incidência de doenças imunológicas e doenças infecciosas que agora são raras em países industrializados, mas ainda comuns em países menos industrializados. 5 Nos países desenvolvidos, crianças menores de 5 anos não estão expostas a muitos dos micróbios, moléculas e antígenos que quase certamente teriam encontrado há um século. A falta de desafios iniciais ao sistema imunológico por organismos com os quais os humanos e seus ancestrais evoluíram pode resultar em falhas no funcionamento do sistema imunológico mais tarde na vida.
Hipersensibilidades do tipo II (citotóxicas)
As reações imunes categorizadas como hipersensibilidades do tipo II, ou hipersensibilidades citotóxicas, são mediadas pela ligação de anticorpos IgG e IgM a antígenos da superfície celular ou antígenos associados à matriz nas membranas basais. Esses anticorpos podem ativar o complemento, resultando em uma resposta inflamatória e lise das células-alvo, ou podem estar envolvidos na citotoxicidade mediada por células dependentes de anticorpos (ADCC) com células T citotóxicas.
Em alguns casos, o antígeno pode ser um autoantígeno, caso em que a reação também seria descrita como uma doença autoimune. (As doenças autoimunes são descritas em Distúrbios autoimunes). Em outros casos, os anticorpos podem se ligar a moléculas naturais, mas exógenas, da superfície celular, como antígenos associados à tipagem sanguínea encontrada nos glóbulos vermelhos (eritrócitos). Isso leva ao revestimento dos eritrócitos por anticorpos, à ativação da cascata do complemento e à lise dos eritrócitos mediada pelo complemento, bem como à opsonização dos eritrócitos para fagocitose. Dois exemplos de reações de hipersensibilidade do tipo II envolvendo eritrócitos são a reação de transfusão hemolítica (HTR) e a doença hemolítica do recém-nascido (HDN). Essas reações de hipersensibilidade do tipo II, que serão discutidas com mais detalhes, estão resumidas na Tabela\(\PageIndex{4}\).
A imunohematologia é o estudo do sangue e do tecido hematopoiético em relação à resposta imune. As respostas iniciadas por anticorpos contra células sanguíneas são hipersensibilidades do tipo II, caindo assim no campo da imunohematologia. Para que os alunos aprendam pela primeira vez sobre imunohematologia, entender os mecanismos imunológicos envolvidos se torna ainda mais desafiador pelo complexo sistema de nomenclatura usado para identificar diferentes antígenos do grupo sanguíneo, geralmente chamados de tipos sanguíneos. Os primeiros antígenos do grupo sanguíneo usavam nomes alfabéticos ou receberam o nome da primeira pessoa conhecida por produzir anticorpos contra o antígeno dos glóbulos vermelhos (por exemplo, Kell, Duffy ou Diego). No entanto, em 1980, o Grupo de Trabalho sobre Terminologia da Sociedade Internacional de Transfusão de Sangue (ISBT) criou um padrão para a terminologia de grupos sanguíneos na tentativa de identificar de forma mais consistente antígenos de grupos sanguíneos recém-descobertos. Agora, novos antígenos recebem um número e são atribuídos a um sistema, coleção ou série de grupos sanguíneos. No entanto, mesmo com esse esforço, a nomenclatura do grupo sanguíneo ainda é inconsistente.
| Nome comum | Causa | Sinais e sintomas |
|---|---|---|
| Doença hemolítica do recém-nascido (HDN) | A IgG da mãe atravessa a placenta, visando a destruição dos eritrócitos do feto | Anemia, edema, aumento do fígado ou baço, hidropisia (líquido na cavidade corporal), levando à morte do recém-nascido em casos graves |
| Reações hemolíticas de transfusão (HTR) | IgG e IgM se ligam a antígenos em eritrócitos transfundidos, visando os eritrócitos de doadores para destruição | Febre, icterícia, hipotensão, coagulação intravascular disseminada, possivelmente levando à insuficiência renal e morte |
Incompatibilidade do grupo sanguíneo ABO
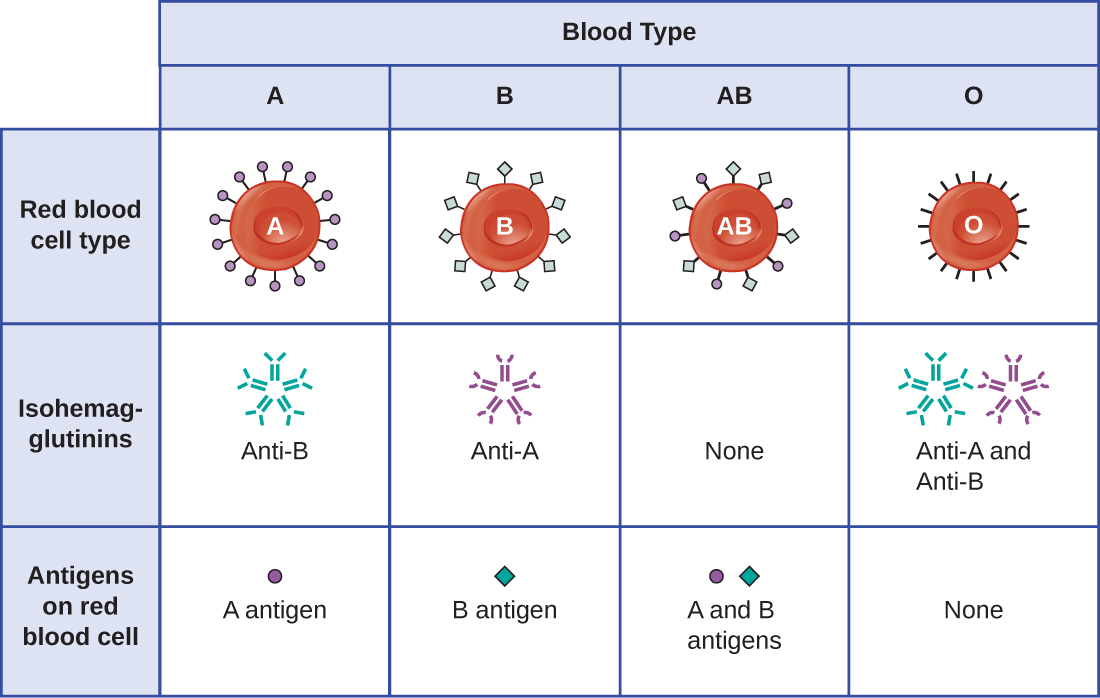
O reconhecimento de que indivíduos têm diferentes tipos sanguíneos foi descrito pela primeira vez por Karl Landsteiner (1868-1943) no início dos anos 1900, com base em sua observação de que o soro de uma pessoa poderia causar um acúmulo de eritrócitos de outra. Esses estudos levaram Landsteiner à identificação de quatro tipos sanguíneos distintos. Pesquisas subsequentes de outros cientistas determinaram que os quatro tipos sanguíneos foram baseados na presença ou ausência de glicoproteínas de superfície “A” e “B”, e isso forneceu a base para o sistema de grupos sanguíneos ABO que ainda está em uso hoje (Figura\(\PageIndex{3}\)). As funções desses antígenos são desconhecidas, mas algumas foram associadas às funções bioquímicas normais da célula. Além disso, os tipos sanguíneos ABO são herdados como alelos (um de cada progenitor) e apresentam padrões de herança dominante e codominante. Os alelos dos tipos sanguíneos A e B são codominantes entre si, e ambos são dominantes sobre o tipo sanguíneo O. Portanto, indivíduos com genótipos de AA ou AO têm sangue tipo A e expressam o antígeno da glicoproteína A na superfície de seus eritrócitos. Pessoas com genótipos de BB ou BO têm sangue tipo B e expressam o antígeno da glicoproteína B na superfície de seus eritrócitos. Aqueles com um genótipo AB têm sangue do tipo AB e expressam antígenos da glicoproteína A e B na superfície de seus eritrócitos. Finalmente, indivíduos com um genótipo de OO têm sangue tipo O e não têm glicoproteínas A e B na superfície de seus eritrócitos.
É importante observar que os eritrócitos de todos os quatro tipos sanguíneos ABO compartilham uma molécula receptora de proteína comum, e é a adição de carboidratos específicos aos receptores de proteína que determina os tipos sanguíneos A, B e AB. Os genes herdados dos tipos sanguíneos A, B e AB codificam enzimas que adicionam o componente carboidrato ao receptor de proteína. Indivíduos com tipo sanguíneo O ainda têm o receptor de proteína, mas não possuem as enzimas que adicionariam carboidratos que tornariam seus glóbulos vermelhos do tipo A, B ou AB.
Os anticorpos IgM no plasma que reagem de forma cruzada com antígenos do grupo sanguíneo não presentes nos eritrócitos do próprio indivíduo são chamados de isohemaglutininas (Figura\(\PageIndex{3}\)). As isohemaglutininas são produzidas nas primeiras semanas após o nascimento e persistem ao longo da vida. Esses anticorpos são produzidos em resposta à exposição a antígenos ambientais de alimentos e microrganismos. Uma pessoa com sangue tipo A tem antígenos A na superfície de seus eritrócitos e produzirá anticorpos anti-B contra antígenos ambientais que se assemelham ao componente carboidrato dos antígenos B. Uma pessoa com sangue tipo B tem antígenos B na superfície de seus eritrócitos e produzirá anticorpos anti-A contra antígenos ambientais que são semelhantes ao componente carboidrato dos antígenos A. Pessoas com sangue do tipo O não têm antígenos A e B em seus eritrócitos e, portanto, produzem anticorpos anti-A e anti-B. Por outro lado, pessoas com tipo sanguíneo AB têm antígenos A e B em seus eritrócitos e, portanto, não possuem anticorpos anti-A e anti-B.
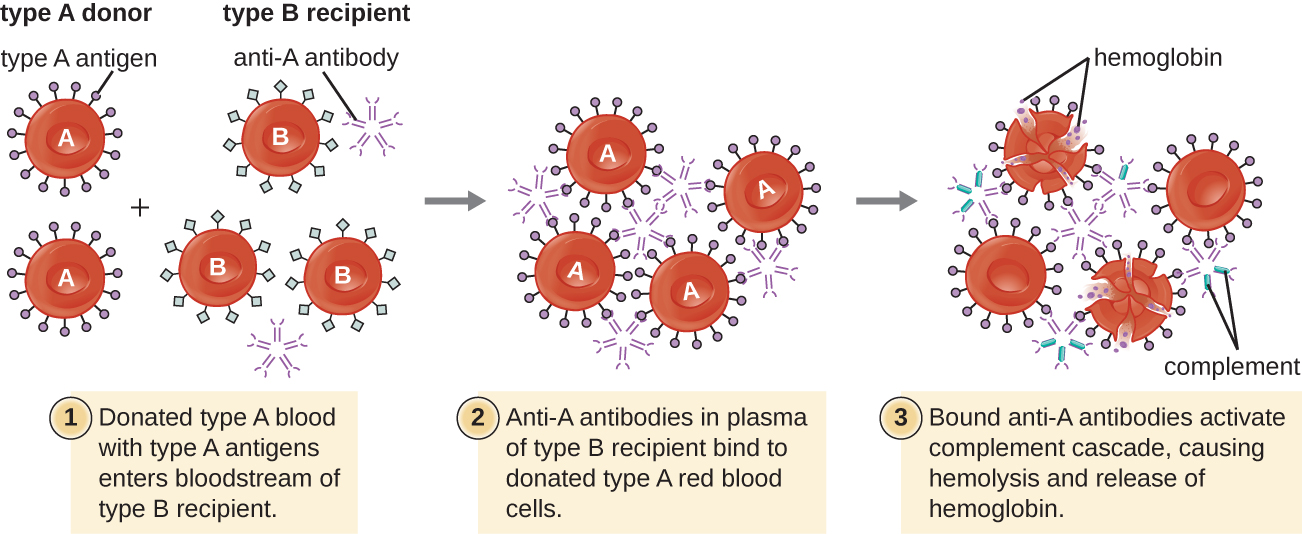
Um paciente pode precisar de uma transfusão de sangue porque não tem eritrócitos (anemia) suficientes ou porque sofreu perda significativa de volume sanguíneo por trauma ou doença. Embora a transfusão de sangue seja administrada para ajudar o paciente, é essencial que o paciente receba uma transfusão com o tipo sanguíneo ABO correspondente. Uma transfusão com um tipo sanguíneo ABO incompatível pode levar a uma resposta citotóxica de hipersensibilidade do tipo II forte e potencialmente letal chamada reação de transfusão hemolítica (HTR) (Figura\(\PageIndex{4}\)).
Por exemplo, se uma pessoa com sangue do tipo B receber uma transfusão de sangue do tipo A, seus anticorpos anti-A se ligarão e aglutinarão os eritrócitos transfundidos. Além disso, a ativação da cascata clássica do complemento levará a uma forte resposta inflamatória, e o complexo de ataque à membrana do complemento (MAC) mediará a hemólise maciça dos eritrócitos transfundidos. Os detritos dos eritrócitos danificados e destruídos podem ocluir os vasos sanguíneos nos alvéolos dos pulmões e nos glomérulos dos rins. Dentro de 1 a 24 horas após uma transfusão incompatível, o paciente apresenta febre, calafrios, prurido (coceira), urticária (urticária), dispneia, hemoglobinúria (hemoglobina na urina) e hipotensão (pressão arterial baixa). Nas reações mais graves, a pressão arterial perigosamente baixa pode causar choque, falência de múltiplos órgãos e morte do paciente.
Hospitais, centros médicos e laboratórios clínicos associados geralmente usam sistemas de hemovigilância para minimizar o risco de HTRs devido a erros administrativos. Os sistemas de hemovigilância são procedimentos que rastreiam as informações de transfusão desde a fonte do doador e os hemoderivados obtidos até o acompanhamento dos pacientes receptores. Os sistemas de hemovigilância usados em muitos países identificam os HTRs e seus resultados por meio de relatórios obrigatórios (por exemplo, para a Food and Drug Administration dos Estados Unidos), e essas informações são valiosas para ajudar a evitar tais ocorrências no futuro. Por exemplo, se for constatado que um HTR é o resultado de um erro laboratorial ou administrativo, hemoderivados adicionais coletados do doador naquele momento podem ser localizados e rotulados corretamente para evitar HTRs adicionais. Como resultado dessas medidas, as mortes associadas à HTR nos Estados Unidos ocorrem em cerca de uma a cada 2 milhões de unidades transfundidas. 6
Fatores Rh
Muitos tipos diferentes de antígenos eritrocitários foram descobertos desde a descrição dos antígenos eritrocitários ABO. Os segundos antígenos RBC descritos com mais frequência são os fatores Rh, nomeados em homenagem aos fatores do macaco rhesus (Macaca mulatta) identificados por Karl Landsteiner e Alexander Weiner em 1940. O sistema Rh dos antígenos RBC é o sistema de grupo sanguíneo mais complexo e imunogênico, com mais de 50 especificidades identificadas até o momento. De todos os antígenos Rh, o designado Rho (Weiner) ou D (Fisher-Race) é o mais imunogênico. As células são classificadas como Rh positivas (Rh+) se o antígeno Rho/D estiver presente ou como Rh negativo (Rh −) se o antígeno Rho/D estiver ausente. Em contraste com as moléculas de carboidratos que distinguem os grupos sanguíneos ABO e são os alvos das isohemaglutininas IgM em HTRs, os antígenos do fator Rh são proteínas. Conforme discutido em Linfócitos B e imunidade humoral, os antígenos proteicos ativam as células B e a produção de anticorpos por meio de um mecanismo dependente de células T, e as células T H 2 estimulam a mudança de classe de IgM para outras classes de anticorpos. No caso dos antígenos do fator Rh, as células T H 2 estimulam a mudança de classe para IgG, e isso tem implicações importantes para o mecanismo do HDN.
Como as incompatibilidades ABO, transfusões de sangue de um doador com antígenos incorretos do fator Rh podem causar uma hipersensibilidade HTR tipo II. No entanto, em contraste com as isohemaglutininas IgM produzidas no início da vida por meio da exposição a antígenos ambientais, a produção de anticorpos anti-fator Rh requer a exposição de um indivíduo com sangue Rh a eritrócitos Rh+ positivos e a ativação de uma resposta primária de anticorpos. Embora essa resposta primária de anticorpos possa causar um HTR no paciente transfusionado, a reação hemolítica seria adiada em até 2 semanas durante o longo período de atraso de uma resposta primária de anticorpos (linfócitos B e imunidade humoral). No entanto, se o paciente receber uma transfusão subsequente com eritrócitos Rh+, uma HTR mais rápida ocorreria com o anticorpo anti-fator RH já presente no sangue. Além disso, a rápida resposta secundária de anticorpos forneceria ainda mais anticorpos anti-fator RH para o HTR.
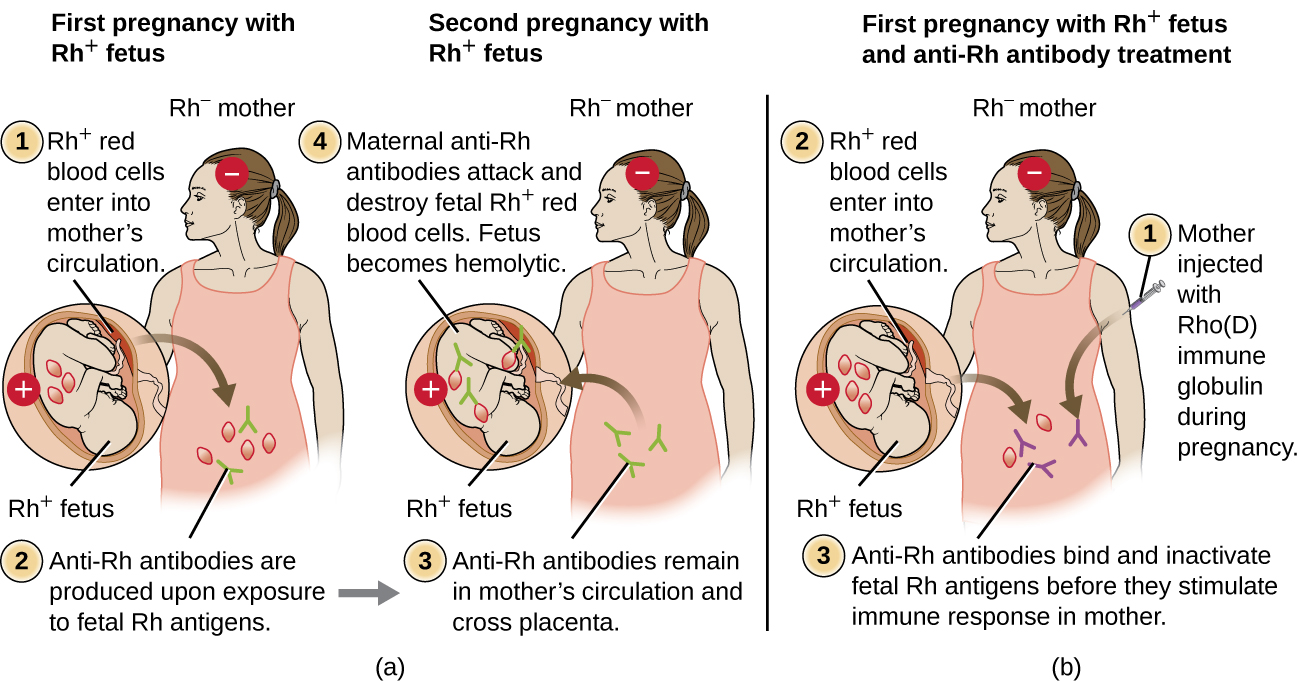
A incompatibilidade do fator Rh entre mãe e feto também pode causar uma reação hemolítica de hipersensibilidade tipo II, conhecida como doença hemolítica do recém-nascido (HDN) (Figura\(\PageIndex{5}\)). Se uma mulher Rh− carrega um bebê Rh+ até o nascimento, o sistema imunológico da mãe pode ser exposto aos glóbulos vermelhos fetais Rh+. Essa exposição geralmente ocorre durante o último trimestre da gravidez e durante o processo de parto. Se essa exposição ocorrer, os eritrócitos fetais Rh+ ativarão uma resposta imune adaptativa primária na mãe e serão produzidos anticorpos IgG anti-fator RH. Os anticorpos IgG são a única classe de anticorpos que podem atravessar a placenta da mãe para o feto; no entanto, na maioria dos casos, o primeiro bebê Rh+ não é afetado por esses anticorpos porque a primeira exposição geralmente ocorre tarde o suficiente na gravidez para que a mãe não tenha tempo de montar um primário suficiente resposta de anticorpos antes do nascimento do bebê.
No entanto, se ocorrer uma gravidez subsequente com um feto Rh+, a segunda exposição da mãe aos antígenos do fator Rh causa uma forte resposta secundária de anticorpos que produz maiores quantidades de fator anti-RH IgG. Esses anticorpos podem atravessar a placenta da mãe para o feto e causar HDN, uma condição potencialmente letal para o bebê (Figura\(\PageIndex{5}\)).
Antes do desenvolvimento de técnicas para diagnóstico e prevenção, a incompatibilidade do fator Rh era a causa mais comum de HDN, resultando em milhares de mortes infantis a cada ano em todo o mundo. 7 Por esse motivo, os fatores Rh dos futuros pais são examinados regularmente e tratamentos foram desenvolvidos para prevenir o HDN causado pela incompatibilidade de Rh. Para evitar o HDN mediado pelo fator Rh, a imunoglobulina humana Rho (D) (por exemplo, RhoGam) é injetada por via intravenosa ou intramuscular na mãe durante a 28ª semana de gravidez e dentro de 72 horas após o parto. Doses adicionais podem ser administradas após eventos que possam resultar em hemorragia transplacentária (por exemplo, coleta de sangue umbilical, coleta de vilosidades coriônicas, trauma abdominal, amniocentese). Este tratamento é iniciado durante a primeira gravidez com um feto Rh+. Os anticorpos anti-Rh na imunoglobulina Rho (D) se ligarão ao fator Rh de quaisquer eritrócitos fetais que tenham acesso à corrente sanguínea da mãe, impedindo que essas células Rh+ ativem a resposta primária de anticorpos da mãe. Sem uma resposta primária de anticorpos anti-fator RH, a próxima gravidez com um Rh+ terá um risco mínimo de HDN. No entanto, a mãe precisará ser tratada novamente com imunoglobulina Rho (D) durante a gravidez para evitar uma resposta primária de anticorpos anti-RH que possa ameaçar gestações subsequentes.
Use este jogo interativo de tipagem sanguínea para reforçar seu conhecimento sobre tipagem sanguínea.
Exercício\(\PageIndex{3}\)
- O que acontece com as células que possuem antígenos incompatíveis em uma reação de hipersensibilidade do tipo II?
- Descreva a doença hemolítica do recém-nascido e explique como ela pode ser prevenida.
Foco clínico: Parte 2
O médico de cuidados primários de Kerry não sabe ao certo por que Kerry parece desenvolver erupções cutâneas depois de passar um tempo ao sol, então ela solicita um exame de urina e exames básicos de sangue. Os resultados revelam que Kerry tem proteinúria (níveis anormais de proteína na urina), hemoglobinúria (excesso de hemoglobina na urina) e baixo hematócrito (contagem de eritrócitos). Esses testes sugerem que Kerry está sofrendo de um leve surto de anemia hemolítica. A médica suspeita que o problema possa ser autoimune, então ela encaminha Kerry a um reumatologista para testes e diagnósticos adicionais.
Exercício\(\PageIndex{4}\)
Os reumatologistas são especializados em doenças musculoesqueléticas, como artrite, osteoporose e dores nas articulações. Por que o médico de Kerry pode encaminhá-la para esse tipo específico de especialista, mesmo que ela não esteja apresentando nenhum desses sintomas?
Hipersensibilidades do tipo III
As hipersensibilidades do tipo III são reações imunocomplexas que foram caracterizadas pela primeira vez por Nicolas Maurice Arthus (1862-1945) em 1903. Para produzir anticorpos para procedimentos experimentais, Arthus imunizou coelhos injetando-os com soro de cavalos. No entanto, ao imunizar coelhos repetidamente com soro de cavalo, Arthus notou uma hemorragia subcutânea localizada inesperada e não relatada anteriormente com edema no local da injeção. Esta reação se desenvolveu dentro de 3 a 10 horas após a injeção. Essa reação localizada a proteínas séricas não próprias foi chamada de reação de Arthus. Uma reação de Arthus ocorre quando antígenos solúveis se ligam à IgG em uma proporção que resulta no acúmulo de agregados antígeno-anticorpo chamados complexos imunes.
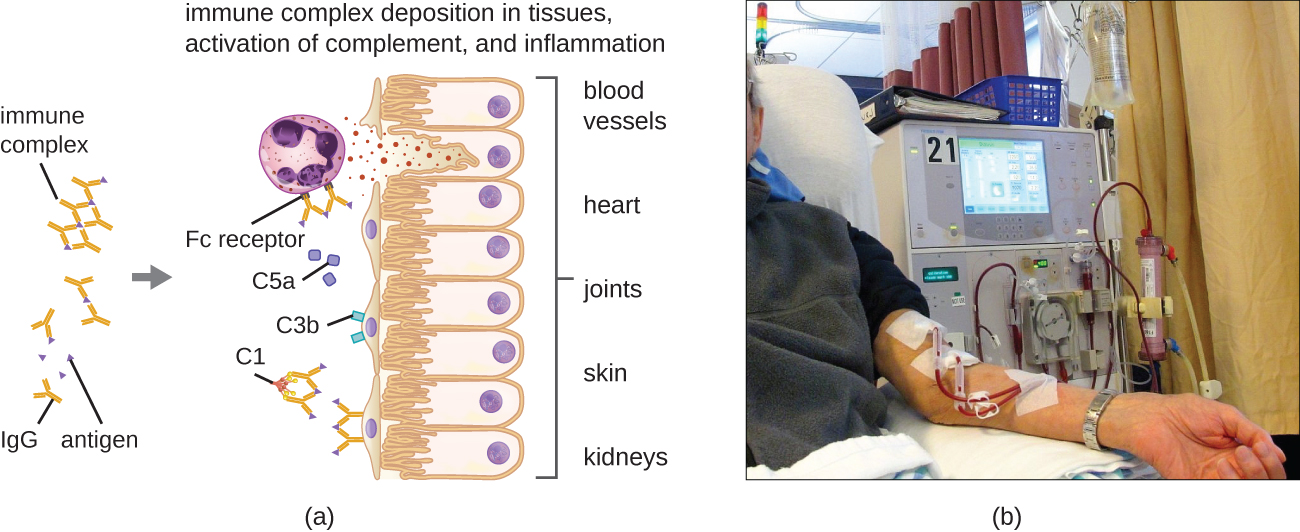
Uma característica única da hipersensibilidade do tipo III é o excesso de anticorpos (principalmente IgG), associado a uma concentração relativamente baixa de antígeno, resultando na formação de pequenos complexos imunes que se depositam na superfície das células epiteliais que revestem o lúmen interno de pequenos vasos sanguíneos ou nas superfícies de tecidos (Figura\(\PageIndex{6}\)). Esse acúmulo de complexo imunológico leva a uma cascata de eventos inflamatórios que incluem o seguinte:
- Ligação de IgG a receptores de anticorpos em mastócitos localizados, resultando em degranulação de mastócitos
- Ativação do complemento com produção de C3a e C5a pró-inflamatórios (ver Defesas químicas)
- Aumento da permeabilidade dos vasos sanguíneos com recrutamento quimiotático de neutrófilos e macrófagos
Como esses complexos imunes não têm o tamanho ideal e são depositados na superfície celular, eles não podem ser fagocitados da maneira usual por neutrófilos e macrófagos, que, por sua vez, são frequentemente descritos como “frustrados”. Embora a fagocitose não ocorra, a degranulação de neutrófilos resulta na liberação de enzimas lisossômicas que causam destruição extracelular do complexo imune, danificando as células localizadas no processo. A ativação das vias de coagulação também ocorre, resultando em trombos (coágulos sanguíneos) que ocluem os vasos sanguíneos e causam isquemia que pode levar à necrose vascular e hemorragia localizada.
A hipersensibilidade sistêmica do tipo III (doença do soro) ocorre quando complexos imunes se depositam em vários locais do corpo, resultando em uma resposta inflamatória sistêmica mais generalizada. Esses complexos imunes envolvem proteínas não próprias, como anticorpos produzidos em animais para imunidade passiva artificial (ver Vacinas), certos medicamentos ou antígenos microbianos que são liberados continuamente ao longo do tempo durante infecções crônicas (por exemplo, endocardite bacteriana subaguda, viral crônica hepatite). Os mecanismos da doença sérica são semelhantes aos descritos na hipersensibilidade localizada do tipo III, mas envolvem a ativação generalizada de mastócitos, complementos, neutrófilos e macrófagos, o que causa destruição de tecidos em áreas como rins, articulações e vasos sanguíneos. Como resultado da destruição do tecido, os sintomas da doença sérica incluem calafrios, febre, erupção cutânea, vasculite e artrite. O desenvolvimento de glomerulonefrite ou hepatite também é possível.
Doenças autoimunes, como lúpus eritematoso sistêmico (LES) e artrite reumatoide, também podem envolver reações prejudiciais de hipersensibilidade do tipo III quando os autoanticorpos formam complexos imunes com autoantígenos. Essas condições são discutidas em Distúrbios autoimunes.
Exercício\(\PageIndex{5}\)
- Por que o excesso de anticorpos é importante na hipersensibilidade do tipo III?
- Descreva as diferenças entre a reação de Arthus e a doença sérica.
Antitoxina diftérica
Os soros antibacterianos são muito menos usados agora do que no passado, tendo sido substituídos por vacinas contra toxóides. No entanto, uma antitoxina diftérica produzida em cavalos é um exemplo desse tratamento que ainda é usado em algumas partes do mundo. Embora não seja licenciada pelo FDA para uso nos Estados Unidos, a antitoxina da difteria pode ser usada para tratar casos de difteria, que são causados pela bactéria Corynebacterium diphtheriae. 8 No entanto, o tratamento não é isento de riscos. A doença do soro pode ocorrer quando o paciente desenvolve uma resposta imune a proteínas que não são do cavalo. Complexos imunes são formados entre as proteínas do cavalo e os anticorpos circulantes quando os dois existem em certas proporções. Esses complexos imunes podem se depositar nos órgãos, causando danos como artrite, nefrite, erupção cutânea e febre. A doença do soro geralmente é transitória, sem danos permanentes, a menos que o paciente seja exposto cronicamente ao antígeno, o que pode resultar em danos irreversíveis em locais do corpo, como articulações e rins. Com o tempo, células fagocíticas, como macrófagos, são capazes de eliminar os antígenos do soro do cavalo, o que resulta na melhora da condição do paciente e na diminuição dos sintomas à medida que a resposta imune se dissipa.
Foco clínico: Parte 3
Kerry não chega ao reumatologista. Ela tem uma convulsão quando está saindo do consultório do médico de atenção primária. Ela é rapidamente levada às pressas para o pronto-socorro, onde seu médico de cuidados primários relaciona seu histórico médico e os resultados de exames recentes. O médico do pronto-socorro chama o reumatologista da equipe do hospital para consulta. Com base nos sintomas e nos resultados dos testes, o reumatologista suspeita que Kerry tem lúpus e solicita um par de exames de sangue: um teste de anticorpos antinucleares (ANA) para procurar anticorpos que se ligam ao DNA e outro teste que procura anticorpos que se liguem a um autoantígeno chamado antígeno Smith (Sm).
Exercício\(\PageIndex{6}\)
Com base nos exames de sangue solicitados, que tipo de reação o reumatologista suspeita estar causando a convulsão de Kerry?
Hipersensibilidades do tipo IV
As hipersensibilidades do tipo IV não são mediadas por anticorpos como os outros três tipos de hipersensibilidade. Em vez disso, as hipersensibilidades do tipo IV são reguladas pelas células T e envolvem a ação das células efetoras. Esses tipos de hipersensibilidade podem ser organizados em três subcategorias com base no subtipo de célula T, no tipo de antígeno e no mecanismo efetor resultante (Tabela\(\PageIndex{5}\)).
Na primeira subcategoria do tipo IV, as reações mediadas por CD4 T H 1 são descritas como hipersensibilidades do tipo retardado (DTH). A etapa de sensibilização envolve a introdução do antígeno na pele e a fagocitose pelas células apresentadoras de antígenos locais (APCs). Os APCs ativam células T auxiliares, estimulando a proliferação clonal e a diferenciação em células T H 1 de memória. Após a exposição subsequente ao antígeno, essas células T H 1 de memória sensibilizada liberam citocinas que ativam macrófagos, e os macrófagos ativados são responsáveis por grande parte dos danos nos tecidos. Exemplos dessa hipersensibilidade mediada pela T H 1 são observados na tuberculina, no teste cutâneo de Mantoux e na dermatite de contato, como ocorre nas reações alérgicas ao látex.
Na segunda subcategoria do tipo IV, as reações mediadas pelo CD4 T H 2 resultam em asma crônica ou rinite alérgica crônica. Nesses casos, o antígeno solúvel é primeiro inalado, resultando no recrutamento e ativação de eosinófilos com a liberação de citocinas e mediadores inflamatórios.
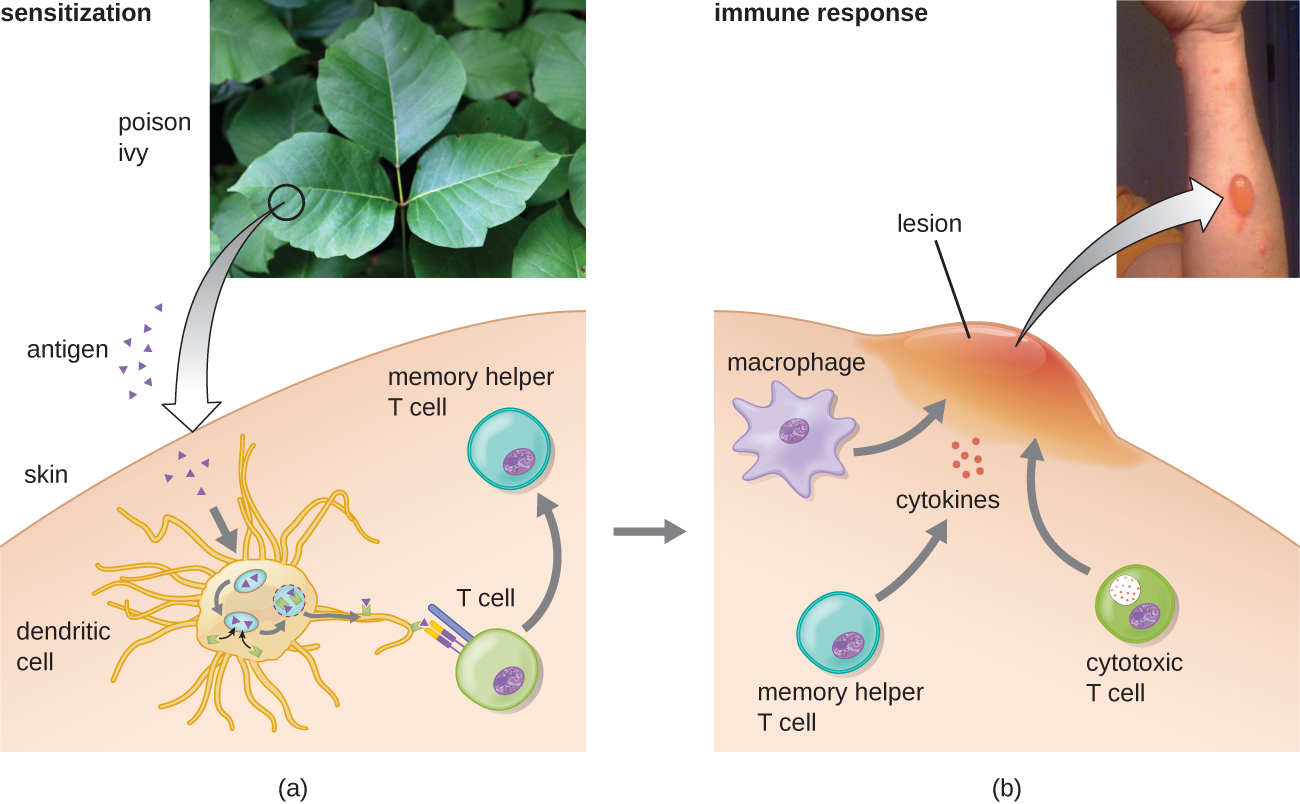
Na terceira subcategoria do tipo IV, as reações mediadas pelo linfócito T citotóxico CD8 (CTL) estão associadas à rejeição do transplante tecidual e à dermatite de contato (Figura\(\PageIndex{7}\)). Para essa forma de hipersensibilidade mediada por células, os APCs processam e apresentam o antígeno com MHC I às células T CD8 ingênuas. Quando essas células T CD8 ingênuas são ativadas, elas proliferam e se diferenciam em CTLs. As células T H 1 ativadas também podem melhorar a ativação dos CTLs. Os CTLs ativados então visam e induzem a apoptose mediada por granzima em células que apresentam o mesmo antígeno com MHC I. Essas células-alvo podem ser células “próprias” que absorveram o antígeno estranho (como na dermatite de contato devido à hera venenosa), ou podem ser células de tecido transplantadas exibindo antígeno do doador.
| Subcategoria | Antígeno | Mecanismo efetor | Exemplos |
|---|---|---|---|
| 1 | Antígeno solúvel | Macrófagos ativados danificam o tecido e promovem a resposta | Dermatite de contato (por exemplo, exposição ao látex) e hipersensibilidade de tipo retardado (por exemplo, reação à tuberculina) |
| 2 | Antígeno solúvel | O recrutamento e ativação de eosinófilos liberam citocinas e produtos químicos pró-inflamatórios | Asma crônica e rinite alérgica crônica |
| 3 | Antígeno associado a células | Citotoxicidade mediada por CTL | Dermatite de contato (por exemplo, contato com hera venenosa) e rejeição de transplante de tecido |
Exercício\(\PageIndex{7}\)
- Descreva os três subtipos de hipersensibilidade do tipo IV.
- Explique como as células T contribuem para danos nos tecidos na hipersensibilidade tipo IV.
Usando hipersensibilidade retardada para testar a tuberculose
O pediatra austríaco Clemans von Pirquet (1874-1929) descreveu pela primeira vez mecanismos de alergia, incluindo a doença sérica tipo III. 9 Seu interesse levou ao desenvolvimento de um teste para tuberculose (TB), usando o antígeno da tuberculina, com base em trabalhos anteriores de identificação do patógeno da tuberculose realizado por Robert Koch. O método de Pirquet envolveu a escarificação, que resulta em múltiplas punções simultâneas, usando um dispositivo com uma série de agulhas para quebrar a pele várias vezes em uma área pequena. O dispositivo usado por Pirquet foi semelhante ao dispositivo de teste dentário com quatro agulhas visto na Figura\(\PageIndex{8}\).
As pontas de todas as agulhas da matriz são revestidas com tuberculina, um extrato proteico da bactéria da tuberculose, introduzindo efetivamente a tuberculina na pele. Um a 3 dias depois, a área pode ser examinada para detectar uma reação de hipersensibilidade tardia, cujos sinais incluem inchaço e vermelhidão.
Como você pode imaginar, a escarificação não foi uma experiência agradável, 10 e as inúmeras punções cutâneas colocaram o paciente em risco de desenvolver infecção bacteriana na pele. Mantoux modificou o teste de Pirquet para usar uma única injeção subcutânea de material purificado de tuberculina. Um teste positivo, indicado por um atraso no inchaço localizado no local da injeção, não significa necessariamente que o paciente esteja atualmente infectado com TB ativa. Como a hipersensibilidade do tipo IV (tipo retardado) é mediada pela reativação das células T de memória, essas células podem ter sido criadas recentemente (devido a uma infecção por corrente ativa) ou anos antes (se um paciente tivesse TB e a tivesse eliminado espontaneamente ou se tivesse entrado em latência). No entanto, o teste pode ser usado para confirmar a infecção nos casos em que sintomas no paciente ou achados em uma radiografia sugerem sua presença.

Pneumonite por hipersensibilidade
Algumas doenças causadas por hipersensibilidades não são causadas exclusivamente por um tipo. Por exemplo, a pneumonite de hipersensibilidade (HP), que geralmente é uma doença ocupacional ou ambiental, ocorre quando os pulmões ficam inflamados devido a uma reação alérgica à poeira inalada, endosporos, penas de pássaros, excrementos de pássaros, bolores ou produtos químicos. O HP tem muitos nomes diferentes associados a várias formas de exposição (Figura\(\PageIndex{9}\)). O HP associado a excrementos de pássaros às vezes é chamado de pulmão de criador de pombos ou pulmão de avicultor, ambos comuns em criadores e manipuladores de pássaros. Doença do manipulador de queijos, pulmão do agricultor, doença dos tomadores de sauna e pulmão de banheira de hidromassagem são outros nomes para HP associados à exposição a fungos em vários ambientes.
A patologia associada ao HP pode ser devida às hipersensibilidades do tipo III (mediada por imunocomplexos) e do tipo IV (mediada por células T H 1 e macrófagos). A exposição repetida a alérgenos pode causar alveolite devido à formação de complexos imunes na parede alveolar do pulmão acompanhados por acúmulo de líquido e à formação de granulomas e outras lesões no pulmão como resultado da ativação de macrófagos mediada pelo T H1. A alveolite com formação de líquido e granuloma resulta em baixa perfusão de oxigênio nos alvéolos, o que, por sua vez, pode causar sintomas como tosse, dispneia, calafrios, febre, sudorese, mialgias, cefaleia e náuseas. Os sintomas podem ocorrer até 2 horas após a exposição e podem persistir por semanas se não forem tratados.

Exercício\(\PageIndex{8}\)
Explique por que a pneumonite por hipersensibilidade é considerada uma doença ocupacional.
A figura\(\PageIndex{10}\) resume os mecanismos e efeitos de cada tipo de hipersensibilidade discutido nesta seção.
Diagnóstico de hipersensibilidades
O diagnóstico de hipersensibilidades do tipo I é um processo complexo que requer vários testes diagnósticos, além de um histórico bem documentado do paciente. Os níveis séricos de IgE podem ser medidos, mas a IgE elevada sozinha não confirma a doença alérgica. Como parte do processo de identificação dos antígenos responsáveis por uma reação alérgica do tipo I, o teste por meio de um teste cutâneo por punção por punção (PPST) ou um teste intradérmico podem ser realizados. O PPST é realizado com a introdução de alérgenos em uma série de picadas superficiais da pele nas costas ou nos braços do paciente (Figura\(\PageIndex{11}\)). Os PPSTs são considerados a maneira mais conveniente e barata de diagnosticar alergias, de acordo com o Conselho Conjunto de Alergia dos EUA e a Academia Europeia de Alergia e Imunologia. O segundo tipo de teste, o teste intradérmico, requer injeção na derme com uma agulha pequena. Essa agulha, também conhecida como agulha de tuberculina, é presa a uma seringa contendo uma pequena quantidade de alérgeno. Tanto o PPST quanto os testes intradérmicos são observados por 15 a 20 minutos para uma reação de exacerbação da pápula aos alérgenos. A medição de qualquer pápula (protuberância elevada com coceira) e erupção (vermelhidão) em minutos indica uma hipersensibilidade do tipo I e, quanto maior a reação de clarão da pápula, maior a sensibilidade do paciente ao alérgeno.
As hipersensibilidades do tipo III muitas vezes podem ser diagnosticadas erroneamente devido à sua natureza inflamatória inespecífica. Os sintomas são facilmente visíveis, mas podem estar associados a várias outras doenças. Uma história forte e abrangente do paciente é crucial para um diagnóstico correto e preciso. Os testes usados para estabelecer o diagnóstico de pneumonite por hipersensibilidade (resultante da hipersensibilidade tipo III) incluem lavagem broncoalveolar (LBA), testes de função pulmonar e tomografia computadorizada de alta resolução (TCAR).
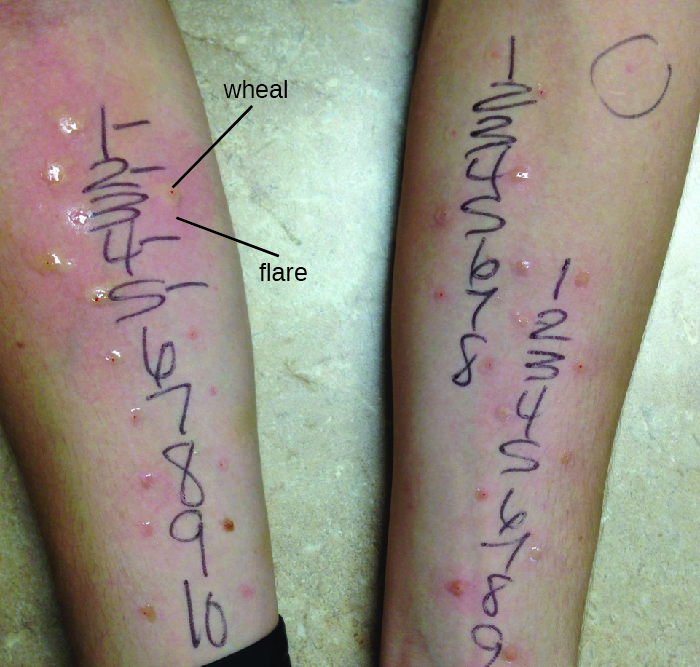
Exercício\(\PageIndex{9}\)
- Descreva o teste cutâneo de punção por punção.
- Explique por que as hipersensibilidades do tipo III podem ser difíceis de diagnosticar
Tratamentos de hipersensibilidades
As reações alérgicas podem ser tratadas de várias maneiras. A prevenção de reações alérgicas pode ser alcançada por meio da terapia de dessensibilização (hipossensibilização), que pode ser usada para reduzir a reação de hipersensibilidade por meio de injeções repetidas de alérgenos. Concentrações extremamente diluídas de alérgenos conhecidos (determinadas a partir dos testes de alérgenos) são injetadas no paciente em intervalos prescritos (por exemplo, semanalmente). A quantidade de alérgeno administrada pelas injeções é aumentada lentamente ao longo de um período de acúmulo até que uma dose efetiva seja determinada e essa dose seja mantida durante o tratamento, que pode durar anos. Os pacientes geralmente são encorajados a permanecer no consultório médico por 30 minutos após receberem a injeção, caso os alérgenos administrados causem uma reação sistêmica grave. Os consultórios médicos que administram a terapia de dessensibilização devem estar preparados para fornecer ressuscitação e tratamento medicamentoso no caso de tal evento.
A terapia de dessensibilização é usada para alergias a picadas de insetos e alergias ambientais. As vacinas contra alergias provocam a produção de diferentes respostas de interleucinas e anticorpos IgG em vez de IgE. Quando o excesso de anticorpos IgG específicos para alérgenos é produzido e se liga ao alérgeno, eles podem atuar como anticorpos bloqueadores para neutralizar o alérgeno antes que ele possa se ligar à IgE nos mastócitos. Existem estudos iniciais que usam terapia oral para dessensibilização de alergias alimentares que são promissores. 11 12 Esses estudos envolvem alimentar crianças com alergias com pequenas quantidades do alérgeno (por exemplo, farinha de amendoim) ou proteínas relacionadas ao longo do tempo. Muitos dos indivíduos mostram uma redução da gravidade da reação ao alérgeno alimentar após a terapia.
Também existem terapias destinadas a tratar reações alérgicas graves. A anafilaxia sistêmica de emergência é tratada inicialmente com uma injeção de epinefrina, que pode neutralizar a queda da pressão arterial. Indivíduos com alergias graves conhecidas geralmente usam um autoinjetor autoadministrado que pode ser usado em caso de exposição ao alérgeno (por exemplo, picada de inseto ou ingestão acidental de um alimento que causa uma reação grave). Ao autoadministrar uma injeção de epinefrina (ou às vezes duas), o paciente pode conter a reação por tempo suficiente para procurar atendimento médico. O tratamento de acompanhamento geralmente envolve administrar ao paciente anti-histamínicos e corticosteroides de ação lenta por vários dias após a reação para evitar possíveis reações de fase tardia. No entanto, os efeitos do tratamento com anti-histamínicos e corticosteroides não são bem estudados e são usados com base em considerações teóricas.
O tratamento de reações alérgicas mais leves geralmente envolve anti-histamínicos e outros medicamentos anti-inflamatórios. Uma variedade de medicamentos anti-histamínicos está disponível, nas dosagens prescritas e sem receita médica. Existem também medicamentos antileucotrienos e antiprostaglandinas que podem ser usados em conjunto com medicamentos anti-histamínicos em um regime terapêutico combinado (e mais eficaz).
Os tratamentos das hipersensibilidades do tipo III incluem a prevenção de uma maior exposição ao antígeno e o uso de medicamentos anti-inflamatórios. Algumas condições podem ser resolvidas quando a exposição ao antígeno é evitada. Os inaladores anti-inflamatórios de corticosteroides também podem ser usados para diminuir a inflamação e permitir a cicatrização das lesões pulmonares. O tratamento sistêmico com corticosteroides, por via oral ou intravenosa, também é comum nas hipersensibilidades do tipo III que afetam os sistemas corporais. O tratamento da pneumonite por hipersensibilidade inclui evitar o alérgeno, juntamente com a possível adição de esteróides prescritos, como a prednisona, para reduzir a inflamação.
O tratamento das hipersensibilidades do tipo IV inclui anti-histamínicos, antiinflamatórios, analgésicos e, se possível, a eliminação de uma maior exposição ao antígeno.
Exercício\(\PageIndex{10}\)
- Descreva a terapia de dessensibilização.
- Explicar o papel da epinefrina no tratamento das reações de hipersensibilidade.
Conceitos principais e resumo
- Uma alergia é uma resposta imune adaptativa, às vezes fatal, a um alérgeno.
- A hipersensibilidade do tipo I requer sensibilização dos mastócitos com IgE, envolvendo uma resposta inicial de anticorpos IgE e ligação de IgE aos mastócitos. Na segunda exposição a um alérgeno, a reticulação de moléculas de IgE nos mastócitos desencadeia a degranulação e a liberação de mediadores químicos pré-formados e recém-formados da inflamação. A hipersensibilidade do tipo I pode ser localizada e relativamente pequena (urticária e febre do feno) ou perigosa em todo o sistema (anafilaxia sistêmica).
- As hipersensibilidades do tipo II resultam da ligação de anticorpos a antígenos nas células e do início de respostas citotóxicas. Os exemplos incluem reação transfusional hemolítica e doença hemolítica do recém-nascido.
- As hipersensibilidades do tipo III resultam da formação e acúmulo de complexos imunes nos tecidos, estimulando respostas inflamatórias prejudiciais.
- As hipersensibilidades do tipo IV não são mediadas por anticorpos, mas pela ativação auxiliar das células T de macrófagos, eosinófilos e células T citotóxicas.
Notas de pé
- 1 D.S. Strayer et al (eds). Patologia de Rubin: Fundamentos clinicopatológicos da medicina. 7ª ed. 2Filadélfia, PA: Lippincott, Williams & Wilkins, 2014.
- 2 C.M. Fitzsimmons et al. “Alérgenos helmínticos, IgE específica do parasita e seu papel protetor na imunidade humana.” Fronteira em Imunologia 5 (2015) :47.
- 3 S.T. Weiss. “Coma sujeira — a hipótese da higiene e as doenças alérgicas.” Jornal de Medicina da Nova Inglaterra 347 nº 12 (2002) :930—931.
- 4 D.P. Strachan “Febre do feno, higiene e tamanho da casa”. Jornal Médico Britânico 299 nº 6710 (1989) :1259.
- 5 H. Okada e cols.. “A 'Hipótese de Higiene' para doenças autoimunes e alérgicas: uma atualização.” Imunologia Clínica e Experimental 160 no. 1 (2010) :1—9.
- 6 E.C. Vamvakas, M.A. Blanchman. “Mortalidade relacionada à transfusão: os riscos contínuos da transfusão sanguínea alogênica e as estratégias disponíveis para sua prevenção.” Sangue 113 nº 15 (2009) :3406—3417.
- 7 G. Reali. “Quarenta anos de imunoprofilaxia anti-D”. Transfusão de sangue 5 no. 1 (2007) :3—6.
- 8 Centros de Controle e Prevenção de Doenças. “Antitoxina diftérica”. http://www.cdc.gov/diphtheria/dat.html. Acessado em 25 de março de 2016.
- 9 B. Huber “100 Jahre Allergie: Clemens von Pirquet—sein Allergiebegriff und das ihm zugrunde liegende Krankheitsverständnis”. Wiener Klinische Wochenschrift 118 nº 19—20 (2006) :573—579.
- 10 C.A. Stewart. “O teste de Pirquet: comparação dos métodos de aplicação da escarificação e da punção”. Arquivos de Pediatria e Medicina do Adolescente 35 no. 3 (1928) :388—391.
- 11 C.L. Schneider et al. “Um estudo piloto de omalizumabe para facilitar a rápida dessensibilização oral em pacientes alérgicos a amendoim de alto risco.” Jornal de Alergia e Imunologia Clínica 132 nº 6 (2013) :1368—1374.
- 12 P. Varshney e cols.. “Um estudo controlado randomizado de imunoterapia oral com amendoim: dessensibilização clínica e modulação da resposta alérgica.” Jornal de Alergia e Imunologia Clínica 127 no. 3 (2011) :654—660.


