18.3: Linfócitos T
- Page ID
- 181400
Objetivos de
- Descreva o processo de maturação e seleção tímica das células T
- Explicar os eventos genéticos que levam à diversidade dos receptores de células T
- Compare e contraste as várias classes e subtipos de células T em termos de ativação e função
- Explicar o mecanismo pelo qual os superantígenos afetam a ativação não regulada das células T
Conforme explicado em Visão geral da imunidade adaptativa específica, os anticorpos envolvidos na imunidade humoral geralmente se ligam a patógenos e toxinas antes que eles possam se ligar e invadir as células hospedeiras. Assim, a imunidade humoral se preocupa principalmente em combater patógenos em espaços extracelulares. No entanto, os patógenos que já entraram nas células hospedeiras estão amplamente protegidos das defesas humorais mediadas por anticorpos. A imunidade celular, por outro lado, visa e elimina patógenos intracelulares por meio da ação dos linfócitos T ou células T (Figura\(\PageIndex{1}\)). As células T também desempenham um papel mais central na orquestração da resposta imune adaptativa geral (humoral e celular) junto com as defesas celulares da imunidade inata.

Produção e maturação de células T
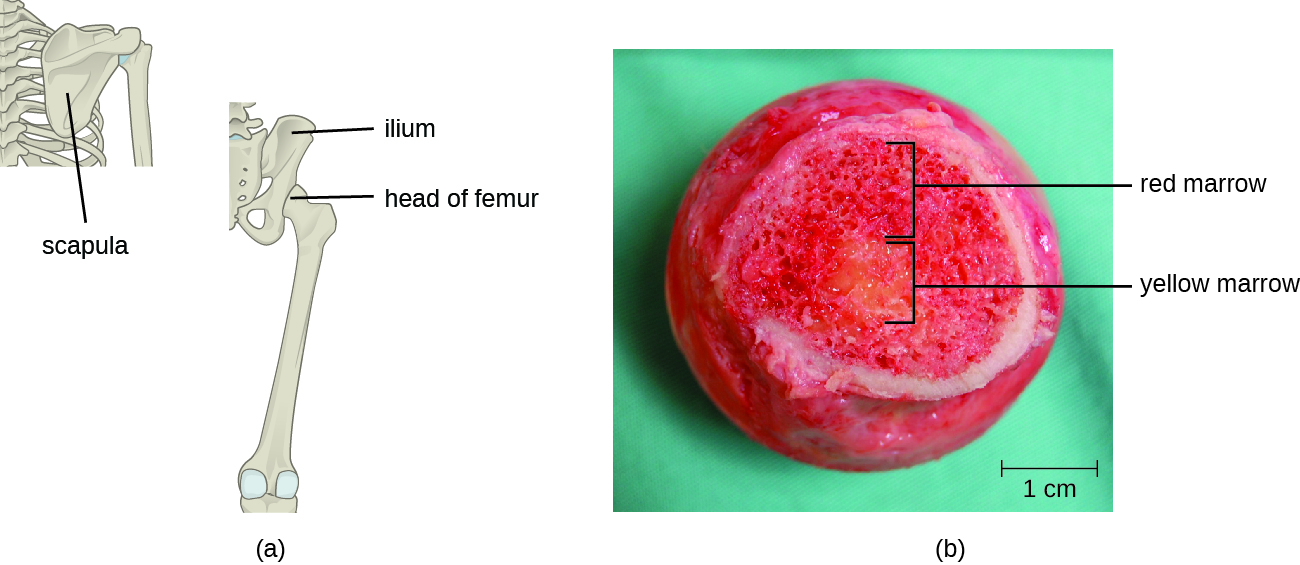
As células T, como todos os outros glóbulos brancos envolvidos na imunidade inata e adaptativa, são formadas a partir de células-tronco hematopoiéticas multipotentes (HSCs) na medula óssea (ver Figura 17.3.1). No entanto, diferentemente dos glóbulos brancos da imunidade inata, as eventuais células T se diferenciam primeiro em células-tronco linfóides que depois se tornam linfócitos pequenos e imaturos, às vezes chamados de linfoblastos. As primeiras etapas de diferenciação ocorrem na medula vermelha dos ossos (Figura\(\PageIndex{2}\)), após a qual os linfócitos T imaturos entram na corrente sanguínea e viajam para o timo para as etapas finais de maturação (Figura\(\PageIndex{3}\)). Uma vez no timo, os linfócitos T imaturos são chamados de timócitos.
A maturação dos timócitos dentro do timo pode ser dividida em três etapas críticas de seleção positiva e negativa, coletivamente chamadas de seleção tímica. A primeira etapa da seleção tímica ocorre no córtex do timo e envolve o desenvolvimento de um receptor funcional de células T (TCR) que é necessário para ativação por APCs. Os timócitos com TCRs defeituosos são removidos por seleção negativa por meio da indução da apoptose (morte celular controlada programada). A segunda etapa da seleção tímica também ocorre no córtex e envolve a seleção positiva de timócitos que interagirão adequadamente com as moléculas de MHC. Os timócitos que podem interagir adequadamente com as moléculas de MHC recebem uma estimulação positiva que os move ainda mais durante o processo de maturação, enquanto os timócitos que não interagem adequadamente não são estimulados e são eliminados pela apoptose. A terceira e última etapa da seleção tímica ocorre tanto no córtex quanto na medula e envolve a seleção negativa para remover timócitos autorreativos, aqueles que reagem aos autoantígenos, por apoptose. Essa etapa final às vezes é chamada de tolerância central porque impede que as células T autorreativas cheguem à corrente sanguínea e potencialmente causem doenças autoimunes, que ocorrem quando o sistema imunológico ataca células “próprias” saudáveis.
Apesar da tolerância central, algumas células T autorreativas geralmente escapam do timo e entram na corrente sanguínea periférica. Portanto, uma segunda linha de defesa chamada tolerância periférica é necessária para proteger contra doenças autoimunes. A tolerância periférica envolve mecanismos de anergia e inibição de células T autorreativas por células T reguladoras. Anergia se refere a um estado de não responsividade à estimulação do antígeno. No caso de células T autorreativas que escapam do timo, a falta de um sinal coestimulador essencial necessário para a ativação causa anergia e impede a ativação autoimune. As células T reguladoras participam da tolerância periférica inibindo a ativação e a função das células T autorreativas e secretando citocinas anti-inflamatórias.
Não se sabe completamente quais eventos direcionam especificamente a maturação dos timócitos em células T reguladoras. As teorias atuais sugerem que os eventos críticos podem ocorrer durante a terceira etapa da seleção tímica, quando a maioria das células T autorreativas é eliminada. As células T reguladoras podem receber um sinal exclusivo que está abaixo do limite necessário para direcioná-las para seleção negativa e apoptose. Consequentemente, essas células continuam amadurecendo e depois saindo do timo, armadas para inibir a ativação de células T autorreativas.
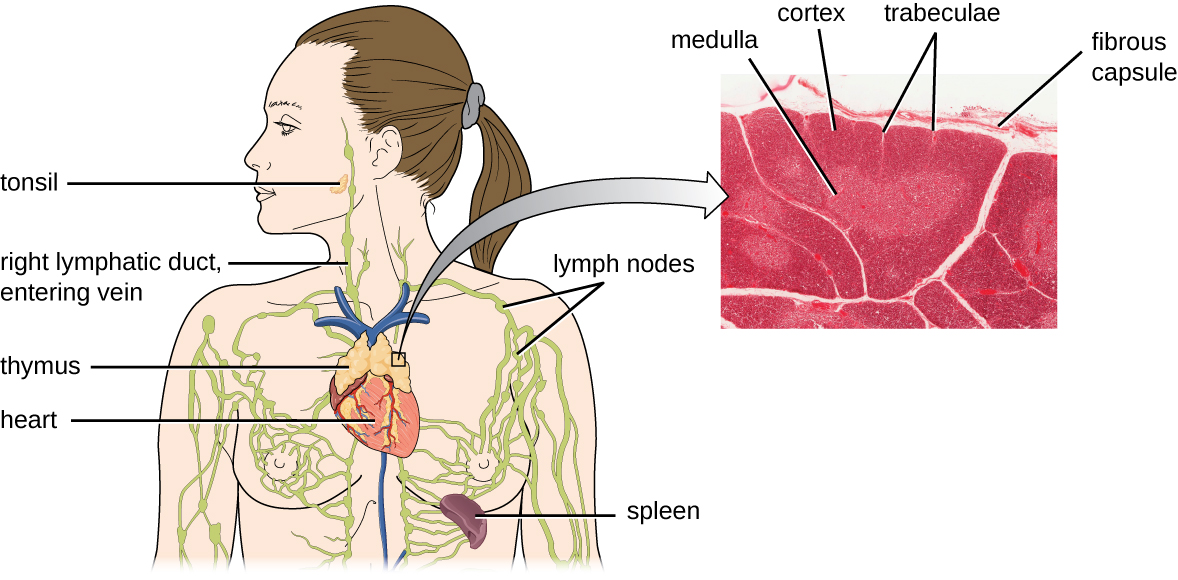
Estima-se que as três etapas da seleção tímica eliminem 98% dos timócitos. Os 2% restantes que saem do timo migram pela corrente sanguínea e pelo sistema linfático para locais de orgãos/tecidos linfóides secundários, como linfonodos, baço e amígdalas (Figura\(\PageIndex{3}\)), onde aguardam ativação por meio da apresentação de antígenos específicos por APCs. Até serem ativadas, elas são conhecidas como células T maduras ingênuas.
Exercício\(\PageIndex{1}\)
- Quais sítios anatômicos estão envolvidos na produção e maturação das células T?
- Quais são as três etapas envolvidas na seleção tímica?
- Por que a tolerância central e a tolerância periférica são importantes? O que eles evitam?
Classes de células T
As células T podem ser categorizadas em três classes distintas: células T auxiliares, células T reguladoras e células T citotóxicas. Essas classes são diferenciadas com base na expressão de certas moléculas de superfície, seu modo de ativação e seus papéis funcionais na imunidade adaptativa (Tabela\(\PageIndex{1}\)).
Todas as células T produzem moléculas de agrupamento de diferenciação (CD), glicoproteínas da superfície celular que podem ser usadas para identificar e distinguir entre os vários tipos de glóbulos brancos. Embora as células T possam produzir uma variedade de moléculas de CD, CD4 e CD8 são as duas mais importantes usadas para diferenciação das classes. As células T auxiliares e as células T reguladoras são caracterizadas pela expressão de CD4 em sua superfície, enquanto as células T citotóxicas são caracterizadas pela expressão de CD8.
As classes de células T também podem ser distinguidas pelas moléculas específicas de MHC e APCs com as quais elas interagem para ativação. As células T auxiliares e as células T reguladoras só podem ser ativadas por APCs que apresentam antígenos associados ao MHC II. Em contraste, as células T citotóxicas reconhecem antígenos apresentados em associação com o MHC I, seja por APCs ou por células nucleadas infectadas com um patógeno intracelular.
As diferentes classes de células T também desempenham diferentes funções funcionais no sistema imunológico. As células T auxiliares servem como orquestradores centrais que ajudam a ativar e direcionar as funções da imunidade humoral e celular. Além disso, as células T auxiliares melhoram as funções de eliminação de patógenos dos macrófagos e das células NK da imunidade inata. Em contraste, o papel principal das células T reguladoras é prevenir respostas imunes indesejáveis e potencialmente prejudiciais. Seu papel na tolerância periférica, por exemplo, protege contra doenças autoimunes, conforme discutido anteriormente. Finalmente, as células T citotóxicas são as principais células efetoras da imunidade celular. Eles reconhecem e têm como alvo células que foram infectadas por patógenos intracelulares, destruindo as células infectadas junto com os patógenos internos.
| Classe | Moléculas de CD de superfície | Ativação | Funções |
|---|---|---|---|
| Células T auxiliares | CD4 | APCs apresentando antígenos associados ao MHC II | Orquestre a imunidade humoral e celular |
| Envolvido na ativação de macrófagos e células NK | |||
| Células T reguladoras | CD4 | APCs apresentando antígenos associados ao MHC II | Envolvido na tolerância periférica e na prevenção de respostas autoimunes |
| células T citotóxicas | CD8 | APCs ou células nucleadas infectadas que apresentam antígenos associados ao MHC I | Destrua células infectadas com patógenos intracelulares |
Exercício\(\PageIndex{2}\)
- Quais são as funções únicas das três classes de células T?
- Quais células T podem ser ativadas por antígenos apresentados por outras células além dos APCs?
Receptores de células T
Tanto para células T auxiliares quanto para células T citotóxicas, a ativação é um processo complexo que requer a interação de várias moléculas e a exposição a citocinas. O receptor de células T (TCR) está envolvido na primeira etapa do reconhecimento do epítopo do patógeno durante o processo de ativação.
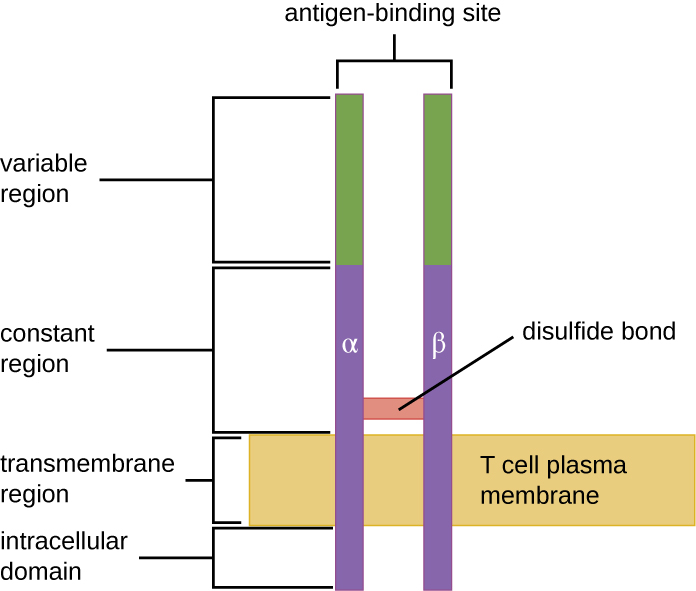
O TCR vem da mesma família de receptores dos anticorpos IgD e IgM, os receptores de antígeno na superfície da membrana da célula B e, portanto, compartilha elementos estruturais comuns. Semelhante aos anticorpos, o TCR tem uma região variável e uma região constante, e a região variável fornece o local de ligação ao antígeno (Figura\(\PageIndex{4}\)). No entanto, a estrutura do TCR é menor e menos complexa do que as moléculas de imunoglobulina (Figura 18.1.4). Enquanto as imunoglobulinas têm quatro cadeias peptídicas e estruturas em forma de Y, o TCR consiste em apenas duas cadeias peptídicas (cadeias α e β), ambas abrangendo a membrana citoplasmática da célula T.
Os TCRs são específicos do epítopo e estima-se que 25 milhões de células T com TCRs exclusivos de ligação ao epítopo são necessárias para proteger um indivíduo contra uma ampla gama de patógenos microbianos. Como o genoma humano contém apenas cerca de 25.000 genes, sabemos que cada TCR específico não pode ser codificado por seu próprio conjunto de genes. Isso levanta a questão de como uma população tão vasta de células T com milhões de TCRs específicos pode ser alcançada. A resposta é um processo chamado rearranjo genético, que ocorre no timo durante a primeira etapa da seleção tímica.
Os genes que codificam as regiões variáveis do TCR são divididos em segmentos genéticos distintos chamados segmentos variáveis (V), de diversidade (D) e de junção (J). Os segmentos de genes associados à cadeia α do TCR consistem em 70 ou mais segmentos V α diferentes e 61 segmentos J α diferentes. Os segmentos genéticos associados à cadeia β do TCR consistem em 52 segmentos V β diferentes, dois segmentos D β diferentes e 13 segmentos J β diferentes. Durante o desenvolvimento do TCR funcional no timo, o rearranjo genético em uma célula T reúne um segmento V α e um segmento J α para codificar a região variável da cadeia α. Da mesma forma, o rearranjo genético reúne um dos segmentos V β com um dos segmentos D β e um dos segmentos TJ β para codificar a região variável da cadeia β. Todas as combinações possíveis de rearranjos entre diferentes segmentos de V, D e J fornecem a diversidade genética necessária para produzir milhões de TCRs com regiões variáveis específicas do epítopo únicas.
Exercício\(\PageIndex{3}\)
- Quais são as semelhanças e diferenças entre TCRs e imunoglobulinas?
- Qual processo é usado para fornecer milhões de sites de ligação TCR exclusivos?
Ativação e diferenciação de células T auxiliares
As células T auxiliares só podem ser ativadas por APCs que apresentam epítopos estranhos processados em associação com o MHC II. A primeira etapa do processo de ativação é o reconhecimento por TCR do epítopo estranho específico apresentado na fenda de ligação ao antígeno MHC II. A segunda etapa envolve a interação do CD4 na célula T auxiliar com uma região da molécula MHC II separada da fenda de ligação ao antígeno. Essa segunda interação ancora o complexo MHC II-TCR e garante que a célula T auxiliar reconheça tanto o epítopo estranho (“não-eu”) quanto o antígeno “próprio” do APC; ambos os reconhecimentos são necessários para a ativação da célula. Na terceira etapa, as células APC e T secretam citocinas que ativam a célula T auxiliar. A célula T auxiliar ativada então prolifera, dividindo-se por mitose para produzir células T auxiliares ingênuas clonais que se diferenciam em subtipos com funções diferentes (Figura\(\PageIndex{5}\)).
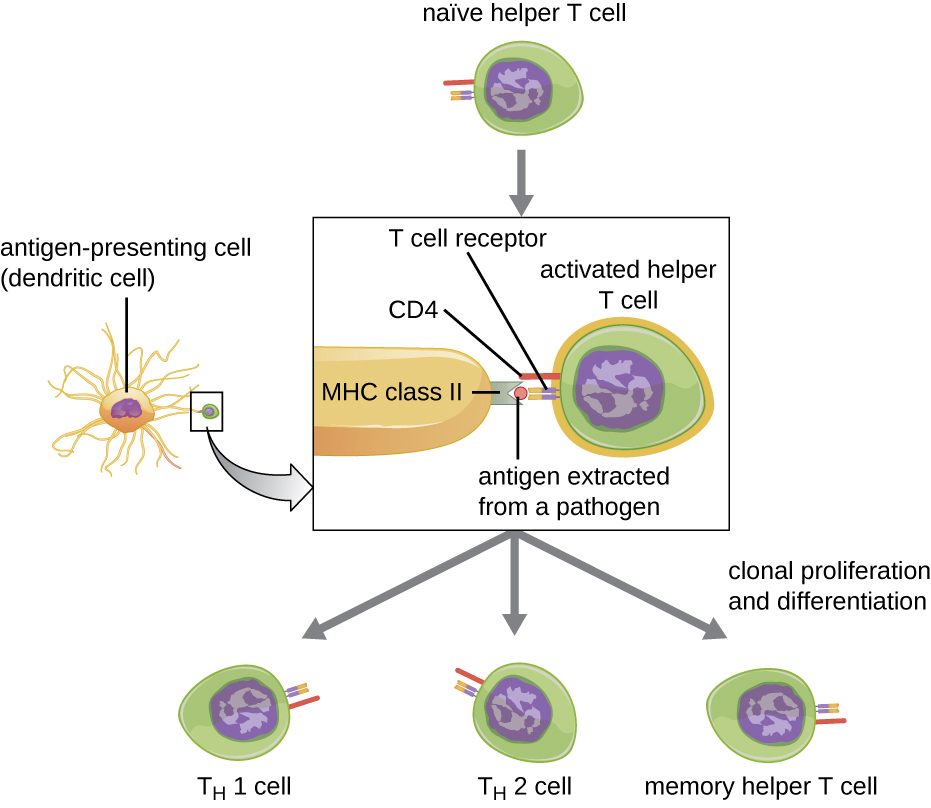
As células T auxiliares ativadas podem se diferenciar em um dos quatro subtipos distintos, resumidos na Tabela\(\PageIndex{2}\). O processo de diferenciação é direcionado por citocinas secretadas por APC. Dependendo de quais citocinas secretadas por APC interagem com uma célula T auxiliar ativada, a célula pode se diferenciar em uma célula T auxiliar 1 (T H 1), uma célula T auxiliar 2 (T H 2) ou uma célula T auxiliar de memória. Os dois tipos de células T auxiliares são células efetoras de vida relativamente curta, o que significa que elas desempenham várias funções da resposta imune imediata. Em contraste, as células T auxiliares de memória têm vida relativamente longa; elas são programadas para “lembrar” um antígeno ou epítopo específico, a fim de criar uma resposta secundária rápida, forte e secundária às exposições subsequentes.
As células T H 1 secretam suas próprias citocinas que estão envolvidas na estimulação e orquestração de outras células envolvidas na imunidade adaptativa e inata. Por exemplo, eles estimulam as células T citotóxicas, aumentando a eliminação de células infectadas e promovendo a diferenciação em células T citotóxicas de memória. As células T H 1 também estimulam macrófagos e neutrófilos a se tornarem mais eficazes na morte de bactérias intracelulares. Eles também podem estimular as células NK a se tornarem mais eficazes em matar as células-alvo.
As células T H 2 desempenham um papel importante na orquestração da resposta imune humoral por meio da secreção de citocinas que ativam as células B e direcionam a diferenciação das células B e a produção de anticorpos. Várias citocinas produzidas pelas células T H 2 orquestram a troca de classes de anticorpos, o que permite que as células B alternem entre a produção de IgM, IgG, IgA e IgE conforme necessário para realizar funções específicas de anticorpos e fornecer respostas imunes humorais específicas do patógeno.
Um terceiro subtipo de células T auxiliares chamadas células T H 17 foi descoberto por meio de observações de que a imunidade a algumas infecções não está associada às células T H 1 ou T H 2. As células T H 17 e as citocinas que elas produzem parecem ser especificamente responsáveis pela defesa do organismo contra infecções mucocutâneas crônicas. Pacientes que não possuem células T H 17 suficientes na mucosa (por exemplo, pacientes com HIV) podem ser mais suscetíveis a bacteremia e infecções gastrointestinais. 1
| Subtipo | Funções |
|---|---|
| Células T H 1 | Estimular células T citotóxicas e produzir células T citotóxicas |
| Estimule macrófagos e neutrófilos (PMNs) para uma morte intracelular mais eficaz de patógenos | |
| Estimule as células NK a matar de forma mais eficaz | |
| Células T H 2 | Estimular a ativação e diferenciação das células B em células plasmáticas e células B de memória |
| Mudança direta de classe de anticorpos em células B | |
| Células T H 17 | Estimular a imunidade a infecções específicas, como infecções mucocutâneas crônicas |
| Células T auxiliares de memória | “Lembre-se” de um patógeno específico e crie uma resposta secundária forte e rápida após a reexposição |
Ativação e diferenciação de células T citotóxicas
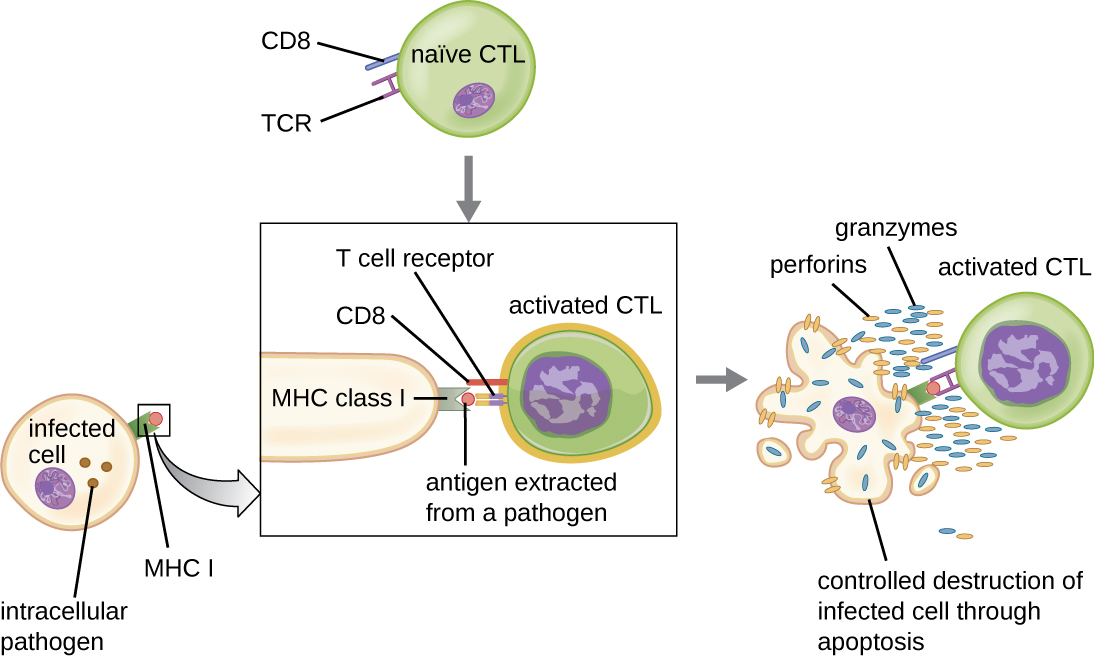
As células T citotóxicas (também conhecidas como linfócitos T citotóxicos ou CTLs) são ativadas por APCs em um processo de três etapas semelhante ao das células T auxiliares. A principal diferença é que a ativação de células T citotóxicas envolve o reconhecimento de um antígeno apresentado com o MHC I (em oposição ao MHC II) e a interação do CD8 (em oposição ao CD4) com o complexo receptor. Após o coreconhecimento bem-sucedido do epítopo estranho e do autoantígeno, a produção de citocinas pela APC e pela célula T citotóxica ativa a proliferação e diferenciação clonal. As células T citotóxicas ativadas podem se diferenciar em células T citotóxicas efetoras que têm como alvo patógenos para destruição ou células de memória que estão prontas para responder às exposições subsequentes.
Conforme observado, a proliferação e diferenciação de células T citotóxicas também são estimuladas por citocinas secretadas por células T H 1 ativadas pelo mesmo epítopo estranho. A coestimulação proveniente dessas células T H 1 é fornecida pelas citocinas secretadas. Embora seja possível que a ativação de células T citotóxicas ocorra sem a estimulação das células T H 1, a ativação não é tão eficaz ou duradoura.
Uma vez ativadas, as células T citotóxicas servem como células efetoras da imunidade celular, reconhecendo e matando células infectadas com patógenos intracelulares por meio de um mecanismo muito semelhante ao das células NK. No entanto, enquanto as células NK reconhecem sinais não específicos de estresse ou anormalidade celular, as células T citotóxicas reconhecem as células infectadas por meio da apresentação antígena de epítopos específicos do patógeno associados ao MHC I. Uma vez que uma célula infectada é reconhecida, o TCR da célula T citotóxica se liga ao epítopo e libera perforina e granzimas que destroem a célula infectada (Figura\(\PageIndex{6}\)). A perforina é uma proteína que cria poros na célula alvo, e as granzimas são proteases que entram nos poros e induzem a apoptose. Esse mecanismo de morte celular programada é um meio controlado e eficiente de destruir e remover células infectadas sem liberar os patógenos internos para infectar as células vizinhas, como poderia ocorrer se as células infectadas fossem simplesmente lisadas.
Neste vídeo, você pode ver uma célula T citotóxica induzindo apoptose em uma célula-alvo.
Exercício\(\PageIndex{4}\)
- Compare e contraste a ativação de células T auxiliares e células T citotóxicas.
- Quais são as diferentes funções dos subtipos de células T auxiliares?
- Qual é o mecanismo de destruição de células infectadas mediada por CTL?
Superantígenos e ativação não regulada de células T
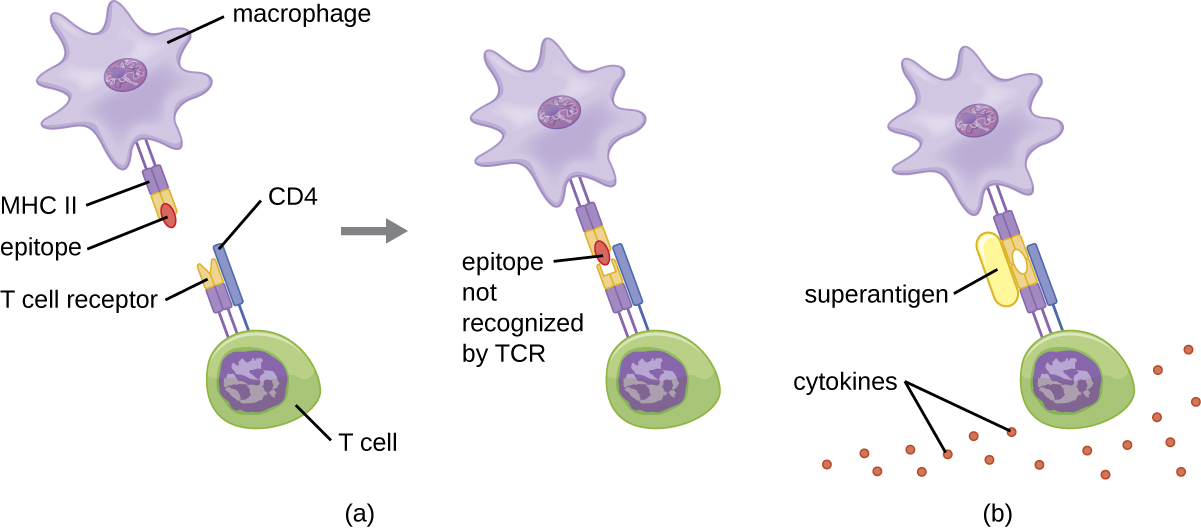
Quando a ativação das células T é controlada e regulada, o resultado é uma resposta protetora eficaz no combate às infecções. No entanto, se a ativação das células T não for regulada e excessiva, o resultado pode ser fatal. Certos patógenos bacterianos e virais produzem toxinas conhecidas como superantígenos (consulte Fatores de Virulência de Patógenos Bacterianos e Virais) que podem desencadear essa resposta não regulamentada. Os superantígenos bacterianos conhecidos incluem a toxina da síndrome do choque tóxico (TSST), enterotoxinas estafilocócicas, toxinas pirogênicas estreptocócicas, superantígeno estreptocócico e a exotoxina mitogênica estreptocócica. Os vírus conhecidos por produzirem superantígenos incluem o vírus Epstein-Barr (herpesvírus humano 4), o citomegalovírus (herpesvírus humano 5) e outros.
O mecanismo de ativação das células T por superantígenos envolve sua ligação simultânea às moléculas MHC II de APCs e à região variável da cadeia β do TCR. Essa ligação ocorre fora da fenda de ligação ao antígeno do MHC II, então o superantígeno se unirá e ativará o MHC II e o TCR sem reconhecimento específico de epítopo estrangeiro (Figura\(\PageIndex{7}\)). O resultado é uma liberação excessiva e descontrolada de citocinas, muitas vezes chamada de tempestade de citocinas, que estimula uma resposta inflamatória excessiva. Isso pode levar a uma diminuição perigosa da pressão arterial, choque, falência de vários órgãos e, potencialmente, morte.
Exercício\(\PageIndex{5}\)
- Quais são os exemplos de superantígenos?
- Como um superantígeno ativa uma célula T auxiliar?
- Qual o efeito de um superantígeno em uma célula T?
Caso em questão: superantígenos
Melissa, uma mulher saudável de 22 anos, é levada ao pronto-socorro por seu namorado preocupado. Ela se queixa de um início repentino de febre alta, vômitos, diarreia e dores musculares. Em sua entrevista inicial, ela diz ao médico assistente que está fazendo controle hormonal de natalidade e também está dois dias na parte menstrual de seu ciclo. Ela não toma nenhum outro medicamento e não está abusando de nenhuma droga ou álcool. Ela não é fumante. Ela não é diabética e atualmente não tem nenhum tipo de infecção, que ela saiba.
Enquanto espera na sala de emergência, a pressão arterial de Melissa começa a cair drasticamente e seu estado mental se deteriora devido à confusão geral. O médico acredita que ela provavelmente está sofrendo da síndrome do choque tóxico (TSS). O TSS é causado pela toxina TSST-1, um superantígeno associado ao Staphylococcus aureus, e o uso inadequado de tampões é uma causa comum de infecções que levam à TSS. O superantígeno estimula inadequadamente a ativação generalizada das células T e a liberação excessiva de citocinas, resultando em uma resposta inflamatória massiva e sistêmica que pode ser fatal.
Exames vaginais ou cervicais podem ser realizados para confirmar a presença do micróbio, mas esses testes não são essenciais para serem realizados com base nos sintomas e no histórico médico de Melissa. O médico prescreve reidratação, terapia de suporte e antibióticos para conter a infecção bacteriana. Ela também prescreve medicamentos para aumentar a pressão arterial de Melissa. Melissa passa três dias no hospital em tratamento; além disso, sua função renal é monitorada devido ao alto risco de insuficiência renal associado à TSS. Depois de 72 horas, Melissa está bem o suficiente para receber alta e continuar sua recuperação em casa.
Exercício\(\PageIndex{6}\)
De que forma a antibioticoterapia ajudaria a combater um superantígeno?
Foco clínico: Parte 2
Os gânglios linfáticos inchados, o abdômen e o baço de Olivia sugerem uma forte resposta imune a uma infecção sistêmica em andamento. Além disso, a pequena Olivia reluta em virar a cabeça e parece estar sentindo fortes dores no pescoço. O médico solicita um hemograma completo, hemocultura e punção lombar. O líquido cefalorraquidiano (LCR) obtido parece turvo e é posteriormente avaliado pela avaliação e cultura da coloração de Gram para possíveis patógenos bacterianos. O hemograma completo indica um número elevado de glóbulos brancos na corrente sanguínea de Olivia. Os aumentos de glóbulos brancos são registrados em 28,5 K/µL (faixa normal: 6,0—17,5 K/µL). A porcentagem de neutrófilos foi registrada como 60% (faixa normal: 23— 45%). Os níveis de glicose no LCR foram registrados em 30 mg/100 mL (intervalo normal: 50—80 mg/100 mL). A contagem leucocitária no líquido cefalorraquidiano foi de 1.163/mm3 (intervalo normal: 5—20/mm 3).
Exercício\(\PageIndex{7}\)
- Com base nesses resultados, você tem um diagnóstico preliminar?
- Qual é o tratamento recomendado com base nesse diagnóstico preliminar?
Conceitos principais e resumo
- Os linfócitos T imaturos são produzidos na medula óssea vermelha e viajam até o timo para maturação.
- A seleção tímica é um processo de três etapas de seleção negativa e positiva que determina quais células T amadurecerão e sairão do timo para a corrente sanguínea periférica.
- A tolerância central envolve a seleção negativa de células T autorreativas no timo, e a tolerância periférica envolve anergia e células T reguladoras que previnem respostas imunes autorreativas e autoimunidade.
- O TCR é semelhante em estrutura às imunoglobulinas, mas menos complexo. Milhões de TCRs exclusivos de ligação ao epítopo são codificados por meio de um processo de rearranjo genético dos segmentos dos genes V, D e J.
- As células T podem ser divididas em três classes — células T auxiliares, células T citotóxicas e células T reguladoras — com base na expressão de CD4 ou CD8, as moléculas de MHC com as quais elas interagem para ativação e suas respectivas funções.
- As células T auxiliares ativadas se diferenciam em subtipos de células T H 1, T H 2, T H 17 ou T de memória. A diferenciação é direcionada pelas citocinas específicas às quais estão expostas. T H 1, T H 2 e T H 17 desempenham diferentes funções relacionadas à estimulação das defesas imunes adaptativas e inatas. As células T de memória são células de vida longa que podem responder rapidamente às exposições secundárias.
- Uma vez ativadas, as células T citotóxicas atacam e matam as células infectadas com patógenos intracelulares. A matança requer o reconhecimento de epítopos específicos de patógenos apresentados na superfície celular usando moléculas de MHC I. A morte é mediada por perforinas e granzimas que induzem a apoptose.
- Superantígenos são proteínas bacterianas ou virais que causam uma ativação inespecífica de células T auxiliares, levando a uma liberação excessiva de citocinas (tempestade de citocinas) e a uma resposta inflamatória sistêmica potencialmente fatal.
Notas de pé
- 1 Blaschitz C., Raffatellu M. “Citocinas Th17 e a barreira mucosa intestinal”. J Clin Immunol. 2010 Mar; 30 (2) :196-203. doi: 10.1007/s10875-010-9368-7.


