17.4: Reconhecimento de patógenos e fagocitose
- Page ID
- 181163
Objetivos de
- Explicar como os leucócitos migram do sangue periférico para os tecidos infectados
- Explicar os mecanismos pelos quais os leucócitos reconhecem patógenos
- Explicar o processo de fagocitose e os mecanismos pelos quais os fagócitos destroem e degradam os patógenos
Vários dos tipos de células discutidos na seção anterior podem ser descritos como fagócitos — células cuja principal função é buscar, ingerir e matar patógenos. Esse processo, chamado de fagocitose, foi observado pela primeira vez em estrelas do mar na década de 1880 pelo zoólogo ganhador do Prêmio Nobel Ilya Metchnikoff (1845-1916), que fez a conexão com glóbulos brancos (WBCs) em humanos e outros animais. Na época, Pasteur e outros cientistas acreditavam que os leucócitos estavam espalhando patógenos em vez de matá-los (o que é verdade para algumas doenças, como a tuberculose). Mas, na maioria dos casos, os fagócitos fornecem uma defesa forte, rápida e eficaz contra uma ampla gama de micróbios, tornando-os um componente crítico da imunidade inata inespecífica. Esta seção se concentrará nos mecanismos pelos quais os fagócitos são capazes de buscar, reconhecer e destruir patógenos.
Extravasamento (Diapedese) de leucócitos
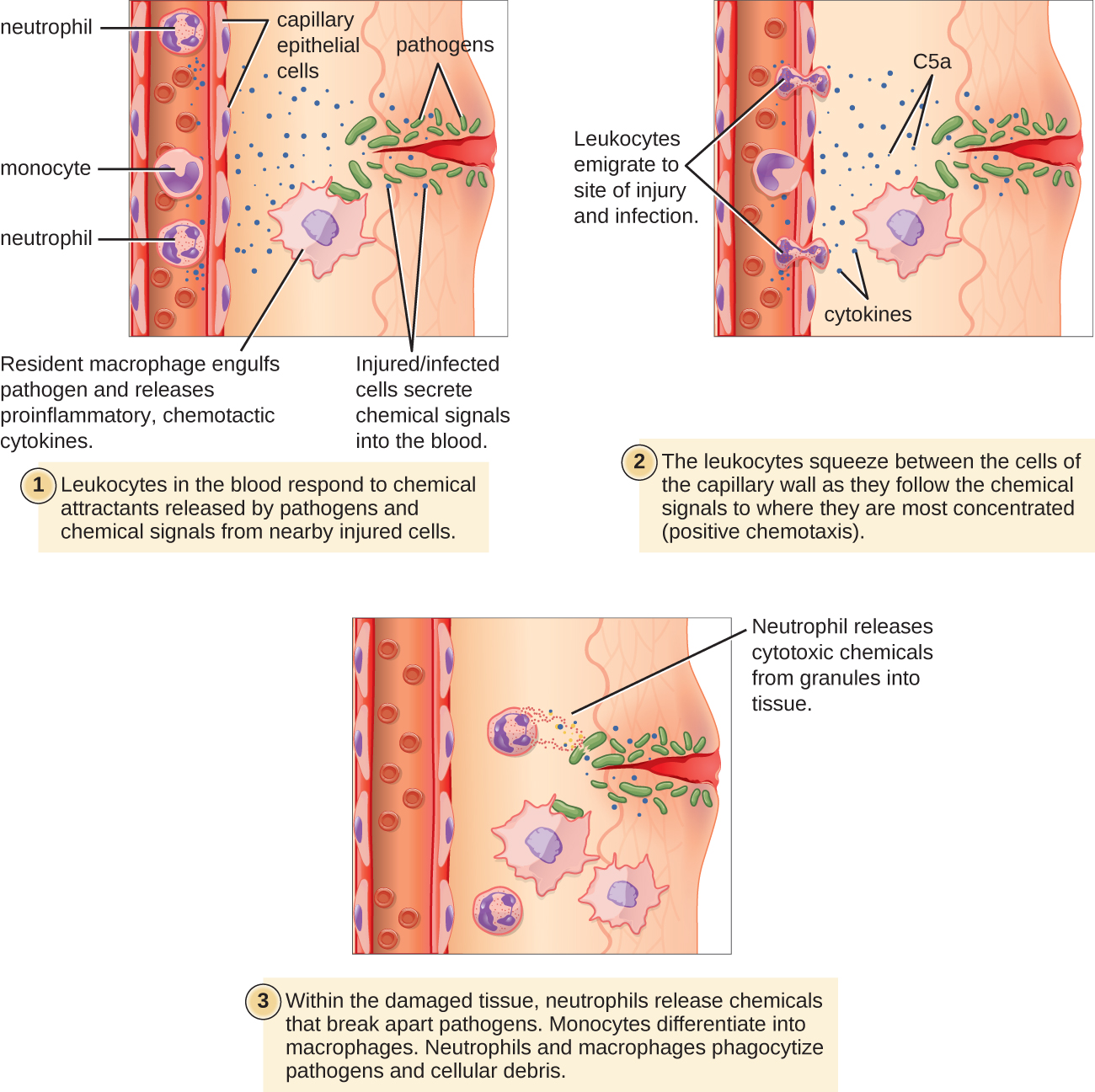
Alguns fagócitos são leucócitos (WBCs) que normalmente circulam na corrente sanguínea. Para alcançar patógenos localizados no tecido infectado, os leucócitos devem passar pelas paredes dos pequenos vasos sanguíneos capilares dentro dos tecidos. Esse processo, chamado de extravasamento, ou diapedese, é iniciado pelo fator de complemento C5a, bem como por citocinas liberadas nas imediações por macrófagos residentes e células teciduais que respondem à presença do agente infeccioso (Figura\(\PageIndex{1}\)). Semelhantes à C5a, muitas dessas citocinas são pró-inflamatórias e quimiotáticas e se ligam às células de pequenos vasos sanguíneos capilares, iniciando uma resposta nas células endoteliais que revestem o interior das paredes dos vasos sanguíneos. Essa resposta envolve a regulação positiva e a expressão de várias moléculas e receptores de adesão celular. Os leucócitos que passam grudam levemente nas moléculas de adesão, diminuindo a velocidade e rolando pelas paredes dos vasos sanguíneos perto da área infectada. Quando atingem uma junção celular, eles se ligam a ainda mais dessas moléculas de adesão, achatando e comprimindo a junção celular em um processo conhecido como migração transendotelial. Esse mecanismo de “adesão contínua” permite que os leucócitos saiam da corrente sanguínea e entrem nas áreas infectadas, onde podem começar a fagocitar os patógenos invasores.
Observe que o extravasamento não ocorre nas artérias ou veias. Esses vasos sanguíneos são cercados por paredes protetoras multicamadas mais espessas, em contraste com as finas paredes de camada única dos capilares. Além disso, o fluxo sanguíneo nas artérias é muito turbulento para permitir uma adesão contínua. Além disso, alguns leucócitos tendem a responder a uma infecção mais rapidamente do que outros. Os primeiros a chegar normalmente são os neutrófilos, geralmente poucas horas após uma infecção bacteriana. Por contrato, os monócitos podem levar vários dias para sair da corrente sanguínea e se diferenciar em macrófagos.
Assista aos vídeos a seguir sobre extravasamento de leucócitos e rolamento de leucócitos para saber mais.
Exercício\(\PageIndex{1}\)
Explicar o papel das moléculas de adesão no processo de extravasamento.
Reconhecimento de patógenos
Conforme descrito na seção anterior, a opsonização de patógenos por anticorpos; fatores complementares C1q, C3b e C4b; e lectinas podem auxiliar as células fagocíticas no reconhecimento de patógenos e na ligação para iniciar a fagocitose. No entanto, nem todo reconhecimento de patógenos depende da opsonina. Os fagócitos também podem reconhecer estruturas moleculares que são comuns a muitos grupos de micróbios patogênicos. Essas estruturas são chamadas de padrões moleculares associados a patógenos (PAMPs). Os PAMPs comuns incluem o seguinte:
- peptidoglicano, encontrado nas paredes celulares bacterianas;
- flagelina, uma proteína encontrada nos flagelos bacterianos;
- lipopolissacarídeo (LPS) da membrana externa de bactérias gram-negativas;
- lipopeptídeos, moléculas expressas pela maioria das bactérias; e
- ácidos nucléicos, como DNA viral ou RNA.
Como vários outros PAMPs, essas substâncias são parte integrante da estrutura de amplas classes de micróbios.
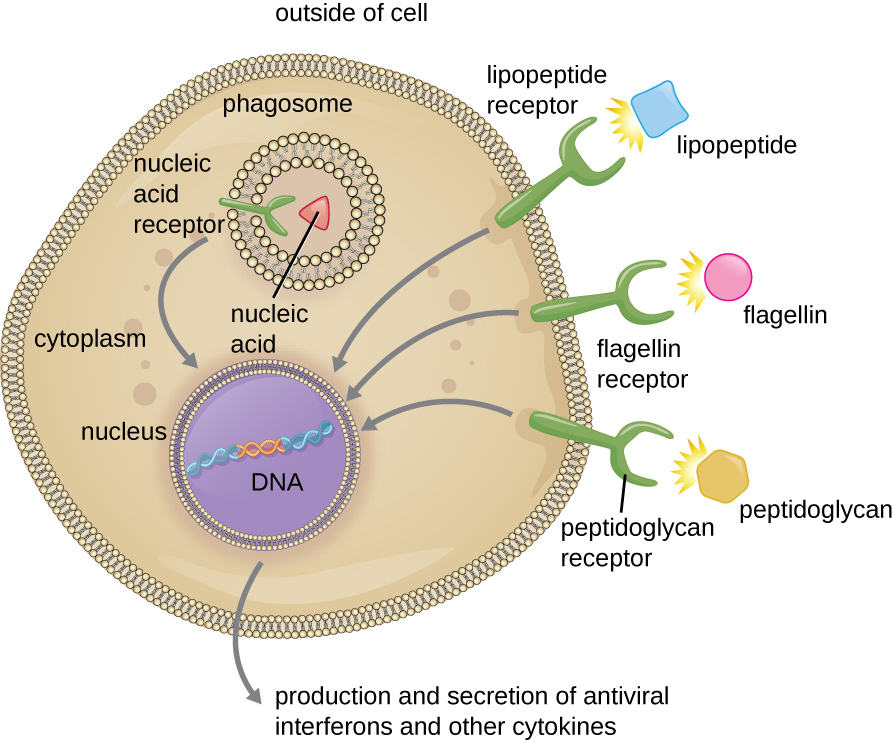
As estruturas que permitem que as células fagocíticas detectem PAMPs são chamadas de receptores de reconhecimento de padrões (PRRs). Um grupo de PRRs são os receptores toll-like (TLRs), que se ligam a vários PAMPs e se comunicam com o núcleo do fagócito para provocar uma resposta. Muitos TLRs (e outros PRRs) estão localizados na superfície de um fagócito, mas alguns também podem ser encontrados embutidos nas membranas dos compartimentos internos e organelas (Figura\(\PageIndex{2}\)). Esses PRRs internos podem ser úteis para a ligação e reconhecimento de patógenos intracelulares que podem ter acesso ao interior da célula antes que a fagocitose pudesse ocorrer. Os ácidos nucléicos virais, por exemplo, podem encontrar um PRR interno, desencadeando a produção do interferon antiviral da citocina.
Além de fornecer a primeira etapa do reconhecimento de patógenos, a interação entre PAMPs e PRRs em macrófagos fornece um sinal intracelular que ativa o fagócito, fazendo com que ele faça a transição de um estado adormecido de prontidão e proliferação lenta para um estado de hiperatividade, proliferação, produção/secreção de citocinas e aumento da morte intracelular. Os PRRs nos macrófagos também respondem a sinais químicos de socorro de células danificadas ou estressadas. Isso permite que os macrófagos estendam suas respostas além da proteção contra doenças infecciosas para um papel mais amplo na resposta inflamatória iniciada por lesões ou outras doenças.
Exercício\(\PageIndex{2}\)
- Cite quatro padrões moleculares associados a patógenos (PAMPs).
- Descreva o processo de ativação dos fagócitos.
Degradação de patógenos
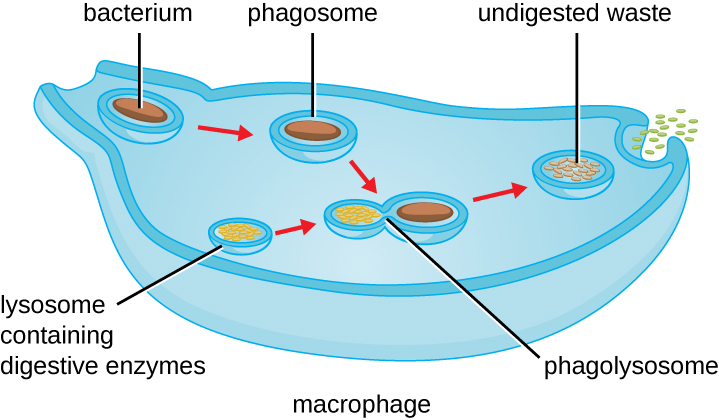
Uma vez que o reconhecimento e a ligação do patógeno ocorrem, o patógeno é engolido por uma vesícula e levado para o compartimento interno do fagócito em um processo chamado fagocitose (Figura\(\PageIndex{3}\)). Os PRRs podem auxiliar na fagocitose ligando-se primeiro à superfície do patógeno, mas os fagócitos também são capazes de engolir itens próximos, mesmo que não estejam ligados a receptores específicos. Para engolir o patógeno, o fagócito forma um pseudópode que envolve o patógeno e o comprime em uma vesícula de membrana chamada fagossomo. A acidificação do fagossomo (o pH diminui para a faixa de 4—5) fornece um importante mecanismo antibacteriano precoce. O fagossomo que contém o patógeno se funde com um ou mais lisossomos, formando um fagolisossomo. A formação do fagolisossomo aumenta a acidificação, que é essencial para a ativação de enzimas lisossômicas digestivas dependentes do pH e a produção de peróxido de hidrogênio e espécies tóxicas reativas de oxigênio. Enzimas lisossômicas, como lisozima, fosfolipase e proteases, digerem o patógeno. Outras enzimas estão envolvidas em uma explosão respiratória. Durante a explosão respiratória, os fagócitos aumentarão a absorção e o consumo de oxigênio, mas não para produção de energia. O aumento do consumo de oxigênio está focado na produção de ânion superóxido, peróxido de hidrogênio, radicais hidroxila e outras espécies reativas de oxigênio que são antibacterianas.
Além das espécies reativas de oxigênio produzidas pela explosão respiratória, também podem se formar compostos reativos de nitrogênio com potencial citotóxico (matar células). Por exemplo, o óxido nítrico pode reagir com o superóxido para formar peroxinitrito, um composto de nitrogênio altamente reativo com capacidades de degradação semelhantes às das espécies reativas de oxigênio. Alguns fagócitos contêm até mesmo um depósito interno de proteínas microbicidas de defensina (por exemplo, grânulos de neutrófilos). Essas forças destrutivas podem ser liberadas na área ao redor da célula para degradar micróbios externamente. Os neutrófilos, especialmente, podem ser bastante eficientes nesse mecanismo antimicrobiano secundário.
Quando a degradação é concluída, os resíduos restantes são excretados da célula em uma vesícula exocítica. No entanto, é importante observar que nem todos os restos do patógeno são excretados como resíduos. Macrófagos e células dendríticas também são células apresentadoras de antígenos envolvidas na resposta imune adaptativa específica. Essas células processam ainda mais os restos do patógeno degradado e apresentam antígenos essenciais (proteínas patogênicas específicas) em sua superfície celular. Essa é uma etapa importante para a estimulação de algumas respostas imunes adaptativas, como será discutido com mais detalhes no próximo capítulo.
Visite este link para ver um fagócito perseguindo e engolfando um patógeno.
Exercício\(\PageIndex{3}\)
Qual é a diferença entre um fagossomo e um lisossoma?
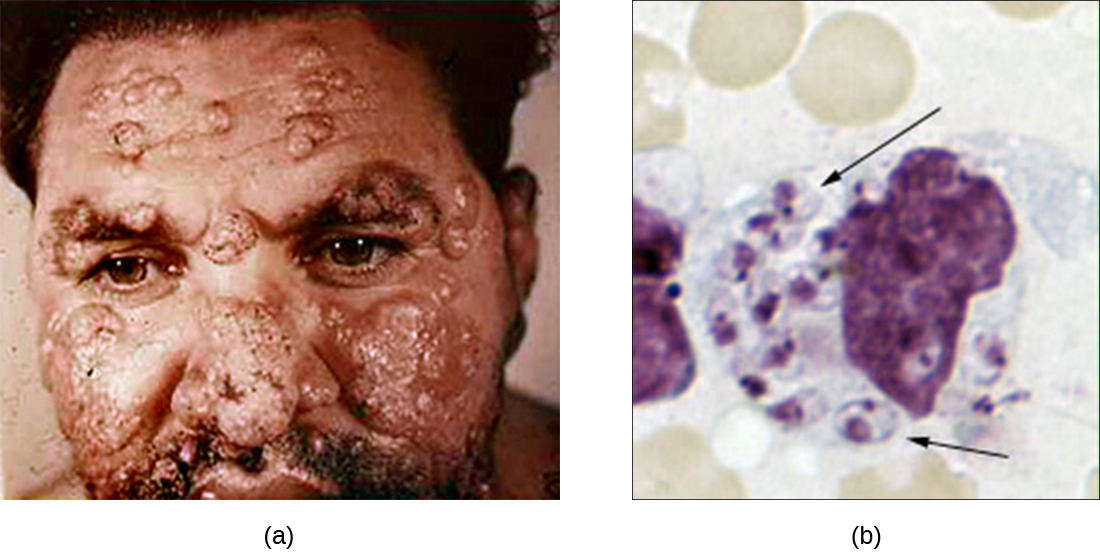
Embora a fagocitose destrua com sucesso muitos patógenos, alguns são capazes de sobreviver e até mesmo explorar esse mecanismo de defesa para se multiplicar no corpo e causar infecções generalizadas. Protozoários do gênero Leishmania são um exemplo. Esses parasitas intracelulares obrigatórios são flagelados transmitidos aos humanos pela picada de um flebotomíneo. As infecções causam feridas e úlceras graves e às vezes desfigurantes na pele e em outros tecidos (Figura\(\PageIndex{4}\)). Em todo o mundo, estima-se que 1,3 milhão de pessoas sejam recém-infectadas com leishmaniose anualmente. 1
Os peptídeos salivares do flebotomíneo ativam os macrófagos hospedeiros no local da picada. A via clássica ou alternativa para a ativação do complemento ocorre com a opsonização C3b do parasita. As células de Leishmania são fagocitadas, perdem seus flagelos e se multiplicam em uma forma conhecida como amastigota (corpo de Leishman-Donovan) dentro do fagolisossomo. Embora muitos outros patógenos sejam destruídos no fagolisossomo, a sobrevivência dos amastigotas de Leishmania é mantida pela presença de lipofosfoglicano superficial e fosfatase ácida. Essas substâncias inibem a explosão respiratória dos macrófagos e as enzimas lisossômicas. O parasita então se multiplica dentro da célula e lisa o macrófago infectado, liberando os amastigotas para infectar outros macrófagos dentro do mesmo hospedeiro. Se outro flebotomíneo picar uma pessoa infectada, ele pode ingerir amastigotas e transmiti-los a outro indivíduo por meio de outra picada.
Existem várias formas diferentes de leishmaniose. A mais comum é uma forma cutânea localizada da doença causada por L. tropica, que normalmente se resolve espontaneamente com o tempo, mas com alguma infiltração linfática significativa e cicatrizes permanentes. Uma forma mucocutânea da doença, causada por L. viannia brasilienfsis, produz lesões no tecido do nariz e da boca e pode ser fatal. Uma forma visceral da doença pode ser causada por várias das diferentes espécies de Leishmania. Ela afeta vários sistemas orgânicos e causa aumento anormal do fígado e do baço. Febres irregulares, anemia, disfunção hepática e perda de peso são todos sinais e sintomas da leishmaniose visceral. Se não for tratada, geralmente é fatal.
Conceitos principais e resumo
- Os fagócitos são células que reconhecem patógenos e os destroem por meio da fagocitose.
- O reconhecimento geralmente ocorre pelo uso de receptores de fagócitos que se ligam a moléculas comumente encontradas em patógenos, conhecidos como padrões moleculares associados a patógenos (PAMPs).
- Os receptores que se ligam aos PAMPs são chamados de receptores de reconhecimento de padrões, ou PRRs. Os receptores Toll-like (TLRs) são um tipo de PRR encontrado nos fagócitos.
- O extravasamento dos glóbulos brancos da corrente sanguínea para o tecido infectado ocorre por meio do processo de migração transendotelial.
- Os fagócitos degradam os patógenos por meio da fagocitose, que envolve engolfar o patógeno, matá-lo e digeri-lo dentro de um fagolisossomo e, em seguida, excretar matéria não digerida.
Notas de pé
- 1 Organização Mundial da Saúde. “Leishmaniose”. 2016. http://www.who.int/mediacentre/factsheets/fs375/en/.


