14.5: Testando a eficácia dos antimicrobianos
- Page ID
- 181756
Objetivos de
- Explicar o conceito de resistência aos medicamentos
- Descreva como os microrganismos desenvolvem ou adquirem
- Descreva os diferentes mecanismos de resistência aos antimicrobianos
A resistência antimicrobiana não é um fenômeno novo. Na natureza, os micróbios estão em constante evolução para superar os compostos antimicrobianos produzidos por outros microrganismos. O desenvolvimento humano de medicamentos antimicrobianos e seu amplo uso clínico simplesmente proporcionaram outra pressão seletiva que promove uma maior evolução. Vários fatores importantes podem acelerar a evolução da resistência aos medicamentos. Isso inclui o uso excessivo e indevido de antimicrobianos, uso inadequado de antimicrobianos, dosagem subterapêutica e não adesão do paciente ao tratamento recomendado.
A exposição de um patógeno a um composto antimicrobiano pode selecionar mutações cromossômicas que conferem resistência, que podem ser transferidas verticalmente para gerações microbianas subsequentes e, eventualmente, tornar-se predominantes em uma população microbiana que é repetidamente exposta ao antimicrobiano. Alternativamente, muitos genes responsáveis pela resistência aos medicamentos são encontrados em plasmídeos ou em transposons que podem ser facilmente transferidos entre micróbios por meio da transferência horizontal de genes (veja Como os procariontes assexuais alcançam a diversidade genética). Os transposons também têm a capacidade de mover genes de resistência entre plasmídeos e cromossomos para promover ainda mais a disseminação da resistência.
Mecanismos de resistência a medicamentos
Existem vários mecanismos comuns de resistência aos medicamentos, resumidos na Figura\(\PageIndex{1}\). Esses mecanismos incluem modificação enzimática do medicamento, modificação do alvo antimicrobiano e prevenção da penetração ou acúmulo do medicamento.
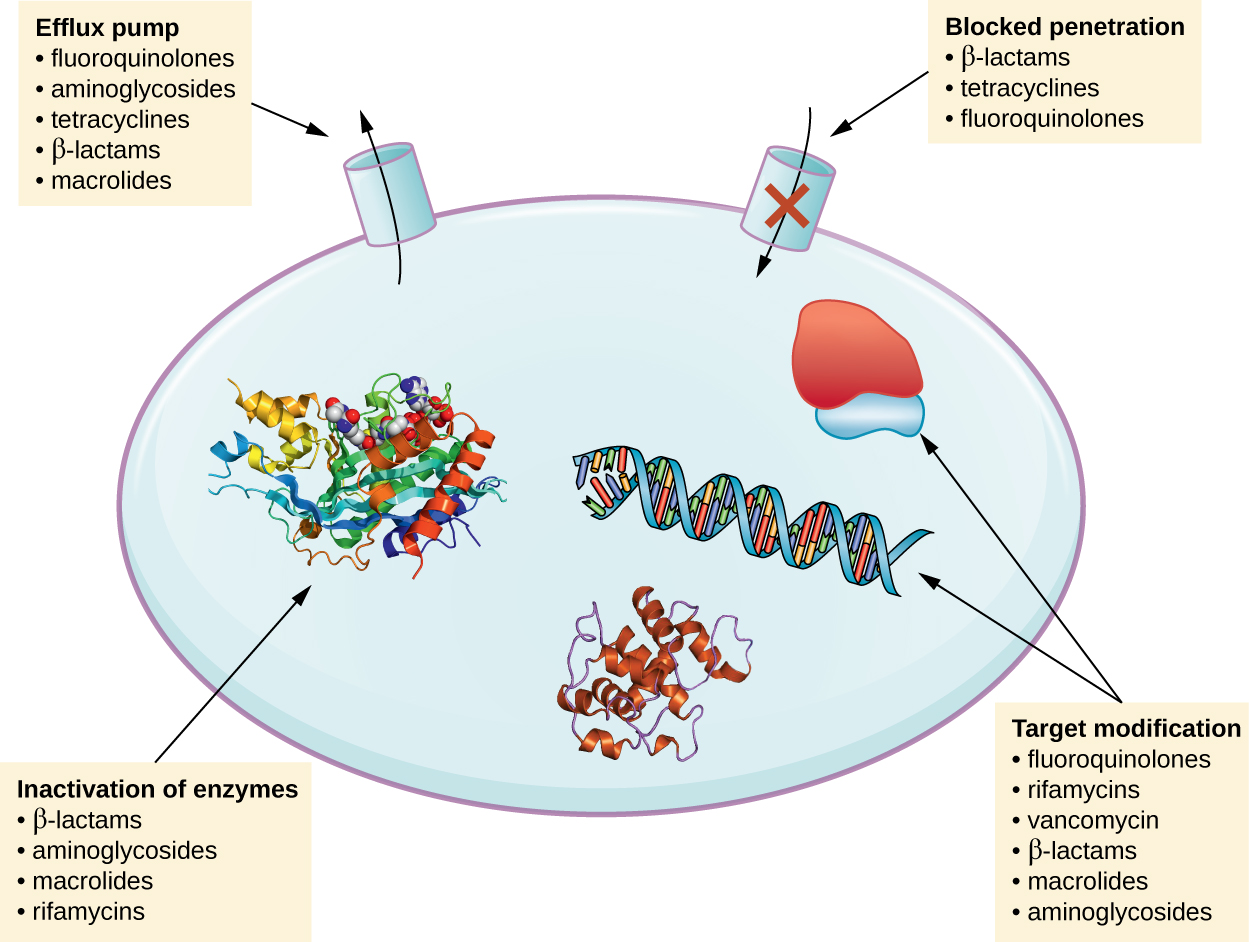
Modificação ou inativação de medicamentos
Os genes de resistência podem codificar enzimas que modificam quimicamente um antimicrobiano, inativando-o ou destruindo um antimicrobiano por hidrólise. A resistência a muitos tipos de antimicrobianos ocorre por meio desse mecanismo. Por exemplo, a resistência aos aminoglicosídeos pode ocorrer por meio da transferência enzimática de grupos químicos para a molécula do fármaco, prejudicando a ligação do fármaco ao seu alvo bacteriano. Para β-lactamas, a resistência bacteriana pode envolver a hidrólise enzimática da ligação β-lactâmica dentro do anel β-lactâmico da molécula do fármaco. Uma vez rompida a ligação β-lactâmica, a droga perde sua atividade antibacteriana. Esse mecanismo de resistência é mediado pelas β-lactamases, que são o mecanismo mais comum de resistência aos β-lactâmicos. A inativação da rifampicina geralmente ocorre por meio de glicosilação, fosforilação ou ribosilação de adenosina difosfato (ADP), e a resistência a macrolídeos e lincosamidas também pode ocorrer devido à inativação enzimática do medicamento ou modificação.
Prevenção da absorção ou efluxo celular
Os micróbios podem desenvolver mecanismos de resistência que envolvem a inibição do acúmulo de um medicamento antimicrobiano, o que impede que o medicamento atinja seu alvo celular. Essa estratégia é comum entre patógenos gram-negativos e pode envolver mudanças na composição lipídica da membrana externa, na seletividade dos canais de porinas e/ou nas concentrações dos canais de porinas. Por exemplo, um mecanismo comum de resistência aos carbapenêmicos entre Pseudomonas aeruginosa é diminuir a quantidade de sua porina oPRD, que é a principal porta de entrada dos carbapenêmicos através da membrana externa desse patógeno. Além disso, muitas bactérias patogênicas gram-positivas e gram-negativas produzem bombas de efluxo que transportam ativamente um medicamento antimicrobiano para fora da célula e evitam o acúmulo de fármaco a um nível que seria antibacteriano. Por exemplo, a resistência a β-lactamas, tetraciclinas e fluoroquinolonas geralmente ocorre por meio de efluxo ativo para fora da célula, e é bastante comum que uma única bomba de efluxo tenha a capacidade de translocar vários tipos de antimicrobianos.
Alteração do alvo
Como os medicamentos antimicrobianos têm alvos muito específicos, mudanças estruturais nesses alvos podem impedir a ligação aos medicamentos, tornando o medicamento ineficaz. Por meio de mutações espontâneas nos genes que codificam alvos de medicamentos antibacterianos, as bactérias têm uma vantagem evolutiva que lhes permite desenvolver resistência aos medicamentos. Esse mecanismo de desenvolvimento de resistência é bastante comum. Alterações genéticas que afetam o sítio ativo das proteínas de ligação à penicilina (PBPs) podem inibir a ligação de medicamentos β-lactâmicos e fornecer resistência a vários medicamentos dentro dessa classe. Esse mecanismo é muito comum entre cepas de Streptococcus pneumoniae, que alteram seus próprios PBPs por meio de mecanismos genéticos. Em contraste, cepas de Staphylococcus aureus desenvolvem resistência à meticilina (MRSA) por meio da aquisição de um novo PBP de baixa afinidade, em vez de alterar estruturalmente seus PBPs existentes. Esse novo PBP de baixa afinidade não apenas fornece resistência à meticilina, mas também fornece resistência a praticamente todos os medicamentos β-lactâmicos, com exceção das novas cefalosporinas de quinta geração projetadas especificamente para matar o MRSA. Outros exemplos dessa estratégia de resistência incluem alterações em
- subunidades ribossômicas, fornecendo resistência a macrolídeos, tetraciclinas e aminoglicosídeos;
- estrutura de lipopolissacarídeos (LPS), proporcionando resistência às polimixinas;
- RNA polimerase, proporcionando resistência à rifampicina;
- DNA girase, fornecendo resistência às fluoroquinolonas;
- enzimas metabólicas, fornecendo resistência a sulfonas, sulfonas e trimetoprim; e
- o peptidoglicano subune as cadeias peptídicas, fornecendo resistência aos glicopeptídeos.
Superprodução alvo ou bypass enzimático
Quando um medicamento antimicrobiano funciona como um antimetabólito, visando uma enzima específica para inibir sua atividade, existem outras maneiras pelas quais a resistência microbiana pode ocorrer. Primeiro, o micróbio pode superproduzir a enzima alvo, de forma que haja uma quantidade suficiente de enzima livre de antimicrobianos para realizar a reação enzimática adequada. Em segundo lugar, a célula bacteriana pode desenvolver um bypass que contorna a necessidade da enzima alvo funcional. Ambas as estratégias foram encontradas como mecanismos de resistência às sulfonamidas. Foi demonstrado que a resistência à vancomicina entre S. aureus envolve a diminuição da ligação cruzada das cadeias peptídicas na parede celular bacteriana, o que proporciona um aumento nos alvos aos quais a vancomicina se liga na parede celular externa. O aumento da ligação da vancomicina na parede celular externa fornece um bloqueio que impede que as moléculas livres do fármaco penetrem até onde possam bloquear a síntese da nova parede celular.
Mimetismo de alvos
Um mecanismo de resistência recentemente descoberto chamado mimetismo de alvos envolve a produção de proteínas que se ligam e sequestram drogas, impedindo que as drogas se liguem ao seu alvo. Por exemplo, o Mycobacterium tuberculosis produz uma proteína com repetições regulares de pentapeptídeos que parece imitar a estrutura do DNA. Essa proteína se liga às fluoroquinolonas, sequestrando-as e impedindo que se liguem ao DNA, proporcionando resistência ao M. tuberculosis às fluoroquinolonas. Verificou-se que proteínas que imitam o sítio A do ribossomo bacteriano também contribuem para a resistência aos aminoglicosídeos. 1
Exercício\(\PageIndex{1}\)
Liste vários mecanismos de resistência aos medicamentos.
Micróbios multirresistentes e resistência cruzada
Do ponto de vista clínico, nossas maiores preocupações são os micróbios multirresistentes (MDRs) e a resistência cruzada. Os MDRs são coloquialmente conhecidos como “superbactérias” e possuem um ou mais mecanismos de resistência, tornando-os resistentes a vários antimicrobianos. Na resistência cruzada, um único mecanismo de resistência confere resistência a vários medicamentos antimicrobianos. Por exemplo, ter uma bomba de efluxo que pode exportar vários medicamentos antimicrobianos é uma forma comum de os micróbios serem resistentes a vários medicamentos usando um único mecanismo de resistência. Nos últimos anos, várias superbactérias clinicamente importantes surgiram, e o CDC relata que as superbactérias são responsáveis por mais de 2 milhões de infecções nos EUA anualmente, resultando em pelo menos 23.000 mortes. 2 Várias das superbactérias discutidas nas seções a seguir foram apelidadas de patógenos ESKAPE. Esta sigla se refere aos nomes dos patógenos (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa e Enterobacter spp.), mas também é adequado que esses os patógenos são capazes de “escapar” de muitas formas convencionais de terapia antimicrobiana. Como tal, infecções por patógenos ESKAPE podem ser difíceis de tratar e causam um grande número de infecções nosocomiais.
Staphylococcus aureus resistente à meticilina (MRSA)
A meticilina, uma penicilina semissintética, foi projetada para resistir à inativação por β-lactamases. Infelizmente, logo após a introdução da meticilina na prática clínica, cepas de S. aureus resistentes à meticilina apareceram e começaram a se espalhar. O mecanismo de resistência, aquisição de um novo PBP de baixa afinidade, proporcionou ao S. aureus resistência a todos os β-lactâmicos disponíveis. Cepas de S. aureus resistente à meticilina (MRSA) são patógenos oportunistas generalizados e uma preocupação particular para infecções cutâneas e outras feridas, mas também podem causar pneumonia e septicemia. Embora originalmente fosse um problema em ambientes de saúde (MRSA adquirido em hospital [HA-MRSA]), as infecções por MRSA agora também são adquiridas por meio do contato com membros contaminados do público em geral, chamado MRSA associado à comunidade (CA-MRSA). Aproximadamente um terço da população carrega S. aureus como membro de sua microbiota nasal normal sem doenças, e cerca de 6% dessas cepas são resistentes à meticilina. 3 4
Ácido clavulânico: o pequeno ajudante da penicilina
Com a introdução da penicilina no início da década de 1940 e sua subsequente produção em massa, a sociedade começou a pensar nos antibióticos como curas milagrosas para uma ampla gama de doenças infecciosas. Infelizmente, já em 1945, a resistência à penicilina foi documentada pela primeira vez e começou a se espalhar. Mais de 90% dos isolados clínicos atuais de S. aureus são resistentes à penicilina. 5
Embora o desenvolvimento de novos medicamentos antimicrobianos seja uma solução para esse problema, os cientistas exploraram novas abordagens, incluindo o desenvolvimento de compostos que inativam os mecanismos de resistência. O desenvolvimento do ácido clavulânico representa um dos primeiros exemplos dessa estratégia. O ácido clavulânico é uma molécula produzida pela bactéria Streptococcus clavuligerus. Ele contém um anel β-lactâmico, tornando-o estruturalmente semelhante à penicilina e outros β-lactâmicos, mas não mostra eficácia clínica quando administrado isoladamente. Em vez disso, o ácido clavulânico se liga irreversivelmente ao sítio ativo das β-lactamases e impede que elas inativem uma penicilina coadministrada.
O ácido clavulânico foi desenvolvido pela primeira vez na década de 1970 e foi comercializado em massa em combinação com a amoxicilina a partir da década de 1980 sob a marca Augmentin. Como é normalmente o caso, a resistência à combinação amoxicilina-ácido clavulânico logo apareceu. A resistência geralmente resulta do aumento da produção de β-lactamase pelas bactérias e da superação dos efeitos inibitórios do ácido clavulânico, mutando sua β-lactamase para que ela não seja mais inibida pelo ácido clavulânico ou da aquisição de uma nova β-lactamase que não é inibida pelo ácido clavulânico. Apesar das crescentes preocupações com a resistência, o ácido clavulânico e os inibidores de β-lactamase relacionados (sulbactam e tazobactam) representam uma nova estratégia importante: o desenvolvimento de compostos que inibem diretamente as enzimas que conferem resistência antimicrobiana.
Enterococos resistentes à vancomicina e Staphylococcus aureus
A vancomicina só é eficaz contra organismos gram-positivos e é usada para tratar infecções de feridas, infecções sépticas, endocardite e meningite causadas por patógenos resistentes a outros antibióticos. É considerada uma das últimas linhas de defesa contra essas infecções resistentes, incluindo o MRSA. Com o aumento da resistência aos antibióticos nas décadas de 1970 e 1980, o uso de vancomicina aumentou, e não é surpreendente que tenhamos visto o surgimento e a disseminação de enterococos resistentes à vancomicina (VRE), S. aureus resistente à vancomicina (VRSA) e S. aureus intermediário à vancomicina (VISA). O mecanismo de resistência à vancomicina entre os enterococos é a modificação do alvo, envolvendo uma mudança estrutural no componente peptídico das subunidades do peptidoglicano, impedindo a ligação da vancomicina. Essas cepas geralmente se espalham entre pacientes em ambientes clínicos pelo contato com profissionais de saúde e superfícies e equipamentos médicos contaminados.
As cepas VISA e VRSA diferem entre si no mecanismo de resistência e no grau de resistência que cada mecanismo confere. As cepas VISA apresentam resistência intermediária, com uma concentração inibitória mínima (MIC) de 4—8 μg/mL, e o mecanismo envolve um aumento nos alvos de vancomicina. As cepas VISA diminuem a reticulação das cadeias peptídicas na parede celular, proporcionando um aumento nos alvos da vancomicina que prendem a vancomicina na parede celular externa. Em contraste, cepas de VRSA adquirem resistência à vancomicina por meio da transferência horizontal de genes de resistência do VRE, uma oportunidade oferecida em indivíduos coinfectados com VRE e MRSA. Os VRSA apresentam um nível mais alto de resistência, com MICs de 16 μg/mL ou mais. 6 No caso de todos os três tipos de bactérias resistentes à vancomicina, a identificação clínica rápida é necessária para que procedimentos adequados para limitar a disseminação possam ser implementados. As oxazolidinonas, como a linezolida, são úteis para o tratamento desses patógenos oportunistas resistentes à vancomicina, bem como do MRSA.
Patógenos Gram-negativos produtores de β-Lactamase de espectro estendido
Patógenos gram-negativos que produzem β-lactamases de espectro estendido (ESBLs) apresentam resistência muito além das penicilinas. O espectro de β-lactamas inativados por ESBLs fornece resistência a todas as penicilinas, cefalosporinas, monobactamas e combinações de inibidores de β-lactamase, mas não aos carbapenêmicos. Uma preocupação ainda maior é que os genes que codificam ESBLs são geralmente encontrados em plasmídeos móveis que também contêm genes de resistência a outras classes de medicamentos (por exemplo, fluoroquinolonas, aminoglicosídeos, tetraciclinas) e podem ser facilmente disseminados para outras bactérias por transferência horizontal de genes. Essas bactérias multirresistentes são membros da microbiota intestinal de alguns indivíduos, mas também são causas importantes de infecções oportunistas em pacientes hospitalizados, das quais podem ser transmitidas para outras pessoas.
Bactérias Gram-negativas resistentes a carbapenêmicos
A ocorrência de Enterobacteriaceae (CRE) resistentes aos carbapenêmicos e resistência aos carbapenêmicos entre outras bactérias gram-negativas (por exemplo, P. aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophila) é um problema crescente de saúde. Esses patógenos desenvolvem resistência aos carbapenêmicos por meio de uma variedade de mecanismos, incluindo a produção de carbapenemases (β-lactamases de amplo espectro que inativam todos os β-lactâmicos, incluindo os carbapenêmicos), efluxo ativo de carbapenêmicos para fora da célula e/ou prevenção da entrada de carbapenêmicos pelos canais de porinas. Semelhantes às preocupações com os ESBLs, os patógenos gram-negativos resistentes aos carbapenêmicos geralmente são resistentes a várias classes de antibacterianos, e alguns até desenvolveram resistência à dor (resistência a todos os antibacterianos disponíveis). Infecções por patógenos gram-negativos resistentes aos carbapenêmicos geralmente ocorrem em ambientes de saúde por meio da interação com indivíduos ou dispositivos médicos contaminados, ou como resultado de cirurgia.
Mycobacterium tuberculosis multirresistente
O surgimento do Mycobacterium tuberculosis multirresistente (MDR-TB) e do Mycobacterium tuberculosis extensivamente resistente a medicamentos (XDR-TB) também é uma preocupação global significativa. As cepas MDR-TB são resistentes tanto à rifampicina quanto à isoniazida, a combinação de medicamentos normalmente prescrita para o tratamento da tuberculose. As cepas XDR-TB também são resistentes a qualquer fluoroquinolona e a pelo menos um dos três outros medicamentos (amicacina, canamicina ou capreomicina) usados como segunda linha de tratamento, deixando para esses pacientes poucas opções de tratamento. Ambos os tipos de patógenos são particularmente problemáticos em pessoas imunocomprometidas, incluindo aquelas que sofrem de infecção pelo HIV. O desenvolvimento de resistência nessas cepas geralmente resulta do uso incorreto de antimicrobianos no tratamento da tuberculose, selecionando a resistência.
Exercício\(\PageIndex{2}\)
Como a resistência aos medicamentos leva às superbactérias?
Para saber mais sobre as 18 principais ameaças resistentes aos medicamentos nos EUA, visite o site do CDC.
Agricultura industrial e resistência aos medicamentos
Embora a pecuária tenha sido há muito tempo uma parte importante da agricultura nos Estados Unidos, o aumento das operações concentradas de alimentação animal (CAFOs) desde a década de 1950 trouxe algumas novas questões ambientais, incluindo a contaminação da água e do ar com resíduos biológicos e questões éticas relacionadas aos direitos dos animais também estão associados ao crescimento de animais dessa maneira. Além disso, o aumento de CAFOs envolve o uso extensivo de medicamentos antimicrobianos na criação de gado. Antimicrobianos são usados para prevenir o desenvolvimento de doenças infecciosas nas proximidades dos CAFOs; no entanto, a maioria dos antimicrobianos usados na agricultura industrial é para promover o crescimento - em outras palavras, para cultivar animais maiores.
O mecanismo subjacente a esse crescimento aprimorado ainda não está claro. Esses antibióticos podem não ser necessariamente os mesmos usados clinicamente para humanos, mas estão estruturalmente relacionados aos medicamentos usados em humanos. Como resultado, o uso de medicamentos antimicrobianos em animais pode selecionar a resistência antimicrobiana, com essas bactérias resistentes se tornando resistentes a medicamentos normalmente usados em humanos. Por exemplo, o uso de tilosina em animais parece selecionar bactérias que também são resistentes a outros macrolídeos, incluindo a eritromicina, comumente usada em humanos.
As concentrações das cepas bacterianas resistentes a medicamentos geradas pelos CAFOs aumentam na água e no solo ao redor dessas fazendas. Se não forem diretamente patogênicas em humanos, essas bactérias resistentes podem servir como um reservatório de elementos genéticos móveis que podem então transmitir genes de resistência para patógenos humanos. Felizmente, o processo de cozimento normalmente inativa qualquer antimicrobiano restante na carne, então os humanos normalmente não estão ingerindo esses medicamentos diretamente. No entanto, muitas pessoas estão pedindo um uso mais criterioso dessas drogas, talvez cobrando taxas de uso dos agricultores para reduzir o uso indiscriminado. De fato, em 2012, o FDA publicou diretrizes para agricultores que voluntariamente eliminaram o uso de medicamentos antimicrobianos, exceto sob supervisão veterinária e quando necessário para garantir a saúde animal. Embora seguir as diretrizes seja voluntário no momento, o FDA recomenda o que chama de uso “criterioso” de medicamentos antimicrobianos em animais produtores de alimentos, em um esforço para diminuir a resistência antimicrobiana.
Foco clínico: Parte 3
Infelizmente, a infecção do trato urinário de Marisa não se resolveu com o tratamento com ciprofloxacina. Testes laboratoriais mostraram que sua infecção foi causada por uma cepa de Klebsiella pneumoniae com resistência antimicrobiana significativa. O perfil de resistência desse K. pneumoniae incluiu resistência à classe de antibacterianos dos carbapenêmicos, um grupo de β-lactâmicos que normalmente é reservado para o tratamento de bactérias altamente resistentes. K. pneumoniae é um bastonete gram-negativo oportunista, capsulado e que pode ser membro da microbiota normal do trato intestinal, mas também pode causar uma série de doenças, incluindo pneumonia e ITUs.
Testes laboratoriais específicos para a produção de carbapenemase foram realizados nas amostras de Marisa e deram positivo. Com base nesse resultado, em combinação com seu histórico de saúde, suspeitava-se da produção de uma carbapenemase conhecida como Metalo-β-Lactamase de Nova Délhi (NDM). Embora a origem da carbapenemase NDM não seja completamente conhecida, muitos pacientes infectados com cepas contendo NDM têm históricos de viagens envolvendo hospitalizações na Índia ou em países vizinhos.
Exercício\(\PageIndex{1}\)
Como os médicos determinariam quais tipos de medicamentos antimicrobianos deveriam ser administrados?
Conceitos principais e resumo
- A resistência antimicrobiana está aumentando e é o resultado da seleção de cepas resistentes a medicamentos em ambientes clínicos, do uso excessivo e indevido de antibacterianos, do uso de doses subterapêuticas de medicamentos antibacterianos e da baixa adesão do paciente às terapias medicamentosas antibacterianas.
- Os genes de resistência a medicamentos são frequentemente transportados em plasmídeos ou transposons que podem sofrer transferência vertical facilmente e entre micróbios por meio da transferência horizontal de genes.
- Os modos comuns de resistência a medicamentos antimicrobianos incluem modificação ou inativação de medicamentos, prevenção da captação ou efluxo celular, modificação do alvo, superprodução do alvo ou bypass enzimático e mimetismo do alvo.
- Cepas microbianas problemáticas que apresentam ampla resistência antimicrobiana estão surgindo; muitas dessas cepas podem residir como membros da microbiota normal em indivíduos, mas também podem causar infecções oportunistas. A transmissão de muitas dessas cepas microbianas altamente resistentes geralmente ocorre em ambientes clínicos, mas também pode ser adquirida na comunidade.
Notas de pé
- 1 D.H. Fong, A.M. Berghuis. “Promiscuidade do substrato de uma enzima de resistência a antibióticos aminoglicosídeos via mimetismo alvo.” Revista EMBO 21 nº 10 (2002) :2323—2331.
- 2 Centros de Controle e Prevenção de Doenças. “Resistência a antibióticos/antimicrobianos”. http://www.cdc.gov/drugresistance/index.html. Acessado em 2 de junho de 2016.
- 3 A.S. Kalokhe et al. “Suscetibilidade a medicamentos para tuberculose multirresistente e testes de diagnóstico molecular: uma revisão da literatura. Jornal Americano de Ciências Médicas 345 nº 2 (2013) :143—148.
- 4 Centros de Controle e Prevenção de Doenças. “Staphylococcus aureus resistente à meticilina (MRSA): informações gerais sobre o MRSA na comunidade.” http://www.cdc.gov/mrsa/community/index.html. Acessado em 2 de junho de 2016
- 5 F.D. Lowy. “Resistência antimicrobiana: o exemplo do Staphylococcus aureus.” Journal of Clinical Investigation 111 no. 9 (2003) :1265—1273.
- 6 Centros de Controle e Prevenção de Doenças. “Infecções associadas à saúde (HIA): informações gerais sobre o VISA/VRSA.” www.cdc.gov/HAI/Organisms/vis... visa_vrsa.html. Acessado em 2 de junho de 2016.


