11.5: Mutações
- Page ID
- 181343
Objetivos de
- Compare mutações pontuais e mutações de mudança de quadro
- Descreva as diferenças entre mutações insensatas, sem sentido e silenciosas
- Descreva as diferenças entre reparos claros e escuros
- Explique como diferentes agentes mutagênicos agem
- Explique por que o teste de Ames pode ser usado para detectar substâncias cancerígenas
- Analise sequências de DNA e identifique exemplos de tipos de mutações
Uma mutação é uma mudança hereditária na sequência de DNA de um organismo. O organismo resultante, chamado de mutante, pode ter uma mudança reconhecível no fenótipo em comparação com o tipo selvagem, que é o fenótipo mais comumente observado na natureza. Uma alteração na sequência de DNA é conferida ao mRNA por meio da transcrição e pode levar a uma sequência alterada de aminoácidos em uma proteína na tradução. Como as proteínas realizam a grande maioria das funções celulares, uma mudança na sequência de aminoácidos em uma proteína pode levar a um fenótipo alterado para a célula e o organismo.
Efeitos das mutações na sequência de DNA
Existem vários tipos de mutações que são classificadas de acordo com a forma como a molécula de DNA é alterada. Um tipo, chamado de mutação pontual, afeta uma única base e ocorre mais comumente quando uma base é substituída ou substituída por outra. As mutações também resultam da adição de uma ou mais bases, conhecida como inserção, ou da remoção de uma ou mais bases, conhecida como deleção.
Exercício\(\PageIndex{1}\)
Que tipo de mutação ocorre quando um gene tem dois nucleotídeos a menos em sua sequência?
Efeitos das mutações na estrutura e função das proteínas
As mutações pontuais podem ter uma ampla gama de efeitos na função proteica (Figura\(\PageIndex{1}\)). Como consequência da degeneração do código genético, uma mutação pontual geralmente resultará na incorporação do mesmo aminoácido ao polipeptídeo resultante, apesar da mudança de sequência. Essa mudança não teria efeito na estrutura da proteína e, portanto, é chamada de mutação silenciosa. Uma mutação missense resulta na incorporação de um aminoácido diferente ao polipeptídeo resultante. O efeito de uma mutação missense depende de quão quimicamente diferente o novo aminoácido é do aminoácido do tipo selvagem. A localização do aminoácido alterado dentro da proteína também é importante. Por exemplo, se o aminoácido alterado fizer parte do sítio ativo da enzima, o efeito da mutação missense pode ser significativo. Muitas mutações insensatas resultam em proteínas que ainda estão funcionais, pelo menos até certo ponto. Às vezes, os efeitos das mutações missense podem ser aparentes apenas sob certas condições ambientais; essas mutações insensatas são chamadas de mutações condicionais. Raramente, uma mutação insensata pode ser benéfica. Sob as condições ambientais certas, esse tipo de mutação pode dar ao organismo que a abriga uma vantagem seletiva. Outro tipo de mutação pontual, chamada de mutação sem sentido, converte um códon que codifica um aminoácido (um códon sensorial) em um códon de parada (um códon sem sentido). Mutações sem sentido resultam na síntese de proteínas que são mais curtas do que as do tipo selvagem e normalmente não funcionam.
As exclusões e inserções também causam vários efeitos. Como os códons são trigêmeos de nucleotídeos, inserções ou deleções em grupos de três nucleotídeos podem levar à inserção ou deleção de um ou mais aminoácidos e podem não causar efeitos significativos na funcionalidade da proteína resultante. No entanto, mutações de mudança de quadro, causadas por inserções ou deleções de vários nucleotídeos que não são múltiplos de três, são extremamente problemáticas porque uma mudança no quadro de leitura resulta (Figura\(\PageIndex{1}\)). Como os ribossomos leem o mRNA em códons trigêmeos, as mutações de mudança de quadro podem alterar todos os aminoácidos após o ponto da mutação. O novo quadro de leitura também pode incluir um códon de parada antes do final da sequência de codificação. Consequentemente, proteínas feitas de genes contendo mutações frameshift quase sempre não funcionam.
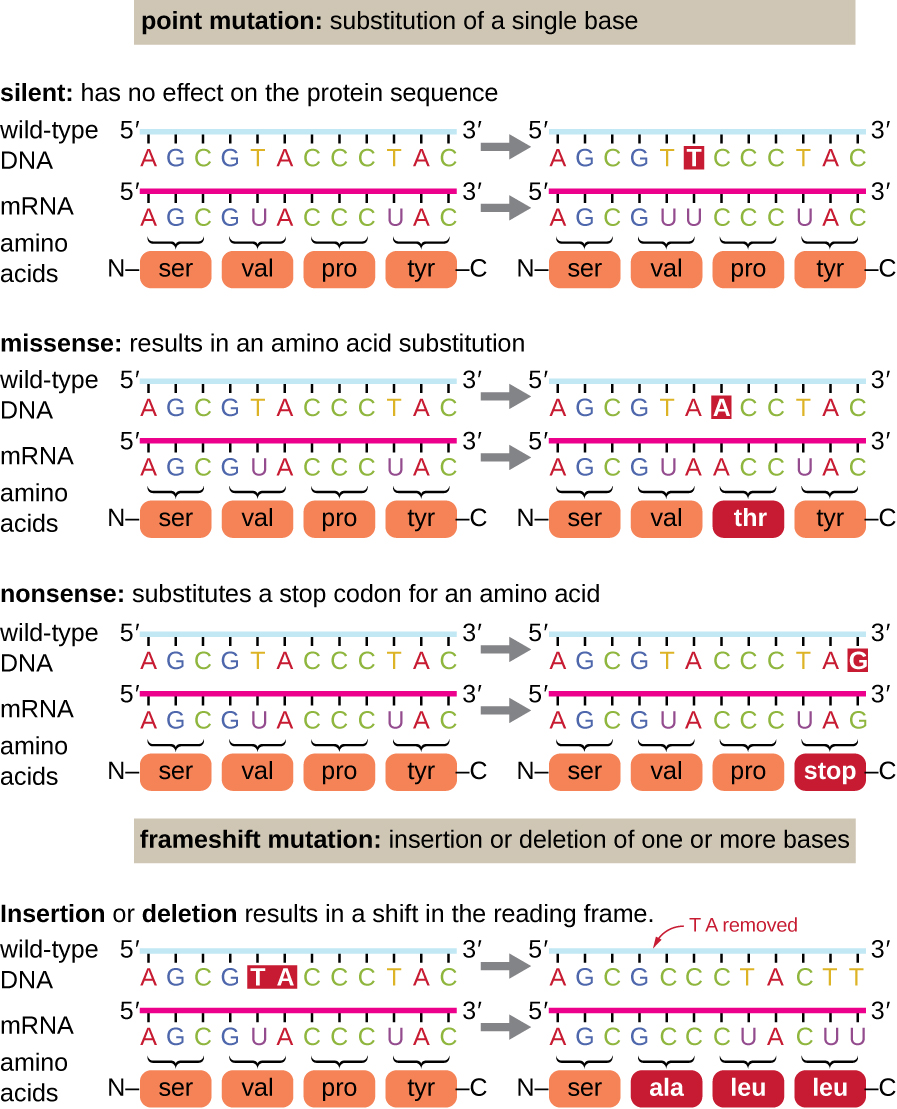
Exercício\(\PageIndex{2}\)
- Quais são as razões pelas quais uma alteração de nucleotídeo em um gene de uma proteína pode não ter nenhum efeito no fenótipo desse gene?
- É possível que uma inserção de três nucleotídeos juntos após o quinto nucleotídeo em um gene codificador de proteína produza uma proteína mais curta que o normal? Como ou como não?
Uma mutação benéfica
Desde que o primeiro caso de infecção pelo vírus da imunodeficiência humana (HIV) foi relatado em 1981, quase 40 milhões de pessoas morreram de infecção pelo HIV, 1 o vírus que causa a síndrome da imunodeficiência adquirida (AIDS). O vírus tem como alvo as células T auxiliares que desempenham um papel fundamental na ponte entre a resposta imune inata e adaptativa, infectando e matando células normalmente envolvidas na resposta do corpo à infecção. Não há cura para a infecção pelo HIV, mas muitos medicamentos foram desenvolvidos para retardar ou bloquear a progressão do vírus. Embora indivíduos em todo o mundo possam estar infectados, a maior prevalência entre pessoas de 15 a 49 anos está na África Subsaariana, onde quase uma pessoa em cada 20 está infectada, representando mais de 70% das infecções em todo o mundo 2 (Figura\(\PageIndex{2}\)). Infelizmente, essa também é uma parte do mundo em que as estratégias de prevenção e os medicamentos para tratar a infecção são as que mais faltam.
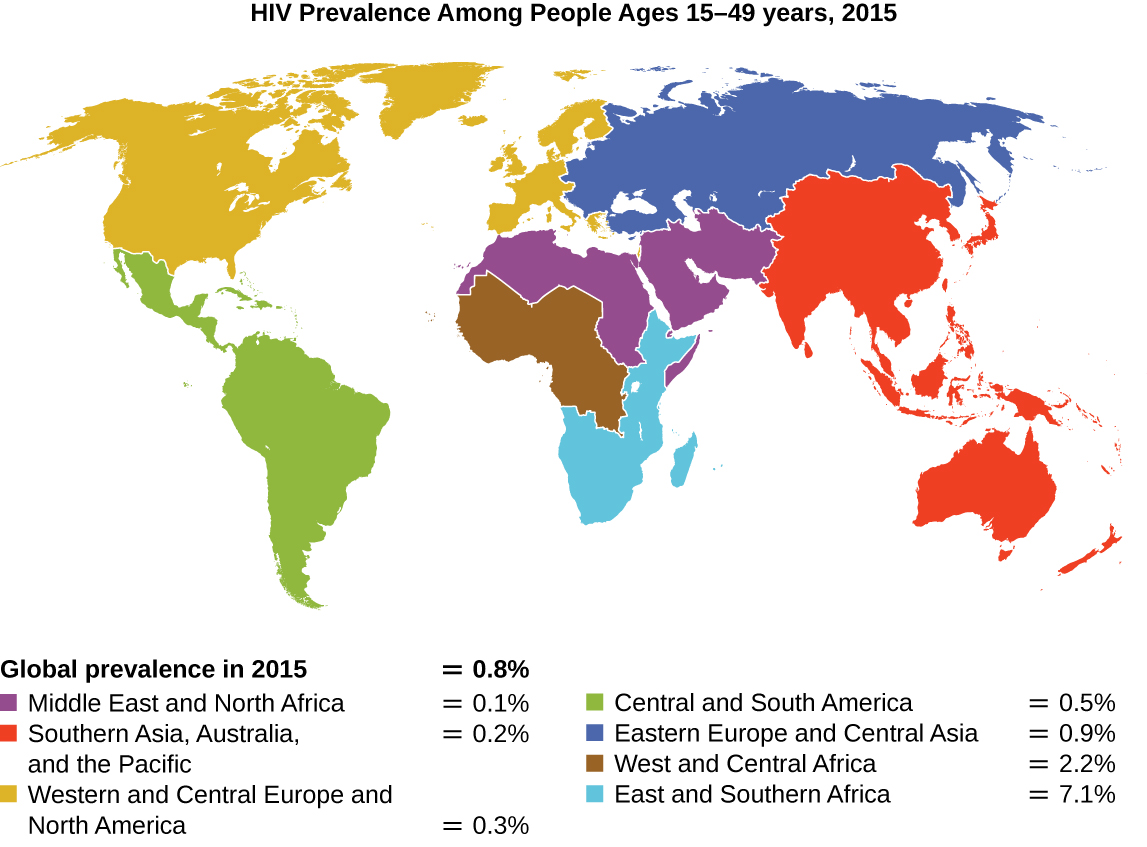
Nos últimos anos, o interesse científico foi despertado pela descoberta de alguns indivíduos do norte da Europa que são resistentes à infecção pelo HIV. Em 1998, o geneticista americano Stephen J. O'Brien do National Institutes of Health (NIH) e colegas publicaram os resultados de sua análise genética de mais de 4.000 indivíduos. Isso indica que muitos indivíduos de ascendência eurasiana (até 14% em alguns grupos étnicos) têm uma mutação de deleção, chamada CCR5-delta 32, no gene que codifica o CCR5. O CCR5 é um correceptor encontrado na superfície das células T que é necessário para que muitas cepas do vírus entrem na célula hospedeira. A mutação leva à produção de um receptor ao qual o HIV não pode se ligar efetivamente e, portanto, bloqueia a entrada viral. Pessoas homozigotas para essa mutação têm uma suscetibilidade bastante reduzida à infecção pelo HIV, e aquelas que são heterozigotas também têm alguma proteção contra a infecção.
Não está claro por que pessoas de ascendência do norte da Europa, especificamente, são portadoras dessa mutação, mas sua prevalência parece ser maior no norte da Europa e diminui constantemente nas populações à medida que se move para o sul. Pesquisas indicam que a mutação está presente desde antes do aparecimento do HIV e pode ter sido selecionada em populações europeias como resultado da exposição à peste ou à varíola. Essa mutação pode proteger os indivíduos da peste (causada pela bactéria Yersinia pestis) e da varíola (causada pelo vírus da varíola), pois esse receptor também pode estar envolvido nessas doenças. A idade dessa mutação é motivo de debate, mas as estimativas sugerem que ela apareceu entre 1875 anos e 225 anos atrás e pode ter se espalhado do norte da Europa por meio de invasões vikings.
Essa descoberta empolgante levou a novos caminhos na pesquisa do HIV, incluindo a busca de medicamentos para bloquear a ligação do CCR5 ao HIV em indivíduos sem a mutação. Embora o teste de DNA para determinar quais indivíduos portadores da mutação CCR5-delta 32 seja possível, há casos documentados de indivíduos homozigotos para a mutação que contraem o HIV. Por esse motivo, o teste de DNA para a mutação não é amplamente recomendado pelas autoridades de saúde pública para não incentivar comportamentos de risco em quem carrega a mutação. No entanto, inibir a ligação do HIV ao CCR5 continua sendo uma estratégia válida para o desenvolvimento de terapias medicamentosas para pessoas infectadas pelo HIV.
Causas das mutações
Erros no processo de replicação do DNA podem causar mutações espontâneas. A taxa de erro da DNA polimerase é de uma base incorreta por bilhão de pares de bases replicados. A exposição a agentes mutagênicos pode causar mutações induzidas, que são vários tipos de agentes químicos ou radiação (Tabela\(\PageIndex{1}\)). A exposição a um mutagênico pode aumentar a taxa de mutação em mais de 1000 vezes. Muitas vezes, os mutagênicos também são cancerígenos, agentes que causam câncer. No entanto, enquanto quase todos os agentes cancerígenos são mutagênicos, nem todos os mutagênicos são necessariamente cancerígenos.
Mutagênicos químicos
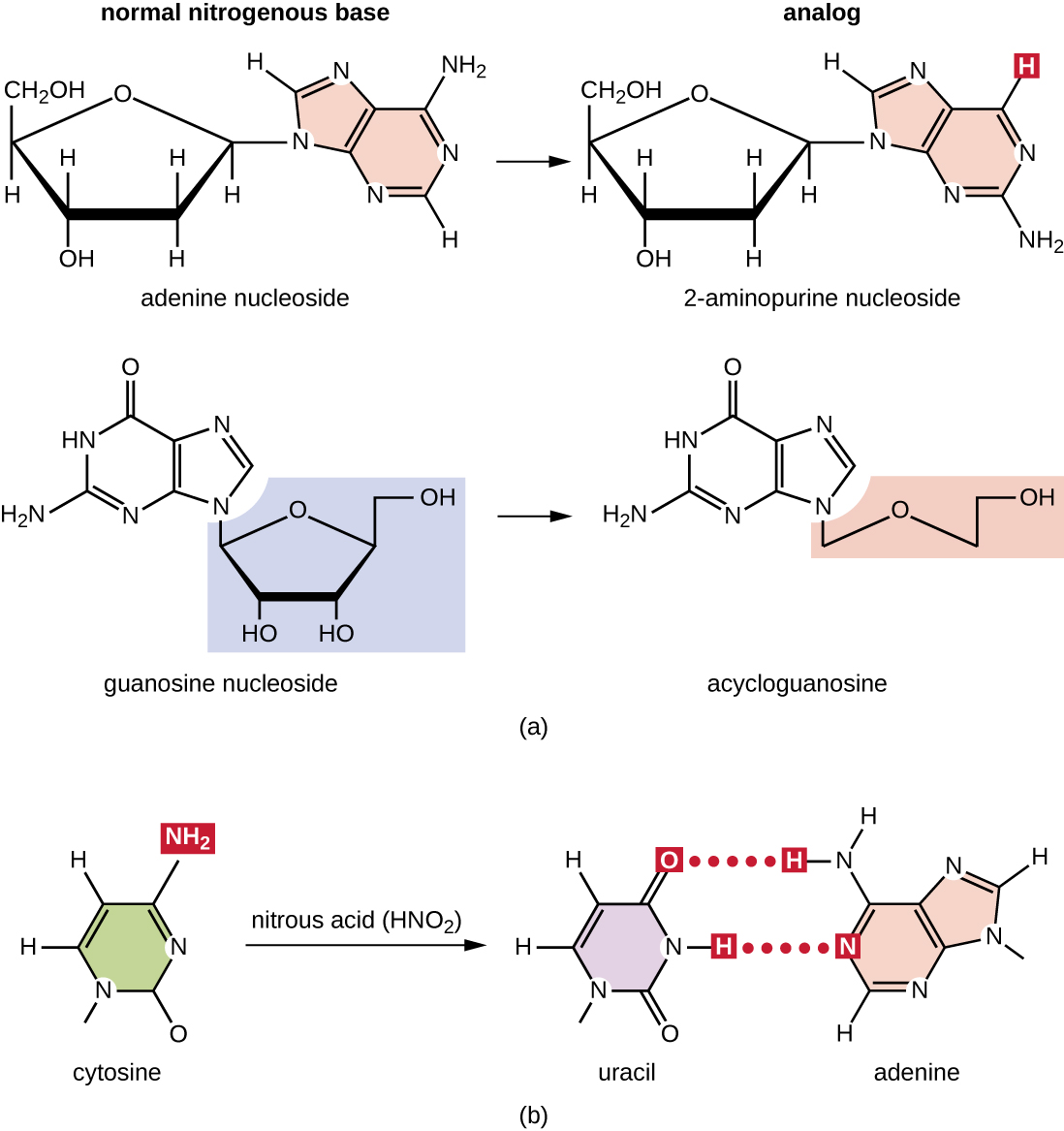
Vários tipos de mutagênicos químicos interagem diretamente com o DNA, seja atuando como análogos de nucleosídeos ou modificando as bases nucleotídicas. Os produtos químicos chamados análogos de nucleosídeos são estruturalmente semelhantes às bases nucleotídicas normais e podem ser incorporados ao DNA durante a replicação (Figura\(\PageIndex{3}\)). Esses análogos básicos induzem mutações porque geralmente têm regras de emparelhamento de bases diferentes das bases que substituem. Outros agentes químicos mutagênicos podem modificar as bases normais de DNA, resultando em diferentes regras de emparelhamento de bases. Por exemplo, o ácido nitroso desamina a citosina, convertendo-a em uracilo. O uracil então emparelha com a adenina em uma rodada subsequente de replicação, resultando na conversão de um par de bases GC em um par de bases AT. O ácido nitroso também desamina adenina em hipoxantina, que combina bases com citosina em vez de timina, resultando na conversão de um par de bases TA em um par de bases CG.
Os mutagênicos químicos conhecidos como agentes intercalantes funcionam de forma diferente. Essas moléculas deslizam entre as bases nitrogenadas empilhadas da dupla hélice do DNA, distorcendo a molécula e criando um espaçamento atípico entre os pares de bases nucleotídicas (Figura\(\PageIndex{4}\)). Como resultado, durante a replicação do DNA, a DNA polimerase pode pular a replicação de vários nucleotídeos (criando uma deleção) ou inserir nucleotídeos extras (criando uma inserção). Qualquer resultado pode levar a uma mutação de mudança de quadro. Produtos de combustão, como hidrocarbonetos aromáticos policíclicos, são agentes intercalantes particularmente perigosos que podem levar a cânceres causados por mutações. Os agentes intercalantes brometo de etídio e laranja de acridina são comumente usados em laboratório para colorir o DNA para visualização e são potenciais mutagênicos.
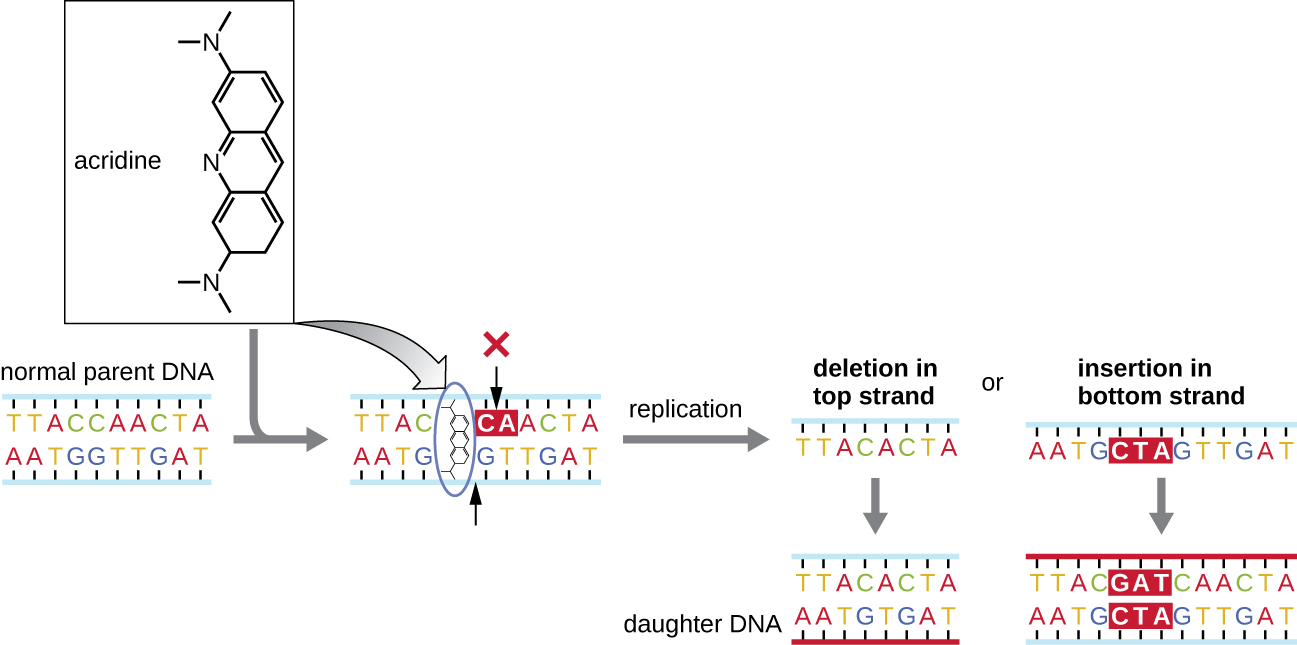
Radiação
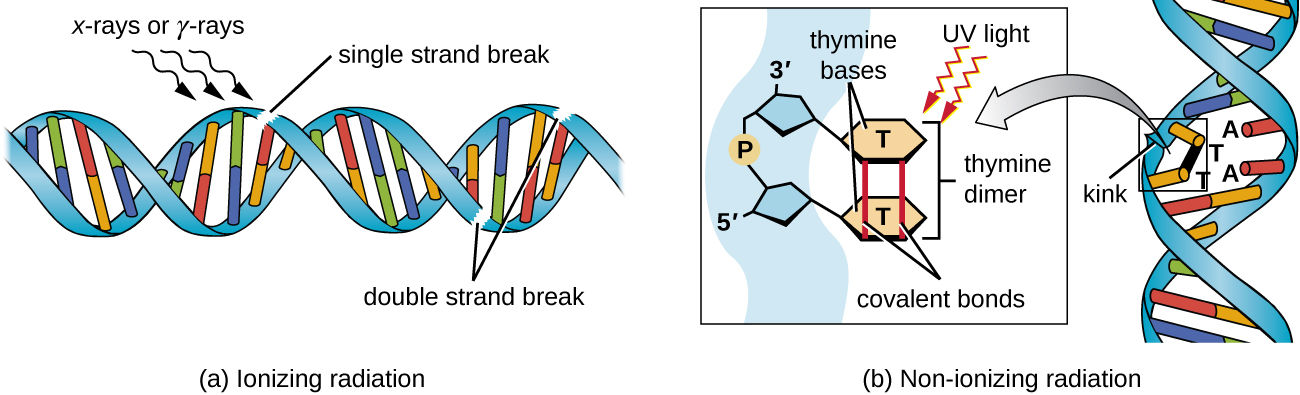
A exposição à radiação ionizante ou não ionizante pode induzir mutações no DNA, embora por mecanismos diferentes. Radiações ionizantes fortes, como raios-X e raios gama, podem causar quebras de fita simples e dupla na espinha dorsal do DNA por meio da formação de radicais hidroxila na exposição à radiação (Figura\(\PageIndex{5}\)). A radiação ionizante também pode modificar as bases; por exemplo, a desaminação da citosina em uracil, análoga à ação do ácido nitroso. 3 A exposição à radiação ionizante é usada para matar micróbios e esterilizar dispositivos médicos e alimentos, devido ao seu dramático efeito não específico em danificar DNA, proteínas e outros componentes celulares (consulte Uso de métodos físicos para controlar microrganismos).
A radiação não ionizante, como a luz ultravioleta, não é energética o suficiente para iniciar esses tipos de mudanças químicas. No entanto, a radiação não ionizante pode induzir a formação de dímeros entre duas bases de pirimidina adjacentes, geralmente duas timinas, dentro de uma fita nucleotídica. Durante a formação do dímero de timina, as duas timinas adjacentes ficam ligadas covalentemente e, se não forem reparadas, tanto a replicação quanto a transcrição do DNA são paralisadas neste ponto. A DNA polimerase pode prosseguir e replicar o dímero incorretamente, potencialmente levando à mudança de quadro ou mutações pontuais.
| Agentes mutagênicos | Modo de ação | Efeito no DNA | Tipo de mutação resultante |
|---|---|---|---|
| Análogos de nucleosídeos | |||
| 2-aminopurina | É inserido no lugar de A, mas emparelha as bases com C | Converte o par de bases AT em GC | Ponto |
| 5-bromouracil | É inserido no lugar de T, mas emparelha com G | Converte o par de bases AT em GC | Ponto |
| Agente modificador de nucleotídeos | |||
| Óxido nitroso | Desamina C a U | Converte o par de bases GC em AT | Ponto |
| Agentes intercalantes | |||
| Laranja de acridina, brometo de etídio, hidrocarbonetos aromáticos policíclicos | Distorce a dupla hélice, cria um espaçamento incomum entre os nucleotídeos | Introduz pequenas exclusões e inserções | Frameshift |
| Radiação ionizante | |||
| Raios-X, raios γ | Forma radicais hidroxilos | Causa quebras de DNA de fita única e dupla | Mecanismos de reparo podem introduzir mutações |
| Raios-X, raios γ | Modifica bases (por exemplo, desaminação de C para U) | Converte o par de bases GC em AT | Ponto |
| Radiação não ionizante | |||
| Ultravioleta | Forma dímeros de pirimidina (geralmente timina) | Provoca erros de replicação | Frameshift ou point |
Exercício\(\PageIndex{3}\)
- Como um análogo básico introduz uma mutação?
- Como um agente intercalante introduz uma mutação?
- Que tipo de mutagênico causa os dímeros de timina?
Reparação de DNA
O processo de replicação do DNA é altamente preciso, mas os erros podem ocorrer espontaneamente ou ser induzidos por agentes mutagênicos. Erros não corrigidos podem levar a sérias consequências para o fenótipo. As células desenvolveram vários mecanismos de reparo para minimizar o número de mutações que persistem.
Revisão
A maioria dos erros introduzidos durante a replicação do DNA é prontamente corrigida pela maioria das DNA polimerases por meio de uma função chamada revisão. Na revisão, a DNA polimerase lê a base recém-adicionada, garantindo que ela seja complementar à base correspondente na fita modelo antes de adicionar a próxima. Se uma base incorreta foi adicionada, a enzima faz um corte para liberar o nucleotídeo errado e uma nova base é adicionada.
Reparo de incompatibilidade
Alguns erros introduzidos durante a replicação são corrigidos logo após a movimentação da máquina de replicação. Esse mecanismo é chamado de reparo de incompatibilidade. As enzimas envolvidas nesse mecanismo reconhecem o nucleotídeo adicionado incorretamente, o excisam e o substituem pela base correta. Um exemplo é o reparo de incompatibilidade dirigido por metil em E. coli. O DNA está hemimetilado. Isso significa que a fita parental é metilada, enquanto a fita filha recém-sintetizada não é. Demora vários minutos até que a nova fita seja metilada. As proteínas MUTs, MuTL e MUTh se ligam ao local hemimetilado onde o nucleotídeo incorreto é encontrado. MuT corta o fio não metilado (o novo fio). Uma exonuclease remove uma parte da fita (incluindo o nucleotídeo incorreto). A lacuna formada é então preenchida pelo DNA pol III e pela ligase.
Reparação de dímeros de timina
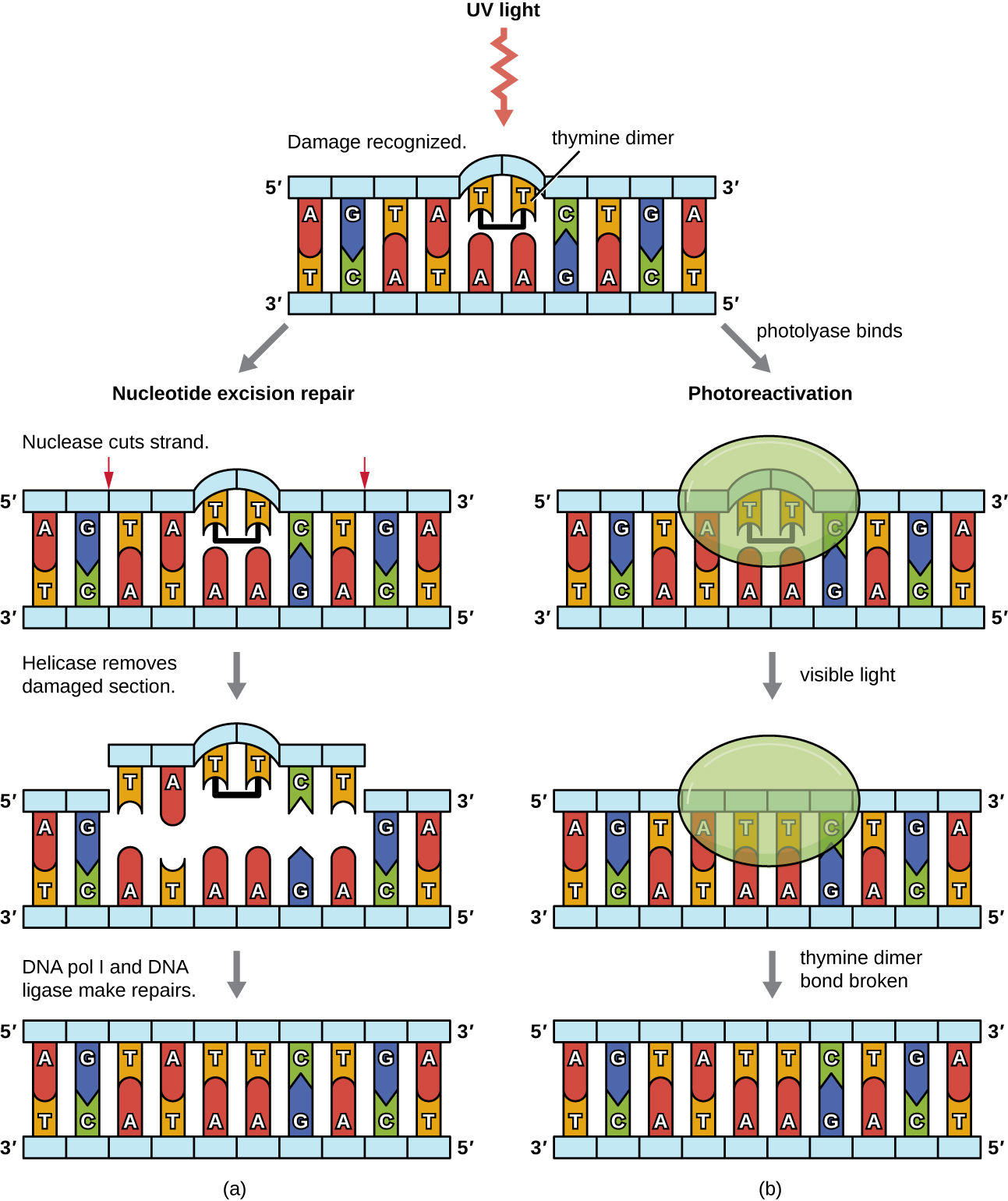
Como a produção de dímeros de timina é comum (muitos organismos não conseguem evitar a luz ultravioleta), mecanismos evoluíram para reparar essas lesões. No reparo por excisão de nucleotídeos (também chamado de reparo escuro), as enzimas removem o dímero de pirimidina e o substituem pelos nucleotídeos corretos (Figura\(\PageIndex{6}\)). Em E. coli, o DNA é escaneado por um complexo enzimático. Se for encontrada uma distorção na dupla hélice introduzida pelo dímero de pirimidina, o complexo enzimático corta a espinha dorsal de açúcar-fosfato várias bases a montante e a jusante do dímero, e o segmento de DNA entre esses dois cortes é então removido enzimaticamente. O DNA pol I substitui os nucleotídeos ausentes pelos corretos e a DNA ligase fecha a lacuna na espinha dorsal do açúcar-fosfato.
O reparo direto (também chamado de reparo da luz) dos dímeros de timina ocorre por meio do processo de fotorreativação na presença de luz visível. Uma enzima chamada fotoliase reconhece a distorção na hélice do DNA causada pelo dímero de timina e se liga ao dímero. Então, na presença de luz visível, a enzima fotoliase muda de conformação e quebra o dímero de timina, permitindo que as timinas se pareem novamente corretamente com as adeninas na fita complementar. A fotorreativação parece estar presente em todos os organismos, com exceção dos mamíferos placentários, incluindo humanos. A fotorreativação é particularmente importante para organismos cronicamente expostos à radiação ultravioleta, como plantas, bactérias fotossintéticas, algas e corais, para evitar o acúmulo de mutações causadas pela formação do dímero de timina.
Exercício\(\PageIndex{4}\)
- Durante o reparo da incompatibilidade, como a enzima reconhece qual é a nova e qual é a antiga?
- Que tipo de mutação a fotoliase repara?
Identificação de mutantes bacterianos
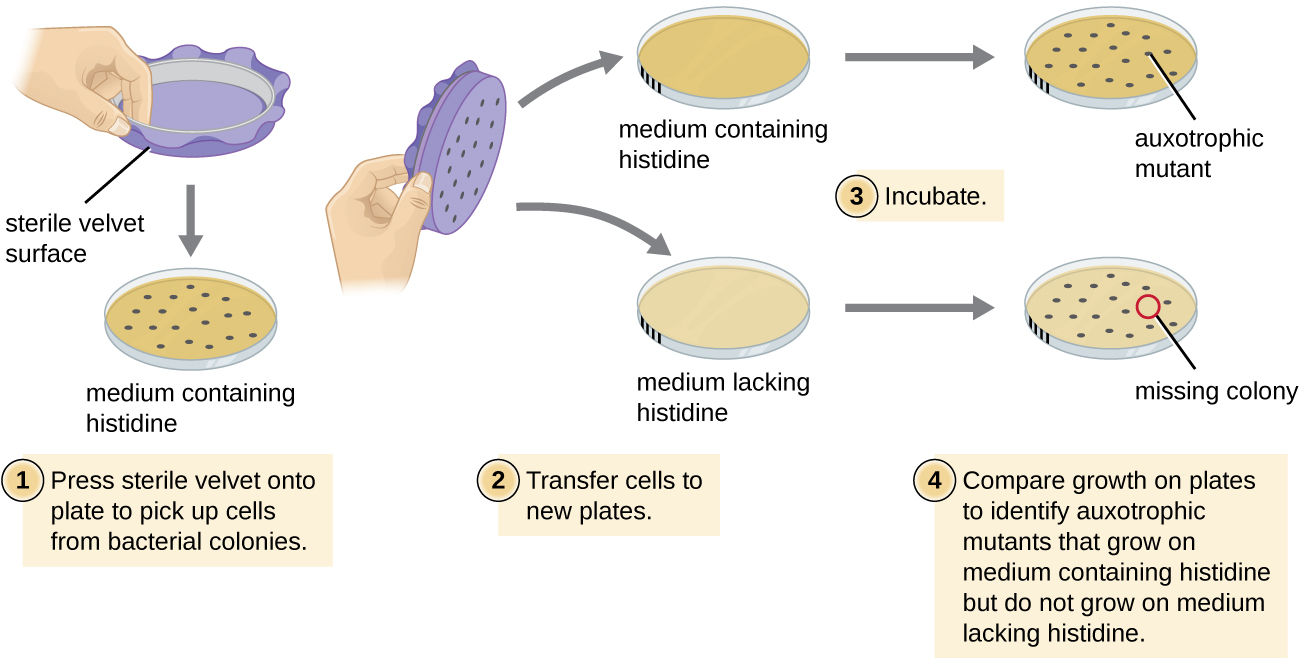
Uma técnica comum usada para identificar mutantes bacterianos é chamada de revestimento de réplica. Essa técnica é usada para detectar mutantes nutricionais, chamados auxotróficos, que têm uma mutação em um gene que codifica uma enzima na via de biossíntese de um nutriente específico, como um aminoácido. Como resultado, enquanto as células do tipo selvagem mantêm a capacidade de crescer normalmente em um meio sem o nutriente específico, os auxotróficos são incapazes de crescer nesse meio. Durante o revestimento de réplicas (Figura\(\PageIndex{7}\)), uma população de células bacterianas é mutagenizada e, em seguida, plantada como células individuais em uma placa nutricionalmente completa complexa e deixada crescer em colônias. As células dessas colônias são removidas dessa placa mestra, geralmente usando veludo estéril. Esse veludo, contendo células, é então pressionado na mesma orientação em placas de vários meios. Pelo menos uma placa também deve estar nutricionalmente completa para garantir que as células sejam transferidas adequadamente entre as placas. As outras placas carecem de nutrientes específicos, permitindo que o pesquisador descubra vários mutantes auxotróficos incapazes de produzir nutrientes específicos. Células da colônia correspondente na placa nutricionalmente completa podem ser usadas para recuperar o mutante para um estudo mais aprofundado.
Exercício\(\PageIndex{5}\)
Por que as células são colocadas em uma placa nutricionalmente completa, além de placas com deficiência de nutrientes, ao procurar um mutante?
O teste de Ames
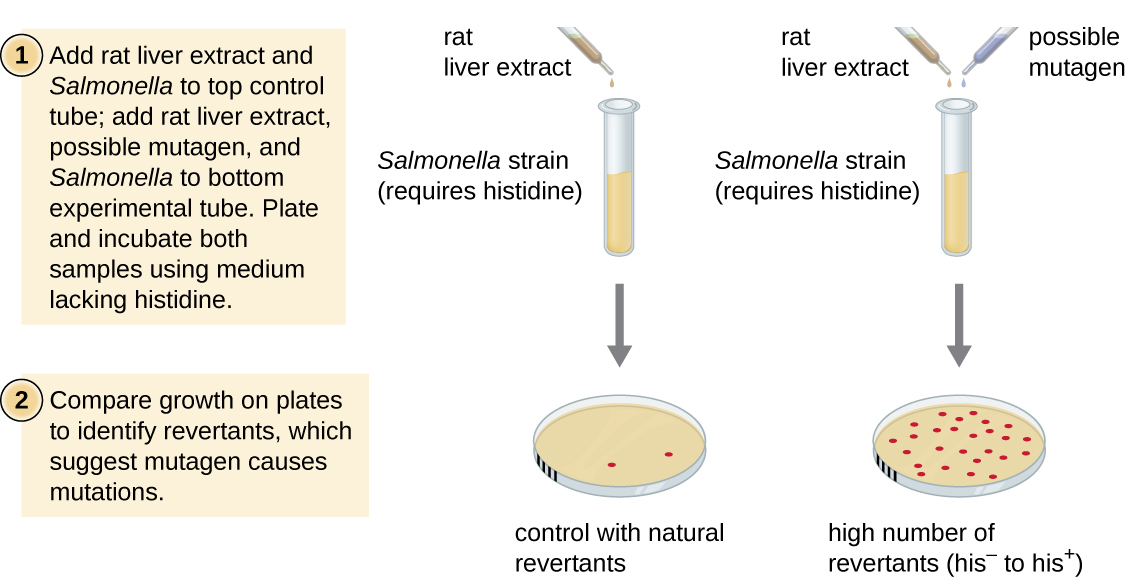
O teste de Ames, desenvolvido por Bruce Ames (1928—) na década de 1970, é um método que usa bactérias para rastrear de forma rápida e barata o potencial carcinogênico de novos compostos químicos. O teste mede a taxa de mutação associada à exposição ao composto, que, se elevada, pode indicar que a exposição a esse composto está associada a um maior risco de câncer. O teste de Ames usa como organismo de teste uma cepa de Salmonella typhimurium que é um auxotrófico de histidina, incapaz de sintetizar sua própria histidina devido a uma mutação em um gene essencial necessário para sua síntese. Após a exposição a um potencial mutagênico, essas bactérias são colocadas em um meio sem histidina, e o número de mutantes que recuperam a capacidade de sintetizar histidina é registrado e comparado com o número desses mutantes que surgem na ausência do potencial mutagênico (Figura\(\PageIndex{8}\)). Produtos químicos mais mutagênicos produzirão mais mutantes com a síntese restaurada de histidina no teste de Ames. Como muitos produtos químicos não são diretamente mutagênicos, mas são metabolizados em formas mutagênicas pelas enzimas hepáticas, o extrato de fígado de rato é comumente incluído no início deste experimento para imitar o metabolismo do fígado. Depois que o teste de Ames é realizado, os compostos identificados como mutagênicos são posteriormente testados quanto às suas propriedades cancerígenas em potencial usando outros modelos, incluindo modelos animais, como camundongos e ratos.
Exercício\(\PageIndex{6}\)
- Qual mutação é usada como indicador da taxa de mutação no teste de Ames?
- Por que o teste de Ames pode funcionar como um teste de carcinogenicidade?
Conceitos principais e resumo
- Uma mutação é uma mudança hereditária no DNA. Uma mutação pode levar a uma alteração na sequência de aminoácidos de uma proteína, possivelmente afetando sua função.
- Uma mutação pontual afeta um único par de bases. Uma mutação pontual pode causar uma mutação silenciosa se o códon do mRNA codificar para o mesmo aminoácido, uma mutação sem sentido se o códon do mRNA codificar para um aminoácido diferente ou uma mutação sem sentido se o códon do mRNA se tornar um códon de parada.
- As mutações missense podem manter a função, dependendo da química do novo aminoácido e de sua localização na proteína. Mutações sem sentido produzem proteínas truncadas e frequentemente não funcionais.
- Uma mutação de mudança de quadro resulta de uma inserção ou deleção de vários nucleotídeos que não é múltiplo de três. A mudança no quadro de leitura altera cada aminoácido após o ponto da mutação e resulta em uma proteína não funcional.
- As mutações espontâneas ocorrem por meio de erros de replicação do DNA, enquanto as mutações induzidas ocorrem por meio da exposição a um mutagênico.
- Os agentes mutagênicos são frequentemente cancerígenos, mas nem sempre. No entanto, quase todos os agentes cancerígenos são mutagênicos.
- Os mutagênicos químicos incluem análogos básicos e produtos químicos que modificam as bases existentes. Em ambos os casos, as mutações são introduzidas após várias rodadas de replicação do DNA.
- A radiação ionizante, como raios-X e raios γ, leva à quebra da espinha dorsal fosfodiéster do DNA e também pode modificar quimicamente as bases para alterar suas regras de emparelhamento de bases.
- Radiações não ionizantes, como a luz ultravioleta, podem introduzir dímeros de pirimidina (timina), que, durante a replicação e transcrição do DNA, podem introduzir mutações pontuais ou de mudança de quadro.
- As células têm mecanismos para reparar mutações que ocorrem naturalmente. A DNA polimerase tem atividade de revisão. O reparo de incompatibilidade é um processo para reparar bases incorporadas incorretamente após a conclusão da replicação do DNA.
- Os dímeros de pirimidina também podem ser reparados. No reparo por excisão de nucleotídeos (reparo escuro), as enzimas reconhecem a distorção introduzida pelo dímero de pirimidina e substituem a fita danificada pelas bases corretas, usando a fita de DNA não danificada como modelo. Bactérias e outros organismos também podem usar o reparo direto, no qual a enzima fotoliase, na presença de luz visível, separa as pirimidinas.
- Por meio da comparação do crescimento na placa completa e da falta de crescimento em meios sem nutrientes específicos, mutantes específicos de perda de função chamados auxotróficos podem ser identificados.
- O teste de Ames é um método barato que usa bactérias auxotróficas para medir a mutagenicidade de um composto químico. A mutagenicidade é um indicador do potencial carcinogênico.
Notas de pé
- 1 Organização Mundial da Saúde. “Dados do Observatório Global da Saúde (GHO), HIV/AIDS”. http://www.who.int/gho/hiv/en/. Acessado em 5 de agosto de 2016.
- 2 Organização Mundial da Saúde. “Dados do Observatório Global da Saúde (GHO), HIV/AIDS”. http://www.who.int/gho/hiv/en/. Acessado em 5 de agosto de 2016.
- 3 K.R. Tindall et al. “Mudanças na sequência de bases de DNA induzidas pela mutagênese de raios gama do fago e do profago lambda.” Genética 118 nº 4 (1988) :551—560.


