6.3: Isolamento, cultura e identificação de vírus
- Page ID
- 181216
Objetivos de
- Discuta por que os vírus foram originalmente descritos como agentes filtráveis
- Descreva o cultivo de vírus e a coleta e manuseio de amostras
- Compare as técnicas in vivo e in vitro usadas para cultivar vírus
No início deste capítulo, descrevemos como filtros Chamberland de porcelana com poros pequenos o suficiente para permitir a passagem de vírus foram usados para descobrir o TMV. Hoje, os filtros de porcelana foram substituídos por filtros de membrana e outros dispositivos usados para isolar e identificar vírus.
Isolamento de vírus
Ao contrário das bactérias, muitas das quais podem ser cultivadas em um meio nutriente artificial, os vírus precisam de uma célula hospedeira viva para replicação. As células hospedeiras infectadas (eucarióticas ou procarióticas) podem ser cultivadas e cultivadas e, em seguida, o meio de crescimento pode ser colhido como fonte do vírus. Os viriões no meio líquido podem ser separados das células hospedeiras por centrifugação ou filtração. Os filtros podem remover fisicamente qualquer coisa presente na solução que seja maior do que os viriões; os vírus podem então ser coletados no filtrado (Figura\(\PageIndex{1}\)).
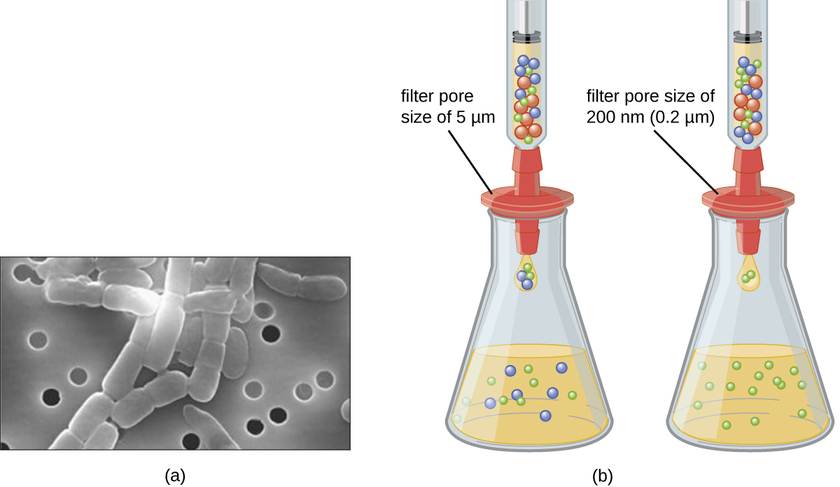
Exercício\(\PageIndex{1}\)
Qual é o tamanho do poro do filtro necessário para coletar um vírus?
Cultivo de vírus
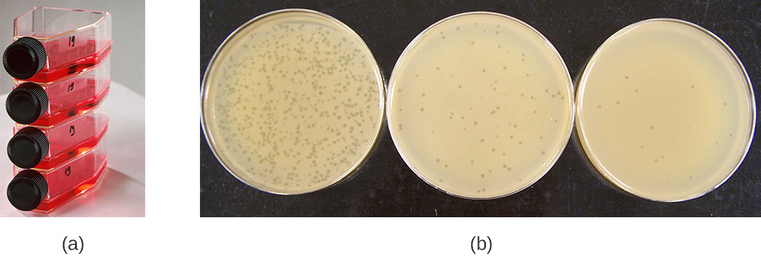
Os vírus podem ser cultivados in vivo (dentro de um organismo vivo, planta ou animal inteiro) ou in vitro (fora de um organismo vivo em células em um ambiente artificial, como um tubo de ensaio, frasco de cultura celular ou placa de ágar). Os bacteriófagos podem ser cultivados na presença de uma camada densa de bactérias (também chamada de gramado bacteriano) cultivada em um ágar mole de 0,7% em uma placa de Petri ou em um frasco plano (horizontal) (Figura\(\PageIndex{2a}\)). A concentração de ágar é reduzida em relação aos 1,5% normalmente usados no cultivo de bactérias. O ágar macio de 0,7% permite que os bacteriófagos se difundam facilmente pelo meio. Para bacteriófagos líticos, a lisação dos hospedeiros bacterianos pode então ser facilmente observada quando uma zona clara chamada placa é detectada (Figura\(\PageIndex{1b}\)). À medida que o fago mata a bactéria, muitas placas são observadas entre o gramado bacteriano nublado.
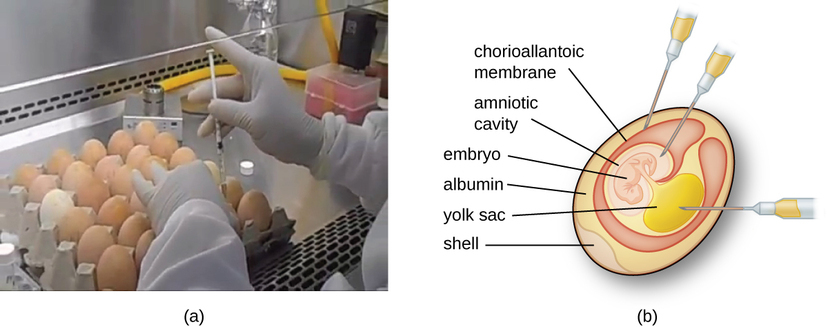
Os vírus animais requerem células dentro de um animal hospedeiro ou células de cultura de tecidos derivadas de um animal. O cultivo de vírus animais é importante para 1) identificação e diagnóstico de vírus patogênicos em amostras clínicas, 2) produção de vacinas e 3) estudos básicos de pesquisa. As fontes hospedeiras in vivo podem ser um embrião em desenvolvimento em um ovo de pássaro embrionado (por exemplo, frango, perú) ou em um animal inteiro. Por exemplo, a maioria das vacinas contra influenza fabricadas para programas anuais de vacinação contra a gripe é cultivada em ovos de galinha.
O embrião ou animal hospedeiro serve como incubadora para replicação viral (Figura\(\PageIndex{3}\)). A localização dentro do embrião ou animal hospedeiro é importante. Muitos vírus têm um tropismo tecidual e, portanto, devem ser introduzidos em um local específico para o crescimento. Dentro de um embrião, os locais alvo incluem a cavidade amniótica, a membrana corioalantóica ou o saco vitelino. A infecção viral pode danificar as membranas dos tecidos, produzindo lesões chamadas varíola; interromper o desenvolvimento embrionário; ou causar a morte do embrião.
Para estudos in vitro, vários tipos de células podem ser usados para apoiar o crescimento de vírus. Uma cultura celular primária é preparada recentemente a partir de órgãos ou tecidos animais. As células são extraídas dos tecidos por raspagem mecânica ou trituração para liberar células ou por um método enzimático usando tripsina ou colagenase para quebrar o tecido e liberar células individuais em suspensão. Devido aos requisitos de dependência de ancoragem, as culturas celulares primárias requerem um meio de cultura líquido em uma placa de Petri ou frasco de cultura de tecidos para que as células tenham uma superfície sólida, como vidro ou plástico, para fixação e crescimento. As culturas primárias geralmente têm uma vida útil limitada. Quando as células de uma cultura primária sofrem mitose e uma densidade suficiente de células é produzida, as células entram em contato com outras células. Quando esse contato de célula a célula ocorre, a mitose é acionada para parar. Isso é chamado de inibição de contato e evita que a densidade das células se torne muito alta. Para evitar a inibição do contato, as células da cultura celular primária devem ser transferidas para outro recipiente com meio de crescimento fresco. Isso é chamado de cultura celular secundária. Periodicamente, a densidade celular deve ser reduzida despejando algumas células e adicionando meio fresco para fornecer espaço e nutrientes para manter o crescimento celular. Em contraste com as culturas celulares primárias, as linhagens celulares contínuas, geralmente derivadas de células ou tumores transformados, geralmente podem ser subcultivadas muitas vezes ou até mesmo cultivadas indefinidamente (nesse caso, são chamadas de imortais). Linhagens celulares contínuas podem não apresentar dependência de ancoragem (elas crescerão em suspensão) e podem ter perdido a inibição de contato. Como resultado, linhagens celulares contínuas podem crescer em pilhas ou caroços que se assemelham a pequenos crescimentos tumorais (Figura\(\PageIndex{4}\)).
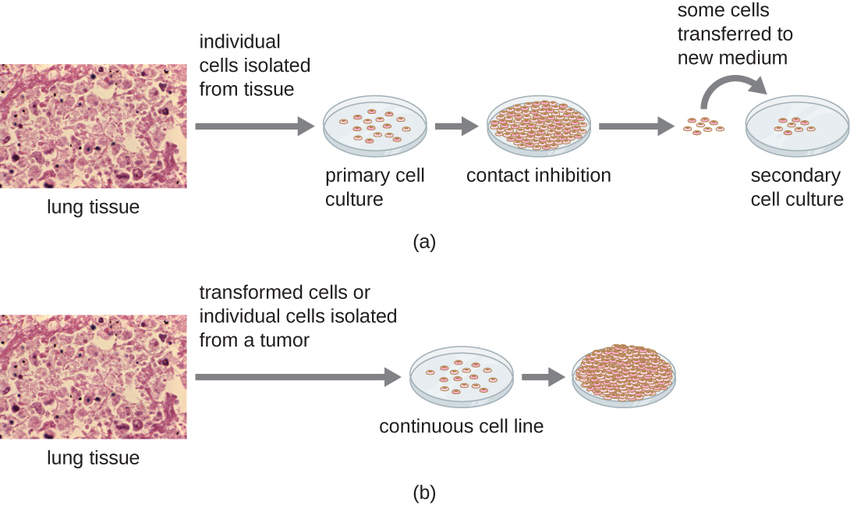
Um exemplo de linhagem celular imortal é a linhagem celular HeLa, que foi originalmente cultivada a partir de células tumorais obtidas de Henrietta Lacks, uma paciente que morreu de câncer cervical em 1951. As células HeLa foram a primeira linhagem celular contínua de cultura de tecidos e foram usadas para estabelecer a cultura de tecidos como uma tecnologia importante para pesquisas em biologia celular, virologia e medicina. Antes da descoberta das células HeLa, os cientistas não conseguiam estabelecer culturas de tecidos com qualquer confiabilidade ou estabilidade. Mais de seis décadas depois, essa linhagem celular ainda está viva e sendo usada para pesquisas médicas. Veja The Immortal Cell Line of Henrietta Lacks para ler mais sobre essa importante linhagem celular e os meios controversos pelos quais ela foi obtida.
Exercício\(\PageIndex{2}\)
Qual propriedade das células torna necessárias diluições periódicas das culturas celulares primárias?
A linha celular imortal de Henrietta Lacks
Em janeiro de 1951, Henrietta Lacks, uma mulher afro-americana de 30 anos de Baltimore, foi diagnosticada com câncer cervical no Hospital John Hopkins. Agora sabemos que o câncer dela foi causado pelo papilomavírus humano (HPV). Os efeitos citopáticos do vírus alteraram as características de suas células em um processo chamado transformação, que dá às células a capacidade de se dividirem continuamente. Essa habilidade, é claro, resultou em um tumor cancerígeno que acabou matando a Sra. Lacks em outubro, aos 31 anos. Antes de sua morte, amostras de suas células cancerosas foram coletadas sem seu conhecimento ou permissão. As amostras acabaram na posse do Dr. George Gey, pesquisador biomédico da Universidade Johns Hopkins. Gey conseguiu cultivar algumas das células da amostra de Lacks, criando o que hoje é conhecido como a linhagem celular HeLa imortal. Essas células têm a capacidade de viver e crescer indefinidamente e, até hoje, ainda são amplamente utilizadas em muitas áreas de pesquisa.
De acordo com o marido de Lacks, nem Henrietta nem a família deram permissão ao hospital para coletar sua amostra de tecido. De fato, a família não sabia até 20 anos após a morte de Lacks que suas células ainda estavam vivas e sendo usadas ativamente para fins comerciais e de pesquisa. No entanto, as células HeLa têm sido fundamentais em inúmeras descobertas de pesquisas relacionadas à poliomielite, câncer e AIDS, entre outras doenças. As células também foram comercializadas, embora nunca tenham sido patenteadas. Apesar disso, a propriedade de Henrietta Lacks nunca se beneficiou do uso das células, embora, em 2013, a família Lacks tenha tido o controle sobre a publicação da sequência genética de suas células.
Este caso levanta várias questões bioéticas relacionadas ao consentimento informado dos pacientes e ao direito de saber. Na época em que os lenços de Lacks foram retirados, não havia leis ou diretrizes sobre consentimento informado. Isso significa que ela foi tratada de forma justa na época? Certamente, pelos padrões atuais, a resposta seria não. Colher tecidos ou órgãos de um paciente moribundo sem consentimento não é apenas considerado antiético, mas ilegal, independentemente de tal ato poder salvar a vida de outros pacientes. É ético, então, que os cientistas continuem usando os tecidos de Lacks para pesquisas, mesmo que tenham sido obtidos ilegalmente de acordo com os padrões atuais?
Éticas ou não, as células de Lacks são amplamente usadas hoje em dia para tantas aplicações que é impossível listá-las todas. É um caso em que os fins justificam os meios? Lacks ficaria feliz em saber sobre sua contribuição à ciência e os milhões de pessoas que se beneficiaram? Ela gostaria que sua família fosse compensada pelos produtos comerciais que foram desenvolvidos usando suas células? Ou ela se sentiria violada e explorada pelos pesquisadores que tomaram parte de seu corpo sem seu consentimento? Porque ela nunca foi questionada, nunca saberemos.
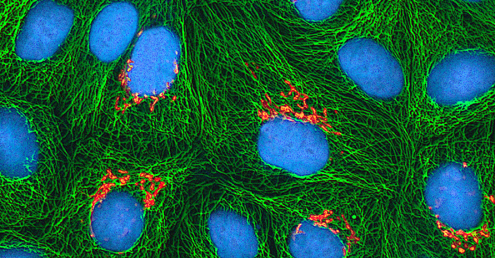
Detecção de um vírus
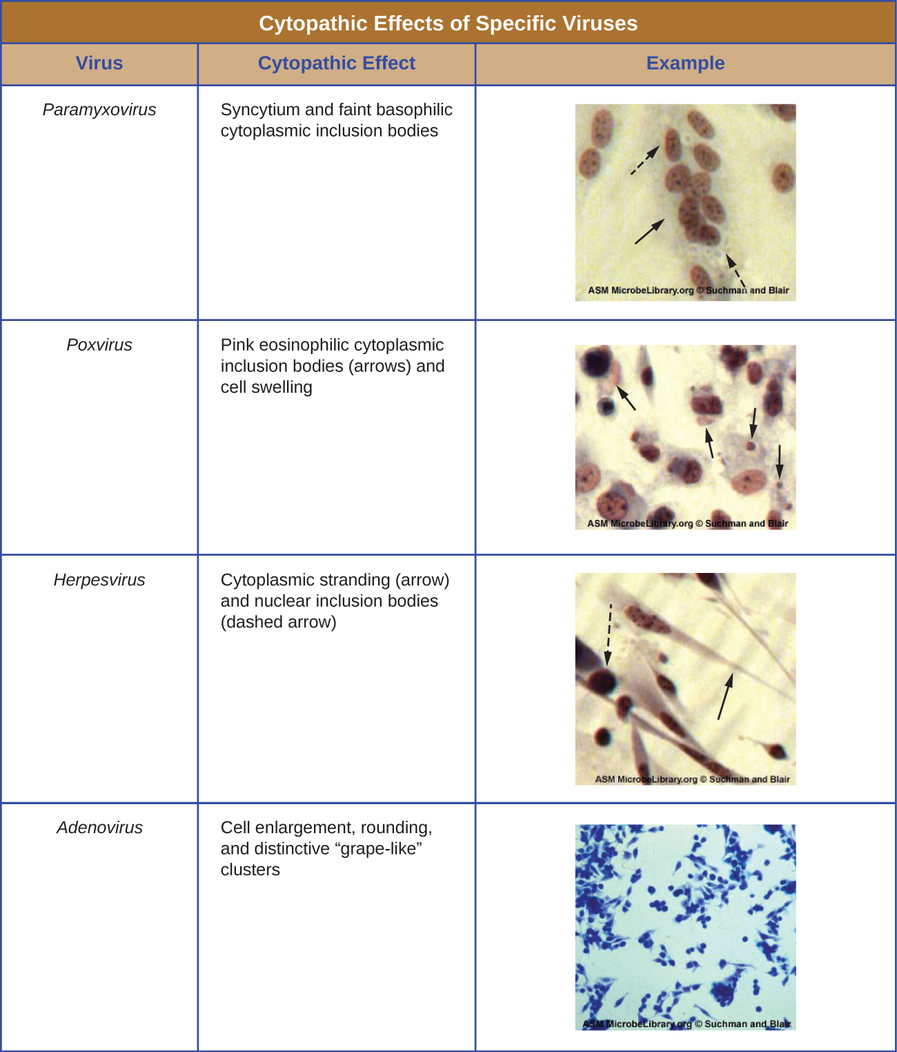
Independentemente do método de cultivo, uma vez que um vírus tenha sido introduzido em todo um organismo hospedeiro, embrião ou célula de cultura de tecidos, uma amostra pode ser preparada a partir do hospedeiro, embrião ou linhagem celular infectada para análise posterior sob um microscópio de campo claro, eletrônico ou fluorescente. Os efeitos citopáticos (CPEs) são anormalidades celulares observáveis distintas devido à infecção viral. Os CPEs podem incluir perda de aderência à superfície do recipiente, mudanças na forma da célula de plana para redonda, encolhimento do núcleo, vacúolos no citoplasma, fusão de membranas citoplasmáticas e formação de sincícios multinucleados, corpos de inclusão no núcleo ou citoplasma e lise celular completa ( (veja a Figura\(\PageIndex{6}\)).
Outras alterações patológicas incluem a ruptura viral do genoma do hospedeiro e a alteração de células normais em células transformadas, que são os tipos de células associadas a carcinomas e sarcomas. O tipo ou gravidade do CPE depende do tipo de vírus envolvido. A figura\(\PageIndex{6}\) lista CPEs para vírus específicos.
Assista a este vídeo para saber mais sobre os efeitos dos vírus nas células.
Ensaio de hemaglutinação
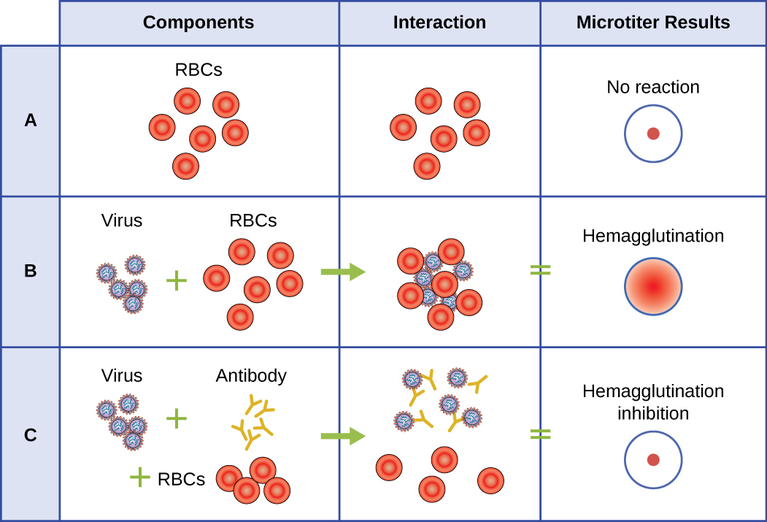
Um ensaio sorológico é usado para detectar a presença de certos tipos de vírus no soro do paciente. O soro é a fração líquida cor de palha do plasma sanguíneo da qual os fatores de coagulação foram removidos. O soro pode ser usado em um ensaio direto chamado ensaio de hemaglutinação para detectar tipos específicos de vírus na amostra do paciente. A hemaglutinação é a aglutinação (aglomeração) de eritrócitos (glóbulos vermelhos). Muitos vírus produzem proteínas de superfície ou picos chamados hemaglutininas que podem se ligar aos receptores nas membranas dos eritrócitos e fazer com que as células se aglutinem. A hemaglutinação é observável sem o uso do microscópio, mas esse método nem sempre diferencia entre partículas virais infecciosas e não infecciosas, pois ambas podem aglutinar eritrócitos.
Para identificar um vírus patogênico específico usando hemaglutinação, devemos usar uma abordagem indireta. Proteínas chamadas anticorpos, geradas pelo sistema imunológico do paciente para combater um vírus específico, podem ser usadas para se ligar a componentes como hemaglutininas que estão exclusivamente associadas a tipos específicos de vírus. A ligação dos anticorpos às hemaglutininas encontradas no vírus posteriormente impede que os eritrócitos interajam diretamente com o vírus. Portanto, quando os eritrócitos são adicionados aos vírus revestidos com anticorpos, não há aparência de aglutinação; a aglutinação foi inibida. Chamamos esses tipos de ensaios indiretos para ensaios de inibição da hemaglutinação (HAI) de anticorpos específicos de vírus. O HAI pode ser usado para detectar a presença de anticorpos específicos para muitos tipos de vírus que podem estar causando ou ter causado uma infecção em um paciente, mesmo meses ou anos após a infecção (veja a Figura\(\PageIndex{7}\)). Este ensaio é descrito com mais detalhes em Ensaios de Aglutinação.
Exercício\(\PageIndex{3}\)
Qual é o resultado de um teste positivo de HIA?
Teste de amplificação de ácido nucléico
Os testes de amplificação de ácido nucléico (NAAT) são usados em biologia molecular para detectar sequências únicas de vírus de ácidos nucléicos em amostras de pacientes. A reação em cadeia da polimerase (PCR) é um NAAT usado para detectar a presença de DNA viral na amostra de tecido ou fluido corporal de um paciente. A PCR é uma técnica que amplifica (ou seja, sintetiza muitas cópias) de um segmento de DNA viral de interesse. Usando PCR, sequências curtas de nucleotídeos chamadas primers se ligam a sequências específicas de DNA viral, permitindo a identificação do vírus.
A transcriptase-PCR reversa (RT-PCR) é um NAAT usado para detectar a presença de vírus de RNA. A RT-PCR difere da PCR porque a enzima transcriptase reversa (RT) é usada para produzir um cDNA a partir da pequena quantidade de RNA viral na amostra. O cDNA pode então ser amplificado por PCR. Tanto a PCR quanto a RT-PCR são usadas para detectar e confirmar a presença do ácido nucléico viral em amostras de pacientes.
Susto do HPV
Michelle, uma estudante de enfermagem de 21 anos, veio à clínica universitária com medo de ter sido exposta a uma doença sexualmente transmissível (DST). Seu parceiro sexual desenvolveu recentemente vários inchaços na base do pênis. Ele adiou a ida ao médico, mas Michelle suspeita que sejam verrugas genitais causadas pelo HPV. Ela está especialmente preocupada porque sabe que o HPV não só causa verrugas, mas é uma causa importante de câncer cervical. Ela e seu parceiro sempre usam preservativos para contracepção, mas ela não tem certeza de que essa precaução a protegerá do HPV.
O médico de Michelle não encontra sinais físicos de verrugas genitais ou outras doenças sexualmente transmissíveis, mas recomenda que Michelle faça um exame de Papanicolaou junto com um teste de HPV. O exame de Papanicolaou rastreará células cervicais anormais e os CPEs associados ao HPV; o teste de HPV testará a presença do vírus. Se os dois testes forem negativos, Michelle pode ter mais certeza de que provavelmente não foi infectada pelo HPV. No entanto, seu médico sugere que talvez seja sensato que Michelle seja vacinada contra o HPV para se proteger de uma possível exposição futura.
Exercício\(\PageIndex{4}\)
Por que o médico de Michelle pede dois exames diferentes em vez de confiar em um ou outro?
Imunoensaio enzimático
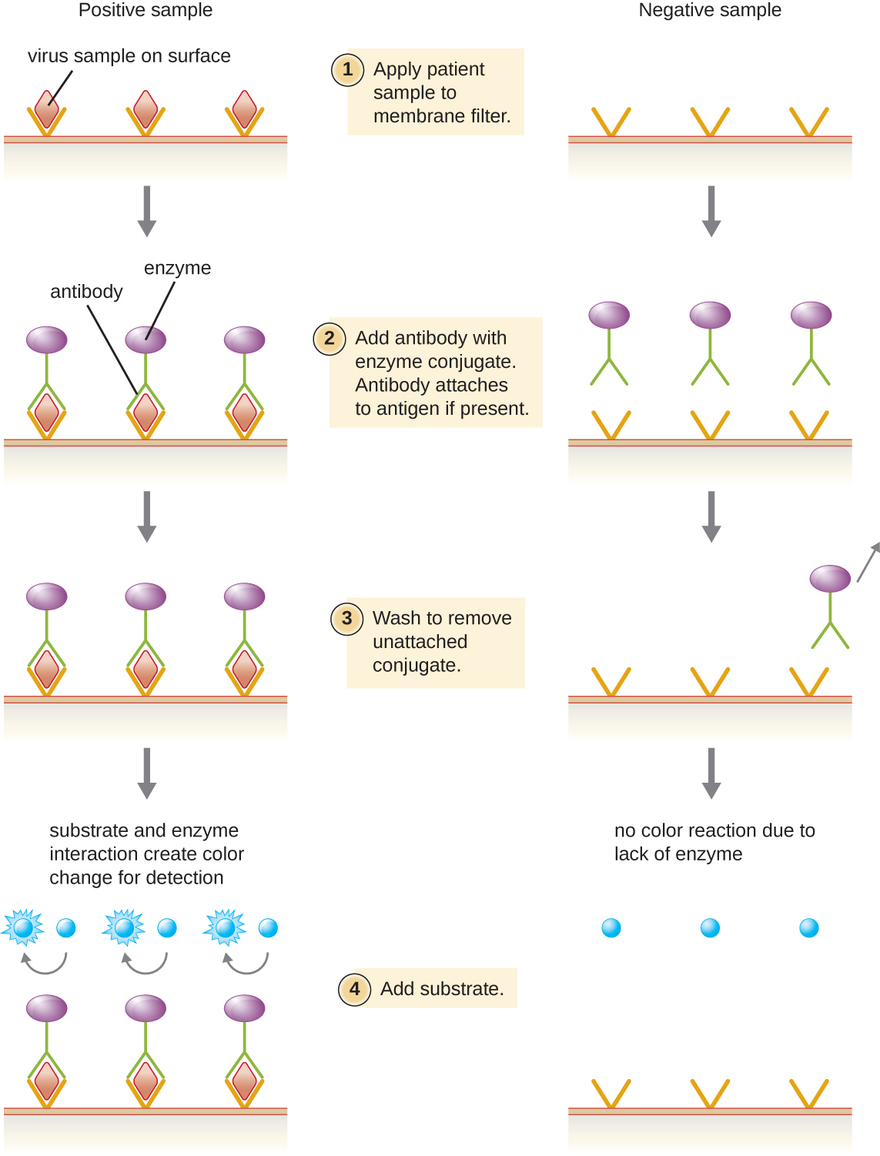
Os imunoensaios enzimáticos (EIAs) dependem da capacidade dos anticorpos de detectar e se ligarem a biomoléculas específicas chamadas antígenos. O anticorpo detector se liga ao antígeno alvo com um alto grau de especificidade no que pode ser uma mistura complexa de biomoléculas. Também está incluída neste tipo de ensaio uma enzima incolor ligada ao anticorpo detector. A enzima atua como uma etiqueta no anticorpo detector e pode interagir com um substrato incolor, levando à produção de um produto final colorido. Os EIAs geralmente dependem de camadas de anticorpos para capturar e reagir com antígenos, todos conectados a um filtro de membrana (veja a Figura\(\PageIndex{8}\)). Os EIAs para antígenos virais são frequentemente usados como testes preliminares de triagem. Se os resultados forem positivos, uma confirmação adicional exigirá testes com sensibilidade ainda maior, como um western blot ou um NAAT. Os EIAs são discutidos com mais detalhes em EIAs e ELISAs.
Exercício\(\PageIndex{5}\)
O que normalmente indica um teste de EIA positivo?
Foco clínico: Parte 3
Junto com a análise de RT/PCR, a saliva de David também foi coletada para o cultivo viral. Em geral, nenhum teste diagnóstico único é suficiente para o diagnóstico antes da morte, pois os resultados dependerão da sensibilidade do ensaio, da quantidade de viriões presentes no momento do teste e do momento do ensaio, pois a liberação de viriões na saliva pode variar. Ao que parece, o resultado foi negativo para o cultivo viral da saliva. Isso não é surpreendente para o médico de David, porque um resultado negativo não é uma indicação absoluta da ausência de infecção. Pode ser que o número de viriões na saliva seja baixo no momento da amostragem. Não é incomum repetir o teste em intervalos para aumentar a chance de detectar maiores cargas de vírus.
Exercício\(\PageIndex{6}\)
O médico de David deveria modificar seu curso de tratamento com base nos resultados desses testes?
Resumo
- O cultivo viral requer a presença de alguma forma de célula hospedeira (organismo inteiro, embrião ou cultura celular).
- Os vírus podem ser isolados das amostras por filtração.
- O filtrado viral é uma fonte rica de viriões liberados.
- Os bacteriófagos são detectados pela presença de placas transparentes no gramado bacteriano.
- Os vírus animais e vegetais são detectados por efeitos citopáticos, técnicas moleculares (PCR, RT-PCR), imunoensaios enzimáticos e ensaios sorológicos (ensaio de hemaglutinação, ensaio de inibição da hemaglutinação).


