6.4: Viróides, virusóides e príons
- Page ID
- 181202
Objetivos de
- Descreva os viróides e suas características únicas
- Descreva os virusoides e suas características únicas
- Descreva os príons e suas características únicas
As tentativas de pesquisa para descobrir os agentes causadores de doenças não investigadas anteriormente levaram à descoberta de agentes de doenças não vivos bem diferentes dos vírus. Isso inclui partículas que consistem apenas de RNA ou apenas de proteína que, no entanto, são capazes de se autopropagar às custas de um hospedeiro - uma semelhança fundamental com os vírus que lhes permite causar doenças. Até o momento, essas descobertas incluem viróides, virusoides e príons proteináceos.
Viroides
Em 1971, Theodor Diener, patologista que trabalhava no Serviço de Pesquisa Agrícola, descobriu uma partícula acelular que ele chamou de viróide, que significa “semelhante a um vírus”. Os viróides consistem apenas em uma pequena fita de RNA circular capaz de se autorreplicar. Descobriu-se que o primeiro viróide descoberto causa a doença do fuso do tubérculo da batata, que causa brotação mais lenta e várias deformidades nas plantas de batata (veja a Figura\(\PageIndex{1}\)). Como os vírus, os viróides do tubérculo fusiforme da batata (PSTVs) assumem o controle da maquinaria hospedeira para replicar seu genoma de RNA. Ao contrário dos vírus, os viróides não têm uma camada proteica para proteger suas informações genéticas.

Os viróides podem resultar em perdas devastadoras de culturas alimentares agrícolas comercialmente importantes cultivadas em campos e pomares. Desde a descoberta do PSTV, foram descobertos outros viróides que causam doenças nas plantas. O viróide planta macho do tomate (TPMVd) infecta plantas de tomate, o que causa perda de clorofila, folhas desfiguradas e quebradiças e tomates muito pequenos, resultando em perda de produtividade nesta cultura de campo. O viroide da mancha solar do abacate (ASBVd) resulta em rendimentos mais baixos e frutas de baixa qualidade. O AsBVd é o menor viróide descoberto até agora que infecta plantas. O viróide do mosaico latente do pêssego (PLMVd) pode causar necrose dos botões e galhos das flores e ferimentos dos frutos maduros, o que leva ao crescimento fúngico e bacteriano do fruto. O PLMVd também pode causar alterações patológicas semelhantes em ameixas, nectarinas, damascos e cerejas, resultando também na diminuição da produtividade nesses pomares. Os viróides, em geral, podem ser dispersos mecanicamente durante a manutenção ou colheita da safra, reprodução vegetativa e possivelmente por meio de sementes e insetos, resultando em uma queda severa na disponibilidade de alimentos e consequências econômicas devastadoras.
Exercício\(\PageIndex{1}\)
Do que é feito o genoma de um viróide?
Virusóides
Um segundo tipo de RNA patogênico que pode infectar culturas agrícolas comercialmente importantes são os virusoides s, que são partículas subvirais melhor descritas como ssRNAs não autorreplicantes. A replicação de RNA dos virusoides é semelhante à dos viróides, mas, ao contrário dos viróides, os virusoides exigem que a célula também seja infectada com um vírus “auxiliar” específico. Atualmente, existem apenas cinco tipos descritos de virusoides e seus vírus auxiliares associados. Os vírus auxiliares são todos da família dos sobemovírus. Um exemplo de vírus auxiliar é o vírus subterrâneo da mancha do trevo, que tem um vírus associado empacotado dentro do capsídeo viral. Uma vez que o vírus auxiliar entra na célula hospedeira, os virusoides são liberados e podem ser encontrados livres no citoplasma das células vegetais, onde possuem atividade ribozima. O vírus auxiliar sofre uma replicação viral típica, independentemente da atividade do virusoide. Os genomas do virusoide são pequenos, com apenas 220 a 388 nucleotídeos. O genoma de um virusoide não codifica nenhuma proteína, mas serve apenas para replicar o RNA virusoide.
Os virusóides pertencem a um grupo maior de agentes infecciosos chamados RNAs satélites, que são RNAs patogênicos semelhantes encontrados em animais. Ao contrário dos virusóides vegetais, os RNAs satélites podem codificar proteínas; no entanto, como os virusoides vegetais, os RNAs satélites devem coinfectar com um vírus auxiliar para se replicarem. Um RNA satélite que infecta humanos e que foi descrito por alguns cientistas como um virusoide é o vírus da hepatite delta (HDV), que, segundo alguns relatos, também é chamado de virusóide da hepatite delta. Muito maior do que um virusóide vegetal, o HDV tem um genoma circular de ssRNA de 1.700 nucleotídeos e pode direcionar a biossíntese de proteínas associadas ao HDV. O vírus auxiliar do HDV é o vírus da hepatite B (HBV). A coinfecção com HBV e HDV resulta em alterações patológicas mais graves no fígado durante a infecção, e foi assim que o HDV foi descoberto pela primeira vez.
Exercício\(\PageIndex{2}\)
Qual é a principal diferença entre um viróide e um virusoide?
Priões
Houve uma época em que os cientistas acreditavam que qualquer partícula infecciosa deveria conter DNA ou RNA. Então, em 1982, Stanley Prusiner, um médico que estuda o tremor epizoótico (uma doença fatal e degenerativa em ovelhas) descobriu que a doença era causada por partículas infecciosas proteináceas, ou príons. Como as proteínas são acelulares e não contêm DNA ou RNA, as descobertas de Prusiner foram originalmente recebidas com resistência e ceticismo; no entanto, sua pesquisa acabou sendo validada e ele recebeu o Prêmio Nobel de Fisiologia ou Medicina em 1997.
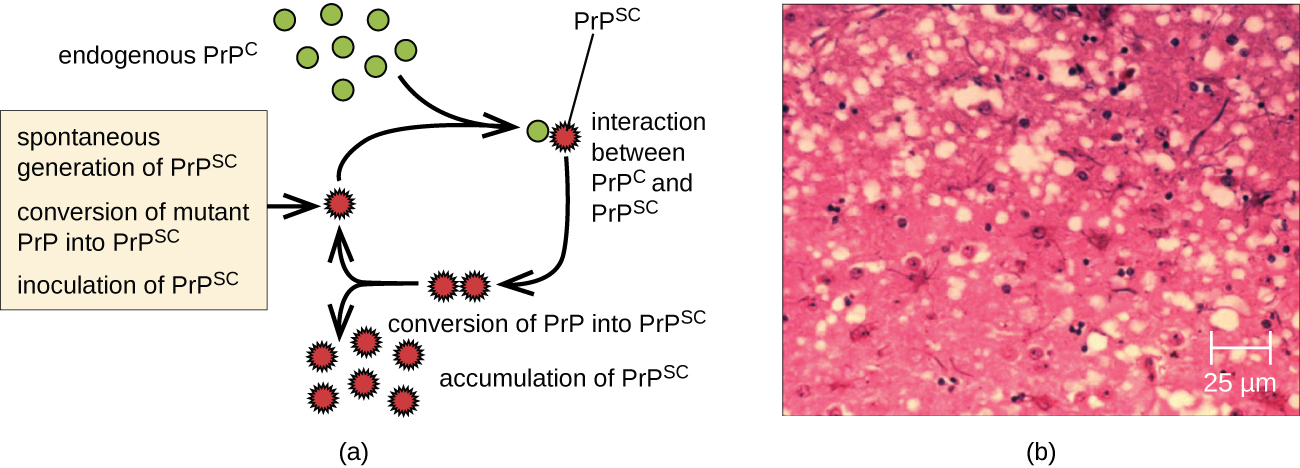
Um príon é uma forma desonesta mal dobrada de uma proteína normal (PrPC) encontrada na célula. Essa proteína priônica nociva (PrPSc), que pode ser causada por uma mutação genética ou ocorrer espontaneamente, pode ser infecciosa, estimulando outras proteínas endógenas normais a se dobrarem mal, formando placas (veja a Figura\(\PageIndex{2}\)). Hoje, sabe-se que os príons causam várias formas de encefalopatia espongiforme transmissível (TSE) em humanos e animais. A TSE é uma doença degenerativa rara que afeta o cérebro e o sistema nervoso. O acúmulo de proteínas nocivas faz com que o tecido cerebral se torne semelhante a uma esponja, matando as células cerebrais e formando buracos no tecido, causando danos cerebrais, perda da coordenação motora e demência (veja a Figura\(\PageIndex{3}\)). Indivíduos infectados têm deficiência mental e ficam incapazes de se mover ou falar. Não há cura e a doença progride rapidamente, levando à morte em alguns meses ou anos.
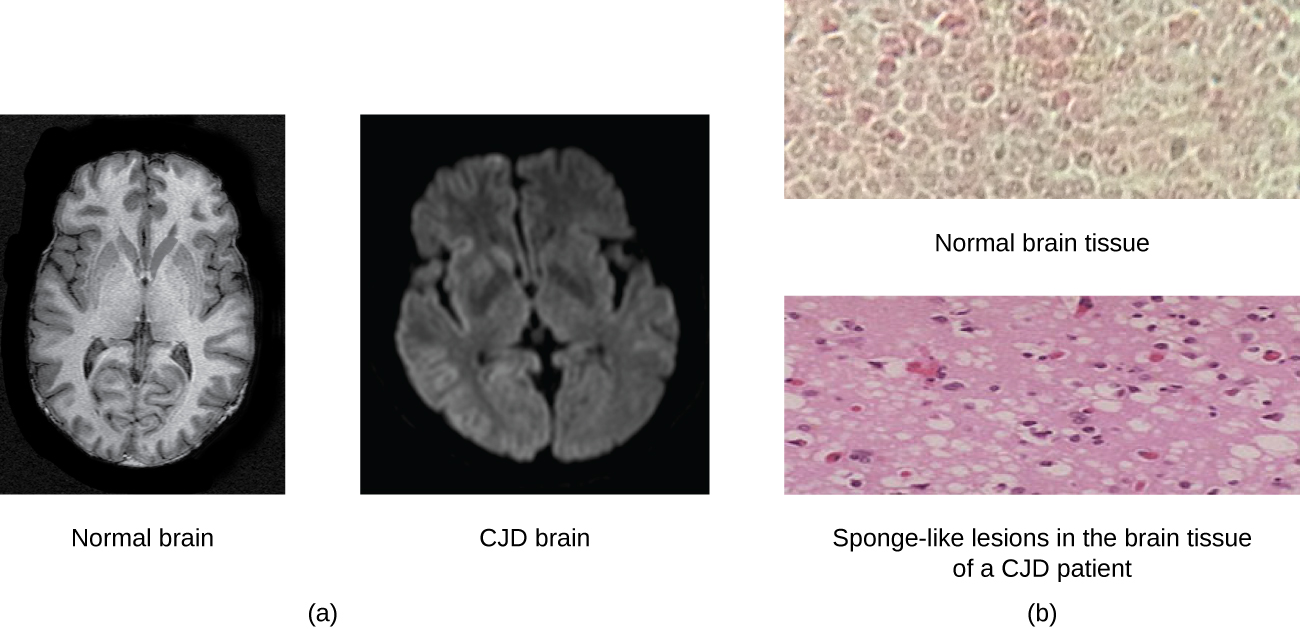
As EET em humanos incluem kuru, insônia familiar fatal, doença de Gerstmann-Straussler-Scheinker e doença de Creutzfeldt-Jakob (ver Figura\(\PageIndex{3}\)). As EET em animais incluem a doença da vaca louca, o tremor epizoótico (em ovelhas e cabras) e a doença emaciante crônica (em alces e veados). As EET podem ser transmitidas entre animais e de animais para humanos pela ingestão de carne contaminada ou ração animal. A transmissão entre humanos pode ocorrer por hereditariedade (como é frequentemente o caso com GSS e CJD) ou pelo contato com tecido contaminado, como pode ocorrer durante uma transfusão de sangue ou transplante de órgão. Não há evidências de transmissão por contato casual com uma pessoa infectada. A tabela\(\PageIndex{1}\) lista as TSEs que afetam humanos e seus modos de transmissão.
| Doença | Mecanismo (s) de transmissão 1 |
|---|---|
| CJD esporádico (ScJD) | Desconhecido; possivelmente por alteração da proteína anterior normal (PrP) para a forma nociva devido à mutação somática |
| Variante CJD (vCJD) | Comer produtos bovinos contaminados e por transmissão secundária transmitida pelo sangue |
| CJD familiar (FCjD) | Mutação no gene prP germinativo |
| CJD iatrogênico (ICJD) | Instrumentos neurocirúrgicos contaminados, enxerto de córnea, hormônio gonadotrófico e, secundariamente, por transfusão de sangue |
| Kuru | Comer carne infectada por meio de canibalismo ritualístico |
| Doença de Gerstmann-Straussler-Scheinker (GSS) | Mutação no gene prP germinativo |
| Insônia familiar fatal (FFI) | Mutação no gene prP germinativo |
Os príons são extremamente difíceis de destruir porque são resistentes ao calor, produtos químicos e radiação. Mesmo os procedimentos padrão de esterilização não garantem a destruição dessas partículas. Atualmente, não há tratamento ou cura para a doença de TSE, e carnes contaminadas ou animais infectados devem ser manuseados de acordo com as diretrizes federais para evitar a transmissão.
Exercício\(\PageIndex{3}\)
Um príon tem um genoma?
Foco clínico: Resolução
Alguns dias depois, o médico de David recebe os resultados do teste de imunofluorescência em sua amostra de pele. O teste é negativo para o antígeno da raiva. Um segundo teste de antígeno viral em sua amostra de saliva também deu negativo. Apesar desses resultados, o médico decide continuar o tratamento atual de David. Dado o teste RT-PCR positivo, é melhor não descartar uma possível infecção por raiva.
Perto do local da picada, David recebe uma injeção de imunoglobulina anti-rábica, que se liga e inativa qualquer vírus da raiva que possa estar presente em seus tecidos. Nos próximos 14 dias, ele recebe uma série de quatro vacinas específicas contra a raiva no braço. Essas vacinas ativam a resposta imune de David e ajudam seu corpo a reconhecer e combater o vírus. Felizmente, com o tratamento, os sintomas de David melhoram e ele se recupera completamente.
Nem todos os casos de raiva têm um resultado tão feliz. Na verdade, a raiva geralmente é fatal quando o paciente começa a apresentar sintomas, e os tratamentos pós-mordida são principalmente paliativos (ou seja, sedação e controle da dor).
Resumo
- Outros agentes acelulares, como viróides, virusoides e príons, também causam doenças. Os viróides consistem em pequenos SSRNAs nus que causam doenças nas plantas. Os virusóides são ssRNAs que requerem outros vírus auxiliares para estabelecer uma infecção. Os príons são partículas infecciosas proteináceas que causam encefalopatias espongiformes transmissíveis.
- Os príons são extremamente resistentes a produtos químicos, calor e radiação.
- Não há tratamentos para a infecção por príons.
Notas de pé
- 1 Instituto Nacional de Distúrbios Neurológicos e Derrame. “Ficha informativa sobre a doença de Creutzfeldt-Jakob”. http://www.ninds.nih.gov/disorders/cjd/detail_cjd.htm (acessado em 31 de dezembro de 2015).


