6.2: O ciclo de vida viral
- Page ID
- 181199
Objetivos de
- Descreva os ciclos de vida lítico e lisogênico
- Descreva o processo de replicação de vírus animais
- Descreva as características únicas dos retrovírus e vírus latentes
- Discuta os vírus humanos e suas interações vírus-célula hospedeira
- Explicar o processo de transdução
- Descreva o processo de replicação de vírus vegetais
Todos os vírus dependem das células para reprodução e processos metabólicos. Sozinhos, os vírus não codificam todas as enzimas necessárias para a replicação viral. Mas dentro de uma célula hospedeira, um vírus pode comandar a maquinaria celular para produzir mais partículas virais. Os bacteriófagos se replicam apenas no citoplasma, pois as células procarióticas não têm núcleo ou organelas. Nas células eucarióticas, a maioria dos vírus de DNA pode se replicar dentro do núcleo, com uma exceção observada nos grandes vírus de DNA, como os poxvírus, que podem se replicar no citoplasma. Os vírus de RNA que infectam células animais geralmente se replicam no citoplasma.
O ciclo de vida de vírus com hospedeiros procariotas
O ciclo de vida dos bacteriófagos tem sido um bom modelo para entender como os vírus afetam as células que infectam, uma vez que processos semelhantes foram observados para os vírus eucarióticos, que podem causar a morte imediata da célula ou estabelecer uma infecção latente ou crônica. Os fagos virulentos normalmente levam à morte da célula por meio da lise celular. Os fagos temperados, por outro lado, podem se tornar parte de um cromossomo hospedeiro e são replicados com o genoma celular até o momento em que são induzidos a produzir vírus recém-montados, ou vírus de progênie.
O ciclo lítico
Durante o ciclo lítico do fago virulento, o bacteriófago assume o controle da célula, reproduz novos fagos e destrói a célula. O fago T-even é um bom exemplo de uma classe bem caracterizada de fagos virulentos. Existem cinco estágios no ciclo lítico do bacteriófago (veja a Figura\(\PageIndex{1}\)). A fixação é o primeiro estágio do processo de infecção no qual o fago interage com receptores específicos da superfície bacteriana (por exemplo, lipopolissacarídeos e proteína OmpC nas superfícies do hospedeiro). A maioria dos fagos tem uma faixa estreita de hospedeiros e pode infectar uma espécie de bactéria ou uma cepa dentro de uma espécie. Esse reconhecimento exclusivo pode ser explorado para tratamento direcionado de infecção bacteriana por fagoterapia ou para fagotipagem para identificar subespécies ou cepas bacterianas únicas. O segundo estágio da infecção é a entrada ou penetração. Isso ocorre por meio da contração da bainha da cauda, que age como uma agulha hipodérmica para injetar o genoma viral através da parede celular e da membrana. A cabeça do fago e os componentes restantes permanecem fora da bactéria.
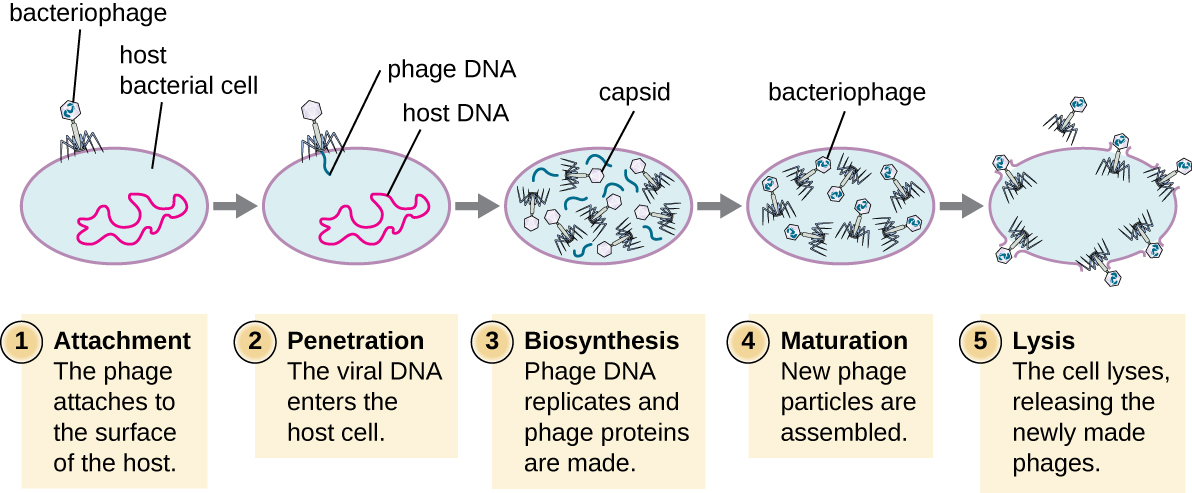
O terceiro estágio da infecção é a biossíntese de novos componentes virais. Depois de entrar na célula hospedeira, o vírus sintetiza endonucleases codificadas por vírus para degradar o cromossomo bacteriano. Em seguida, ele sequestra a célula hospedeira para replicar, transcrever e traduzir os componentes virais necessários (capsômeros, bainha, placas de base, fibras da cauda e enzimas virais) para a montagem de novos vírus. Os genes da polimerase geralmente são expressos no início do ciclo, enquanto as proteínas do capsídeo e da cauda são expressas posteriormente. Durante a fase de maturação, novos viriões são criados. Para liberar fagos livres, a parede celular bacteriana é rompida por proteínas fágicas, como holina ou lisozima. A fase final é o lançamento. Os vírus maduros saem da célula hospedeira em um processo chamado lise e os vírus da progênie são liberados no meio ambiente para infectar novas células.
O ciclo lisogênico
Em um ciclo lisogênico, o genoma do fago também entra na célula por meio de fixação e penetração. Um excelente exemplo de fago com esse tipo de ciclo de vida é o fago lambda. Durante o ciclo lisogênico, em vez de matar o hospedeiro, o genoma do fago se integra ao cromossomo bacteriano e se torna parte do hospedeiro. O genoma integrado do fago é chamado de profago. Um hospedeiro bacteriano com um profago é chamado de lisogênio. O processo no qual uma bactéria é infectada por um fago temperado é chamado de lisogenia. É típico que os fagos temperados estejam latentes ou inativos dentro da célula. À medida que a bactéria replica seu cromossomo, ela também replica o DNA do fago e o passa para novas células-filhas durante a reprodução. A presença do fago pode alterar o fenótipo da bactéria, pois pode trazer genes extras (por exemplo, genes de toxinas que podem aumentar a virulência bacteriana). Essa mudança no fenótipo do hospedeiro é chamada de conversão lisogênica ou conversão fágica. Algumas bactérias, como Vibrio cholerae e Clostridium botulinum, são menos virulentas na ausência do profago. Os fagos que infectam essas bactérias carregam os genes da toxina em seu genoma e aumentam a virulência do hospedeiro quando os genes da toxina são expressos. No caso da V. cólera, a toxina codificada por fagos pode causar diarreia grave; em C. botulinum, a toxina pode causar paralisia. Durante a lisogenia, o profago persistirá no cromossomo hospedeiro até a indução, o que resulta na excisão do genoma viral do cromossomo hospedeiro. Após a indução ter ocorrido, o fago temperado pode passar por um ciclo lítico e, em seguida, sofrer lisogenia em uma célula recém-infectada (veja a Figura\(\PageIndex{2}\)).
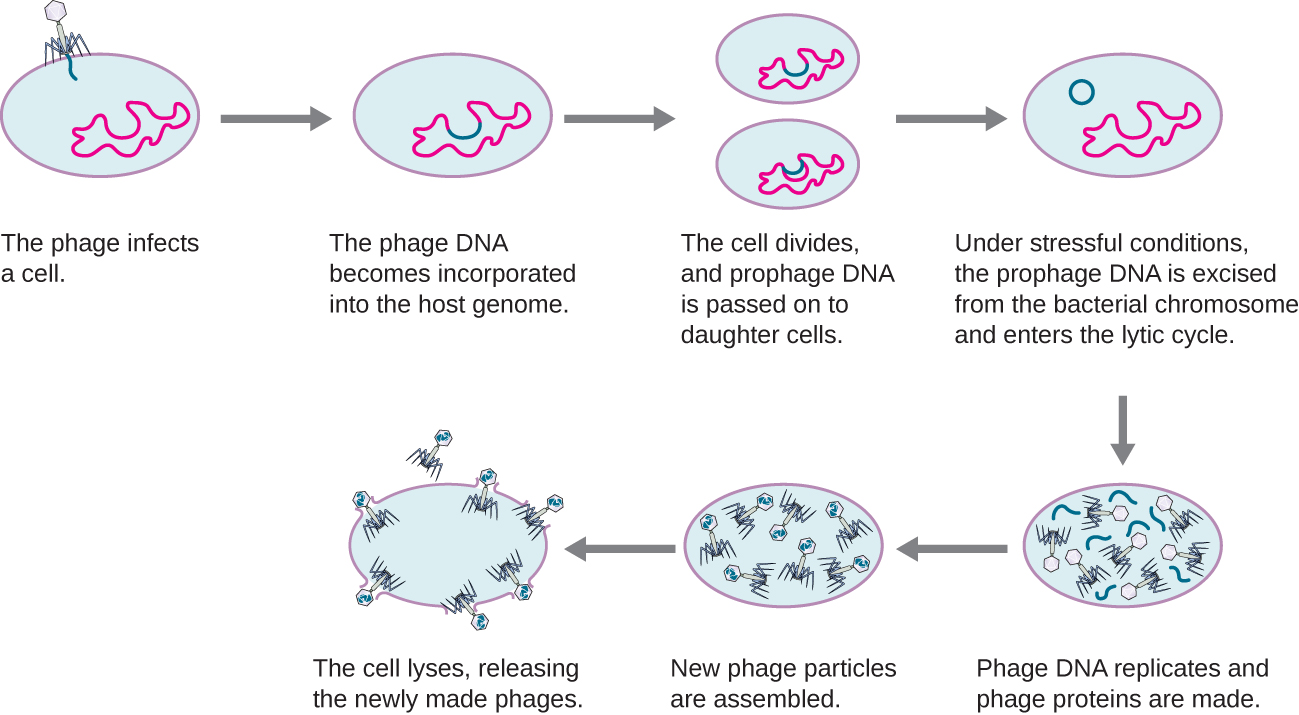
Este vídeo ilustra os estágios do ciclo de vida lisogênico de um bacteriófago e a transição para uma fase lítica.
Exercício\(\PageIndex{1}\)
Um fago latente é indetectável em uma bactéria?
Transdução
A transdução ocorre quando um bacteriófago transfere DNA bacteriano de uma bactéria para outra durante infecções sequenciais. Existem dois tipos de transdução: transdução generalizada e especializada. Durante o ciclo lítico da replicação viral, o vírus sequestra a célula hospedeira, degrada o cromossomo hospedeiro e produz mais genomas virais. Ao reunir e empacotar o DNA na cabeça do fago, a embalagem ocasionalmente comete um erro. Em vez de empacotar o DNA viral, ele pega um pedaço aleatório do DNA do hospedeiro e o insere na cápside. Uma vez liberado, esse virião injetará o DNA do antigo hospedeiro em um hospedeiro recém-infectado. A transferência assexuada de informações genéticas pode permitir a recombinação do DNA, fornecendo ao novo hospedeiro novos genes (por exemplo, um gene de resistência a antibióticos ou um gene metabolizador de açúcar). A transdução generalizada ocorre quando um pedaço aleatório de DNA cromossômico bacteriano é transferido pelo fago durante o ciclo lítico. A transdução especializada ocorre no final do ciclo lisogênico, quando o profago é excisado e o bacteriófago entra no ciclo lítico. Como o fago está integrado ao genoma do hospedeiro, o profago pode se replicar como parte do hospedeiro. No entanto, algumas condições (por exemplo, exposição à luz ultravioleta ou exposição química) estimulam o profago a ser induzido, fazendo com que o fago se retire do genoma, entre no ciclo lítico e produza novos fagos para deixar as células hospedeiras. Durante o processo de excisão do cromossomo hospedeiro, um fago pode ocasionalmente remover algum DNA bacteriano próximo ao local da integração viral. O DNA do fago e do hospedeiro de uma extremidade ou de ambas as extremidades do local de integração são empacotados dentro do capsídeo e transferidos para o novo hospedeiro infectado. Como o DNA transferido pelo fago não é empacotado aleatoriamente, mas é um pedaço específico de DNA próximo ao local de integração, esse mecanismo de transferência de genes é chamado de transdução especializada (veja a Figura\(\PageIndex{3}\)). O DNA pode então se recombinar com o cromossomo hospedeiro, dando a este último novas características. A transdução parece desempenhar um papel importante no processo evolutivo das bactérias, dando-lhes um mecanismo para a troca assexual de informações genéticas.
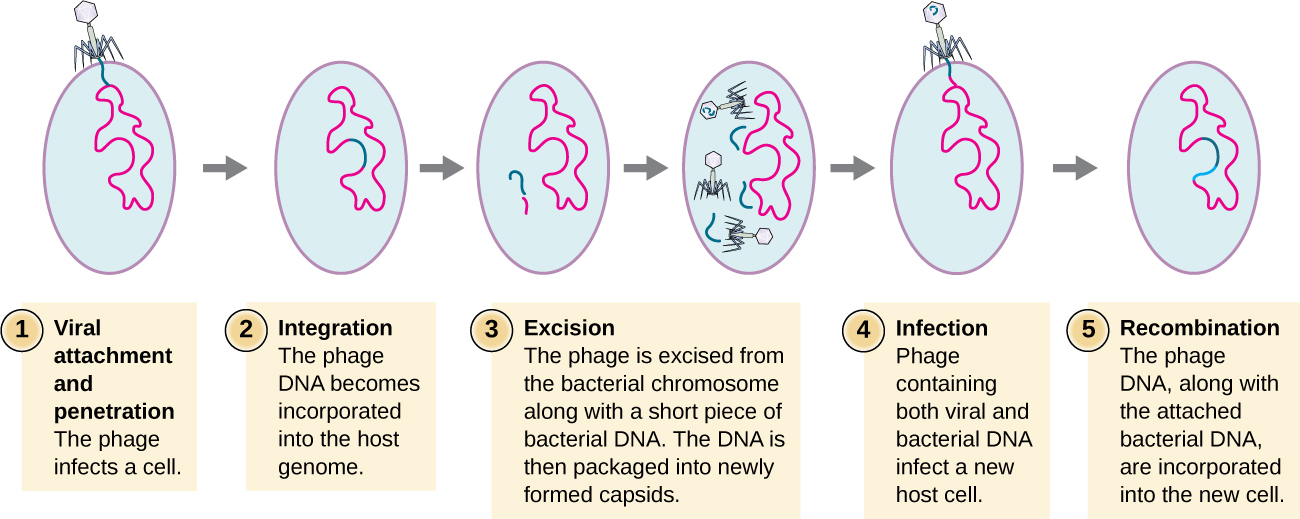
Exercício\(\PageIndex{2}\)
Qual ciclo de vida do fago está associado a quais formas de transdução?
Ciclo de vida de vírus com hospedeiros animais
Os vírus líticos animais seguem estágios de infecção semelhantes aos bacteriófagos: fixação, penetração, biossíntese, maturação e liberação (veja a Figura\(\PageIndex{4}\)). No entanto, os mecanismos de penetração, biossíntese e liberação de ácidos nucléicos diferem entre vírus bacterianos e animais. Após a ligação aos receptores do hospedeiro, os vírus animais entram por endocitose (engolfamento pela célula hospedeira) ou por fusão de membrana (envelope viral com a membrana da célula hospedeira). Muitos vírus são específicos do hospedeiro, o que significa que infectam apenas um determinado tipo de hospedeiro; e a maioria dos vírus infecta apenas certos tipos de células nos tecidos. Essa especificidade é chamada de tropismo tecidual. Exemplos disso são demonstrados pelo poliovírus, que exibe tropismo nos tecidos do cérebro e da medula espinhal, ou o vírus da gripe, que tem um tropismo primário para o trato respiratório.
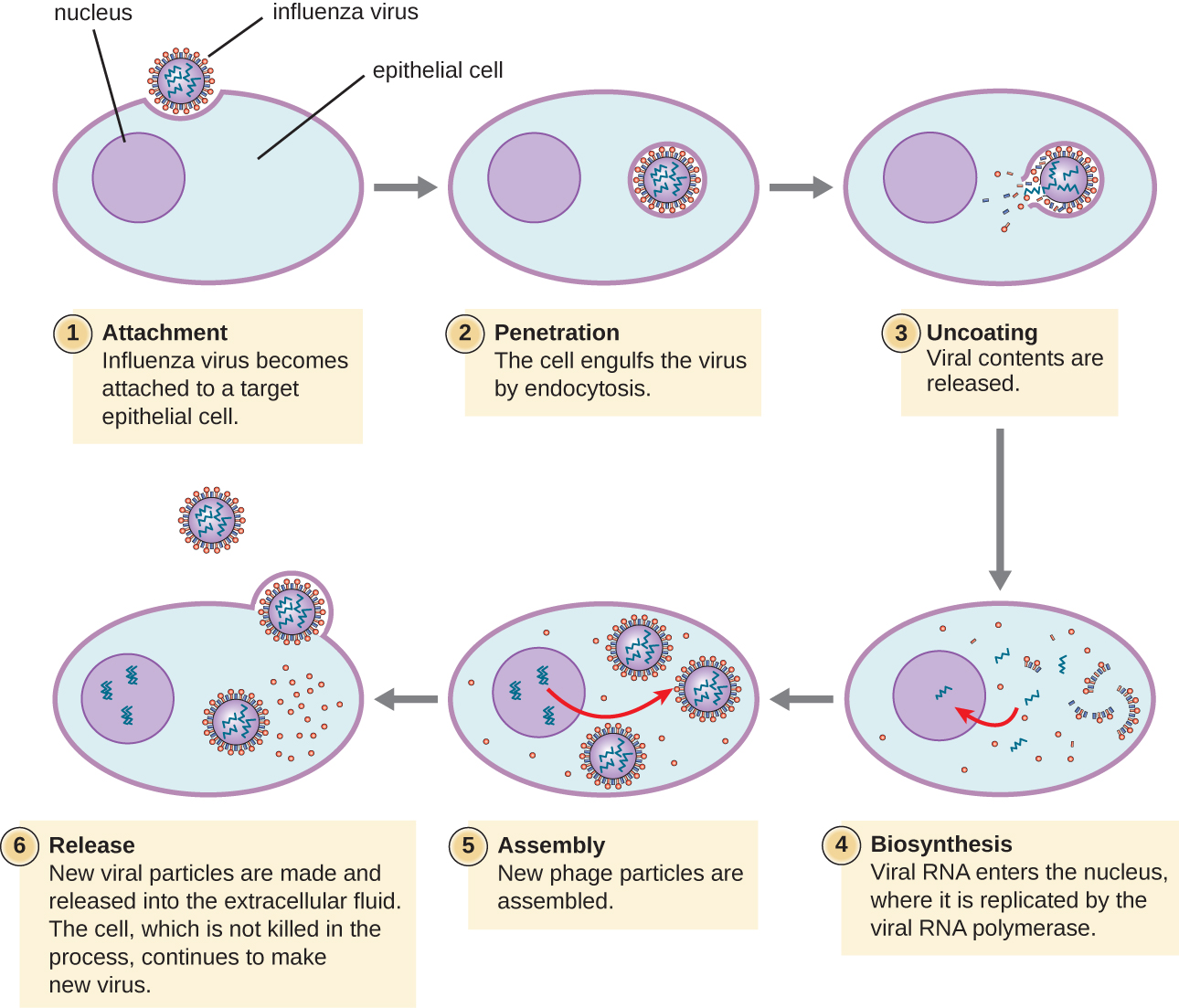
Os vírus animais nem sempre expressam seus genes usando o fluxo normal de informações genéticas — do DNA ao RNA e às proteínas. Alguns vírus têm um genoma de dsDNA, como organismos celulares, e podem seguir o fluxo normal. No entanto, outros podem ter genomas ssDNA, dsRNA ou ssRNA. A natureza do genoma determina como o genoma é replicado e expresso como proteínas virais. Se um genoma for ssDNA, as enzimas hospedeiras serão usadas para sintetizar uma segunda fita que é complementar à fita do genoma, produzindo assim dsDNA. O dsDNA agora pode ser replicado, transcrito e traduzido de forma semelhante ao DNA do hospedeiro.
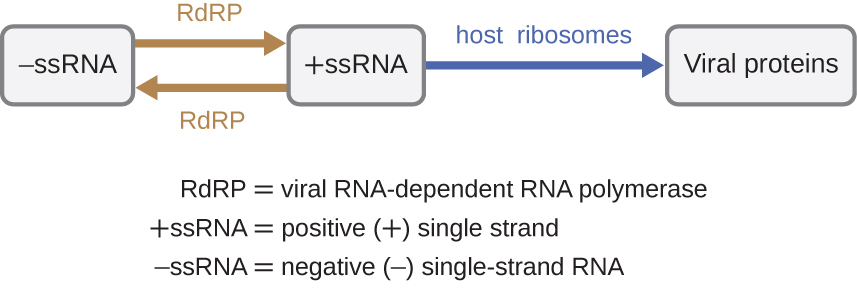
Se o genoma viral for RNA, um mecanismo diferente deve ser usado. Existem três tipos de genoma de RNA: dsRNA, RNA de fita única positivo (+) (+ssRNA) ou negativo (−) de fita única (−sSRNA). Se um vírus tem um genoma +ssRNA, ele pode ser traduzido diretamente para produzir proteínas virais. O genômico viral +ssRNA atua como o mRNA celular. No entanto, se um vírus contém um genoma −ssRNA, os ribossomos hospedeiros não podem traduzi-lo até que o −ssRNA seja replicado em +ssRNA pela RNA polimerase viral dependente de RNA (RdRP) (veja a Figura\(\PageIndex{5}\)). O RdRP é trazido pelo vírus e pode ser usado para produzir +ssRNA a partir do genoma original de −ssRNA. O RdRP também é uma enzima importante para a replicação dos vírus dsRNA, porque usa a fita negativa do genoma de fita dupla como modelo para criar +ssRNA. As cópias recém-sintetizadas de +ssRNA podem então ser traduzidas por ribossomos celulares.
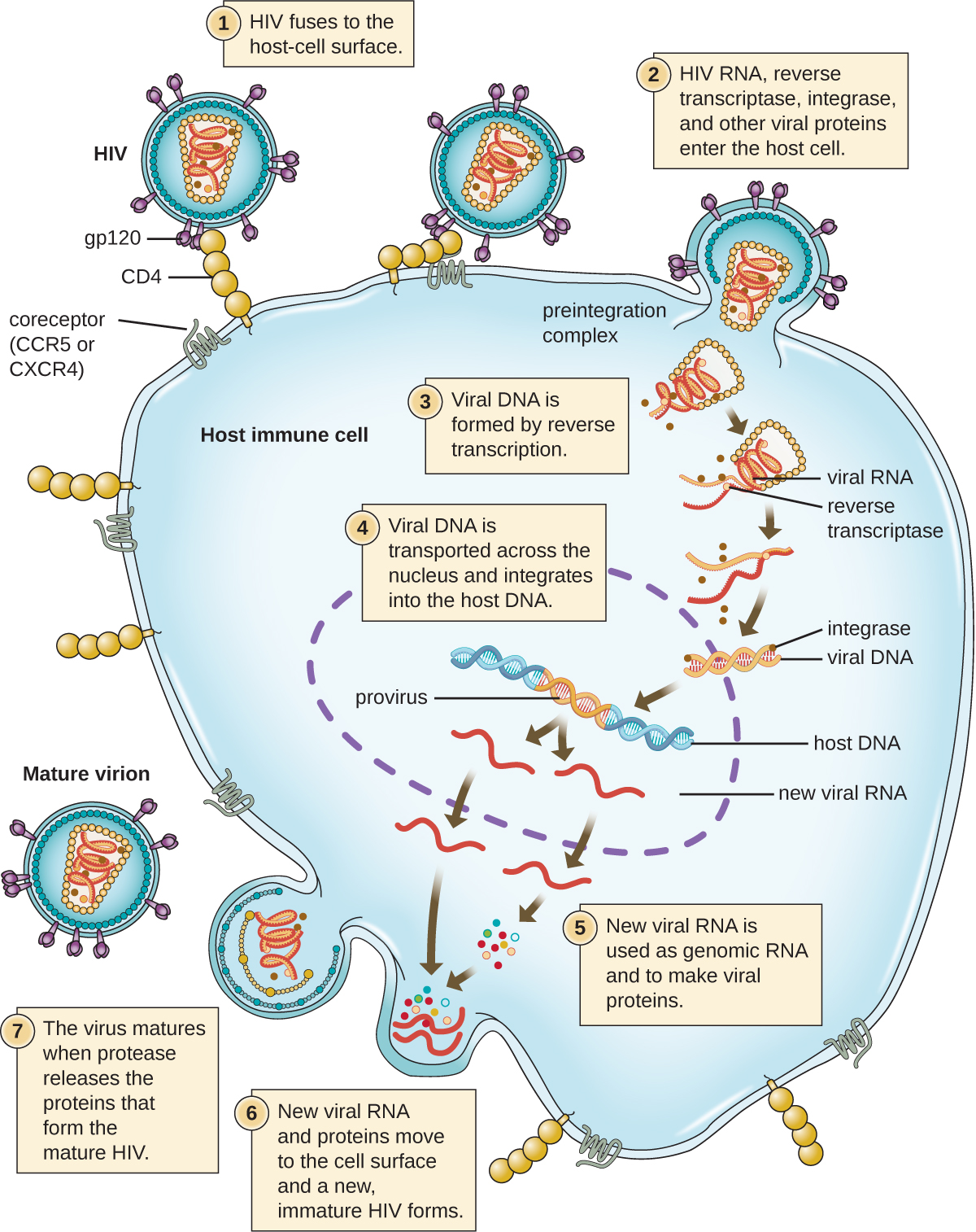
Um mecanismo alternativo para a síntese de ácido nucléico viral é observado nos retrovírus, que são vírus +ssRNA (veja a Figura\(\PageIndex{6}\)). Vírus de RNA de fita simples, como o HIV, carregam uma enzima especial chamada transcriptase reversa dentro do capsídeo que sintetiza uma cópia complementar de ssDNA (cDNA) usando o genoma +ssRNA como modelo. O ssDNA é então transformado em dsDNA, que pode se integrar ao cromossomo hospedeiro e se tornar uma parte permanente do hospedeiro. O genoma viral integrado é chamado de provírus. O vírus agora pode permanecer no hospedeiro por muito tempo para estabelecer uma infecção crônica. O estágio do provírus é semelhante ao estágio do profago em uma infecção bacteriana durante o ciclo lisogênico. No entanto, ao contrário do profago, o provírus não sofre excisão após ser inserido no genoma.
Exercício\(\PageIndex{3}\)
A RNA polimerase dependente de RNA é produzida a partir de um gene viral ou de um gene hospedeiro?
infecções persistentes
A infecção persistente ocorre quando um vírus não é completamente eliminado do sistema do hospedeiro, mas permanece em certos tecidos ou órgãos da pessoa infectada. O vírus pode permanecer silencioso ou sofrer uma infecção produtiva sem prejudicar ou matar seriamente o hospedeiro. Os mecanismos de infecção persistente podem envolver a regulação das expressões do gene viral ou do hospedeiro ou a alteração da resposta imune do hospedeiro. As duas categorias principais de infecções persistentes são infecção latente e infecção crônica. Exemplos de vírus que causam infecções latentes incluem o vírus herpes simplex (herpes oral e genital), o vírus varicela-zoster (varicela e herpes zoster) e o vírus Epstein-Barr (mononucleose). O vírus da hepatite C e o HIV são dois exemplos de vírus que causam infecções crônicas de longo prazo.
Infecção latente
Nem todos os vírus animais são replicados pelo ciclo lítico. Existem vírus que são capazes de permanecer ocultos ou inativos dentro da célula em um processo chamado latência. Esses tipos de vírus são conhecidos como vírus latentes e podem causar infecções latentes. Vírus capazes de latência podem inicialmente causar uma infecção aguda antes de ficarem dormentes.
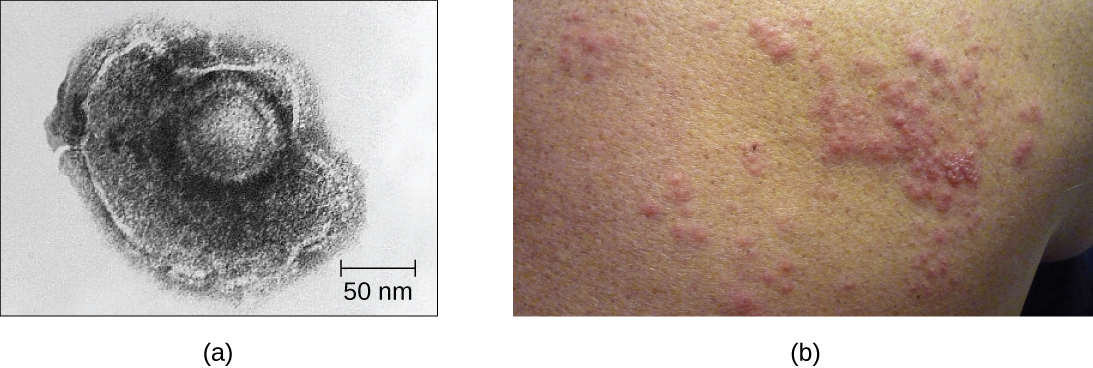
Por exemplo, o vírus varicela-zoster infecta muitas células em todo o corpo e causa catapora, caracterizada por uma erupção de bolhas cobrindo a pele. Cerca de 10 a 12 dias após a infecção, a doença se resolve e o vírus fica adormecido, vivendo dentro dos gânglios das células nervosas por anos. Durante esse período, o vírus não mata as células nervosas nem continua se replicando. Não está claro por que o vírus para de se replicar dentro das células nervosas e expressa poucas proteínas virais, mas, em alguns casos, normalmente após muitos anos de dormência, o vírus é reativado e causa uma nova doença chamada herpes zoster (Figura\(\PageIndex{7}\)). Enquanto a varicela afeta muitas áreas do corpo, o herpes zoster é uma doença específica das células nervosas que emerge dos gânglios nos quais o vírus estava adormecido.
Os vírus latentes podem permanecer inativos por existirem como moléculas circulares do genoma viral fora do cromossomo hospedeiro. Outros se tornam provírios ao se integrarem ao genoma do hospedeiro. Durante a dormência, os vírus não causam nenhum sintoma da doença e podem ser difíceis de detectar. Um paciente pode não saber que é portador do vírus, a menos que um teste de diagnóstico viral tenha sido realizado.
Infecção crônica
Uma infecção crônica é uma doença com sintomas recorrentes ou persistentes por muito tempo. Algumas infecções virais podem ser crônicas se o corpo não conseguir eliminar o vírus. O HIV é um exemplo de vírus que produz uma infecção crônica, geralmente após um longo período de latência. Quando uma pessoa é infectada pelo HIV, o vírus pode ser detectado continuamente nos tecidos a partir de então, mas pacientes não tratados geralmente não apresentam sintomas por anos. No entanto, o vírus mantém a persistência crônica por meio de vários mecanismos que interferem na função imune, incluindo a prevenção da expressão de antígenos virais na superfície das células infectadas, a alteração das próprias células imunes, a restrição da expressão de genes virais e a rápida alteração dos antígenos virais por meio de mutação. Eventualmente, os danos ao sistema imunológico resultam na progressão da doença, levando à síndrome da imunodeficiência adquirida (AIDS). Os vários mecanismos que o HIV usa para evitar ser eliminado pelo sistema imunológico também são usados por outros vírus que infectam cronicamente, incluindo o vírus da hepatite C.
Exercício\(\PageIndex{4}\)
De que duas maneiras um vírus consegue manter uma infecção persistente?
Ciclo de vida de vírus com hospedeiros vegetais
Os vírus vegetais são mais semelhantes aos vírus animais do que aos bacteriófagos. Os vírus vegetais podem estar envelopados ou não. Como muitos vírus animais, os vírus vegetais podem ter um genoma de DNA ou RNA e ser de fita simples ou dupla. No entanto, a maioria dos vírus vegetais não tem um genoma de DNA; a maioria tem um genoma +ssRNA, que age como RNA mensageiro (mRNA). Apenas uma minoria dos vírus vegetais tem outros tipos de genomas.
Os vírus vegetais podem ter uma gama de hospedeiros estreita ou ampla. Por exemplo, o vírus da tristeza cítrica infecta apenas algumas plantas do gênero Citrus, enquanto o vírus do mosaico do pepino infecta milhares de plantas de várias famílias de plantas. A maioria dos vírus vegetais é transmitida pelo contato entre plantas ou por fungos, nematóides, insetos ou outros artrópodes que atuam como vetores mecânicos. No entanto, alguns vírus só podem ser transferidos por um tipo específico de inseto vetor; por exemplo, um vírus específico pode ser transmitido por pulgões, mas não por moscas brancas. Em alguns casos, os vírus também podem entrar nas plantas saudáveis por meio de feridas, o que pode ocorrer devido a podas ou danos causados pelo clima.
Os vírus que infectam as plantas são considerados parasitas biotróficos, o que significa que podem estabelecer uma infecção sem matar o hospedeiro, semelhante ao observado nos ciclos de vida lisogênicos dos bacteriófagos. A infecção viral pode ser assintomática (latente) ou pode levar à morte celular (infecção lítica). O ciclo de vida começa com a penetração do vírus na célula hospedeira. Em seguida, o vírus não é revestido dentro do citoplasma da célula quando o capsídeo é removido. Dependendo do tipo de ácido nucléico, os componentes celulares são usados para replicar o genoma viral e sintetizar proteínas virais para a montagem de novos viriões. Para estabelecer uma infecção sistêmica, o vírus deve entrar em uma parte do sistema vascular da planta, como o floema. O tempo necessário para a infecção sistêmica pode variar de alguns dias a algumas semanas, dependendo do vírus, da espécie vegetal e das condições ambientais. O ciclo de vida do vírus é concluído quando ele é transmitido de uma planta infectada para uma planta saudável.
Exercício\(\PageIndex{5}\)
Qual é a estrutura e o genoma de um vírus vegetal típico?
Curva de crescimento viral
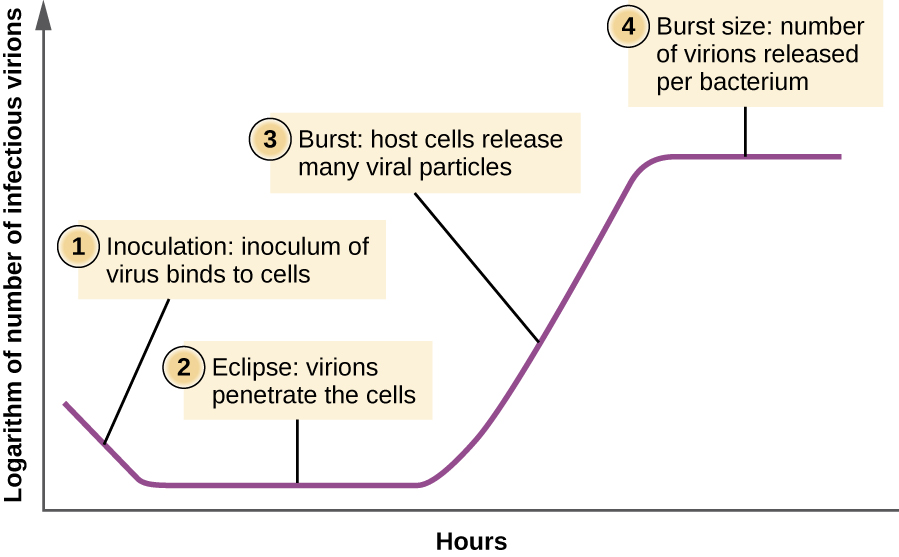
Ao contrário da curva de crescimento de uma população bacteriana, a curva de crescimento de uma população de vírus ao longo de seu ciclo de vida não segue uma curva sigmoidal. Durante o estágio inicial, um inóculo de vírus causa infecção. Na fase de eclipse, os vírus se ligam e penetram nas células sem detectar vírions no meio. A principal diferença que aparece a seguir na curva de crescimento viral em comparação com uma curva de crescimento bacteriano ocorre quando os vírions são liberados da célula hospedeira lisada ao mesmo tempo. Essa ocorrência é chamada de explosão, e o número de viriões por bactéria liberada é descrito como o tamanho da explosão. Em uma curva de multiplicação de uma etapa para o bacteriófago, as células hospedeiras se lisam, liberando muitas partículas virais para o meio, o que leva a um aumento muito acentuado no título viral (o número de viriões por unidade de volume). Se nenhuma célula hospedeira viável permanecer, as partículas virais começam a se degradar durante o declínio da cultura (veja a Figura\(\PageIndex{8}\)).
Exercício\(\PageIndex{6}\)
Qual aspecto do ciclo de vida de um vírus leva ao aumento repentino na curva de crescimento?
Tratamentos não registrados
O ebola é incurável e mortal. O surto na África Ocidental em 2014 foi sem precedentes, superando outras epidemias de ebola humano no nível de mortalidade. Dos 24.666 casos suspeitos ou confirmados relatados, 10.179 pessoas morreram. 1
Não há tratamentos ou vacinas aprovados para o Ebola disponíveis. Embora alguns medicamentos tenham demonstrado potencial em estudos de laboratório e modelos animais, eles não foram testados em humanos quanto à segurança e eficácia. Esses medicamentos não são apenas testados ou não registrados, mas também são escassos.
Dado o grande sofrimento e as altas taxas de mortalidade, é justo perguntar se medicamentos não registrados e não testados são melhores do que nenhum. Esses medicamentos devem ser dispensados e, em caso afirmativo, quem deve recebê-los, à luz de seus suprimentos extremamente limitados? É ético tratar medicamentos não testados em pacientes com Ebola? Por outro lado, é ético reter medicamentos potencialmente salvadores de vidas de pacientes moribundos? Ou talvez os medicamentos devam ser reservados para profissionais de saúde que trabalham para conter a doença?
Em agosto de 2014, dois trabalhadores humanitários americanos infectados e um padre espanhol foram tratados com o ZMapp, um medicamento não registrado que havia sido testado em macacos, mas não em humanos. Os dois trabalhadores humanitários americanos se recuperaram, mas o padre morreu. Mais tarde naquele mês, a OMS divulgou um relatório sobre a ética do tratamento de pacientes com o medicamento. Como o ebola costuma ser fatal, o painel argumentou que é ético administrar medicamentos não registrados e antiético retê-los por questões de segurança. Essa situação é um exemplo de “uso compassivo” fora do sistema bem estabelecido de regulação e governança das terapias.
Ebola nos EUA
Em 24 de setembro de 2014, Thomas Eric Duncan chegou ao Hospital Presbiteriano de Saúde do Texas, em Dallas, reclamando de febre, dor de cabeça, vômitos e diarreia — sintomas comumente observados em pacientes com gripe ou resfriado. Após o exame, um médico do pronto-socorro o diagnosticou com sinusite, prescreveu alguns antibióticos e o mandou para casa. Dois dias depois, Duncan retornou ao hospital de ambulância. Sua condição piorou e exames de sangue adicionais confirmaram que ele foi infectado com o vírus Ebola.
Investigações posteriores revelaram que Duncan tinha acabado de voltar da Libéria, um dos países em meio a uma grave epidemia de Ebola. Em 15 de setembro, nove dias antes de aparecer no hospital em Dallas, Duncan ajudou a transportar um vizinho com ebola para um hospital na Libéria. O hospital continuou a tratar Duncan, mas ele morreu vários dias depois de ser internado.
O cronograma do caso Duncan é indicativo do ciclo de vida do vírus Ebola. O tempo de incubação do Ebola varia de 2 dias a 21 dias. Nove dias se passaram entre a exposição de Duncan à infecção pelo vírus e o aparecimento de seus sintomas. Isso corresponde, em parte, ao período do eclipse no crescimento da população do vírus. Durante a fase do eclipse, Duncan teria sido incapaz de transmitir a doença a outras pessoas. No entanto, quando um indivíduo infectado começa a apresentar sintomas, a doença se torna muito contagiosa. O vírus Ebola é transmitido pelo contato direto com gotículas de fluidos corporais, como saliva, sangue e vômito. Duncan poderia ter transmitido a doença a outras pessoas a qualquer momento depois de começar a ter sintomas, presumivelmente algum tempo antes de sua chegada ao hospital em Dallas. Quando um hospital percebe que um paciente como Duncan está infectado com o vírus Ebola, o paciente é imediatamente colocado em quarentena e as autoridades de saúde pública iniciam um rastreamento nas costas para identificar todas as pessoas com quem um paciente como Duncan possa ter interagido durante o período em que ele estava apresentando sintomas.
As autoridades de saúde pública conseguiram rastrear 10 indivíduos de alto risco (membros da família de Duncan) e 50 indivíduos de baixo risco para monitorá-los quanto a sinais de infecção. Ninguém contraiu a doença. No entanto, uma das enfermeiras encarregadas dos cuidados de Duncan foi infectada. Isso, junto com o diagnóstico incorreto inicial de Duncan, deixou claro que os hospitais dos EUA precisavam fornecer treinamento adicional à equipe médica para evitar um possível surto de Ebola nos EUA.
Exercício\(\PageIndex{7}\)
- Que tipos de treinamento podem preparar os profissionais de saúde para conter epidemias emergentes, como o surto de Ebola de 2014?
- Qual é a diferença entre um patógeno contagioso e um patógeno infeccioso?

Para obter informações adicionais sobre o Ebola, visite o site do CDC.
Resumo
- Muitos vírus têm como alvo hospedeiros ou tecidos específicos. Alguns podem ter mais de um hospedeiro.
- Muitos vírus seguem vários estágios para infectar as células hospedeiras. Esses estágios incluem fixação, penetração, desrevestimento, biossíntese, maturação e liberação.
- Os bacteriófagos têm um ciclo lítico ou lisogênico. O ciclo lítico leva à morte do hospedeiro, enquanto o ciclo lisogênico leva à integração do fago no genoma do hospedeiro.
- Os bacteriófagos injetam DNA na célula hospedeira, enquanto os vírus animais entram por endocitose ou fusão de membrana.
- Os vírus animais podem sofrer latência, semelhante à lisogenia de um bacteriófago.
- A maioria dos vírus vegetais são ssRNA de cadeia positiva e podem sofrer infecção latente, crônica ou lítica, conforme observado em vírus animais.
- A curva de crescimento das populações de bacteriófagos é uma curva de multiplicação de uma etapa e não uma curva sigmoidal, em comparação com a curva de crescimento bacteriano.
- Os bacteriófagos transferem informações genéticas entre hospedeiros usando transdução generalizada ou especializada.
Notas de pé
- 1 Organização Mundial da Saúde. “Dados e estatísticas do ebola da OMS”. 18 de março de 2005. http://apps.who.int/gho/data/view.eb...150318? lang=pt


