19E: Mitambo ya Mpito na Kemia ya Uratibu (Mazoezi)
- Page ID
- 176667
19.1: Matukio, Maandalizi, na Mali ya Madini ya Mpito na Misombo Yao
Q19.1.1
Andika mipangilio ya elektroni kwa kila moja ya mambo yafuatayo:
- Sc
- Ti
- Cr
- Fe
- Ru
S19.1.1
Configuration ya elektroni ya atomi ni uwakilishi wa utaratibu wa elektroni kusambazwa kati ya shells orbital na ndogo shells. Configuration ya elektroni ya kila elementi ni ya pekee kwa msimamo wake kwenye meza ya mara kwa mara ambapo kiwango cha nishati kinatambuliwa na kipindi na idadi ya elektroni hutolewa na namba atomia ya elementi. Kuna aina nne tofauti za orbitali (s, p, d, na f) ambazo zina maumbo tofauti na kila orbital zinaweza kushikilia kiwango cha juu cha elektroni 2, lakini orbitali p, d na f zina viwango vidogo tofauti, maana yake ni kwamba wana uwezo wa kushikilia elektroni zaidi.
Jedwali la mara kwa mara limevunjwa katika makundi ambayo tunaweza kutumia ili kuamua orbitals na hivyo, kuandika usanidi wa elektroni:
Kikundi cha 1 & 2: S orbital
Kikundi 13 - 18: P orbital
Kikundi 3 - 12: D orbital
Lanthanide & Actinides: F orbital
Kila orbital (s, p, d, f) ina idadi kubwa ya elektroni ambayo inaweza kushikilia. Njia rahisi ya kukumbuka upeo wa elektroni wa kila mmoja ni kuangalia meza ya mara kwa mara na kuhesabu idadi ya vipindi katika kila mkusanyiko wa vikundi.
Kikundi 1 & 2:2 (2 elektroni jumla = 1 orbital x max ya elektroni 2 = 2 elektroni)
Kikundi 13 - 18:6 (jumla ya elektroni 6 = orbitals 3 x 2 elektroni max = 6 elektroni)
Kikundi 3 - 12:10 (elektroni 10 jumla = 5 orbitals x 2 elektroni max = elektroni 10)
Lanthanide & Actinides: 14 (14 elektroni jumla = 7 orbitals x 2 elektroni max = 14 elektroni)
Electron inajaza orbitals katika muundo maalum unaoathiri utaratibu ambao matoleo ya muda mrefu yameandikwa:
Mchoro wa kujaza elektroni: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f
Njia rahisi na ya haraka ya kuandika usanidi wa elektroni ni kutumia usanidi wa gesi yenye heshima kama kupunguzwa kwa muda mfupi. Tunaweza kufanya hivyo kwa sababu mazungumzo ya elektroni ya gesi yenye heshima daima yana orbitals zote zilizojaa.
yeye: 1s 2 2s 2
Mpya: 1s 2 2 2s 2 2p 6
Ar: 1s 2 2s 2 2p 6 3s 2 3p 6
Kr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Xe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6
Rn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6
Configuration ya kawaida ya gesi yenye sifa nzuri hutumiwa ni Ar. Unapotaka kutumia muundo wa gesi mzuri wa muda mfupi, unaweka ishara ya gesi yenye heshima ndani ya mabano:
[Ar]
na kisha kuandika kabla ya mapumziko ya Configuration, ambayo ni tu orbitals kuendelea baada ya ile ya gesi vyeo.
sc
Hebu tuanze kwa kutambua wapi Scandium anakaa kwenye meza ya mara kwa mara: mstari wa 4, kikundi cha 3. Kitambulisho hiki ni msingi muhimu tunahitaji kuandika usanidi wake wa elektroni.
Kwa kuangalia namba atomiki ya Scandium, 21, inatupa idadi ya protoni na idadi ya elektroni. Mwishoni mwa kuandika usanidi wake wa elektroni, elektroni inapaswa kuongeza hadi 21.
Katika mstari wa 4, kikundi cha 3 Sc, ni chuma cha mpito; maana yake ya usanidi wa elektroni utajumuisha D orbital.
Sasa, tunaweza kuanza hawawajui elektroni 21 ya Sc kwa orbitals. Kama kuwapa elektroni kwa orbitals yao, wewe hoja haki katika meza ya mara kwa mara.
Elektroni zake za kwanza 2 ziko katika orbital ya 1s ambayo inaashiria kama
1s 2
ambapo “1" iliyotangulia s inaashiria ukweli kwamba ni ya mstari mmoja, na ina exponent ya 2 kwa sababu inatimiza s orbital ya upeo elektroni idadi. Sasa tuna elektroni 21-2=19 zaidi ya kuwapa.
Elektroni zake za pili 2 ziko katika orbital ya 2s ambayo inaashiria kama
2s 2
ambapo “2" iliyotangulia s inaonyesha kwamba ni ya mstari mbili, na ina exponent ya 2 kwa sababu inatimiza s orbital ya upeo elektroni idadi. Sasa tuna elektroni 19-2=17 zaidi ya kuwapa.
Elektroni zake 6 zifuatazo ziko katika orbital 2p ambayo inaashiria kama
2p 6
ambapo “2" iliyotangulia p inaonyesha kuwa ni ya mstari wa mbili, na ina exponent ya 6 kwa sababu inatimiza idadi ya juu ya elektroni ya p orbital. Sasa tuna elektroni 17-6=11 zaidi ya kugawa.
Elektroni zake za pili 2 ziko katika orbital ya 3s ambayo inaashiria kama
3s 2
ambapo “3" iliyotangulia s inaonyesha kwamba ni ya mstari wa tatu, na ina exponent ya 2 kwa sababu inatimiza s orbital ya upeo elektroni idadi. Sasa tuna elektroni 11-2=9 zaidi ya kuwapa.
Elektroni zake 6 zifuatazo ziko katika orbital ya 3p ambayo inaashiria kama
3p 6
ambapo “3" iliyotangulia p inaonyesha kuwa ni ya mstari wa tatu, na ina kielelezo cha 6 kwa sababu inatimiza idadi ya juu ya elektroni ya p orbital. Sasa tuna elektroni 9-6=3 zaidi ya kuwapa.
Elektroni zake za pili 2 ziko katika orbital ya 4s ambayo inaashiria kama
4s 2
ambapo “4" iliyotangulia s inaonyesha kwamba ni ya mstari wa nne, na ina exponent ya 2 kwa sababu inatimiza s orbital ya upeo elektroni idadi. Sasa tuna 3-2=1 elektroni zaidi ya kugawa.
Electron yake ya mwisho ingekuwa peke yake katika orbital ya 3 d ambayo inaashiria kama
3d 1
ambapo “3" iliyotangulia d inaonyesha kwamba, ingawa ni kitaalam ya mstari wa 4, kwa kupuuza mstari wa kwanza wa H na Yeye, hii ni mstari wa tatu na ina exponent ya 1 kwa sababu kuna elektroni 1 tu kuwekwa katika d orbital. Sasa tumewapa elektroni zote kwa orbitals zinazofaa na vidogo vidogo, ili usanidi wa mwisho, wote wa elektroni umeandikwa kama:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Hii ni toleo la muda mrefu la usanidi wake wa elektroni.
Hivyo kwa Sc, toleo lake la muda mfupi la usanidi wake wa elektroni ingekuwa:
[ar] 4s 2 3d 1
b Ti
Anza mbali kwa kutambua ambapo Titanium anakaa kwenye meza ya mara kwa mara: mstari wa 4, kikundi cha 4, maana yake ina elektroni 22 jumla. Titanium ni kipengele kimoja na haki ya Sc tatizo la awali, kwa hiyo tutatumia njia sawa isipokuwa, mwishoni, kutakuwa na elektroni 2 zilizobaki, hivyo kwa hiyo orbital ya mwisho itaonyeshwa kama:
3d 2
Ikiwa inahitajika, angalia hapo juu kwa hatua halisi za jinsi ya kufanya hivyo kwa undani tena; usanidi wa elektroni wa muda mrefu wa Titanium utakuwa:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Hivyo kwa Ti, toleo lake la mkono mfupi la usanidi wake wa elektroni ingekuwa:
[ar] 4s 2 3d 2
c. cr
Anza kwa kutambua ambapo Chromium anakaa kwenye meza ya mara kwa mara: mstari wa 4, kikundi cha 6, hiyo ina maana ina jumla ya elektroni 24. Lakini kwanza, Cr, pamoja na Mo, Nb, Ru, Rh, Pd, Cu, Sg, Pt na Au, ni kesi maalum. Ungefikiri kwamba kwa kuwa ina elektroni 24 kwamba usanidi wake utaonekana kama:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4
ambayo ni jinsi tulivyojifunza hapo awali. Hata hivyo, usanidi huu wa elektroni hauwezi kushikamana kwa sababu ya ukweli kwamba kuna elektroni 4 katika orbital yake ya 3 d. Configurations imara zaidi ni nusu kujazwa (d 5) na orbitals kamili (d 10), hivyo mambo na elektroni kusababisha kuishia na d 4 au d 9 ni hivyo imara kwamba sisi kuandika fomu yake imara badala, ambapo elektroni kutoka orbital iliyotangulia itakuwa wakiongozwa kujaza orbital d, kusababisha orbital imara.
Ikiwa inahitajika, angalia hapo juu kwa hatua halisi za jinsi ya kufanya mwanzo wa usanidi kwa undani tena. Hata hivyo tunapaswa kufuta utawala mpya ili kufikia utulivu ili usanidi wa elektroni wa muda mrefu wa Chromium utakuwa:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Hivyo kwa Cr, toleo lake la muda mfupi la usanidi wake wa elektroni ingekuwa:
[ar] 4s 1 3d 5
d.
Anza mbali kwa kutambua ambapo Iron anakaa kwenye meza ya mara kwa mara: mstari wa 4, kikundi cha 8, maana yake ina elektroni 26 jumla. Hii ni vipengele 5 kwa haki ya Sc ya tatizo la awali, kwa hiyo tutatumia njia sawa isipokuwa, mwishowe, kutakuwa na elektroni 6 zilizobaki, hivyo kwa hiyo orbital ya mwisho itaonyeshwa kama:
3d 6
Ikiwa inahitajika, angalia hapo juu kwa hatua halisi za jinsi ya kufanya hivyo kwa undani tena; Configuration ya elektroni ya muda mrefu kwa Iron itakuwa:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Hivyo kwa Fe, toleo lake la muda mfupi la usanidi wake wa elektroni ingekuwa:
[ar] 4s 2 3d 6
e. Ru
Anza kwa kutambua wapi Ruthenium anakaa kwenye meza ya mara kwa mara: mstari wa 5, kikundi cha 8, hiyo ina maana ina jumla ya elektroni 44. Lakini kwanza, kama ilivyoelezwa hapo awali, Ru, pamoja na Cr, Mo, Nb, Rh, Pd, Cu, Sg, Pt na Au, ni kesi maalum. Ungefikiri kwamba kwa kuwa ina elektroni 44 kwamba usanidi wake utaonekana kama:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 6
ambayo ni jinsi tulivyojifunza hapo awali. Hata hivyo, usanidi huu wa elektroni hauna msimamo sana kwa sababu ya ukweli kwamba, ingawa kuna elektroni 4 zilizounganishwa, pia kuna elektroni 4 zisizo na nguvu. Hii matokeo katika Configuration imara sana, hivyo kurejesha utulivu, tuna kutumia Configuration ambayo ina zaidi paired elektroni, ambayo itakuwa kuchukua elektroni kutoka s orbital na kuiweka katika d orbital kujenga:
5s 1 4d 7
Ikiwa inahitajika, angalia hapo juu kwa hatua halisi za jinsi ya kufanya mwanzo wa usanidi kwa undani tena. Hata hivyo tunapaswa kufuta utawala mpya ili kufikia utulivu ili usanidi wa elektroni wa muda mrefu kwa Ru utakuwa:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7
Hivyo kwa Cr, toleo lake la muda mfupi la usanidi wake wa elektroni ingekuwa:
[Kr] 5s 1 4d 7
A19.1.1
- Sc: [Ar] 4 s 2 3 d 1
- Kidokezo: [Ar] 4 s 2 3 x 2
- Gari: [Ar] 4 s 1, 3 d 5
- Fe: [Ar] 4 s 2 3 d 6
- Ru: [Kr] 5 s 1 4 d 7 (Configuration ajabu)
Q19.1.2
Andika mipangilio ya elektroni kwa kila moja ya mambo yafuatayo na ions zake:
- Ti
- Ti 2+
- Ti 3+
- Ti 4+
S19.1.2
Electroni ni kusambazwa katika orbitals Masi,\(s, p, d, and f\) vitalu. Orbital itakuwa na idadi mbele yake na barua ambayo inalingana na block. Kizuizi cha s kinashikilia elektroni mbili, kizuizi cha p kinashikilia sita, block d inashikilia kumi, na block f ina kumi na nne. Kwa hiyo, kulingana na idadi ya elektroni atomi ina, orbitali za Masi hujazwa kwa namna fulani. Utaratibu wa orbitals ni\(1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p\). Kielelezo kitawekwa baada ya barua kwa kila orbital kuashiria jinsi elektroni nyingi ziko katika orbital hiyo. Noble gesi nukuu pia inaweza kutumika kwa kuweka gesi vyeo kabla ya kipengele wewe ni kuandika Configuration kwa, na kisha kuendelea kwa kuandika orbitals kujazwa baada ya gesi vyeo. Chuma ions ya d-block itakuwa na elektroni mbili kuondolewa kutoka kuzuia s kabla ya elektroni yoyote kuondolewa kutoka kuendelea d-block.
Ufumbuzi:
1. \(Ti\)
Titanium ina namba atomia ya 22, maana yake ina elektroni 22. Gesi nzuri kabla ya Titanium ni Argon. Kuangalia mstari wa 4 wa meza ya mara kwa mara, Titanium bado ina elektroni 4 zinazowekwa katika orbitals tangu Argon ina elektroni 18 ambazo tayari zimewekwa. Electroni zilizobaki zitajaza\(4s\) orbital na elektroni mbili zilizobaki zitaingia kwenye\(3d\) orbital. [ar] 4s 2 3d 2
2. \(Ti^{+2}\)
Hii ni ioni yenye malipo ya pamoja na 2, maana ya elektroni 2 zimeondolewa. Electroni zitaondolewa kwenye\(4s\) orbital na elektroni 2 zilizobaki zitawekwa kwenye\(3d\) orbital. Kama namba 1, gesi ya awali yenye heshima ni Argon. [ar] 3d 2
3. \(Ti^{+3}\)
Hii ni ioni yenye malipo ya pamoja na 3, maana ya elektroni 3 zimeondolewa. Electroni 2 za kwanza zitaondolewa kwenye\(4s\) orbital, na ya tatu itachukuliwa kutoka\(3d\) orbital, na elektroni iliyobaki 1 itawekwa kwenye orbital 3d. Kama namba 1, gesi ya awali yenye heshima ni Argon. [ar] 3d 1
4. \(Ti^{+4}\)
Hii ni ioni yenye malipo ya pamoja na 4, maana ya elektroni 4 zimeondolewa. Electroni 2 za kwanza zitaondolewa kwenye\(4s\) orbital na 2 ya pili itaondolewa kwenye\(3d\) orbital. Hii inasababisha ion kuwa na usanidi sawa wa elektroni kama Argon. [Ar]
Majibu:
- \([Ar]4s^23d^2\)
- \([Ar]3d^2\)
- \([Ar]3d^1\)
- \([Ar]\)
A19.1.2
- \([Ar]4s^2 3d^2\)
- \([Ar]3d^2\)
- \([Ar]3d^1\)
- \([Ar]\)
Q19.1.3
Andika usanidi wa elektroni kwa kila moja ya vipengele vifuatavyo na ions zake 3+:
- La
- Sm
- Lu
S19.1.3
Ili kuandika usanidi wa elektroni, tunaanza kwa kutafuta kipengele kwenye meza ya mara kwa mara. Kwa kuwa La, Sm, na Lu wote ni kipindi chini ya Xenon ya gesi yenye heshima, tunaweza kufupisha\({1s^2}{2s^2}{2p^6}{3s^2}{3p^6}{3d^{10}}{4s^2}{4p^6}{4d^{10}}{5s^2}{5p^6}\) kama [Xe] wakati wa kuandika usanidi wa orbital. Kisha tunapata iliyobaki ya usanidi wa orbital kwa kutumia Kanuni ya Aufbau. Kwa vipengele vingine sio tu wale walio katika kipindi cha 6, notation ya shorthand kwa kutumia gesi nzuri itakuwa gesi yenye heshima katika kipindi cha juu ya kipengele kilichopewa.
1. La ina elektroni tatu za ziada. Wawili wao hujaza shell ya 6s na elektroni nyingine moja imewekwa kwenye shell ya 5d.
\(La:\)[Xe]\({6{s}^2} {5{d}^1}\)
2. Sm ina elektroni nane zaidi. Orbital ya 6s imejaa kama hapo awali na orbital 4f inapokea elektroni 6 kwa sababu elektroni za kuunganisha zinahitaji nishati ya chini kwenye shell ya 4f kuliko kwenye ganda la 5d.
\(Sm:\)[Xe]\({6{s}^2} {4{f}^6}\)
3. Lu ina elektroni kumi na saba zaidi. Electroni mbili zinajaza orbital ya 6s, elektroni 14 zinajaza orbital ya 4f, na elektroni moja ya ziada inakwenda kwenye orbital ya 5d.
\(Lu:\)[Xe]\({6s^2}{4f^{14}}{5d^1}\)
Ili kupata usanidi wa elektroni wa ioni 3+, tunaondoa elektroni 3 kutoka kwa usanidi wa neutral, kuanzia na orbital ya 6s.
1. Ionization ya La 3+ huondoa elektroni tatu za ziada. Hivyo ni reverts nyuma Configuration imara Xenon.
\({La^{3+}:}\)[Xe]
2. Ionization ya Sm 3+ huondoa elektroni mbili kutoka kwenye shell ya 6s na moja kutoka shell ya nje (4f)
\({Sm^{3+}}:\)[Xe]\({4f^5}\)
3. Ionization ya Lu 3+ huondoa shell yake miwili ya 6s na moja kutoka kwenye shell ya nje (5d), na kuacha tu shell kamili ya 4f
\(Lu^{3+}:\)[Xe]\(4f^{14}\)
A19.1.3
La: [Xe] 6 s 2, 5 d 1, La 3+: [Xe]; Sm: [Xe] 6 s 2, 4 x 6, Sm 3+: [Xe] 4 f 5; Lu: [Xe] 6 s 2 4 f 14 5 d 1, Lu 3+: [Xe] 4 ya 14
Q19.1.4
Kwa nini vipengele vya lanthanoid havipatikani katika asili katika fomu zao za msingi?
A19.1.4
Lanthanides haipatikani mara kwa mara katika fomu zao za msingi kwa sababu zinawapa elektroni zao kwa vipengele vingine vya electronegative zaidi, na kutengeneza misombo badala ya kukaa katika fomu safi ya msingi. Wana mali sawa za kemikali na kila mmoja, mara nyingi hupatikana ndani ya dunia, na vigumu kuchimba. Wao ni mambo ya ndani ya mpito na kuwa sehemu kujazwa d orbitals ambayo inaweza kuchangia elektroni. Kwa sababu ya hili, wao ni tendaji sana na electropositive.
Q19.1.5
Ni ipi kati ya mambo yafuatayo yanayotumiwa kutayarisha La kwa kupunguza La 2 O 3: Al, C, au Fe? Kwa nini?
S19.1.5
Mfululizo wa shughuli ni orodha ya vipengele katika utaratibu wa kupungua kwa reactivity yao. Elements juu ya orodha ni nzuri kupunguza mawakala kwa sababu urahisi kutoa juu ya elektroni, na mambo ya chini ya mfululizo ni nzuri oxidizing mawakala kwa sababu wao ni sana electronegative ingekuwa kweli wanataka kukubali elektroni.
hatua 1: Linganisha Aluminium, Carbon, na Iron juu ya mfululizo shughuli. Mfululizo wa shughuli nyingi ni pamoja na kaboni na hidrojeni kama kumbukumbu. Mfululizo wa shughuli unaweza kupatikana hapa
Mfululizo wa shughuli huenda kwa utaratibu (kutoka juu hadi chini): Aluminium, Carbon, na Iron.
Hatua ya 2: Tambua kipengele ambacho ni wakala bora wa kupunguza.
Elements juu ya orodha ni mawakala bora kupunguza, kwa sababu wao kutoa elektroni bora.
Aluminium ni wakala bora wa kupunguza chaguzi zilizopo.
Kwa hiyo alumini itakuwa wakala bora wa kupunguza kuandaa La kwa kupunguza La 2 O 3 kwa sababu ni tendaji zaidi katika mfululizo miongoni mwa vipengele vitatu.
A19.1.5
Al hutumiwa kwa sababu ni wakala wa kupunguza nguvu zaidi na chaguo pekee lililoorodheshwa ambalo linaweza kutoa nguvu ya kutosha ya kuendesha gari ili kubadilisha La (III) kuwa La.
Q19.1.6
Ni ipi kati ya yafuatayo ni wakala mwenye nguvu zaidi:\(\ce{VO4^{3-}}\),\(\ce{CrO4^2-}\), au\(\ce{MnO4-}\)?
S19.1.6
Wakala oxidizing oxidize vitu vingine. Kwa maneno mengine, hupata elektroni au hupunguzwa. Wakala hawa wanapaswa kuwa katika hali yao ya juu ya oxidation. Ili kuamua, nguvu ya misombo hapo juu kama mawakala oxidizing, kuamua idadi oxidation ya kila vipengele constituent.
\(\\\mathrm{VO_4^{3-}}\)
Tunajua kwamba\(\mathrm{O}\) ina hali ya oxidation -2 na malipo ya jumla ya ion ni -3. Tunahitaji tu kuamua nambari ya oxidation ya Vanadate katika kiwanja hiki.
\(\\\mathrm{V} + \mathrm{-2(4)} = \mathrm{-3}\)
\(\\\mathrm{V} = \mathrm{+5}\)
Vanadate ina idadi ya oxidation ya +5, ambayo ni hali yake ya juu zaidi ya oxidation.
\(\\\mathrm{CrO_4^{2-}}\)
Kama ilivyo katika hesabu ya awali,\(\mathrm{O}\) ina hali ya oxidation -2. Malipo ya jumla ni -2. Hivyo hesabu kwa chromium.
\(\\\mathrm{Cr} + \mathrm{-2(4)} = \mathrm{-2}\)
\(\\\mathrm{Cr} = \mathrm{+6}\)
Chromium iko katika hali yake ya juu zaidi ya oxidation ya +6 katika kiwanja hiki.
\(\\\mathrm{MnO_4^-}\)
\(\mathrm{O}\)ina hali ya oxidation -2 na malipo ya jumla ni -1.
\(\\\mathrm{Mn} + \mathrm{-2(4)} = \mathrm{-1}\)
\(\\\mathrm{Mn} = \mathrm{+7}\)
Manganese pia iko katika hali yake ya juu ya oxidation, +7.
Wakala wa oxidizing anaweza kupata elektroni ambayo, kwa upande wake, inapunguza hali yake ya oxidation. Hapa manganese ina hali kubwa ya oxidation ambayo inaruhusu kupata upungufu mkubwa katika hali yake ya oxidation ikiwa inahitajika, maana yake inaweza kupata elektroni zaidi. Hivyo kati ya misombo mitatu,\(\mathrm{MnO_4^-}\) ni wakala mwenye nguvu zaidi wa oxidizing. Njia hii inachukua metali zina shughuli za elektronegativities sawa.
Vinginevyo, angalia meza ya redox.
A19.1.6
\(MnO_4^-\)
Q19.1.7
Ni ipi kati ya vipengele vifuatavyo vinavyoweza kuunda oksidi na formula MO 3: Zr, Nb, au Mo?
S19.1.7
Mo kwa sababu Zr ina hali ya oxidation ya +4 na Nb ina hali ya oxidation ya +5 na wale wasingeweza kusawazisha malipo ya oksijeni 3 katika hali ya -2 ambayo inajenga malipo ya -6. Mo hata hivyo ina mataifa mengi ya oxidation, kuwa ya kawaida +6 ambayo mizani nje ya malipo -6 iliyoundwa na ions 3 oksijeni. Hii ndiyo sababu kuna uwezekano mkubwa wa kuunda oksidi na formula MO 3 au\(\ce{MoO3}\).
A19.1.7
Mo
Q19.1.8
Athari zifuatazo zote hutokea katika tanuru ya mlipuko. Ni ipi kati ya haya ni athari za redox?
- \(\ce{3Fe2O3}(s)+\ce{CO}(g)⟶\ce{2Fe3O4}(s)+\ce{CO2}(g)\)
- \(\ce{Fe3O4}(s)+\ce{CO}(g)⟶\ce{3FeO}(s)+\ce{CO2}(g)\)
- \(\ce{FeO}(s)+\ce{CO}(g)⟶\ce{Fe}(l)+\ce{CO2}(g)\)
- \(\ce{C}(s)+\ce{O2}(g)⟶\ce{CO2}(g)\)
- \(\ce{C}(s)+\ce{CO2}(g)⟶\ce{2CO}(g)\)
- \(\ce{CaCO3}(s)⟶\ce{CaO}(s)+\ce{CO2}(g)\)
- \(\ce{CaO}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l)\)
S19.1.8
o kutambua redox mmenyuko, tuna kuamua kama kuwa na kuona kama equation ni oxidation kupunguza mmenyuko-maana kwamba aina ni kubadilisha hali oxidation wakati wa mmenyuko, ambayo inahusisha uhamisho wa elektroni kati ya aina mbili. Ikiwa spishi inapoteza elektroni, basi spishi hiyo inaoksidishwa. Kama spishi inapata elektroni, basi spishi hiyo inapunguzwa. Njia ya kukumbuka hii ni kutumia vifupisho OIL RIG. Juu ya oxidation mimi ni kupoteza L, na R elimu - I ni GG maumivu, akimaanisha elektroni. Hizi zote mbili zinapaswa kutokea kwa equation kuwa mmenyuko wa redox. Hebu tuone kama equations hizi ni athari za redox au la:
a Katika upande wa reactants\(\ce{Fe2O3}\), Fe ina idadi ya oxidation ya +3. Katika bidhaa\(\ce{Fe3O4}\), Fe ina idadi ya oxidation ya +2.67. Tangu Fe ilibadilika kutoka +3 hadi +2.67, tunaweza kusema kwamba Fe alikuwa amepata elektroni na hivyo kupunguzwa. Katika reactant, CO, kaboni ina idadi ya oxidation ya +2, na katika\(\ce{CO2}\) (bidhaa) kaboni ina idadi ya oxidation ya +4. Kwa hiyo kaboni imepoteza elektroni na imeoksidishwa. Kwa kuwa kuna oxidation na kupunguza aina- tunaweza kuhitimisha kuwa hii ni mmenyuko wa redox.
b Katika reactant\(\ce{Fe3O4}\), Fe ina idadi ya oxidation ya +2.67. Katika bidhaa, FeO, Fe ina idadi ya oxidation ya +2. Tangu oxidation ya Fe imebadilika kutoka +2.67 hadi +2, elektroni zimeongezwa kwa hiyo Fe imepunguzwa. Katika reactant, CO, kaboni ina idadi ya oxidation ya +2, na katika\(\ce{CO2}\) (bidhaa) kaboni ina idadi ya oxidation ya +4. Kwa hiyo kaboni imepoteza elektroni na imeoksidishwa. Kwa kuwa kuna oxidation na kupunguza aina- tunaweza kuhitimisha kuwa hii ni mmenyuko wa redox.
c Katika upande wa reactant, katika FeO, Fe ina idadi ya oxidation ya +2 na katika upande wa bidhaa Fe ina idadi ya oxidation ya 0. Tangu idadi ya oksidi ya Fe ilibadilika kutoka +2 hadi 0, elektroni zimepatikana na kwa hiyo Fe imepunguzwa. Katika reactant, CO, kaboni ina idadi ya oxidation ya +2, na katika\(\ce{CO2}\) (bidhaa) kaboni ina idadi ya oxidation ya +4. Kwa hiyo kaboni imepoteza elektroni na imeoksidishwa. Kwa kuwa kuna oxidation na kupunguza aina- tunaweza kuhitimisha kuwa hii ni mmenyuko wa redox.
d Katika reactants C ina idadi ya oxidation ya 0, na katika upande wa bidhaa\(\ce{CO2}\), C ina idadi ya oxidation ya +4. Kwa kuwa idadi ya oxidation ya C imebadilika kutoka 0 hadi +4, tunaweza kusema kwamba C imekuwa oxidized. Katika reactants,\(\ce{O2}\) oksijeni ina idadi oxidation ya 0, na katika bidhaa CO2, oksijeni ina idadi oxidation ya -2. Kwa kuwa idadi ya oksijeni ya oksijeni imebadilika kutoka 0 hadi -2, oksijeni imepunguzwa. Kwa kuwa kuna oxidation na kupunguza aina- tunaweza kuhitimisha kuwa hii ni mmenyuko wa redox.
e Katika reactants\(\ce{CO2 }\) ina idadi ya oxidation ya +4, na katika upande wa bidhaa katika CO, C ina idadi ya oxidation ya +2. Tangu kaboni ilitoka +4 hadi +2, kaboni imepunguzwa. Katika reactants,\(\ce{CO2 }\) oksijeni ina idadi ya oxidation ya -4 na katika bidhaa CO carbon ina idadi oxidation ya -2. Tangu oksijeni iliondoka -4 hadi -2, imekuwa iliyooksidishwa. Kwa kuwa kuna oxidation na kupunguza aina- tunaweza kuhitimisha kuwa hii ni mmenyuko wa redox.
f. reactants,\(\ce{CaCO3}\) Ca ina idadi oxidation ya +2, na katika bidhaa CaO Ca ina oxidation idadi ya +2. Kwa kuwa idadi oxidization haina mabadiliko- tunaweza kuhitimisha kwamba equation hii si mmenyuko redox.
g Katika bidhaa CaO Ca ina idadi ya oxidation ya +2, na katika bidhaa\(\ce{CaSiO3}\) Ca ina idadi ya oxidation ya +2. Kwa kuwa idadi oxidization haina mabadiliko- tunaweza kuhitimisha kwamba equation hii si mmenyuko redox.
A19.1.8
a, b, c, d, e
Q19.1.9
Kwa nini malezi ya slag yanafaa wakati wa smelting ya chuma?
S19.1.9
Slag ni dutu iliyotengenezwa kama bidhaa ya madini ya chuma au pellets za chuma zinazoyeyuka pamoja katika tanuru ya mlipuko. Slag pia ni byproduct ambayo hutengenezwa wakati chuma taka imetenganishwa na madini yake ghafi. Ni muhimu kutambua kwamba slag kutoka kwa viwanda vya chuma huundwa kwa namna ambayo inapunguza kupoteza kwa madini ya chuma. \(\ce{CaSiO3}\)Slag ni ndogo kuliko chuma kilichochombwa, hivyo inaweza kutengwa kwa urahisi. Pia, floating slag safu inajenga kizuizi kwamba kuzuia chuma kuyeyuka kutoka yatokanayo na\(\ce{O2}\), ambayo oxidize\(\ce{Fe}\) nyuma kwa\(\ce{Fe2O3}\). Kwa kuwa Fe ina uwezo mdogo wa kupunguza -0.440 hii inamaanisha ina uwezo mkubwa wa oxidation hivyo ingekuwa oxidize kwa urahisi mbele ya O2. Kujenga kizuizi kati ya chuma na oksijeni inaruhusu bidhaa ya juu ya chuma kupatikana mwishoni mwa smelting.
A19.1.9
Slag ya CasIO 3 ni ndogo kuliko chuma kilichochombwa, hivyo inaweza kutenganishwa kwa urahisi. Pia, safu ya slag inayozunguka inajenga kizuizi kinachozuia chuma kilichochombwa kutoka kwenye O 2, ambayo ingeweza kuimarisha Fe nyuma ya Fe 2 O 3.
Q19.1.10
Je! Unatarajia ufumbuzi wa oksidi ya manganese yenye maji (VII) kuwa na pH kubwa au chini ya 7.0? Thibitisha jibu lako.
S19.1.10
Manganese (VII) oksidi, inaweza kuandikwa kama Mn 2 O 7.
Kuhusiana na nadharia ya asidi-msingi ya Lewis, asidi ya Lewis inakubali elektroni za jozi moja, na pia inajulikana kama mpokeaji wa jozi ya elektroni. Kulingana na nadharia hii, asidi inaweza kupimwa kwa uwezo wa elementi wa kukubali jozi za elektroni. Kwa kufanya hesabu, tunaona kwamba Manganese ina hali ya oxidation ya +7 (Oksijeni ina hali ya oxidation ya -2, na 2x-7=-14 au hii inaweza kuonyeshwa kama\(-7(2)+2(x)=0\) na\(x=7\) tangu kiwanja nzima ina malipo ya sifuri, ili kusawazisha malipo ya ion, Mn lazima awe +7). Kwa hiyo Mn ina uwezo mkubwa wa kukubali elektroni kutokana na chaji yake ya juu chanya. Kwa metali nyingi, kama idadi ya oxidation inavyoongezeka, ndivyo asidi yake, kwa sababu ya uwezo wake wa kuongezeka kwa kukubali elektroni.
A19.1.10
Kuhusiana na nadharia ya asidi-msingi ya Lewis, asidi ya Lewis inakubali elektroni za jozi moja; hivyo, inajulikana pia kama kikubali jozi ya elektroni. Hii inaweza kuwa aina yoyote ya kemikali. Acids ni vitu ambavyo vinapaswa kuwa chini kuliko 7. Kwa hiyo, oksidi za manganese zinaweza kuwa tindikali zaidi katika ufumbuzi (aq) ikiwa idadi ya oxidation inaongezeka.
Q19.1.11
Iron (II) inaweza kuwa oxidized kwa chuma (III) na ion dichromate, ambayo ni kupunguzwa kwa chromium (III) katika ufumbuzi asidi. Sampuli ya 2.5000-g ya madini ya chuma hupasuka na chuma hubadilishwa kuwa chuma (II). Hasa 19.17 ml ya 0.1000 M Na 2 Cr 2 O 7 inahitajika katika titration. Ni asilimia gani ya sampuli ya madini ilikuwa chuma?
S19.1.11
Ili kujibu swali hili, tunapaswa kwanza kutambua equation ya ionic wavu kutoka kwa athari za nusu zilizopewa. Tunaweza kuandika oxidation na kupunguza athari za nusu:
\[ \text{ oxidation:} \text{ Fe}^\text{ 2+} \rightarrow \text{ Fe}^\text{ 3+} \]
\[ \text{ reduction: }\ce{Cr2O7^2-} \rightarrow \text{ Cr}^\text{ 3+} \]
Tunaweza haraka kusawazisha oxidation nusu mmenyuko kwa kuongeza idadi sahihi ya elektroni kupata
\[ \text{ Fe}^\text{ 2+} \rightarrow \text{ Fe}^\text{ 3+}+\text{ e}^- \]
Hatua ya kwanza katika kusawazisha kupunguza nusu-mmenyuko ni kusawazisha mambo katika equation zaidi ya O na H. Kwa kufanya hivyo, tunapata
\[\ce{Cr2O7^2-} \rightarrow 2 \text{ Cr}^\text{ 3+} \]
Hatua ya pili itakuwa kuongeza molekuli ya maji ya kutosha kusawazisha oksijeni.
\[ \ce{Cr2O7^2-} \rightarrow 2 \text{ Cr}^\text{ 3+}+ \ce{7H2O} \]
Kisha, tunaongeza kiasi sahihi cha H + ili kusawazisha atomi za hidrojeni.
\[ \ce{Cr2O7^2-}+14 \text{ H}^+ \rightarrow 2 \text{ Cr}^\text{ 3+}+ \ce{7H2O} \]
Hatimaye, tunaongeza elektroni za kutosha kusawazisha malipo.
\[ \ce{Cr2O7^2-}+14 \text{ H}^++6 \text{ e}^- \rightarrow 2 \text{ Cr}^\text{ 3+}+ \ce{7H2O} \]
Electroni zinazohusika katika athari zote mbili za nusu lazima ziwe sawa ili tuunganishe mbili ili kupata equation ya ionic ya wavu. Hii inaweza kufanyika kwa kuzidisha kila equation kwa mgawo sahihi. Kuongeza oxidation nusu mmenyuko na 6, tunapata
\[ 6 \text{ Fe}^\text{ 2+} \rightarrow 6 \text{ Fe}^\text{ 3+}+6 \text{ e}^- \]
Sasa tunaweza kuchanganya athari zote mbili za nusu ili kupata
\[ 6 \text{ Fe}^\text{ 2+}+\ce{Cr2O7^2-}+14 \text{ H}^++6 \text{ e}^- \rightarrow 6 \text{ Fe}^\text{ 3+}+6 \text{ e}^-+2 \text{ Cr}^\text{ 3+}+ \ce{7H2O}\]
Electroni hufuta nje, ili uweze kupata:
\[ 6 \text{ Fe}^\text{ 2+}+\ce{Cr2O7^2-}+14 \text{ H}^+ \rightarrow 6 \text{ Fe}^\text{ 3+}+2 \text{ Cr}^\text{ 3+}+ \ce{7H2O}\]
Kutoka hili tunaweza kuona kwamba uwiano wa mole wa Cr 2 O 7 2- hadi Fe 2+ ni 1:6. Kutokana na kwamba 19.17 mL (au 0.01917 L) ya 0.01 M Na 2 Cr 2 O 7 ilihitajika kwa titration tunajua kwamba
\[ 0.01917\text{ L} \times 0.01 \text{ M} = 1.917 \times 10^{-4} \text{ mol} \]
ya Na 2 Cr 2 the 7 ilijibu. Pia, kwa kuwa idadi yoyote ya moles ya Na 2 Cr 2 O 7 hutoa idadi sawa ya moles ya Cr 2 O 7 2- katika suluhisho
\[ 1.917 \times 10^{-4} \text{ mol} \text{ of } \ce{Na2Cr2O7} =1.917 \times 10^{-4} \text{ mol} \text{ of } \ce{Cr2O7^2-}\]
Tunaweza kutumia uwiano wa mole wa Cr 2 O 7 2- hadi Fe 2+ ili kuamua ngapi moles ya chuma (ii) ilikuwa katika suluhisho. Idadi ya moles ya chuma (ii) ni sawa na idadi ya moles ya chuma safi katika sampuli kwani chuma zote zilibadilishwa kuwa chuma (ii).
\[ 1.917 \times 10^{-4} \text{ mol} \text{ of } \ce{Cr2O7^2-}\times \frac{6\text{ mol}\text{ of } \text{ Fe}^\text{ 2+}}{1\text{ mol}\text{ of }\ce{Cr2O7^2-}} = 0.0011502\text{ mol}\text{ of } \text{ Fe}^\text{ 2+} \]
\[ 0.0011502\text{ mol}\text{ of } \text{ Fe}^\text{ 2+} = 0.0011502\text{ mol}\text{ of } \text{ Fe} \]
Sasa tunaweza kupata idadi ya gramu za chuma ambazo zilikuwapo katika sampuli ya chuma ya 2.5 g.
\[ 0.0011502\text{ mol}\text{ of } \text{ Fe}\times\frac{55.847\text { g}}{1\text{ mol}} = 0.0642352194\text{ g}\text{ of }\text{ Fe} \]
Hatimaye, tunaweza kujibu swali na kupata asilimia gani ya sampuli ya madini ilikuwa chuma.
\[ \frac{0.0642352194\text{ g}}{2.5\text{ g}} \times 100 \approx 2.57\text{%} \]
Hivyo 2.57% ya sampuli ya madini ilikuwa chuma.
A19.1.11
2.57%
Q19.1.12
Ni ngapi futi za ujazo za hewa kwa shinikizo la torr 760 na 0 °C inahitajika kwa tani ya Fe 2 O 3 ili kubadilisha ile Fe 2 O 3 kuwa chuma katika tanuru ya mlipuko? Kwa zoezi hili, kudhani hewa ni 19% oksijeni kwa kiasi.
S19.1.12
Swali hili linatumia mfululizo wa mabadiliko ya kitengo na\(PV=nRT\) equation.
Hatua ya kwanza ni kuandika usawa wa kemikali ya usawa kwa uongofu wa Fe 2 O 3 kwa chuma safi.
\[2\;Fe_2O_3(s)\rightarrow 4\;Fe(s)+3\;O_2(g)\]
Kisha, tunahitaji kuchambua swali la awali ili kuamua thamani tunayohitaji kutatua. Kwa sababu swali linauliza thamani ya miguu ya ujazo, tunajua tunahitaji kutatua kwa kiasi. Tunaweza\(PV=nRT\) kuendesha kutatua kwa kiasi.
\[V={nRT}/P\]
Sasa tambua vigezo vinavyojulikana na ubadilishe kuwa vitengo ambavyo vitakuwa rahisi kukabiliana nazo.
\[n = 2000\:lbs\; Fe_2O_3\frac{453.592\: grams\: Fe_2O_3}{1\: lb \:Fe_2O_3}\frac{1\: mole \:Fe_2O_3}{159.69\: grams \:Fe_2O_3}\frac{3 \;moles\: O_2}{2\; moles \:Fe_2O_3}\]
\[n=8521\: moles\: of \:O_2\]
Badilisha kwa atm kwa mahesabu rahisi
\[R=\frac{.0821\:L\:atm}{mol\:K}\]
\[T=0^{\circ}C=273\:K\]
\[P=760 \:torr= 1 \:atm\]
Sasa kuziba namba katika sheria manipulated gesi kupata jibu kwa V.
\[V=190991.8\: liters \:of\: O_2\]
Kutoka hapa tunabadilisha lita kwa miguu ya ujazo.
tumia uongofu
\[1\;L=.0353 ft^3\]
hivyo tuna 6744.811 ft 3 ya O 2
Sisi kisha kurejea swali la awali na kukumbuka kwamba thamani hii ni 19% tu ya kiasi cha hewa jumla. Kwa hiyo tumia equation rahisi kuamua kiasi cha jumla cha hewa katika miguu ya ujazo.
\[6744.811ft^3=.19x\]
x=35499 ft 3 ya hewa
A19.1.12
35499 ft 3 ya hewa
Q19.1.13
Pata uwezekano wa seli ya electrochemical ifuatayo:
Cd | Cd 2+ (M = 0.10) 合 Ni 2+ (M = 0.50) | Ni
S19.1.13
Hatua ya 1 Andika nusu yako athari mbili na kutambua ambayo ni oxidation na ambayo ni kupunguza kwa kutumia kifupi OIL RIG kukumbuka kwamba oxidation ni hasara ya elektroni na kupunguza ni faida ya elektroni
Cd (s) Cd 2+ (aq) +2e - (oxidation)
Ni 2+ (q) +2e - ni (s) (kupunguza)
Hatua ya 2 Andika usawa kamili wa usawa
Cd (s) + Ni 2+ (aq) Cd 2+ (aq) +Ni (s)
Hatua ya 3: Pata E kwenye kiini
E o kiini = E cathode -E anode
oxidation: Cd (s) Cd 2+ (aq) +2e - E o =-0.40V
kupunguza: Ni 2+ (qq) +2e - ni (s) E o =-0.26V
* E maadili kuja kutoka kiwango kupunguza uwezo meza iliyotolewa hapo juu. Pia, kumbuka anode ndipo oxidation hutokea, na cathode ndipo kupunguza hutokea.
E o kiini = -0.26- (-.40)
E o kiini = 0.14V
Hatua ya 4 Pata Swali
Q= [bidhaa]/[reactants] (angalia usawa kamili wa usawa) (kumbuka kwamba [x] inamaanisha mkusanyiko wa x kawaida iliyotolewa katika molarity na kwamba sisi kupuuza yabisi au vinywaji)
Q= [Cd 2+]/[Ni 2+]
Q=0.10/0.50
Q=0.2
Hatua ya 5 Tumia E kutumia E= E o kiini - (.0592/n) LogQ (n ni idadi ya moles ya elektroni iliyohamishwa na kwa upande wetu majibu ya uwiano huhamisha elektroni 2)
E= 0.14- (.0592/2) logi (0.2)
E= 0.14- (-.207)
E=0.16 V
A19.1.13
0.16 V
Q19.1.14
Sampuli ya 2.5624-g ya kloridi safi ya alkali ya chuma hupasuka katika maji na kutibiwa na nitrati ya ziada ya fedha. Kutokana na precipitate, kuchujwa na kavu, uzito 3.03707 g Nini ilikuwa asilimia kwa wingi wa ioni kloridi katika kiwanja awali? Je! Ni utambulisho gani wa chumvi?
S19.1.14
Sampuli ya 2.5624-g ya kloridi safi ya alkali ya chuma hupasuka katika maji na kutibiwa na nitrati ya ziada ya fedha. Kutokana na precipitate, kuchujwa na kavu, uzito 3.03707 g Nini ilikuwa asilimia kwa wingi wa ioni kloridi katika kiwanja awali? Je! Ni utambulisho gani wa chumvi?
Kutokana kwamba chuma kloridi ni xCl
Equation usawa kwa majibu itakuwa:
\[XCl(aq)+AgNO_{3}(aq)\rightarrow XNO_{3}(aq) +AgCl(s)\]
Masi ya AgCl = 3.03707g
Ili kupata moles ya AgCl sasa:
Kisha, tunaweza kuamua moles ya AgCl iliyopo katika mmenyuko tangu 1) umati wa precipitate umetolewa kwetu na 2) thamani hii inaweza kutusaidia kuamua moles ya kiwanja cha alkali chuma chloride sasa. Kutokana na uzito wa AgCl ni 3.03707g katika tatizo na molekuli ya molekuli ya AgCl kwa mole ni 143.32g, tunaweza kutatua kwa ngapi moles ya AgCl iko katika mmenyuko:
\[moles of Agcl=\tfrac{3.03707g}{143.32g/mol}=0.0211 mol\]
Kwa kuwa uwiano wa molar wa misombo ni 1:1, hivyo idadi ya moles ya xCl kutumika = 0.0211 mol
Tunaweza kuhesabu uzito wa Cl - na equation:
\[0.0211 mol \times 35.5g/mol = 0.7490g\]
kiasi cha chuma kilichopo katika kiwanja cha awali ni uzito wa kiwanja kilichoondolewa kwa uzito wa ion ya Cl:
\[(2.5624- 0.7490)g= 1.8134g\]
Na asilimia inaweza kuwa mahesabu kwa
\[\frac{0.7490}{2.5624}\times 100= 29.23 \%\]
uwiano wa molar wa xCl ni 1:1 hivyo basi
Masi ya atomiki ya chuma =\(=\frac{1.8134\;g\; metal}{0.0211\; mol\; RbCl}=85.943g/mol\)
Hivyo masi atomia ni 85.943 g/mol, ambayo ni ya Rb, hivyo utambulisho wa chumvi ni rbCl.
Q19.1.15
Uwezo wa kupunguza kiwango cha mmenyuko\(\ce{[Co(H2O)6]^3+}(aq)+\ce{e-}⟶\ce{[Co(H2O)6]^2+}(aq)\) ni kuhusu 1.8 V. uwezekano wa kupunguza majibu\(\ce{[Co(NH3)6]^3+}(aq)+\ce{e-}⟶\ce{[Co(NH3)6]^2+}(aq)\) ni +0.1 V. mahesabu ya uwezo wa seli kuonyesha kama ions tata, [Co (H 2 O) 6] 2+ na/au [Co (NH 3) 6] 2+, inaweza kuwa oxidized kwa cobalt sambamba (III) tata na oksijeni.
S19.1.15
Ili kuhesabu uwezo wa seli, tunahitaji kujua uwezekano wa kila mmenyuko wa nusu. Baada ya kufanya hivyo, tunahitaji kuamua ni nani anayeoksidishwa na ni nani anayepunguzwa. Yule ambayo ni oxidized ni anode na ile iliyopunguzwa ni cathode. Ili kupata uwezo wa seli, unatumia formula hii na maadili ya kupunguza uwezo hupatikana katika meza ya kupunguza uwezo. Ikiwa seli ya E° ni chanya,\(\Delta\) G ni hasi na mmenyuko ni wa pekee.
E° kiini = E°cathode - E° anode
Kwa sababu inasema kwamba\([Co(H_{2}O)_{6}]^{3+}\) itakuwa oxidized, hii ina maana ni anode.
\(O_{2}(g) + 4 H^{+}(aq) + 4 e^{-} \rightarrow 2 H_{2}O\)+1.229 V
\(O_{2}\)ni kuwa kupunguzwa, hivyo ni cathode.
1.229V - 1.8V = -.571 V, au -0.6 V kwa kutumia takwimu muhimu. Hii haiwezi kutokea kwa hiari kwa sababu seli ya E° ni hasi.
Kwa\([Co(NH_{3})_{6}]^{3+}\), ni tena kuwa oxidized, maana yake ni anode.
1.229-.1= 1.129 V au 1.1 V kwa kutumia takwimu muhimu. Mmenyuko huu ni wa pekee kwa sababu seli ya E° ni chanya.
A19.1.15
a) E° = -0.6 V, E° ni hasi hivyo kupunguza hii sio kwa hiari.
b) E° = +1.1 V, E° ni chanya hivyo kupunguza hii ni kwa hiari.
Q19.1.16
Kutabiri bidhaa za kila moja ya athari zifuatazo. (Kumbuka: Mbali na kutumia habari katika sura hii, pia utumie ujuzi uliyokusanya katika hatua hii ya utafiti wako, ikiwa ni pamoja na taarifa juu ya utabiri wa bidhaa za majibu.)
- \(\ce{MnCO3}(s)+\ce{HI}(aq)⟶\)
- \(\ce{CoO}(s)+\ce{O2}(g)⟶\)
- \(\ce{La}(s)+\ce{O2}(g)⟶\)
- \(\ce{V}(s)+\ce{VCl4}(s)⟶\)
- \(\ce{Co}(s)+xs\ce{F2}(g)⟶\)
- \(\ce{CrO3}(s)+\ce{CsOH}(aq)⟶\)
S19.1.16
Kuna idadi kubwa ya athari ambazo zinaweza kutokea, ambazo ni pamoja na: uingizwaji mmoja, uingizwaji mara mbili, mwako, asidi-msingi/neutralization, kuharibika au awali. Hatua ya kwanza ya kuamua bidhaa za mmenyuko ni kutambua aina ya mmenyuko. Kuanzia hapo, hatua zifuatazo unazochukua ili kutabiri bidhaa zitatofautiana kulingana na aina ya majibu.
- Mmenyuko huu ni mmenyuko wa uhamisho mara mbili, ambapo cations na anions ya reactants hubadilisha maeneo ili kuunda misombo mpya. Kuandika equation katika suala la ni maji ions itasaidia taswira nini hasa ni kupata wakiongozwa karibu:
\[2H^{+}(aq)+2I^{-}(aq)\rightarrow 2H^{+}(aq)+CO_{3}^{2-}(aq)+Mn^{2+}(aq)+2I^{-}(aq)\]
Katika kesi hii, cations hidrojeni itakuwa recombined na anions carbonate wakati cations manganese itakuwa recombined na anions iodidi kutupa zifuatazo equation:
\[\ce{MnCO3}(s)+\ce{2HI}(aq)⟶\ce{MnI2}(aq)+\ce{H2CO3}(aq)\]
Hii bado si jibu la mwisho hata hivyo, kama asidi kaboni ni imara na hutengana na dioksidi kaboni na maji chini ya hali ya kiwango. Kuzingatia hili, equation yetu ya mwisho ni:
\[\ce{MnCO3}(s)+\ce{2HI}(aq)⟶\ce{MnI2}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\] - Tabia hii ni mmenyuko wa awali, ambapo majibu mawili au zaidi huchanganya ili kuunda kiwanja ngumu zaidi. Katika kesi hii sisi pia ni tukijibu oksidi ya chuma na oksijeni ambayo ingeweza kusababisha oksidi nyingine ya chuma kama bidhaa. Bidhaa hiyo itakuwa mchanganyiko wa valence oxide Co 3 O 4 ambayo atomi moja ya cobalt ina hali ya oxidation ya +2 wakati wengine wawili wana hali ya oxidation ya +3. Sasa yote yameachwa ni kusawazisha equation:
\[\ce{6CoO}(s)+\ce{O2}(g)⟶\ce{2Co3O4}(s)\] - Kama equation 2, mmenyuko huu pia ni mmenyuko wa awali unaohusisha chuma na oksijeni ambayo inapaswa kusababisha kuundwa kwa oksidi ya chuma. Ni suala sasa la kusawazisha mataifa ya oxidation kufikia kiwanja cha neutral. Oksijeni daima itashikilia hali ya oxidation ya -2 katika misombo wakati lanthanum itaonyesha hali ya +3 ya oxidation. Kwa hivyo, mchanganyiko wa atomi 2 za lanthanum na hali ya oxidation ya +3 na atomi za oksijeni 3 na hali ya oxidation ya -2 itatupa molekuli na malipo ya jumla ya 0 (3 (-2) +2 (+3) =0). Tunajua bidhaa zetu sasa, La 2 O 3, na sasa tu haja ya kusawazisha equation jumla, kutupa:
\[\ce{4La}(s)+\ce{3O2}(g)⟶\ce{2La2O3}(s)\] - Mmenyuko huu ni vigumu kidogo kufafanua kama ni encapsulates wote mali ya awali na utengano athari, ambayo vanadium humenyuka na vanadium tetrakloridi kuzalisha trichloride vanadium. Mmenyuko huu hata hivyo kimsingi ni mmenyuko wa awali tangu tunachanganya majibu mawili ili kuzalisha kiwanja kimoja tata. Kwa trichloride ya vanadium kama bidhaa zetu, tunaweza kusawazisha equation:
\[\ce{V}(s)+\ce{3VCl4}(s)⟶\ce{4VCl3}(s)\] - Hii ni mmenyuko mwingine wa awali unaochanganya cobalt na fluorine. Ulinganisho huu unajumuisha nukuu ya “xs” mbele ya fluorini ambayo ni fupi kwa 'ziada', maana yake ni fluorini zaidi kuliko inavyotakiwa kweli iko katika reactants, kuhakikisha majibu inakwenda kukamilika. Kutafuta bidhaa kama jambo rahisi la kuchanganya cobalt na fluorine katika molekuli moja, ambayo tayari inatuacha kwa usawa wa usawa:
\[\ce{Co}(s)+xs\ce{F2}(g)⟶\ce{CoF2}(s)\] - Haiwezi kuwa dhahiri hapa, lakini majibu tuliyopewa hapa ni mmenyuko wa asidi-msingi/neutralization, huku trioxide ya chromium inayofanya kama asidi na hidroksidi ya cesiamu kama msingi. Chromium trioxide inajulikana kama oksidi tindikali ambayo ina maana kwamba itakuwa kuguswa na maji ili kuunda asidi. Kumbuka kwamba mmenyuko huu bado unaweza kuendelea hata kama reactants si katika awamu sawa. Utawala wa msingi wa athari za asidi-msingi/neutralization ni wao huunda chumvi (chumvi kuwa neno la jumla kwa kiwanja chochote cha ionic kilichoundwa kutokana na athari za asidi-msingi) na maji. Kwa kuwa tunajua maji ni moja ya bidhaa zetu, bidhaa zetu nyingine lazima chumvi linajumuisha cesium, chromium na oksijeni. Hivyo, bidhaa zetu nyingine zinapaswa kuwa chromate ya cesium, na sasa unaweza kusawazisha equation ipasavyo:
\[\ce{CrO3}(s)+\ce{2CsOH}(aq)⟶\ce{Cs2CrO4}(aq)+\ce{H2O}\]
A19.1.16
- \(\ce{MnCO3}(s)+\ce{2HI}(aq)⟶\ce{MnI2}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\)
- \(\ce{6CoO}(s)+\ce{O2}(g)⟶\ce{2Co3O4}(s)\)
- \(\ce{4La}(s)+\ce{3O2}(g)⟶\ce{2La2O3}(s)\)
- \(\ce{V}(s)+\ce{3VCl4}(s)⟶\ce{4VCl3}(s)\)
- \(\ce{Co}(s)+xs\ce{F2}(g)⟶\ce{CoF2}(s)\)
- \(\ce{CrO3}(s)+\ce{2CsOH}(aq)⟶\ce{Cs2CrO4}(aq)+\ce{H2O}\)
Q19.1.17
Kutabiri bidhaa za kila moja ya athari zifuatazo. (Kumbuka: Mbali na kutumia habari katika sura hii, pia utumie ujuzi uliyokusanya katika hatua hii ya utafiti wako, ikiwa ni pamoja na taarifa juu ya utabiri wa bidhaa za majibu.)
- \(\ce{Fe}(s)+\ce{H2SO4}(aq)⟶\)
- \(\ce{FeCl3}(aq)+\ce{NaOH}(aq)⟶\)
- \(\ce{Mn(OH)2}(s)+\ce{HBr}(aq)⟶\)
- \(\ce{Cr}(s)+\ce{O2}(g)⟶\)
- \(\ce{Mn2O3}(s)+\ce{HCl}(aq)⟶\)
- \(\ce{Ti}(s)+xs\ce{F2}(g)⟶\)
S19.1.17
Kutabiri bidhaa za kila moja ya athari zifuatazo.
- Fe (s) +H 2 SO 4 (aq)?
Wakati wowote chuma humenyuka na asidi, bidhaa ni chumvi na hidrojeni. Kwa sababu Fe ni ya chini kwenye mfululizo wa shughuli, tunajua kwamba inapogusa na asidi itasababisha kuundwa kwa gesi ya hidrojeni. Ili kurahisisha equation ni:
\[Metal + Acid ⟶ Salt + Hydrogen\]
Chumvi zinazozalishwa itategemea chuma na katika kesi hii, chuma ni chuma (Fe) hivyo equation kusababisha itakuwa:
\[\ce{Fe}(s)+\ce{H2SO4}(aq)⟶ \ce{FeSO4}(aq) + \ce{H2}(g)\]
Equation hii kazi nje kama H2 ni kuondolewa kutoka H 2 SO 2, kusababisha SO 4 2- ion ambapo Fe itachukua hali oxidation ya Fe +2 kuunda FeSO 4 ambayo itakuwa chumvi katika mfano huu.
Lakini tangu FeSO 4 na H2SO 4 ni maji, reactants na bidhaa pia inaweza kuandikwa kama ions yake ambapo equation jumla inaweza kuwa:
\[\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{SO2^{−4}}(aq)⟶\ce{Fe2+}(aq)+\ce{SO2^{−4}}(aq)+\ce{H2}(g)+\ce{2H2O}(l)\]
- FeCl 3 (aq) +NaOH (aq)?
Katika kesi hiyo, kuongeza hidroksidi ya chuma (NaOH) kwa suluhisho na ion ya chuma ya mpito (Fe) itaunda hidroksidi ya chuma ya mpito (XOH). Kama chuma huunganishwa na atomi tatu za klorini katika upande wa reactants, ina hali ya oxidation ya +3 ambapo ioni tatu za hidroksidi (OH -) zinahitajika kusawazisha mashtaka wakati wao ni Bonded katika bidhaa. Ions iliyobaki ni Na + na Cl - ambapo huunganisha pamoja katika uwiano wa 1:1 ambapo kuna molekuli 3 za NaCl mara majibu yamekuwa na usawa.
Majibu ya jumla yatakuwa:
\[\ce{FeCl3}(aq)+\ce{NaOH}(aq)⟶ \ce{Fe(OH)3}(s) + \ce{3NaCl}(aq)\]
KUMBUKA: Fe (OH) 3 (s) ni imara kama ilivyo kanuni kwamba hidroksidi zote za chuma za mpito hazipatikani na upepo hutengenezwa.
Kwa kuwa NaOH (aq) na NaCl (aq) ni maji, tunaweza kuandika katika fomu zao za ion:
\[\ce{FeCl3}(aq)+\ce{3Na+}(aq)+\ce{3OH^{−}}(aq)+\ce{Fe(OH)3}(s)+\ce{3Na+}(aq)+\ce{3Cl+}(aq)\]
- Mn (OH) 2 (s) +HBR (aq)?
Hii ni mfano wa hidroksidi ya chuma inayoitikia na asidi ambapo chumvi na maji ya chuma hutengenezwa daima:
\[Metal Hydroxide + Acid ⟶ Metal Salt + Water\]
Wakati sheria hii inatumika kwa equation hii, tutapata zifuatazo:
\[\ce{Mn(OH)2}(s)+\ce{HBr}(aq)⟶ \ce{MnBr2}(aq)+\ce{2H2O}(l)\]
Lakini kufuata na swali hili, ufumbuzi wa maji kama vile HbR (aq) na MnBr 2 (aq) unaweza kuandikwa tena kama:
\[\ce{Mn(OH)2}(s)+\ce{2H3O+}(aq)+\ce{2Br-}(aq)⟶\ce{Mn2+}(aq)+\ce{2Br-}(aq)+\ce{4H2O}(l)\]
- Cr (s) +O 2 (g)?
Hii ni mmenyuko wa jumla wa chuma unaoitikia na oksijeni, ambayo daima itasababisha oksidi ya chuma. Hata hivyo, oksidi ya chuma imedhamiriwa na hali ya oxidation ya chuma hivyo kunaweza kuwa na matokeo kadhaa ya mmenyuko huu kama vile:
\[\ce{4Cr}(s)+\ce{3O2}(g)⟶\ce{2Cr2O3}(s)\]
\[\ce{Cr}(s)+\ce{O2}(g)⟶\ce{2CrO}(s)\]
\[\ce{Cr}(s)+\ce{O2}(g)⟶\ce{CrO2}(s)\]
\[\ce{2Cr}(s)+\ce{3O2}(g)⟶\ce{CrO3}(s)\]
Hata hivyo, Cr 2 O 3 ni oksidi kuu ya chromium hivyo inaweza kudhani kuwa hii ni bidhaa ya jumla ya mmenyuko huu.
- Mn 2 O 3 (s) +HCL (aq)?
Hii ifuatavyo majibu ya jumla ya oksidi ya chuma na asidi daima husababisha chumvi na maji.
\[Metal Oxide + Acid ⟶ Salt + Water\]
Kutumia majibu haya ya jumla, sawa na athari za jumla hapo juu, majibu yatasababisha:
\[\ce{Mn2O3}(s)+\ce{HCl}(aq)⟶\ce{2MnCl3}(s)+\ce{9H2O}(l)\]
Hata hivyo, tangu HCl ni suluhisho la maji, equation ya jumla inaweza pia kuandikwa tena kama:
\[\ce{Mn2O3}(s)+\ce{6H3O+}(aq)+\ce{6Cl-}(aq)⟶\ce{2MnCl3}(s)+\ce{9H2O}(l)\]
- Ti (s) +xSF 2 (g)?
Titanium inaweza kuguswa na halojeni ambapo kuna hali mbili za oxidation ambazo titanium inaweza kuwa: +3 na +4. Athari zifuatazo hufuata kila hali ya oxidation ipasavyo:
\[\ce{2Ti}(s)+\ce{3F2}(g)⟶ \ce{2TiF3}(s)\]
\[\ce{Ti}(s)+\ce{2F2}(g)⟶\ce{TiF4}(s)\]
Hata hivyo, kwa kuwa kuna ishara “xs”, hii inaonyesha kwamba F 2 imeongezwa kwa ziada hivyo mmenyuko wa pili unapendekezwa zaidi kama inavyoendesha majibu ya kukamilika.
JUMLA:
\[\ce{Ti}(s)+\ce{xsF2}(g)⟶\ce{TiF4}(g)\]
A19.1.17
- \(\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{SO4^2-}(aq)⟶\ce{Fe^2+}(aq)+\ce{SO4^2-}(aq)+\ce{H2}(g)+\ce{2H2O}(l)\);
- \(\ce{FeCl3}(aq)+\ce{3Na+}(aq)+\ce{3OH-}(aq)+\ce{Fe(OH)3}(s)+\ce{3Na+}(aq)+\ce{3Cl+}(aq)\);
- \(\ce{Mn(OH)2}(s)+\ce{2H3O+}(aq)+\ce{2Br-}(aq)⟶\ce{Mn^2+}(aq)+\ce{2Br-}(aq)+\ce{4H2O}(l)\);
- \(\ce{4Cr}(s)+\ce{3O2}(g)⟶\ce{2Cr2O3}(s)\);
- \(\ce{Mn2O3}(s)+\ce{6H3O+}(aq)+\ce{6Cl-}(aq)⟶\ce{2MnCl3}(s)+\ce{9H2O}(l)\);
- \(\ce{Ti}(s)+xs\ce{F2}(g)⟶\ce{TiF4}(g)\)
Q19.1.18
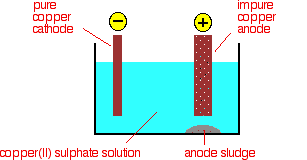
Eleza mchakato wa electrolytic wa kusafisha shaba.
S19.1.18
Kwa electrolysis, shaba inaweza kusafishwa na kufanywa kwa usahihi. Sababu kwa nini shaba inahitaji kuondoa uchafu ni kwa sababu inasaidia kuongeza conductivity umeme katika waya umeme. Unaweza kuboresha shaba na kuondoa uchafu kupitia electrolysis. Shaba safi ni muhimu katika kufanya waya wa umeme, kwa sababu inajenga conductivity bora ya umeme wakati wa kuhamisha umeme. Ili conductivity bora ya umeme, uchafu unahitaji kuondolewa na hii inaweza kufanyika kwa kurusha shaba safi ili kuondoa uchafu, kama vile sulfuri, oksijeni, n.k. na kuifanya kuwa anodes za umeme ambazo zinaweza kutumika katika electrolysis. Kisha electrodes ya shaba huwekwa kwenye kiini cha umeme (ndani ya beakers tofauti) ambapo sasa umeme unaweza kupita kupitia beakers na kwenye electrodes. Kupitia mchakato huu, shaba imeondolewa kwenye anode na imewekwa kwenye cathode. Utaratibu huu husaidia kuondoa uchafu na kuboresha shaba kwa sababu shaba yote imekuwa zilizoingia kwenye cathode yote katika electrode moja. Utaratibu huu huongeza uzito wa cathode kutokana na shaba iliyowekwa kwenye cathode. Huu ni mfano mkuu wa jinsi ya kujua kama electrode ni cathode au anode, kama ilivyoelezwa katika Q17.2.9 hapo juu.
Q19.1.19
Kutabiri bidhaa za athari zifuatazo na usawa usawa.
- Zn imeongezwa kwa suluhisho la Cr 2 (SO 4) 3 katika asidi.
- FeCl 2 imeongezwa kwenye suluhisho iliyo na ziada ya\(\ce{Cr2O7^2-}\) asidi hidrokloric.
- Cr 2+ imeongezwa\(\ce{Cr2O7^2-}\) kwa ufumbuzi wa asidi.
- Mtu anawaka na CRO 3.
- CRO ni aliongeza kwa 2HNO 3 katika maji.
- FeCl 3 imeongezwa kwa suluhisho la maji la NaOH.
S19.1.19
imeongezwa kwa suluhisho
la asidi.
- Oxidized nusu mmenyuko:
- Kupunguza majibu ya nusu:
- Kwa ujumla majibu:
- Chromium itapunguza nje ya suluhisho kwa sababu ina uwezo mkubwa wa kupunguza kuliko Zinki; mmenyuko ni badala moja.
- Oxidized nusu mmenyuko:
imeongezwa kwa suluhisho iliyo na ziada ya asidi
hidrokloric.
- Mmenyuko wa kujitenga:
- Oxidation nusu mmenyuko:
- Kupunguza majibu ya nusu:
- Kwa ujumla majibu:
- Uwezo wa kupunguza permanganate ni kubwa, hivyo majibu bado yanafaa hata wakati oxidation ya
ni hasi.
- Mmenyuko wa kujitenga:
imeongezwa
kwa ufumbuzi wa asidi.
- Kupunguza majibu ya nusu:
- Oxidation nusu mmenyuko:
- Kwa ujumla majibu:
- Majibu ni mazuri na chanya cha juu
- Kupunguza majibu ya nusu:
ni joto na
.
- Kupunguza majibu ya nusu:
- Oxidation nusu mmenyuko:
- Kwa ujumla majibu:
- Joto hujenga bidhaa yenye nishati ya juu kuliko majibu yote ya awali.
- Kupunguza majibu ya nusu:
ni aliongeza
kwa maji.
- Nguvu ya asidi dissociation:
- Kwa ujumla majibu:
- Tabia hii inafanya kazi kwa kubadilishana elektroni ili kuzalisha ions za Chromium.
- Nguvu ya asidi dissociation:
ni aliongeza kwa ufumbuzi wa maji ya
.
- Kwa ujumla majibu:
- Iron hidroksidi mapenzi precipitate kwa sababu metali mbili kubadilishana anions.
- Kwa ujumla majibu:
A19.1.19
- \(\ce{Cr2(SO4)3}(aq)+\ce{2Zn}(s)+\ce{2H3O+}(aq)⟶\ce{2Zn^2+}(aq)+\ce{H2}(g)+\ce{2H2O}(l)+\ce{2Cr^2+}(aq)+\ce{3SO4^2-}(aq)\);
- \(\ce{4TiCl3}(s)+\ce{CrO4^2-}(aq)+\ce{8H+}(aq)⟶\ce{4Ti^4+}(aq)+\ce{Cr}(s)+\ce{4H2O}(l)+\ce{12Cl-}(aq)\);
- Katika ufumbuzi wa asidi kati ya pH 2 na pH 6,\(\ce{CrO4^2-}\) fomu\(\ce{HrCO4-}\), ambazo ni katika usawa na ion ya dichromate. Majibu ni\(\ce{2HCrO4-}(aq)⟶\ce{Cr2O7^2-}(aq)+\ce{H2O}(l)\). Katika PHs nyingine tindikali, majibu ni\(\ce{3Cr^2+}(aq)+\ce{CrO4^2-}(aq)+\ce{8H3O+}(aq)⟶\ce{4Cr^3+}(aq)+\ce{12H2O}(l)\);
- \(\ce{8CrO3}(s)+\ce{9Mn}(s)\overset{Δ}{⟶}\ce{4Cr2O3}(s)+\ce{3Mn3O4}(s)\);
- \(\ce{CrO}(s)+\ce{2H3O+}(aq)+\ce{2NO3-}(aq)⟶\ce{Cr^2+}(aq)+\ce{2NO3-}(aq)+\ce{3H2O}(l)\);
- \(\ce{CrCl3}(s)+\ce{3NaOH}(aq)⟶\ce{Cr(OH)3}(s)+\ce{3Na+}(aq)+\ce{3Cl-}(aq)\)
Q19.1.20
Gesi huzalishwa nini wakati sulfidi ya chuma (II) inatibiwa na asidi isiyo ya oxidizing?
S19.1.20
Mfumo wa sulfidi ya chuma (II):\[FeS\]
Ufafanuzi wa asidi isiyo ya oksidi: Asidi isiyo ya oksidi ni asidi ambayo haina kutenda wakala wa oksidi. Anion yake ni wakala dhaifu wa oksidi kuliko H+, hivyo haiwezi kupunguzwa. Mifano ya asidi zisizo za oxidizing:\[HCl, HI, HBr, H_3PO_4, H_2SO_4\]
Hatua ya 2: Chagua moja ya asidi isiyo ya oxidizing, katika kesi hii HCl, na uandike mmenyuko wa kemikali:
\[FeS(s)+2HCl(aq)\rightarrow FeCl_2(s)+H_2S(g)\]
Gesi zinazozalishwa wakati chuma (II) sulfidi inatibiwa na asidi isiyo ya oksidi, HCl, ni H 2 S (dihidrojeni sulfidi) gesi.
Q19.1.21
Kutabiri bidhaa za kila moja ya athari zifuatazo na kisha usawa equations kemikali.
- Fe ni joto katika hali ya mvuke.
- NaOH imeongezwa kwenye suluhisho la Fe (NO 3) 3.
- FeSO 4 imeongezwa kwa suluhisho la tindikali la KMNo 4.
- Fe imeongezwa kwa suluhisho la kuondokana la H 2 SO 4.
- Suluhisho la Fe (NO 3) 2 na HNO 3 inaruhusiwa kusimama hewa.
- FeCO 3 imeongezwa kwenye suluhisho la HClo 4.
- Fe ni joto katika hewa.
S19.1.21
a. mvuke ni maji (\(\ce{H_{2}O}\))
Tunaweza kuandika majibu kama:
\(\ce{Fe}\)+\(\ce{H_{2}O}\) →?
Hii ni mmenyuko mmoja badala, hivyo\(\ce{Fe}\) nafasi\(\ce{H_{2}}\). Kwa hiyo, moja ya bidhaa ni kwa\(\ce{Fe_{3}O_{4}}\) kuwa ni mchanganyiko wa oksidi ya chuma (II),\(\ce{FeO}\), na chuma (III) oksidi,\(\ce{Fe_{2}O_{3}}\).
Ya\(\ce{Fe}\) ni joto katika hali ya mvuke. \(\ce{H_{2}}\)inakuwa neutrally kushtakiwa na inakuwa bidhaa nyingine.
Baada ya kusawazisha coefficients, mmenyuko wa mwisho ni:
\(\ce{3Fe}(s)\)+\(\ce{4H_{2}O}(g)\) →\(\ce{Fe_{3}O_{4}}(s)\) +\(\ce{4H_{2}}(g)\)
b.\(\ce{NaOH}\) aliongeza kwa suluhisho la\(\ce{Fe(NO_{3})_{3}}\) ni mara mbili badala na mmenyuko wa mvua.
Tunaweza kuandika majibu kama:
\(\ce{NaOH}\)+\(\ce{Fe(NO_{3})_{3}}\) →?
Ya\(\ce{Na}\) na\(\ce{Fe}\) kubadili fomu\(\ce{Fe(OH)_{3}}(s)\) na\(\ce{NaNO_{3}}(aq)\).
\(\ce{Fe(OH)_{3}}\)ni imara kwa sababu ni hakuna kulingana na sheria umumunyifu.
Baada ya kusawazisha coefficients katika mmenyuko, majibu ya mwisho ni:
\(\ce{Fe(NO_{3})_{3}}(aq)\)+\(\ce{3NaOH}(aq)\) →\(\ce{Fe(OH)_{3}}(s)\) +\(\ce{NaNO_{3}}(aq)\)
c Kwa mfano, asidi inayotumiwa kufanya suluhisho la tindikali ni\(\ce{H_{2}SO_{4}}\), basi mmenyuko ni:
\(\ce{FeSO_{4}}\)+\(\ce{KMnO_{4}}\) +\(\ce{H_{2}SO_{4}}\) →\(\ce{Fe_{2}(SO_{4})_{3}}\)\(\ce{MnSO_{4}}\) +\(\ce{H_{2}O}\) +\(\ce{K_{2}SO_{4}}\)
Kisha, mmenyuko wa ionic wavu unapaswa kuandikwa ili kuondokana na ions za mtazamaji katika majibu, hii imeandikwa kama:
\(\ce{Fe^{2+}}\)+\(\ce{MnO_{4}^{-}}\) +\(\ce{H^{+}}\) →\(\ce{Fe^{3+}}\)\(\ce{Mn^{2+}}\) +\(\ce{H_{2}O}\)
Kama inavyoonekana katika wavu ionic equation juu,\(\ce{Fe^{2+}}\) ni iliyooksidishwa\(\ce{Fe^{3+}}\) na\(\ce{MnO_{4}^{-}}\) ni kupunguzwa kwa\(\ce{Mn^{2+}}\). Hizi zinaweza kuandikwa kama athari mbili za nusu:
\(\ce{Fe^{2+}}\)→\(\ce{Fe^{3+}}\)
\(\ce{MnO_{4}^{-}}\)→\(\ce{Mn^{2+}}\)
Ili kusawazisha oxidation nusu mmenyuko, elektroni moja kama kuongezwa kwa\(\ce{Fe^{3+}}\), hii ni umeonyesha kama:
\(\ce{Fe^{2+}}\)→\(\ce{Fe^{3+}}\) +\(\ce{e^{-}}\)
Mmenyuko wa nusu ya kupunguza pia inapaswa kuwa na usawa, lakini kwa\(\ce{H^{+}}\) ions na\(\ce{H_{2}O}\), hii inaonyeshwa kama:
\(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) →\(\ce{Mn^{2+}}\) +\(\ce{4H_{2}O}\)
Baada ya malipo ya\(\ce{Mn}\) atomi kuwa na usawa, malipo ya jumla yanapaswa kuwa na usawa pande zote mbili kwa sababu upande wa majibu\(\ce{7+}\), malipo ni, na malipo upande wa bidhaa ni\(\ce{2+}\). Malipo ya jumla yanaweza kuwa na usawa kwa kuongeza elektroni, hii inaonyeshwa kama:
\(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) +\(\ce{5e^{-}}\) →\(\ce{Mn^{2+}}\) +\(\ce{4H_{2}O}\)
Sasa kwa kuwa athari zote mbili za nusu ni za usawa, elektroni katika athari zote mbili za nusu zinapaswa kuwa sawa, na kisha athari za nusu zinaongezwa pamoja. Baada ya hayo kufanywa, majibu inaonekana kama hii:
\(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) +\(\ce{5Fe^{2+}}\) +\(\ce{5e^{-}}\) →\(\ce{Mn^{2+}}\)\(\ce{4H_{2}O}\) +\(\ce{5Fe^{3+}}\) +\(\ce{5e^{-}}\)
Ya\(\ce{5e^{-}}\) pande zote mbili kufuta nje na majibu ya mwisho ya uwiano ni:
\(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) +\(\ce{5Fe^{2+}}\) →\(\ce{Mn^{2+}}\)\(\ce{4H_{2}O}\) +\(\ce{5Fe^{3+}}\)
d.\(\ce{Fe}\) aliongeza kwa ufumbuzi diluted ya\(\ce{H_{2}SO_{4}}\) ni moja badala majibu.
Ya\(\ce{Fe}\) imeongezwa kwa suluhisho la kuondokana na hivyo\(\ce{H_{2}SO_{4}}\) imeandikwa kama ions tofauti.
Tunaweza kuandika majibu kama:
\(\ce{Fe}(s)\)+\(\ce{2H^+}(aq)\) +\(\ce{(SO_{4})^{2-}}(aq)\) →?
Fe inachukua nafasi ya\(\ce{H^+}\) ioni, na inakuwa\(\ce{Fe^{2+}}\) ioni.
\(\ce{H_{2}O}\)pia ni bidhaa kwa sababu ufumbuzi ni diluted.
Zaidi ya hayo,\(\ce{FeSO_{4}}\) pia ina kuwa kutengwa katika ions kama matokeo ya\(\ce{Fe}\) kuwa aliongeza kwa ufumbuzi diluted.
Baada ya kusawazisha coefficients zote, majibu ya mwisho ni:
\(\ce{Fe}(s)\)+\(\ce{(2H_{3}O)^+}(aq)\) +\(\ce{(SO_{4})^{2-}}(aq)\) →\(\ce{Fe^{2+}}(aq)\)\(\ce{SO_{4}^{2-}}(aq)\) +\(\ce{H_{2}}(g)\) +\(\ce{2H_{2}O}(l)\)
Kumbuka:\(\ce{H^+}\) inaweza pia kuandikwa kama ioni ya hydronium,\(\ce{(H_{3}O)^{+}}\).
e Sisi awali tunaweza kuandika:
\(\ce{4Fe(NO_{3})_{2}}\)+\(\ce{4HNO_{3}}\) +\(\ce{O_{2}}\) →?
Tunaandika neno la oksijeni katika majibu kwa sababu imeelezwa kuwa suluhisho linaruhusiwa kusimama hewa.
Tunapaswa tu kuchambua bidhaa zinazowezekana ambazo zinaweza kuundwa na tunaweza kuona kwamba hidrojeni kutoka asidi ya nitriki inaweza kuchanganya na gesi ya oksijeni kuunda maji na kisha kuchanganya kila kitu pamoja, tunapata majibu ya mwisho kuwa:
\(\ce{4Fe(NO_{3})_{2}}(aq)\)+\(\ce{4HNO_{3}}(aq)\) +\(\ce{O_{2}}(g)\) →\(\ce{2H_{2}O}(l)\) +\(\ce{4Fe(NO_{3})_{3}}(aq)\)
f Wakati\(\ce{FeCO_{3}}\) ni aliongeza kwa\(\ce{HClO_{4}}\), mara mbili badala majibu hutokea.
\(\ce{Fe^{2+}}\)Ioni inachukua matangazo na\(\ce{H^+}\) ion kuunda\(\ce{Fe(ClO_{4})_{2}}\) kama bidhaa.
Wakati\(\ce{H^+}\) ion ni aliongeza kwa\(\ce{(CO_{3})^{2-}}\) ion,\(\ce{H_{2}CO_{3}}\) ni sumu.
Baada ya kusawazisha coefficients, mmenyuko wa mwisho ni:
\(\ce{FeCO_{3}}(s)\)+\(\ce{HClO_{4}}(aq)\) →\(\ce{Fe(ClO_{4})_{2}}(aq)\)\(\ce{H_{2}O}(l)\) +\(\ce{CO_{2}}(g)\)
g Air inajumuisha gesi ya oksijeni, ambayo ni molekuli ya diatomic, hivyo ni\(\ce{O_{2}}\).
\(\ce{Fe}\)Kuongeza\(\ce{O_{2}}\) kwa kusababisha mmenyuko wa awali kutokea kutengeneza\(\ce{Fe_{2}O_{3}}\).
Baada ya kusawazisha coefficients, majibu ya mwisho ni:
\(\ce{3Fe}(s)\)+\(\ce{2O_{2}}(g)\) →\(\ce{Fe_{2}O_{3}}(s)\)
A19.1.21
- \(\ce{3Fe}(s)+\ce{4H2O}(g)⟶\ce{Fe3O4}(s)+\ce{4H2}(g)\);
- \(\ce{3NaOH}(aq)+\ce{Fe(NO3)3}(aq)\xrightarrow{\ce{H2O}}\ce{Fe(OH)3}(s)+\ce{3Na+}(aq)+\ce{3NO3-}(aq)\);
- \(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) +\(\ce{5Fe^{2+}}\) →\(\ce{Mn^{2+}}\)\(\ce{4H_{2}O}\) +\(\ce{5Fe^{3+}}\)
- \(\ce{Fe}(s)\)+\(\ce{(2H_{3}O)^+}(aq)\) +\(\ce{(SO_{4})^{2-}}(aq)\) →\(\ce{Fe^{2+}}(aq)\)\(\ce{SO_{4}^{2-}}(aq)\) +\(\ce{H_{2}}(g)\) +\(\ce{2H_{2}O}(l)\)
- \(\ce{4Fe(NO_{3})_{2}}(aq)\)+\(\ce{4HNO_{3}}(aq)\) +\(\ce{O_{2}}(g)\) →\(\ce{2H_{2}O}(l)\) +\(\ce{4Fe(NO_{3})_{3}}(aq)\)
- \(\ce{FeCO_{3}}(s)\)+\(\ce{HClO_{4}}(aq)\) →\(\ce{Fe(ClO_{4})_{2}}(aq)\)\(\ce{H_{2}O}(l)\) +\(\ce{CO_{2}}(g)\)
- \(\ce{3Fe}(s)\)+\(\ce{2O_{2}}(g)\) →\(\ce{Fe_{2}O_{3}}(s)\)
Q19.1.22
Mizani equations zifuatazo na mbinu za kupunguza oxidation; kumbuka kuwa mambo matatu hubadilisha hali ya oxidation.
\[\ce{Co(NO3)2}(s)⟶\ce{Co2O3}(s)+\ce{NO2}(g)+\ce{O2}(g)\]
S19.1.22
Mizani equations zifuatazo na mbinu za kupunguza oxidation; kumbuka kuwa mambo matatu hubadilisha hali ya oxidation.
\[Co(NO_3){_2(s)}⟶Co_2O{_3(s)}+NO{_2(g)}+O{_2(g)}\]
Katika mmenyuko huu, N hubadilisha hali za oxidation kutoka +5 hadi +4 (kupunguzwa), Co hubadilisha hali za oxidation kutoka +2 hadi +3 (iliyooksidishwa), na O hubadilisha hali za oxidation kutoka -2 hadi 0 (pia iliyooksidishwa).
Kwanza, kugawanya mmenyuko huu katika oxidation na kupunguza nusu mmenyuko kuweka, na kusawazisha mambo yote ambayo si hidrojeni au oksijeni (tutashughulika na haya baadaye):
\[Reduction: 2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2\]
Sasa, kwa mmenyuko wa oxidation, tunashughulika tu na O 2 kwenye upande wa bidhaa. Ili kusawazisha hili, tutahitaji kuongeza maji na hidrojeni kwa pande zote mbili:
\[Oxidation: 2H_2O\rightarrow O_2+4H^+ \]
Kusawazisha kiasi cha oksijeni kila upande kwa kuongeza idadi sahihi ya molekuli za maji (H 2 O), na usawazisha kiasi cha hidrojeni kwa kuongeza idadi sahihi ya atomi za H +:
\[Reduction: 2H^++2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2+H_2O\]
\[Oxidation: 2H_2O\rightarrow O_2+4H^+\]
Hatimaye, usawazisha mashtaka kwa kuongeza elektroni kwa kila upande wa equation. Kwa mmenyuko wa kupunguza, tutaongeza elektroni 2 ili kusawazisha nje ya 2H +, na kwa mmenyuko wa oxidation, tutaongeza elektroni 4 ili kusawazisha 4H +. Kumbuka, lengo la hatua hii ni kuhakikisha kwamba mashtaka ni ya usawa, ili tuweze kufuta yao nje mwishoni.
\[Reduction: 2e^- + 2H^++2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2+H_2O\]
\[Oxidation: 2H_2O\rightarrow O_2+4H^+ +4e^-\]
Panua majibu ya kupunguza kwa mbili, ili kusawazisha mashtaka hivyo kuna elektroni 4 kila upande wa mmenyuko.
\[Reduction: 2(2e^- + 2H^++2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2+H_2O)\]
na kuchanganya athari zote mbili ambazo hutoka kwa:
\[2H_2O + 4Co(NO_3)_2 + 4H^+ \rightarrow 2CO_2O_3 + 8NO_2 + 2H_2O + O_2 + 4H^+\]
Futa nje kama maneno:
\[4Co(NO_3){_2(s)} \rightarrow 2CO_2O{_3(s)} + 8NO{_2(g)} + O{_2(g)}\]
Pande zote mbili zina mashtaka ya jumla ya 0 na inaweza kuchunguzwa ili kuona kama ni uwiano.
A19.1.22
\[4Co(NO_3){_2(s)} \rightarrow 2CO_2O{_3(s)} + 8NO{_2(g)} + O{_2(g)}\]
Q19.1.23
Punguza ufumbuzi wa sodiamu ya cyanide hupungua polepole kwenye ufumbuzi wa nitrati ya fedha iliyopungua polepole. Upepo mweupe huunda kwa muda lakini hupasuka kama kuongeza kwa sianidi ya sodiamu inaendelea. Tumia milinganyo ya kemikali kuelezea uchunguzi huu. Cyanide ya fedha ni sawa na kloridi ya fedha katika umumunyifu wake.
S19.1.23
Punguza ufumbuzi wa sodiamu ya cyanide hupungua polepole kwenye ufumbuzi wa nitrati ya fedha iliyopungua polepole. Upepo mweupe huunda kwa muda lakini hupasuka kama kuongeza kwa sianidi ya sodiamu inaendelea. Tumia milinganyo ya kemikali kuelezea uchunguzi huu. Cyanide ya fedha ni sawa na kloridi ya fedha katika umumunyifu wake.
A: Hatua ya 1: angalia swali na uanze kuandika bidhaa ya jumla kwa formula ya reactant kwa mmenyuko huu.
Hatua ya 2: jaribu kufikiri kwa nini usahihi utaunda lakini kwa muda wa mwisho kabla ya kuleta mageuzi katika dutu yenye maji.
Hatua ya 3: Kwa hatua ya 2 unapaswa kuwa umeona kwamba mmenyuko ni mmenyuko wa hatua nyingi na kutumia formula mbaya ambayo umetokana na hatua ya 1, unapaswa kujaribu na kuona nini mfululizo wa hatua ni kwamba kusababisha bidhaa ya jumla ya AgCn 2 ya kioevu
Katika majibu haya tunaona jinsi NaCn ni aliongeza kwa AgNo 3 A. Precipitate aina lakini kisha kutoweka na kuongeza ya NaCn zaidi, hii lazima maana kwamba ni majibu kati ambayo si kuonekana kama bidhaa ya mwisho. Fedha na sianidi dhamana kwa muda, lakini dhamana ni dhaifu mno kuwashika pamoja hivyo vunjwa mbali tena wakati NaCn inapoongezwa kwa sababu kiwanja kipya, chenye nguvu zaidi na imara kinaundwa: [Ag (CN) 2] - (aq).
halisi mmenyuko equation wakati ni ya kwanza unafanyika ni\[AgCl(aq)+NaCN(aq)\rightarrow AgCN(s)+NaCl(aq)\]
Hii inaweza kuandikwa kwa njia ifuatayo: kama CN - inavyoongezwa, fedha na sianidi huchanganya: Ag + (aq) +CN - (aq) → Agcn (s)
Kama zaidi CN - ni aliongeza fedha na sianidi mbili kuchanganya kujenga kiwanja imara zaidi: Ag + (aq) +2CN - (aq) → [Ag (CN) 2] - (aq)
AGCN (s) + CN - (aq) → [Ag (CN 2)] - (aq)
A19.1.23
Kama CN - ni aliongeza,
\[\ce{Ag+}(aq)+\ce{CN-}(aq)⟶\ce{AgCN}(s)\]
Kama CN zaidi - imeongezwa,
\[\ce{Ag+}(aq)+\ce{2CN-}(aq)⟶\ce{[Ag(CN)2]-}(aq)\]
\[\ce{AgCN}(s)+\ce{CN-}(aq)⟶\ce{[Ag(CN)2]-}(aq)\]
Q19.1.24
Kutabiri ambayo itakuwa imara zaidi, [CRO 4] 2- au [WO 4] 2-, na kueleza.
S19.1.24
Kwa mujibu wa sheria zinazohusiana na Crystal Field Kuimarisha Nguvu, molekuli imara zina elektroni zaidi katika orbitals ya chini ya nishati ya Masi kuliko katika orbitals high-nishati Masi. Katika kesi hiyo, magumu yote yana O 4 kama ligands, na wote wana malipo ya -2. Kwa hiyo, unaamua utulivu kwa kulinganisha metali. Chromium iko katika orbital 3d, kulingana na meza ya mara kwa mara. Tungsten (W) iko katika orbital ya 5d. 3d ni kiwango cha chini cha nishati kuliko 5D.Orbitals ya ngazi ya juu ni ionized kwa urahisi zaidi, na hufanya fomu yao ya msingi ya msingi imara zaidi. Ikiwa fomu ya msingi imara zaidi, fomu iliyooksidishwa haiwezi imara. Kwa hiyo, [CrO 4] 2—ni imara zaidi kuliko [WO 4] 2.
A19.1.24
[CrO 4] 2- ni imara zaidi kwa sababu Chromium iko katika orbital 3d wakati Tungsten iko katika orbital 4d, ambayo ina kiwango cha juu cha nishati na inafanya kuwa imara.
Q19.1.25
Kutoa hali ya oxidation ya chuma kwa kila moja ya oksidi zifuatazo za mfululizo wa kwanza wa mpito. (Kidokezo: Oxides ya formula M 3 O 4 ni mifano ya misombo ya mchanganyiko wa valence ambayo ion ya chuma iko katika hali zaidi ya moja ya oxidation. Inawezekana kuandika formula hizi kiwanja katika format sawa MO· M 2 O 3, kuruhusu makadirio ya chuma ya nchi mbili oxidation.)
- Sc 2 O 3
- Tio 2
- V 2 O 5
- CRO 3
- No 2
- Fe 3 ya 4
- Co 3 Ya 4
- No
- Cu 2 O
S19.1.25
Hatua ya kwanza ya kutatua tatizo hili ni kuangalia sheria za majimbo ya oxidizing kwa vipengele mbalimbali:
Chem.libretexts.org/core/analytical_Chemistry/electrochemistry/redox_Chemistry/oxidation_state
Sheria kuu zitatumika katika matatizo haya zitakuwa utawala wa hali ya oxidation 6 ambayo inasema kuwa hali ya oxidation kwa Oxygen ni (-2) na utawala 2 ambayo ni kwamba jumla ya hali ya oxidation ya atomi zote katika aina yoyote fulani ni sawa na malipo halisi juu ya aina hiyo. Kutatua matatizo haya inahitaji algebra rahisi. Majimbo ya oxidation ya vipengele vyote viwili katika kiwanja ni sawa na sifuri, hivyo kuweka oxidation haijulikani ya kipengele ambacho si oksijeni kwa kutofautiana\({x}\), na hali ya oxidation ya oksijeni sawa na\({-2}\). Kisha kuzidisha majimbo yote ya oksijeni kwa idadi ya atomi za kipengele kilichopo. Kuongeza maadili pamoja, kuweka equation sawa na sifuri na kutatua kwa\({x}\).
- \(\ce{Sc2O3}={3{(-2)}}+{2{x}}={0}⟶{-6}+{2{x}}={0}⟶{x}={Sc}={+3}\)\(Sc^{3+}\)
- \(\ce{TiO2}={2{(-2)}}+{x}={0}⟶{-4}+{x}={0}⟶{x}={Ti}={+4}\)\(Ti^{4+}\)
- \(\ce{V2O5}={5{(-2)}}+{2{x}}={0}⟶{-10}+{2{x}}={0}⟶{x}={V}={+5}\)\(V^{5+}\)
- \(\ce{CrO3}={3{(-2)}}+{x}={0}⟶{-6}+{x}={0}⟶{x}={Cr}={+6}\)\(Cr^{6+}\)
- \(\ce{MnO2}={2{(-2)}}+{x}={0}⟶{-4}+{x}={0}⟶{x}={Mn}={+4}\)\(Mn^{4+}\)
- \(\ce{Fe3O4}=\ce{FeO}·\ce{Fe2O3}=\)
\(\ce{FeO}={-2}+{x}={0}⟶{x}={Fe}={+2}\)\(Fe^{2+}\)
\(\ce{Fe2O3}={3{(-2)}}+{2{x}}={0}⟶{-6}+{2x}={0}⟶{x}={Fe}={+3}\)\(Fe^{3=}\)
(Atom moja ya Fe ina hali ya oxidation ya +2 na atomi nyingine 2 za Fe zina hali ya oxidation ya +3)
7. \(\ce{Co3O4}=\ce{CoO}·\ce{Co2O3}=\)
\(\ce{CoO}={-2}+{x}={0}⟶{x}={Co}={+2}\)\(Co^{2+}\)
\(\ce{Co2O3}={3{(-2)}}+{2{x}}={0}⟶{-6}+{2x}={0}⟶{x}={Co}={+3}\)\(Co^{3+}\)
(One Co Atom ina hali ya oxidation ya +2 na nyingine 2 atomi za Co zina hali ya oxidation ya +3)
8. \(\ce{NiO}={-2}+{x}={0}⟶{x}={Ni}={+2}\)\(Ni^{2+}\)
9. \(\ce{Cu2O}={-2}+{2{x}}={0}⟶{-2}+{2x}={0}⟶{x}={Cu}={+1}\)\(Cu^{1+}\)
A19.1.25
Sc 3+; Ti 4+; V 5+; Cr 6+; Mn 4+; Fe 2+ na Fe 3+; Co 2+ na Co 3+; Ni 2+; Cu +
19.2: Kemia ya Uratibu wa Vyuma vya Mpito
Q19.2.1
Eleza nambari ya uratibu kwa atomi ya kati ya chuma katika kila moja ya misombo ya uratibu ifuatayo:
- [Pt (H 2 O) 2 Br 2]
- [Pt (NH 3) (py) (Cl) (Br)] (py = pyridine, C 5 H 5 N)
- [Zn (NH 3) 2 Cl 2]
- [Zn (NH 3) (py) (Cl) (Br)]
- [Ni (H 2 O 4) Cl 2]
- [Fe (en) 2 (CN) 2] + (en = ethylenediamine, C 2 H 8 N 2)
S19.2.1
Kwanza tunapaswa kutambua kama ligand ina atomi zaidi ya moja iliyofungwa (bidentate/polidentate). Kutumia meza hapa chini tunaweza kufanya hivyo.
| Ligand | Idadi ya atomi zilizounganishwa |
|---|---|
| Amine (NH 3) | monodentate |
| Aqua (H 2 O) | monodentate |
| Bromo (Br) | monodentate |
| Chloro (Cl) | monodentate |
| Cyano (CN) | monodentate |
| Pyridine (C 5 H 5 N) | monodentate |
| Ethylenediamine (C 2 H 8 N 2) | bidentate |
Sasa kwa kuwa tumegundua idadi ya atomi zilizounganishwa kutoka kila ligand, tunaweza kupata jumla ya idadi ya atomi zilizounganishwa na ioni ya kati ya chuma, kutupa namba ya uratibu.
- \([Pt(H_2O)_2Br_2]\): Tunaweza kutambua ion chuma katika tata kama Pt, platinum, kama wengine wawili ni waliotajwa kama ligands hapo juu na ni nonmetallic. Sasa tunaweza kutumia idadi ya ligandi na atomi zao za kuunganisha ili kupata namba yake ya uratibu. Kutoka jedwali hapo juu tunaona kwamba H 2 O ina chembe moja tu ya kuunganisha na Br pia. Hivyo kwa kila chembe Br tuna moja bonding atomi, na tuna mbili ya hizi, kujitoa 2 bonding atomi; hii ni sawa kwa H 2 O, kutupa idadi ya atomi 4 bonding, na kwa hiyo uratibu idadi ya 4.
- \([Pt(NH_3)(py)(Cl)(Br)]\)(py = pyridine, C 5 H 5 N): Ioni ya chuma katika tata hii, sawa na ya kwanza, inaweza kutambuliwa kama Pt, platinum. Ligandi zinaweza kutambuliwa kama NH 3, pyridine, Cl, na Br, ambazo zote ni ligandi za monodentati na zina atomu moja ya kuunganisha kila mmoja. Kwa kuwa tuna ligands nne, kila mmoja na atomi moja ya kuunganisha, jumla ya atomi za kuunganisha kwenye ion ya chuma ni 4, kwa hiyo tata ina idadi ya uratibu wa 4.
- \([Zn(NH_3)_2Cl_2]\): Ioni ya chuma katika tata hii inaweza kutambuliwa kama Zn, zinki, na ligands zinaweza kutambuliwa kama NH 3 na Cl. Kwa kuwa hizi mbili zote mbili ni ligandi za monodentati zina atomu moja ya kuunganisha kila mmoja. Kwa kuwa tuna jumla ya mbili NH 3 na mbili ligands Cl, sisi kupata jumla ya nne ligands monodentate, kutupa 4 bonding atomi na uratibu idadi ya 4.
- \([Zn(NH_3)(py)(Cl)(Br)]\): Ioni ya chuma katika tata hii inaweza kutambuliwa kama Zn, zinki, na ligandi zinaweza kutambuliwa kama NH 3, pyridine, Cl, na Br, ambazo zote ni ligandi za monodentate na zina atomu moja ya kuunganisha kila mmoja. Kwa kuwa tuna ligands nne, kila mmoja na atomi moja ya kuunganisha, jumla ya atomi za kuunganisha kwenye ion ya chuma ni 4, kwa hiyo tata ina idadi ya uratibu wa 4.
- \([Ni(H_2O)_4Cl_2]\): Ioni ya chuma katika tata hii inaweza kutambuliwa kama Ni, nikeli, na sasa tunaweza kutumia idadi ya ligandi na atomi zao za kuunganisha ili kupata namba yake ya uratibu. Kutoka jedwali hapo juu tunaona kwamba H 2 O ina atomi moja tu ya kuunganisha na Cl pia. Hivyo kwa kila chembe Cl tuna moja bonding atomi, na tuna mbili ya hizi, kujitoa 2 bonding atomi. H 2 O ni sawa, kuwa na atomi moja tu ya kuunganisha, lakini kuna nne kati ya hizi. Hivyo hii inatupa jumla ya idadi ya atomi 6 bonding, na hivyo idadi uratibu wa 6.
- \([Fe(en)_2(CN)_2]^+\)(en = ethylenediamine, C 2 H 8 N 2): Ioni ya chuma katika tata hii inaweza kutambuliwa kama Fe, chuma, na ligands inaweza kutambuliwa kama (en) na CN. Tangu (en) ni bidentate, maana ina 2 atomi bonding, na kuna wawili wa hizi, jumla ya idadi ya atomi bonding kutoka (en) ni nne. Kwa kuwa CN ni monodentati, maana yake ina atomi moja ya kuunganisha, na kuna mbili kati ya hizi, jumla ya idadi ya atomi za kuunganisha kutoka CN ligand ni mbili. Kwa hiyo, idadi ya atomi za kuunganisha ni 6, kwa hiyo tata ina idadi ya uratibu wa 6.
A19.2.1
- Aqua 2 na 2 bromo ligands kuunda jumla ya 4 kuratibu vifungo covalent na matokeo yake idadi ya uratibu ni 4.
- Amine, pyridine, chloro na bromo kila fomu moja kuratibu dhamana covalent ambayo inatoa jumla ya 4 na hivyo CN=4.
- Amine mbili na mbili ligands chloro kutoa jumla ya 4 kuratibu vifungo covalent na CN = 4.
- Amine moja, pyrimidine, chloro na ligand ya bromo hutoa jumla ya vifungo 4 vya covalent, na kusababisha CN = 4.
- Ligandi nne za aqua na ligandi mbili za kloro huunda jumla ya vifungo 6 vya kuratibu covalent na CN =6.
- Ethylenediamine ni ligand ya bidentate ambayo huunda vifungo viwili vya kuratibu covalent; pamoja na ligandi mbili za cyano, huunda jumla ya vifungo 6, na hivyo ina CN=6.
Q19.2.2
Kutoa namba za uratibu na uandike fomu kwa kila moja ya yafuatayo, ikiwa ni pamoja na isomers zote ikiwa inafaa:
- tetrahydroxozincate (II) ion (tetrahedral)
- hexacyanopalladate (IV) juu
- dichloroaurate ion (kumbuka kwamba aurum ni Kilatini kwa “dhahabu”)
- diaminedichloroplatinum (II)
- potassium almasi tetrachlorochromate (III)
- hexaamminecobalt (III) hexacyanochromate (III)
- dibromobis (ethylenediamine) cobalt (III) nitrati
S19.2.2
Kuamua namba za uratibu tunapaswa kuhesabu idadi ya ligands iliyounganishwa na chuma cha kati na kutofautisha ligands za monodentate na polidentate. Kuamua formula, tunatumia sheria za majina na kufanya kazi nyuma.
- “tetrahydroxo” = ligandi 4 za hidroksidi; tangu hidroksidi ni ligand ya monodentate, tuna jumla ya vifungo 4 kwenye chuma cha kati.
Uratibu Idadi: 4
Sisi kupitia misingi ya utaratibu wa majina na kuona kwamba “tetra” = 4 na “hydroxo” = OH -. Kwa kuwa malipo ya zinki ni 2+, ambayo hutolewa katika nomenclature na namba za Kirumi, tunaweza kuhesabu malipo ya jumla kwenye ngumu kuwa 2-.
Mfumo: [Zn (OH) 4] 2- - “hexacyano” = 6 ligands ya cyanide; tangu sianidi ni ligand ya monodentate, tuna jumla ya vifungo 6 kwenye chuma cha kati.
Uratibu Idadi: 6
Sisi kupitia misingi ya utaratibu wa majina na kuona kwamba “hexa” = 6 na “cyano” = CN -. Kwa kuwa malipo ya Pd ni 4+, ambayo hutolewa katika nomenclature na namba za Kirumi, tunaweza kuhesabu malipo ya jumla kwenye ngumu kuwa 2-.
Mfumo: [Pd (CN) 6] 2 - “dichloro” = 2 ligands ya kloridi; tangu kloridi ni ligand ya monodentate, tuna jumla ya vifungo 2 kwenye chuma cha kati.
Uratibu Idadi: 2
Sisi kupitia misingi ya utaratibu wa majina na kuona kwamba “di” = 2 na “chloro” = Cl -. Kwa kuwa malipo ya Au daima ni 1+, tunaweza kuhesabu malipo ya jumla kwenye ngumu kuwa 1-.
Mfumo: [AuCl 2] - - “diammine” = 2 ligandi za amonia na “dichloro” = 2 ligands ya kloridi; kwa kuwa ligandi zote za amonia na kloridi ni monodentate, tuna jumla ya vifungo 4 kwenye chuma cha kati.
Idadi ya Uratibu: 4
Tunaangalia misingi ya utaratibu wa majina na kuona kwamba “di” = 2, “chloro” = Cl - na “ammine” = NH 3. Kwa kuwa malipo ya Pt ni 2+, ambayo hutolewa katika nomenclature na namba za Kirumi, tunaweza kuhesabu kwamba malipo ya jumla ni 0, hivyo tata haifai.
Mfumo: [Pt (NH 3) 2 Cl 2] - “diammine” = 2 ligandi za amonia na “tetrachloro” = ligandi 4 za kloridi; kwa kuwa ligandi zote za amonia na kloridi ni monodentate, tuna jumla ya vifungo 6 kwenye chuma cha kati.
Uratibu Idadi: 6
Sisi kupitia misingi ya utaratibu wa majina na kuona kwamba “di” = 2, “ammine” = NH 3, “tetra” = 4 na “chloro” = Cl -. Kwa kuwa malipo kwenye chuma cha kati, Cr, ni 3+, ambayo hutolewa katika nomenclature na namba za Kirumi, tunaweza kuhesabu kwamba malipo ya jumla ya tata ni 1-. “Potasiamu” mbele ya nomenclature inaonyesha kwamba ni cation sambamba na tata hii anionic.
Mfumo: K [Cr (NH 3) 2 Cl 4] - Vipande vyote vya chuma vina “hexa” ligands za monodentate, ambayo inamaanisha wote wana idadi ya uratibu wa 6.
Uratibu Idadi: 6
Sisi kupitia misingi ya utaratibu wa majina na kuona kwamba “hexa” = 6, “ammine” = NH 3, na “cyano” = CN -. Kwa kuwa malipo ya Cr ni 3+ na Co ni 3+, ambayo hutolewa katika nomenclature na namba za Kirumi, tunaona kwamba mashtaka haya ya tata yanafanana.
Mfumo: [Co (NH 3) 6] [Cr (CN) 6] - “dibromo” = 2 ligandi za bromidi “bis (ethylenediamine)” = 2 (en) ligandi; bromidi ni ligandi ya monodentati ilhali (en) ni ligandi ya bidentati. Kwa hiyo, tuna idadi ya uratibu wa 6.
Idadi ya Uratibu: 6
Tunaangalia misingi ya utaratibu wa majina na kuona kwamba “di” = 2, “bromo” = Br -, “bis” = 2, na “ethylenediamine” = sw. Kwa kuwa malipo ya Co ni 3+, ambayo hutolewa katika nomenclature na namba za Kirumi, tunaona kwamba malipo ya jumla ya tata ni 1+. Nitrate ni anion inayofanana na tata hii ya cationic.
Mfumo: [Co (en) 2 Br 2] NO 3
A19.2.2
- 4, [Zn (OH) 4] 2;
- 6, [Pd (CN) 6] 2;
- 2, [AUCl 2] -;
- 4, [Pt (NH 3) 2 Cl 2];
- 6, K [Cr (NH 3) 2 Cl 4];
- 6, [Co (NH 3) 6] [Cr (CN) 6];
- 6, [Co (sw) 2 Br 2] NO 3
Q19.2.3
Kutoa namba ya uratibu kwa kila ion ya chuma katika misombo ifuatayo:
- [Co (CO 3) 3] 3—( kumbuka kuwa CO 3 2 - ni bidentate katika tata hii)
- [Cu (NH 3) 4] 2+
- [Co (NH 3) 4 rubles 2] 2 (SO 4) 3
- [Pt (NH 3) 4] [PtCl 4]
- [Cr (sw) 3] (NO 3) 3
- [Pd (NH 3) 2 rubles 2] (mpango mraba)
- K 3 [Cu (Cl) 5]
- [Zn (NH 3) 2 Cl 2]
S19.2.3
Unaweza kuamua namba ya uratibu wa kiwanja kulingana na jinsi ligandi nyingi zinafungwa kwenye atomi kuu.
1) Katika kiwanja hiki, Cobalt ni atomi kuu, na ina 3 CO 3 2- molekuli zilizounganishwa nayo. Hata hivyo, CO 3 2- ni ligandi ya bidentati, maana yake inafunga kwa atomu ya kati katika sehemu mbili badala ya moja. Hii ina maana kwamba idadi ya uratibu wa [Co (CO 3) 3] 3- ni 6. Nambari ya uratibu wa 6 ina maana kwamba muundo huo ni uwezekano mkubwa wa octahedral.
2) Katika kiwanja hiki, Copper ni atomi kuu. 4 molekuli za amonia zimeunganishwa nayo. Hii ina maana namba ya uratibu ni 4, na muundo ni uwezekano wa tetrahedral.
3) Kwa kiwanja hiki, tunaweza kupuuza (SO 4) 3 kwa sababu si amefungwa kwa atomu kuu. Atomu ya kati ni cobalt, na ina molekuli 4 za amonia na molekuli 2 za bromini zilizofungwa nayo. Nambari ya uratibu ni 6.
4) Kuna misombo miwili hapa, iliyoonyeshwa na mabano. Atomi kuu kwa wote wawili ni platinamu. Mmoja wao ana molekuli 4 za amonia zilizounganishwa, na nyingine ina atomi 4 za klorini zilizounganishwa. Wote complexes wana idadi ya uratibu wa 4.
5) Tunaweza kupuuza (NO 3) 3 kwa kiwanja hiki. Atomu ya kati ni Chromium. Kuna molekuli 3 za ethylenediamine zilizounganishwa na chromium. Ethylenediamine ni ligand ya bidentate, hivyo namba ya uratibu ni 6.
6) Palladium ni atomi kuu. Molekuli 2 za amonia na atomi 2 za bromini zinatokana na atomi ya palladium. Nambari ya uratibu ni 4.
7) Tunaweza kupuuza muundo wa K 3. Copper ni atomi kuu, na kuna molekuli 5 za klorini zilizounganishwa nayo. Nambari ya uratibu ni 5, hivyo muundo ni ama trigonal bipyramidal au mraba pyramidal.
8) Katika kiwanja hiki, zinki ni atomi kuu. Kuna molekuli 2 za amonia na atomi 2 za klorini zilizounganishwa. Hii ina maana kwamba idadi ya uratibu ni 4.
Q19.2.4
Mchoro miundo ya complexes zifuatazo. Onyesha yoyote cis, trans, na isomers macho.
- [Pt (H 2 O) 2 rubles 2] (planar mraba)
- [Pt (NH 3) (py) (Cl) (Br)] (planar mraba, py = pyridine, C 5 H 5 N)
- [Zn (NH 3) 3 Cl] + (tetrahedral)
- [Pt (NH 3) 3 Cl] + (mpango wa mraba)
- [Ni (H 2 O 4) Cl 2]
- [Co (C 2 O 4) 2 Cl 2] 3—( kumbuka kuwa\(\ce{C2O4^2-}\) ni ioni bidentate oxalate,\(\ce{−O2CCO2-}\))
S19.2.4
Cis na trans ni aina ya isoma ya kijiometri, maana kuna tofauti katika mwelekeo ambao ligands zinaunganishwa na chuma cha kati. Katika cis, mbili ya ligands sawa ni karibu na mtu mwingine na katika trans, mbili ya ligands sawa ni moja kwa moja hela kutoka kwa mtu mwingine.
Isoma za macho → zina uwezo wa kugeuza mwanga, isomers za macho pia ni chiral. Tu complexes chiral na isomers macho
Chiral → asymmetric, muundo wa picha yake ya kioo haipatikani
Enantiomers: isoma ya macho ya chiral (kiwanja kinaweza kuwa na enantiomers nyingi)
Tetrahedral tata na ligands 4 tofauti → daima chiral
- Kwa tetrahedral, ikiwa ligands 2 ni sawa, basi haiwezi kuwa chiral, ina ndege ya ulinganifu
Ufumbuzi:
a.\([Pt(H_2O)_2Br_2]\) (mpango wa mraba)
Ugumu huu una aina 2 za ligands. Ligands vinavyolingana zinaweza kuwa karibu na kila mmoja na kuwa cis, au zinaweza kuwa hela kutoka kwa kila mmoja na kuwa trans.
b.\([Pt(NH_3)(py)(Cl)(Br)]\) (mpango wa mraba, py = pyridine,\(C_5H_5N\))
Ugumu huu una ligands 4 tofauti. Hakuna ndege ya ulinganifu katika yoyote ya enantiomers, na kufanya miundo chiral na kwa hiyo ina isomers macho.
c.\([Zn(NH_3)_3Cl]^+\) (tetrahedral)
Kuna ndege ya ulinganifu kutoka\(Zn\) kwa\(NH_3\) njia ya nyingine\(NH_3\), kwa hiyo sio chiral.
d.\([Pt(NH_3)_3Cl]^+\) (mpango wa mraba)
Kuna ndege ya ulinganifu kutoka\(Pt\) kwa\(NH_3\) njia ya nyingine\(NH_3\), kwa hiyo sio chiral.
e.\([Ni(H_2O)_2Cl_2]\)
\(Cl\)Ligands inaweza ama kuwa haki karibu na kila mmoja, au moja kwa moja hela kutoka kwa mtu mwingine kuruhusu kwa wote cis na trans geometries.
f.\([Co(C_2O_4)_2Cl_2]^-3\) (kumbuka kuwa\(C_2O_4^-2\) ni ioni ya oxalate ya bidentate,\(^−O_2CCO_2^-\)
Kuna ndege ya ulinganifu kutoka kwa\(Cl\) njia ya Co na nyingine\(Cl\) katika “trans” klorini Configuration, kwa hiyo si chiral katika klorini “trans” Configuration. Hata hivyo, hakuna ulinganifu katika usanidi wa klorini “cis”, unaonyesha isoma nyingi za “cis”.
A19.2.4
a. [Pt (H 2 O) 2 rubles 2]:
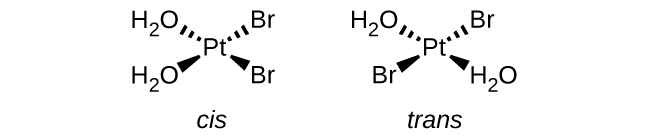
b. [Pt (NH 3) (py) (Cl) (Br)]:
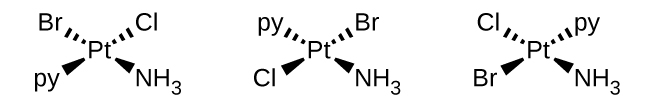
c. [Zn (NH 3) 3 Cl] +:
d. [Pt (NH 3) 3 Cl] +:

e. [Ni (H 2 O 4) Cl 2]:
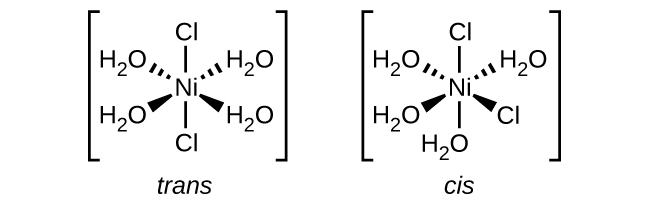
f. [Co (C 2 O 4) 2 Cl 2] 3:
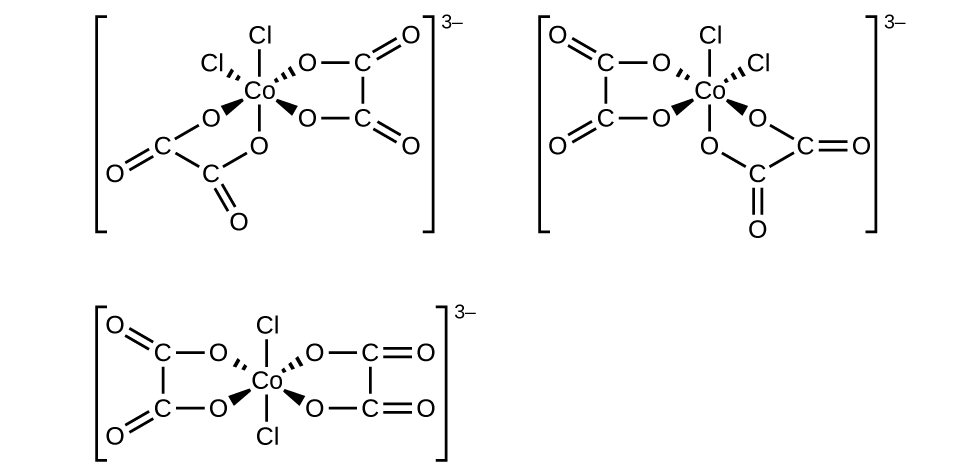
Q19.2.5
Chora michoro kwa cis yoyote, trans, na isoma macho ambayo inaweza kuwepo kwa yafuatayo (en ni ethylenediamine):
- [Co (en) 2 (NO 2) Cl] +
- [Co (en) 2 Cl 2] +
- [Pt (NH 3) 2 Cl 4]
- [Cr (sw) 3] 3+
- [Pt (NH 3) 2 Cl 2]
S19.2.5
Tunaagizwa kuteka isomers zote za kijiometri na isomers za macho kwa kiwanja maalum. Isoma za macho zipo wakati usanidi wa isomer hauwezi kuingizwa kwenye picha yake ya kioo. Hii inamaanisha kuna maumbo mawili tofauti ya Masi. Mara nyingi mkono wa kushoto na wa kulia unatajwa kama mfano; ikiwa ungechukua mkono wako wa kuume na kuiweka upande wako wa kushoto, huwezi kufanya sehemu kuu za mkono wako zimeunganishwa juu ya kila mmoja. Wazo la msingi wakati wa kuamua kama kitu kinachofanya kazi kwa macho ni kutafuta ndege ya ulinganifu-ikiwa una uwezo wa kugawanya kiwanja kwa namna inayoanzisha ulinganifu, basi kiwanja hakina isoma ya macho.
Isoma za Cis zipo wakati kuna ligandi 2 za spishi moja zilizowekwa kwenye pembe 90 za shahada kutoka kwa kila mmoja. Isoma za Trans zipo wakati kuna ligandi 2 za spishi moja zilizowekwa kwenye pembe 180 za shahada kutoka kwa kila mmoja.
Tatizo 1
Kiwanja hiki ni molekuli ya octahedral, hivyo ligandi sita (atomi katika tata ambazo sio chuma cha mpito kati) huwekwa karibu na atomi ya kati kwa pembe 90 za shahada. Isoma mbili za macho zipo kwa [Co (en) 2 (NO 2) Cl] +. Isoma ya pili hutolewa kwa kuchukua picha ya kioo ya kwanza.
Tatizo 2
Kiwanja hiki pia ni molekuli ya octahedral. Mbili cis (macho) isomers na moja trans isoma kuwepo kwa [Co (en) 2 Cl 2] +. Isoma ya trans inaweza kuteka kwa kuweka ligandi za klorini katika nafasi ambapo zinaunda angle ya shahada 180 na atomi ya kati. Isoma ya kwanza ya cis inaweza kuteka kwa kuweka ligandi za klorini katika nafasi ambapo zinaunda angle ya shahada 90 na atomi ya kati. Isoma ya pili ya cis inaweza kupatikana kwa kuiga isoma ya kwanza ya cis, kama tulivyofanya katika tatizo 1.
Tatizo 3
Kiwanja hiki pia ni molekuli ya octahedral. Moja trans isoma na moja cis isoma ya [Pt (NH 3) 2 Cl 4] zipo. Isoma ya trans inaweza inayotolewa kwa kuweka ligandi za amonia katika nafasi ambapo huunda angle ya shahada 180 na atomi ya kati. Isoma ya cis inaweza kuteka kwa kuweka ligandi za amonia katika nafasi ambapo huunda angle ya shahada 90 na atomi ya kati.
Tatizo 4
Kiwanja hiki pia ni molekuli ya octahedral. Mbili isoma macho kwa [Cr (en) 3] 3+ zipo. Isoma ya pili ya macho inaweza kupatikana kwa kuchukua picha ya kioo ya isoma ya kwanza ya macho.
Tatizo 5
Kiwanja hiki ni tata ya mpango wa mraba, hivyo ligandi huwekwa karibu na atomi ya kati katika ndege, kwenye pembe 90. isoma trans na isoma cis kuwepo kwa tata [Pt (NH 3) 2 Cl 2]. Isoma ya trans inaweza kuvutwa kwa kuweka ligandi za amonia katika nafasi ambapo huunda angle ya shahada 180 katika ndege yenye atomi ya kati. Isoma ya cis inaweza kuteka kwa kuweka ligandi za amonia katika nafasi ambapo zinaunda angle ya shahada 90 katika ndege na atomi ya kati.
Q19.2.6
Jina kila moja ya misombo au ions iliyotolewa katika Zoezi Q19.2.3, ikiwa ni pamoja na hali ya oxidation ya chuma.
S19.2.6
Kanuni za kufuata kwa complexes ya uratibu
1. Cations daima huitwa kabla ya anions.
2. Ligandi ni jina kabla ya atomi ya chuma au ion.
3. Majina ya Ligand yamebadilishwa na kuongezwa kwa jina la mzizi wa anioni. Kwa ligands zisizo na upande jina la molekuli hutumiwa, isipokuwa OH2, NH3, CO na NO.
4. Viambishi awali mono—, di—, tri—, tetra—, penta—, na hexa— hutumika kuashiria idadi ya ligandi rahisi.
5. Viambishi awali bis—, tris—, tetrakis— n.k., vinatumika kwa ligandi ngumu zaidi au zile ambazo tayari zina di—, tri— n.k.
6. Hali ya oxidation ya ion ya kati ya chuma huteuliwa na nambari ya Kirumi katika mabano.
7. Wakati aina zaidi ya moja ya ligand iko, huitwa kialfabeti. Viambishi awali haviathiri utaratibu.
8. Ikiwa ion tata ina malipo hasi, suffix -ate imeongezwa kwa jina la chuma.
9. Katika kesi ya isomerism tata ya ioni majina cis, trans, fac, au mer yanaweza kutangulia formula ya jina tata la ioni ili kuonyesha mpangilio wa anga wa ligandi. Cis ina maana ligands kuchukua nafasi karibu uratibu, na trans ina maana nafasi kinyume kama wao kufanya kwa misombo ya kikaboni. Ugumu wa complexes octahedral inaruhusu isomers mbili za ziada za kijiometri ambazo ni za pekee kwa complexes ya uratibu. Fac ina maana ya uso, au kwamba tatu kama ligands huchukua alama za uso mmoja wa octahedron. Mer ina maana meridional, au kwamba tatu kama ligandi huchukua vipeo vya pembetatu upande mmoja ambao ni pamoja na atomi ya kati ya chuma au ion.
A19.2.6
- tricarbonatocobaltate (III) ion;
- tetraaminecopper (II) ion;
- tetraaminedibromocobalt (III) sulfate;
- tetraamini platinum (II) tetrachloroplatinate (II);
- tris- (ethylenediamine) chromium (III) nitrati;
- diaminedibromopalladium (II);
- pentachlorocuprate ya potasiamu (II);
- diamine dichlorozinc (II)
Q19.2.7
Jina kila moja ya misombo au ions iliyotolewa katika Zoezi Q19.2.5.
S19.2.7
Kutokana na:
- [Co (en) 2 (NO 2) Cl] +
- [Co (en) 2 Cl 2] +
- [Pt (NH 3) 2 Cl 4]
- [Cr (sw) 3] 3+
- [Pt (NH 3) 2 Cl 2]
Alitaka:
Majina ya misombo hapo juu.
1. [Co (en) 2 (NO 2) Cl] +
Hatua ya 1: Fikia majina ya ligands na mawasiliano ya chuma. Majina yanaweza kupatikana hapa.
Co: Cobalt
sw: Ethylenediamine
NO 2: Nitro
Cl: Chloro
Hatua ya 2: Ongeza sahihi kabla ya kurekebisha kwa kila ligand kulingana na idadi. Pre-fixes inaweza kupatikana hapa.
(en) 2: bis (Ethylenediamine)
Hatua ya 3: Pata mashtaka ya ligands. Malipo yanaweza kupatikana hapa.
sw: 0
HAPANA 2: -1
Cl: -1
Hatua ya 4: Algebraically kufikia malipo ya mawasiliano ya chuma kwa kutumia malipo ya jumla ya ion tata na mashtaka ya mtu binafsi ligand.
Co + 2 (en) + (NO 2) + Cl = 1
Co +2 (0) + (-1) + (-1) = 1
Co = 3
Hatua ya 5: Kwa jina kialfabeti mahali ligands, kabla ya fixes haipaswi kuhesabiwa, na kutumia namba za Kirumi kwa mawasiliano ya chuma ambayo yanapaswa kuwekwa mwisho.
Chlorobis (ethylenediamine) nitrocobalt (III)
2. [Co (en) 2 Cl 2] +
Hatua ya 1: Fikia majina ya ligands na mawasiliano ya chuma. Majina yanaweza kupatikana hapa.
Co: Cobalt
sw: Ethylenediamine
Cl: Chloro
Hatua ya 2: Ongeza sahihi kabla ya kurekebisha kwa kila ligand kulingana na idadi. Pre-fixes inaweza kupatikana hapa.
(en) 2: bis (Ethylenediamine)
Cl 2: dichloro
Hatua ya 3: Pata mashtaka ya ligands. Malipo yanaweza kupatikana hapa.
sw: 0
Cl: -1
Hatua ya 4: Algebraically kufikia malipo ya mawasiliano ya chuma kwa kutumia malipo ya jumla ya ion tata na mashtaka ya mtu binafsi ligand.
Co + 2 (en) +2 (Cl) = 1
Co + 2 (0) + 2 (-1) = 1
Co = 3
Hatua ya 5: Kwa jina kialfabeti mahali ligands, kabla ya fixes haipaswi kuhesabiwa, na kutumia namba za Kirumi kwa mawasiliano ya chuma ambayo yanapaswa kuwekwa mwisho.
Dichlorobis (Ethylenediamine) cobalt (III)
3. [Pt (NH 3) 2 Cl 4]
Hatua ya 1: Fikia majina ya ligands na mawasiliano ya chuma. Majina yanaweza kupatikana hapa.
Pt: Platinum
NH 3: Ammine
Cl: Chloro
Hatua ya 2: Ongeza sahihi kabla ya kurekebisha kwa kila ligand kulingana na idadi. Pre-fixes inaweza kupatikana hapa.
(NH 3) 2: almasi
Cl 4: tetrachloro
Hatua ya 3: Pata mashtaka ya ligands. Malipo yanaweza kupatikana hapa.
NH 3: 0
Cl: -1
Hatua ya 4: Algebraically kufikia malipo ya mawasiliano ya chuma kwa kutumia malipo ya jumla ya ion tata na mashtaka ya mtu binafsi ligand.
Pt + 2 (NH 3) + 4 (Cl) = 0
Pt + 2 (0) + 4 (-1) = 0
Pt = 4
Hatua ya 5: Kwa jina kialfabeti mahali ligands, kabla ya fixes haipaswi kuhesabiwa, na kutumia namba za Kirumi kwa mawasiliano ya chuma ambayo yanapaswa kuwekwa mwisho.
Diamine tetrachloroplatinum (IV)
4. [Cr (sw) 3] 3+
Hatua ya 1: Fikia majina ya ligands na mawasiliano ya chuma. Majina yanaweza kupatikana hapa.
Gari: Cromium
sw: ethylenediamine
Hatua ya 2: Ongeza sahihi kabla ya kurekebisha kwa kila ligand kulingana na idadi. Pre-fixes inaweza kupatikana hapa.
(sw) 3: tris (ethylenediamine)
Hatua ya 3: Pata mashtaka ya ligands. Malipo yanaweza kupatikana hapa.
sw: 0
Hatua ya 4: Algebraically kufikia malipo ya mawasiliano ya chuma kwa kutumia malipo ya jumla ya ion tata na mashtaka ya mtu binafsi ligand.
Cr + 3 (sw) = 3
Cr + 3 (0) = 3
Cr = 3
Hatua ya 5: Kwa jina kialfabeti mahali ligands, kabla ya fixes haipaswi kuhesabiwa, na kutumia namba za Kirumi kwa mawasiliano ya chuma ambayo yanapaswa kuwekwa mwisho.
Tris (ethylenediamine) - cromium (III)
5. [Pt (NH 3) 2 Cl 2]
Hatua ya 1: Fikia majina ya ligands na mawasiliano ya chuma. Majina yanaweza kupatikana hapa.
NH 3: Ammine
Cl: Chloro
Pt: Platinum
Hatua ya 2: Ongeza sahihi kabla ya kurekebisha kwa kila ligand kulingana na idadi.
(NH 3) 2: almasi
Cl 2: dichloro
Hatua ya 3: Pata mashtaka ya ligands. Malipo yanaweza kupatikana hapa.
NH 3: 0
Cl: -1
Hatua ya 4: Algebraically kufikia malipo ya mawasiliano ya chuma kwa kutumia malipo ya jumla ya ion tata na mashtaka ya mtu binafsi ligand.
Pt + 2 (NH 3) + 2 (Cl) = 0
Pt + 2 (0) + 2 (-1) = 0
Pt = 2
Hatua ya 5: Kwa jina kialfabeti mahali ligands, kabla ya fixes haipaswi kuhesabiwa, na kutumia namba za Kirumi kwa mawasiliano ya chuma ambayo yanapaswa kuwekwa mwisho.
Diaminedichloroplatinum (II)
A19.2.7
- Chlorobis (ethylenediamine) nitrocobalt (III)
- Dichlorobis (Ethylenediamine) cobalt (III)
- Diamine tetrachloroplatinum (IV)
- Tris (ethylenediamine) - cromium (III)
- Diaminedichloroplatinum (II)
Q19.2.8
Taja kama complexes zifuatazo zina isomers.
- tetrahedral [Ni (CO 2) (Cl 2)]
- trigonal bipyramidal [Mn (CO) 4 NO]
- [Pt (en) 2 Cl 2] Cl 2
S19.2.8
Isoma ni misombo ambayo ina idadi sawa ya atomi, lakini ina miundo tofauti. Isoma za miundo (uhusiano, ionization, uratibu) na stereoisomers (jiometri na macho) zinaweza kutokea kwa misombo kadhaa.
1. tetrahedral\(\mathrm{[Ni(CO)_2(Cl)_2]}\)
(Kielelezo 1.) Katika mfano huu, nikeli ni atomi ya kati ya kijani, ligandi za kabonili ni atomi ya pink, na ligandi za chloro ni atomi za kijani nyepesi.
Mara moja, tunaweza kufuta uwezekano wa kuunganisha, ionization, na isomers ya uratibu. Hakuna uratibu mwingine wa uratibu wa isomerism ya uratibu, hakuna ligand ambayo inaweza kushikamana na atomi kwa njia zaidi ya moja ili kuonyesha isomerism ya uhusiano, na hakuna ions nje ya nyanja ya uratibu kwa isomerism ionization.
Huu ni muundo wa tetrahedral ambao mara moja hutawala isoma zozote za kijiometri kwani zinahitaji pembe za dhamana za 90° na/au 180°. Miundo ya tetrahedral ina pembe 109.5°.
Ili kuthibitisha kwamba muundo hauna isoma ya macho, lazima tueleze ikiwa kuna ndege ya ulinganifu. Miundo ambayo haina ndege ya ulinganifu inachukuliwa kuwa ya chiral na ingekuwa na isoma za macho.
(Kielelezo 2.) Tunaweza kugeuza muundo na kupata kwamba kwa kweli kuna ndege ya ulinganifu kupitia ligandi mbili za kloro na atomi ya kati na kati ya ligandi za kabonili.
Kwa kuwa kuna ndege ya ulinganifu, tunaweza kuhitimisha kuwa hakuna isomers za macho.
Kwa ujumla, hakuna isomers zilizopo kwa kiwanja hiki.
2. trigonal byprimidal\(\mathrm{[Mn(CO)_4(NO)]}\)
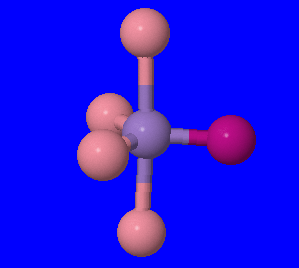
(Kielelezo 3.) Atomi ya kati ya zambarau ni manganese, ligandi za kabonili ni atomi za pink, na ligand ya nitrosyl ni atomi ya fuschia.
Hakuna ions, tata nyingine ya uratibu, na ligands ambidentate. Kwa hiyo, hakuna isoma za miundo zilizopo kwa muundo huu.
Isoma za kijiometri hazipo kwa kiwanja hiki kwa sababu kuna ligand moja tu ya nitrosyl.
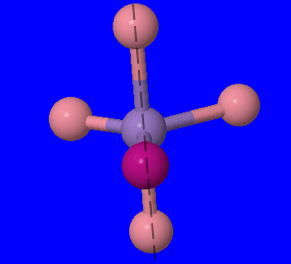
(Kielelezo 4.) Dashed line bisects molekuli na inaonyesha ndege ya ulinganifu. Molekuli imezungushwa katika picha hii.
Katika picha hapo juu, baada ya muundo kuzungushwa, tunaweza kuona kwamba kuna ndege ya ulinganifu. Kwa hiyo, hakuna isomers za macho.
Hakuna isomers (zilizotajwa hapo juu) zipo kwa kiwanja hiki.
3. \(\mathrm{[Pt(en)_{2}Cl_2]Cl_2}\)
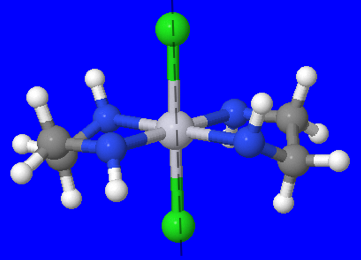
(Kielelezo 5.) Atomi za kijani ni ligandi za kloro, atomu ya kati ni platinamu, na atomi za kijivu/buluu ni ligandi za ethyldiamine.
Uratibu isomerism haiwezi kuwepo kwa tata hii kwa sababu hakuna magumu mengine. Hakuna isoma za uhusiano kwa sababu hakuna ligandi za ambidentate. Isoma za ionization haziwezi kuwepo katika tata hii ama, ingawa kuna molekuli ya neutral nje ya nyanja ya uratibu. Kama sisi kubadilishana\(\mathrm{Cl_2}\) na moja ethyldiamine molekuli, Kutakuwa na 5 ligands katika nyanja uratibu badala ya 4. Tofauti hii katika uwiano wa atomi ya chuma kwa ligandi inamaanisha kuwa isoma ya ionization haiwezi kuwepo.
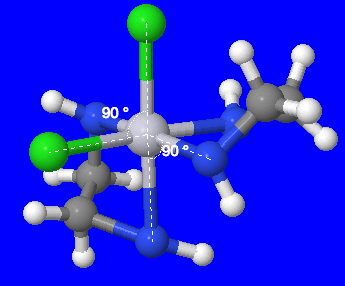
(Kielelezo 6.) Hapa, ligand moja ya chloro ilibadilisha sehemu na ethyldiamine ili iweze kuwa kwenye angle ya 90° na ligand nyingine ya chloro.
Picha hapo juu, inaonyesha ligandi za kloro na ethyldiamine kwenye angle ya 90° na ligandi yake nyingine inayofanana. Hii ni isoma ya cis, wakati Mtini. 5 inaonyesha isoma ya trans.
Kielelezo 5. inaonyesha kwamba kuna ndege ya ulinganifu katika isoma ya trans. Kwa hiyo, muundo huo hauna isoma ya macho. Kwa upande mwingine, isoma ya cis haina ndege ya ulinganifu na kwa hiyo ina isoma ya macho.
A19.2.8
hakuna; hakuna; mbili Cl ligands inaweza kuwa cis au trans. Wakati wao ni cis, kutakuwa na isoma ya macho.
Q19.2.9
Kutabiri kama ligand\(\ce{CO3^2-}\) carbonate kuratibu na kituo cha chuma kama monodentate, bidentate, au tridentate ligand.
S19.2.9
\(\ce{CO3^2−}\)inaweza kuwa ama monodentate au bidentate, kwa kuwa mbili za atomi zake za oksijeni zina jozi moja kama ilivyoonyeshwa hapo juu na zinaweza kuunda vifungo vya covalent na ioni ya chuma ya mpito. Katika hali nyingi carbonate ni monodentati kwa sababu ya jiometri yake ya trigonal planar (kuna digrii 120 kati ya oksijeni hivyo ni vigumu kwa wote kumfunga kwa chuma sawa). Hata hivyo, wakati mwingine itakuwa kumfunga kwa metali mbili tofauti, na kuifanya bidentate.
A19.2.9
CO 3 -2 itaratibu kituo cha chuma kama ligand ya monodentate.
Q19.2.10
Chora isoma za kijiometri, uhusiano, na ionization kwa [CoCl 5 CN] [CN].
S19.2.10
Isoma ni misombo yenye fomula ileile lakini mpangilio wa atomu tofauti. Kuna makundi mawili: isoma za kimuundo, ambazo ni isoma ambazo zina idadi sawa ya atomi za kila aina lakini hutofautiana ambazo atomi zinaunganishwa, na stereoisoma, isomers ambazo zina fomula sawa za Masi na ligandi, lakini hutofautiana katika mpangilio wa wale ligands katika nafasi ya 3D.
Kuna makundi matatu chini ya isoma za kimuundo: isomers ionization, ambazo ni isoma zinazofanana isipokuwa kwa ligand ina kubadilishana maeneo na molekuli ya anioni au ya neutral ambayo awali ilikuwa nje ya tata ya uratibu; isoma za uratibu, isoma zilizo na kubadilishana kwa ligands fulani kutoka sehemu ya cationic hadi sehemu ya anionic; na isoma za kuunganisha, katika misombo miwili au zaidi ya uratibu ambayo atomi ya wafadhili ya angalau moja ya ligands ni tofauti.
Pia kuna aina mbili kuu ya stereoisoma: isomers kijiometri, complexes chuma ambayo tofauti tu ambayo ligands ni karibu na mtu mwingine (cis) au moja kwa moja hela kutoka kwa mtu mwingine (trans) katika uratibu nyanja ya chuma, na isoma macho, ambayo hutokea wakati kioo picha ya kitu ni yasiyo ya superimposable juu ya kitu awali.
Baadhi ya isoma huonekana karibu sawa, lakini hiyo ni kwa sababu CN ligand inaweza kushikamana na wote (lakini si wakati huo huo) C au N.
A19.2.10

19.3: Spectroscopic na Magnetic Mali ya Uratibu Misombo
Q19.3.1
Tambua idadi ya elektroni zisizoharibika zinazotarajiwa kwa [Fe (NO 2) 6] 3—na kwa [FeF 6] 3—kwa mujibu wa nadharia ya kioo ya shamba.
S19.3.1
- Nadharia ya shamba la kioo ni mfano unaoelezea kuvunjika kwa upunguvu wa majimbo ya orbital ya elektroni, kwa kawaida d au f orbitals, kutokana na uwanja wa umeme tuli unaozalishwa na usambazaji wa malipo ya jirani.
- D-orbitals d-degenerate imegawanywa katika ngazi mbili\(_{2g}\), e\(_{g}\) na t, mbele ya ligands.
- Tofauti ya nishati kati ya viwango viwili huitwa nishati ya kugawanya shamba la kioo,\(\Delta_{\circ}\).
- Baada ya elektroni 1 kila mmoja imejazwa katika\(_{2g}\) orbitals tatu t, kujazwa kwa elektroni ya nne hufanyika ama katika e\(_{g}\) orbital au katika t\(_{2g}\), ambapo elektroni jozi up. kulingana na kama tata ni spin ya juu au spin ya chini.
- Ikiwa\(\Delta_{\circ}\) thamani ya ligand ni chini ya nishati ya kuunganisha (P), basi elektroni huingia e\(_{g}\) orbital, lakini ikiwa\(\Delta_{\circ}\) thamani ya ligand ni zaidi ya nishati ya pairing (P), basi elektroni huingia t\(_{2g}\) orbital.
- wakati
ni chini ya nishati pairing, elektroni wanapendelea basi e g orbitals kwa sababu hakuna nishati ya kutosha kwa jozi elektroni pamoja. Itakuwa high spin
- wakati
ni zaidi ya nishati pairing, elektroni wanapendelea t 2g kwa sababu kuna nishati ya kutosha kwa jozi elektroni. Itakuwa chini ya spin.
Hatua ya 1: Tambua hali ya oxidation ya Fe
Kwa\([Fe(NO_{2}){_{6}}]^{3-}\) na\([FeF_{6}]^{3-}\), wote wawili\(NO_{2}\) na\(F_{6}\) kuwa na malipo ya -1. Kwa kuwa kuna 6 kati yao basi hiyo inamaanisha malipo ni -6 na ili kuwe na malipo ya jumla ya -3, Fe inapaswa kuwa na malipo ya +3.
Hatua ya 2: Tambua aina ya ligand
Kulingana na mfululizo spectrochemical tunaweza kuona kwamba\(NO_{2}^{-}\) ni nguvu uwanja ligand ya F\(^{-}\), na kwa hiyo ni ya chini spin tata kwa sababu ina high\(\Delta_{\circ}\) tofauti F\(^{-}\) ambayo ni spin high.
Hatua ya 3: Chora shamba la kioo
\([Fe(NO_{2}){_{6}}]^{3-}\)
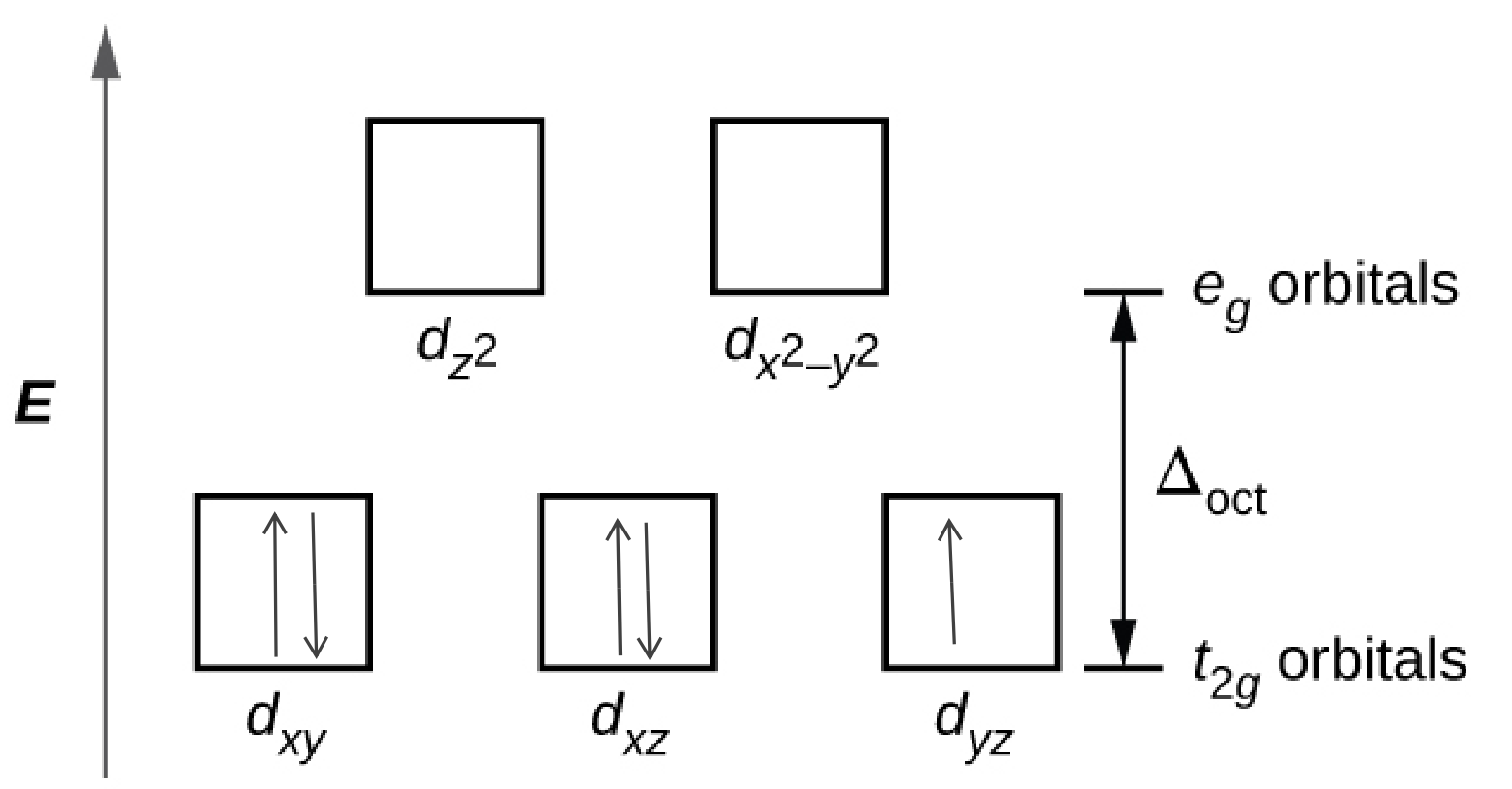
\([FeF_{6}]^{3-}\)
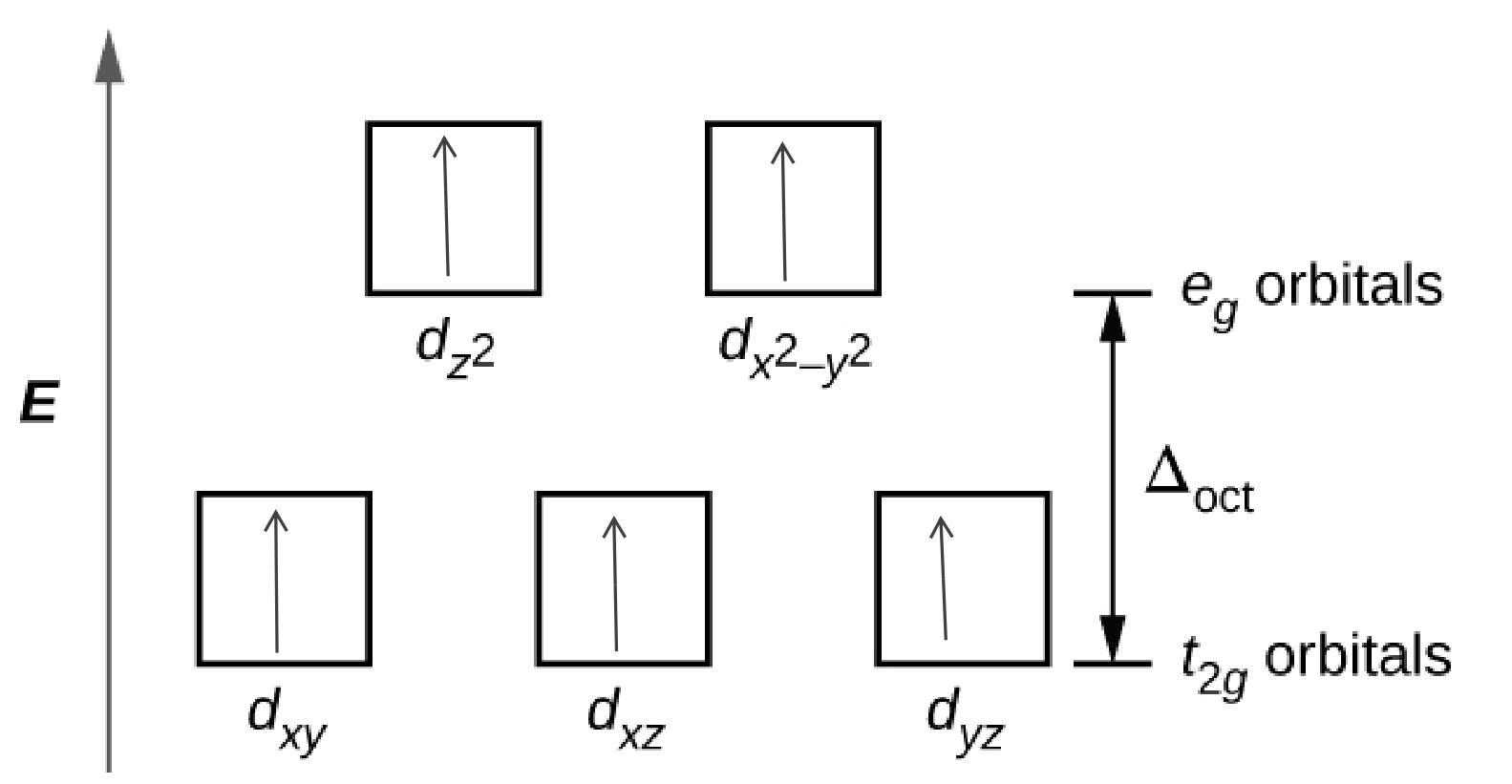
Kuna 1 unpaired elektroni kwa\([Fe(NO_{2}){_{6}}]^{3-}\), na 5 kwa\([FeF_{6}]^{3-}\) misingi ya nadharia kioo shamba.
A19.3.1
[Fe (NO 2) 6] 3:1 elektroni
[FeF 6] elektroni 3:5
Q19.3.2
Chora michoro ya shamba la kioo kwa ajili ya [Fe (NO 2) 6] 4 na [FeF 6] 2-. Hali kama kila tata ni spin ya juu au chini spin, paramagnetic au diamagnetic, na kulinganisha Δ Okt kwa P kwa kila tata.
S19.3.2
a)\[[Fe(NO_2)_6]^{_{-4}}\]
- NO 2 - ina malipo -1. Ioni ya jumla ina malipo ya -4, kwa hiyo Fe lazima awe +2 malipo. (hesabu: \(x+(6)(-1)=-4, x+-6=-4, x=+2\)au 2+ (6*-1) =-4)
- Fe 2+ ina elektroni 6 za valence.
- Next sisi kuangalia ligand bonded kwa Fe, ambayo ni NO 2 -. Kulingana na Spectrochemical Series, NO 2 - ni nguvu shamba ligand maana kwamba ina kubwa DELTA o kubwa splitting nishati ikilinganishwa na nishati pairing, P. hivyo elektroni ingekuwa afadhali jozi up, kama inachukua kiasi kidogo cha nishati.
- Hivyo [Fe (NO 2) 6] 4—ni spin ya chini.
- Electroni zote 6 zimeunganishwa, hivyo ni diamagnetic.
b)\[[FeF_6]^{_{-3}}\]
- F - ina malipo -1. Ioni ya jumla ina malipo ya -3, kwa hiyo Fe lazima iwe malipo ya +3. (hesabu: \(x+(-1)(6)=-3, x+-6=-3, x=+3\)au 3+ (6*-1) =-3)
- F 3 + ina elektroni za valence 5.
- Next sisi kuangalia ligand bonded kwa Fe, ambayo ni F -. Kulingana na Spectrochemical Series, F - ni dhaifu shamba ligand, maana yake ni kwamba ina ndogo DELTA o au ndogo splitting nishati ikilinganishwa na nishati pairing, P. hivyo elektroni ni afadhali kupasuliwa na hoja juu ya kiwango cha juu cha nishati, badala ya pairing up, kama inachukua angalau kiasi cha nishati.
- Hivyo [Fe (NO 2) 6] 4—ni spin kubwa.
- [FeF 6] 3—ni paramagnetic kwa sababu ina elektroni zisizoharibika.
A19.3.2
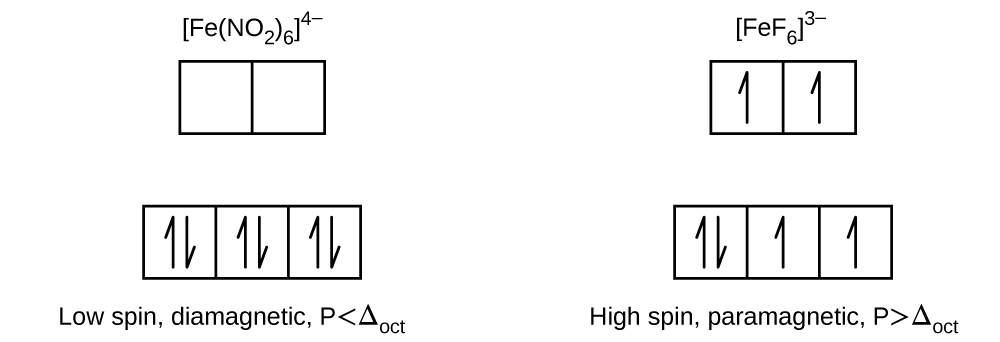
Q19.3.3
Kutoa hali ya oxidation ya chuma, idadi ya elektroni d, na idadi ya elektroni zisizoharibika zilizotabiriwa kwa [Co (NH 3) 6] Cl 3.
S19.3.3
Hali ya oxidation ya chuma inaweza kupatikana kwa kutambua malipo ya moja ya kila molekuli katika kiwanja cha kuratibu, kuzidisha malipo ya kila molekuli kwa idadi husika ya molekuli zilizopo, na kuongeza bidhaa. Jumla hii ya mwisho inawakilisha malipo ya kiwanja cha jumla cha uratibu. Unaweza kisha kutatua hali ya oxidation ya chuma algebraically. Katika kesi hii, anion moja ya kloridi Cl - ina malipo ya -1. Hivyo anioni tatu za kloridi zina malipo ya jumla ya -3. Ligand moja ya ammine NH 3 haina malipo hivyo ligandi sita za amini zina malipo ya jumla ya sifuri. Hatimaye, tunajaribu kutatua hali ya oxidation ya ion ya cobalt. Sasa tunaweza kuandika equation kwamba anaongeza mashtaka jumla ya kila molekuli au ion na ni sawa na malipo ya jumla ya jumla ya kuratibu kiwanja.
\[ (\text{oxidation}\text{ state}\text{ of}\text{ Co})+(-3)+0=0 \]
\[ \text{oxidation}\text{ state}\text{ of}\text{ Co}=+3 \]
Hivyo hali ya oxidation ya Co ni +3. Sasa tunahitaji kutambua idadi ya d-elektroni katika Co 3+ ion. Configuration ya elektroni kwa cobalt ambayo haina malipo ni
\[ [\text{Ar}]4\text{s}^23\text{d}^7 \]
Hata hivyo, ioni ya Co 3+ ina elektroni 3 chini kuliko mwenzake wa neutral na ina usanidi wa elektroni wa
\[ [\text{Ar}]3\text{d}^6 \]
Kwa metali za mpito,\( \text{s} \) elektroni zinapotea kwanza. Hivyo cobalt inapoteza\( 4\text{s} \) elektroni zake mbili kwanza halafu hupoteza\( 3\text{d} \) elektroni moja inayomaanisha Co 3+ ion ina\( \text{d} \) elektroni 6. Ili kutabiri idadi ya elektroni zisizo na nguvu, lazima kwanza tueleze kama ngumu ni ya juu ya spin au spin ya chini. Ikiwa ngumu ni spin ya juu au spin ya chini imedhamiriwa na ligand katika tata ya kuratibu. Hasa, ligand inapaswa kutambuliwa kama ligand dhaifu ya shamba au ligand yenye nguvu ya shamba kulingana na mfululizo wa spectrochemical. Ligands dhaifu shamba kushawishi spin high wakati nguvu shamba ligands kushawishi spin chini. Tunaweza kisha kujenga mchoro nishati au kioo shamba mchoro wa spin mteule ambayo ina sahihi elektroni placings. Sura ya kijiometri ya kiwanja lazima pia kutambuliwa ili kujenga mchoro sahihi. Hatimaye, kutokana na mchoro huu kioo shamba tunaweza kuamua idadi ya elektroni unpaired. Idadi ya elektroni katika mchoro ni sawa na idadi ya\( \text{d} \) elektroni za chuma. Ligand katika kesi hii ni NH 3, ambayo ni shamba ligand yenye nguvu kulingana na mfululizo wa spectrochemical. Hii ina maana kwamba tata ni ndogo spin. Zaidi ya hayo, ligands sita za monodentate inamaanisha uwanja wa ligand ni octahedral. Idadi ya elektroni ambayo itakuwa katika mchoro ni 6 tangu ion ya chuma Co 3+ ina\( \text{d} \) elektroni 6. Sasa mchoro sahihi wa shamba la kioo unaweza kujengwa.
.jpg)
Kutoka kwenye mchoro wa shamba la kioo, tunaweza kusema kwamba tata haina elektroni zisizo na uharibifu.
A19.3.3
a) 3+
b) 6 d elektroni
c) Hakuna elektroni zisizo na uharibifu
Q19.3.4
CoCl 2 imara imara ya anhydrous ni rangi ya bluu. Kwa sababu urahisi inachukua maji kutoka hewa, ni kutumika kama kiashiria unyevu kufuatilia kama vifaa (kama vile simu ya mkononi) imekuwa wazi kwa viwango vya kupindukia ya unyevu. Kutabiri ni bidhaa gani inayoundwa na mmenyuko huu, na ngapi elektroni zisizo na uharibifu huu utakuwa na ngumu hii.
S19.3.4
Kutokana na ujuzi wetu wa ligands na misombo ya uratibu (au ikiwa unahitaji misombo ya uratibu wa kufufua), tunaweza kudhani bidhaa za CoCL 2 katika maji. H 2 O ni ligand ya kawaida dhaifu ya shamba inayounda vifungo sita vya ligand karibu na atomu ya kati ya Cobalt ilhali Kloridi inakaa kwenye tufe la nje. Tunaweza kutumia hii kuamua tata:
\([Co(H_2O)_6]Cl_2\)
Kutokana na malezi haya, tunaweza kutumia Theory ya Uwanja wa Crystal (CFT) (Theory ya Field ya Crystal) kuamua idadi ya elektroni zisizoharibika. Kiwanja hiki cha uratibu kina vifungo sita vya ligand vilivyounganishwa na atomu ya kati ambayo inamaanisha mfano wa CFT utafuata ugawanyiko wa octahedral. Kumbuka kwamba tunajua H 2 O ni dhaifu shamba ligand na kuzalisha spin high. High spin ni wakati elektroni pairing nishati (P) ni kubwa kuliko octahedral splitting nishati. Hivyo, elektroni huenea na kuongeza spin.
Ili kujaza mchoro wetu wa shamba la kioo, tunahitaji kuamua malipo ya cobalt. Kwa sababu H 2 O ligand ni neutral, na kuna ions mbili klorini, tunaweza kuthibitisha malipo ya cobalt ni pamoja na mbili ili kufanya uratibu tata neutral. Kutoka hapa, tunaweza kutumia Configuration elektroni ya Co 2+ ni [Ar] 4s 2 3d 7. Electroni ambazo zinachukuliwa mbali na atomi ya cobalt ili kuunda malipo ya pamoja na mbili zitatoka kwa orbital ya 4s na kuacha orbital 3d bila kutafakari. Hivyo, kutakuwa na elektroni 7 katika mchoro wa shamba la kioo na kuonekana kama:
Tunaweza kuona hapa kwamba kuna elektroni 3 zisizo na nguvu.
A19.3.4
[Co (H 2 O) 6] Cl 2 na elektroni tatu zisizo na nguvu.
Q19.3.5
Inawezekana kwa tata ya chuma katika mfululizo wa mpito kuwa na elektroni sita zisizo na nguvu? Eleza.
A19.3.5
Inawezekana kwa tata ya chuma katika mfululizo wa mpito kuwa na elektroni sita zisizo na nguvu? Eleza.
Haiwezekani kwa chuma katika mfululizo wa mpito kuwa na elektroni sita zisizo na nguvu. Hii ni kwa sababu metali za mpito zina usanidi wa jumla wa elektroni wa (n-1) d 1-10 ns 1-2 ambapo n ni namba ya quantum. Electroni ya mwisho itaingia katika orbital d ambayo ina orbitals 5 ambayo inaweza kila vyenye elektroni 2, ikitoa elektroni 10 jumla. Kwa mujibu wa Utawala wa Hund, elektroni hupendelea kujaza kila orbital peke yake kabla ya kuunganisha. Hii ni nzuri zaidi kwa nguvu. Kwa kuwa kuna orbitals 5 tu na kutokana na Utawala wa Hund, idadi kubwa ya elektroni zisizo na nguvu ambazo chuma cha mpito kinaweza kuwa na 5. Kwa hiyo, hawezi kuwa na tata ya metali ya mpito ambayo ina elektroni 6 zisizo na nguvu.
Kwa mfano, hebu tuangalie usanidi wa elektroni wa chuma. Iron ina usanidi wa elektroni wa 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6. Sasa orbital muhimu zaidi ya kuangalia ni d orbital ambayo ina elektroni 6 ndani yake, lakini kuna elektroni 4 tu zisizoharibika kama unavyoweza kuona kwa mchoro huu:
3d: [] [] [] []
Kila [] inawakilisha orbital ndani ya d orbital. Mchoro huu unafuata utawala wa Hund na unaonyesha kwa nini hakuna chuma cha mpito kinachoweza kuwa na elektroni 6 zisizo na nguvu.
Q19.3.6
Ni elektroni ngapi zisizo na nguvu zilizopo katika kila moja ya yafuatayo?
- [Cof 6] 3—( high spin)
- [Mn (CN) 6] 3—( spin chini)
- [Mn (CN) 6] 4—( spin chini)
- [MnCl 6] 4—( high spin)
- [RHCl 6] 3—( chini spin)
S19.3.6
1. Kwa [CoF 6] 3-, sisi kwanza kupatikana hali oxidation ya Co, ambayo ni 3+tangu F ina 1- malipo na kwa kuwa kuna 6 F, malipo Co lazima 3+kwa malipo ya jumla kuwa 3-.
\[\textrm{charge of Co} + \textrm{-6} = \textrm{-6}\]\[\textrm{charge of Co} = \textrm{+3}\]
Baada ya kupata hali ya oxidation, kisha nenda kwenye meza ya mara kwa mara ili kupata usanidi wake wa elektroni: [Ar] 3d 6
Tunasambaza elektroni 6 d-orbital pamoja na ngumu na kwa kuwa ni spin ya juu, elektroni inasambazwa mara moja katika kila ngazi ya nishati kabla ya kuunganishwa. Kuna jozi moja tu na elektroni nyingine 4 hazipatikani, na kufanya jibu 4.

2. Mchakato huo unarudiwa. Tunapata malipo ya Mn, ambayo ni 3+, na kufanya usanidi wa elektroni: [Ar] 3d 4
\[\textrm{charge of Mn} + \textrm{-6} = \textrm{-3}\]\[\textrm{charge of Mn} = \textrm{+3}\]
Kuna tofauti kati ya hii na namba 1. Hii ni ya chini spin hivyo badala ya kusambaza elektroni moja katika kila ngazi kabla ya pairing yake, ni lazima kusambaza elektroni moja juu ya chini na kisha jozi yao yote juu kabla ya mimi nina uwezo wa hoja ya sehemu ya juu. Hivyo kwa kuwa kuna 4, kuna jozi tu katika d yz na nyingine elektroni mbili ni unpaired. Kufanya idadi ya elektroni zisizo na nguvu 2.
3.Mchakato huo kama namba 2 hutumiwa. Tofauti pekee ni kwamba malipo ya Mn sasa ni 2+ hivyo usanidi wa elektroni: [Ar] 3d 5.
\[\textrm{charge of Mn} + \textrm{-6} = \textrm{-4}\]\[\textrm{charge of Mn} = \textrm{+2}\]
Kwa kuwa ni ya chini spin kama namba 2, mimi tu haja ya kuongeza elektroni ziada katika ngazi ya pili, na kufanya kwamba 2 jozi ya elektroni na elektroni 1 tu unpaired.

4. Kwa kuwa Cl ina chaji -1 kama CN, malipo ya Mn pia ni 2+ yenye usanidi sawa wa elektroni kama namba 3, ambayo ni 5.
\[\textrm{charge of Mn} + \textrm{-6} = \textrm{-4}\]\[\textrm{charge of Mn} = \textrm{+2}\]
Kwa elektroni 5, hii ni spin ya juu badala ya chini. Hivyo kama ilivyoelezwa katika namba 1, sisi jozi kusambaza elektroni katika ngazi zote kwanza. Kwa kuwa kuna elektroni 5 na ngazi 5 na zote zinasambazwa, kuna jozi za sifuri, na kuifanya kuwa elektroni 5 zisizo na nguvu.

5. Kutumia mchakato sawa na matatizo hapo juu, malipo ya Rh ni 3+, na usanidi wa elektroni: [Kr] 4d 6.
\[\textrm{charge of Rh} + \textrm{-6} = \textrm{-3}\]\[\textrm{charge of Mn} = \textrm{+3}\]
Kwa spin ya chini na elektroni 6, elektroni zote zimeunganishwa, na kuifanya elektroni 0 ambazo hazipatikani.

A19.3.6
4; 2; 1; 5; 0
Q19.3.7
Eleza jinsi ioni ya diphosphate, [O 3 P-O-PO 3] 4—inaweza kufanya kazi kama softener ya maji inayozuia mvua ya Fe 2+ kama chumvi isiyo na chuma.
S19.3.7
Ioni ya diphosphate, [O 3 P—O-PO 3] 4—inaweza kufanya kazi kama softener ya maji inayoweka chuma katika fomu ya mumunyifu wa maji kwa sababu ya uwezo wake hasi wa electrochemical kuliko ya maji. Hii ni sawa na njia ya upako unazuia metali kuitikia na oksijeni ili kutu.
Amana ya madini huundwa na athari za ionic. Fe 2+ itaunda chumvi isiyo na chuma ya chuma (III) oxide-hidroksidi wakati chumvi ya chuma cha feri hidrolisisi maji. Hata hivyo, pamoja na kuongezewa kwa [O 3 P-O-PO 3] 4, cations Fe 2+ huvutiwa zaidi na kundi la PO 3, na kutengeneza tata ya Fe (PO 3).
Madini ya ziada katika aina hii ya maji huchukuliwa kuwa ngumu hivyo jina lake maji ngumu.
Q19.3.8
Kwa magumu ya ioni sawa ya chuma na hakuna mabadiliko katika idadi ya oxidation, utulivu huongezeka kama idadi ya elektroni katika orbitals t 2 g huongezeka. Ni ngumu gani katika kila jozi zifuatazo za complexes ni imara zaidi?
- [Fe (H 2 O) 6] 2+ au [Fe (CN) 6] 4
- [Co (NH 3) 6] 3+ au [Cof 6] 3
- [Mn (CN) 6] 4—au [MnCl 6] 4-
S19.3.8
Spectrochemical Series ni kama ifuatavyo:\[I^{-}<Br^{-}<SCN^{-}\approx Cl^{-}<F^{-}<OH^{-}<ONO^{-}<ox<H_{2}O<SCN^{-}<EDTA<NH_{3}<en<NO_{2}^{-}<CN\]
Ligandi za shamba kali (upande wa kulia) ni spin ya chini ambayo hujaza elektroni zaidi katika orbitals t 2 g. Ligandi za shamba dhaifu (upande wa kushoto) ni spin ya juu hivyo inaweza kujaza elektroni katika orbitals t 2 g na e g orbitals. Kwa kumalizia, elektroni zaidi hujazwa kutoka ligandi zenye nguvu za shamba kwa sababu elektroni hazisogei hadi kwenye orbitali e g.
a.\([Fe(CN)_{6}]^{4-}\)
\(CN\)ni ligand nguvu kuliko\(H_{2}O\) hivyo ni ya chini spin, ambayo hujaza up t 2 g orbitals.
b.\([Co(NH_{3})_{6}]^{3+}\)
\(NH_{3}\)ni ligand yenye nguvu kuliko\(F\).
c.\([Mn(CN)_{6}]^{4-}\)
\(CN\)ni ligand yenye nguvu kuliko\(Cl^{-}\).
Kwa habari zaidi kuhusu sura ya usanidi tata na d-elektroni, libretext hutoa maelezo zaidi juu ya jinsi ya kuainisha magumu ya juu na ya chini ya spin.
A19.3.8
[Fe (CN) 6] 4—4; [Co (NH 3) 6] 3+; [Mn (CN) 6] 4-
Q19.3.9
Trimethylphosphine, P (CH 3) 3, inaweza kutenda kama ligand kwa kutoa jozi moja ya elektroni kwenye atomi ya fosforasi. Ikiwa trimethylphosphine imeongezwa kwenye suluhisho la kloridi ya nikeli (II) katika asetoni, kiwanja cha bluu ambacho kina molekuli ya takriban 270 g na ina 21.5% Ni, 26.0% Cl, na 52.5% P (CH 3) 3 inaweza kutengwa. Kiwanja hiki cha bluu hauna aina yoyote ya isomeric. Je, ni jiometri na formula ya Masi ya kiwanja cha bluu?
S19.3.9
1) Pata fomu ya upimaji. Kuna jumla ya gramu 270. Ili kujua ni gramu ngapi za kila kipengele/kiwanja kuna, kuzidisha asilimia kwa wingi (270).
\[(270g)(0.215)=58.05gNi\]
\[(270g)(0.26)=70.2gCl\]
\[(270g)(0.525)=141.75gP(CH_3)_3\]
Sasa kwa kuwa tuna gramu za kila kipengele/kiwanja, tunaweza kuzibadilisha kwa moles kwa kutumia molekuli yao ya molar.
\[(58.055gNi)(\frac{1mol.}{58.69gNi})=0.989mol.Ni\]
\[(70.2gCl)(\frac{1mol.}{35.45gCl})=1.98mol.Cl\]
\[(141.75gP(CH_3)_3)(\frac{1mol.}{76.07gP(CH_3)_3})=1.86mol.P(CH_3)_3\]
Sasa kwa kuwa tuna moles ya mambo yote/misombo, tunaweza kupata uwiano wa wote kwa kila mmoja. Ili kufanya hivyo, tunachukua kipengele/kiwanja na kiasi kidogo cha moles na kugawanya moles zote za kipengele/kiwanja kwa kiasi hiki. Katika kesi hiyo, Ni ina idadi ndogo ya moles.
\[\frac{0.989mol.Ni}{0.989mol.Ni}=1\]
\[\frac{1.98mol.Cl}{0.989mol.Ni}=approx.2\]
\[\frac{1.86mol.P(CH_3)_3}{0.989mol.Ni}=approx.2\]
Sasa tunajua uwiano wa kipengele chote/misombo katika kiwanja cha bluu.
Fomu ya upimaji ni: NiCl (P (CH 3) 3) 2
Fomu hii inatuonyesha kuna ligands 4. Kuna ligands 2 za klorini na ligands 2 za trimethylphosphine. Hii ina maana kwamba kiwanja bluu ina ama tetrahedral au mraba planar sura, ambapo maumbo tetrahedral ni uwezo wa aina tofauti isomeric wakati ligands zote ni tofauti (kwa sababu kama si, kuna njia 1 tu kwa ajili yao kupangwa), na maumbo ya mraba planar ni uwezo wa aina CIS/trans. Katika tatizo, inasema kiwanja hiki hakina aina yoyote ya isomeric, kwa hiyo hii ina sura ya tetrahedral.
A19.3.9
a) NiCl (P (CH 3) 32)
b) Tetrahedral
Q19.3.10
Je, unatarajia tata [Co (en) 3] Cl 3 kuwa na elektroni yoyote unpaired? Isomers yoyote?
S19.3.10
Weka majimbo ya oxidation kwa kila kipengele. Cl- ina hali ya oxidation -1. En ni neutral, hivyo 0. Ngumu nzima pia haifai, hivyo ili kusawazisha mashtaka nje, Co lazima iwe +3 kwa sababu kuna kloridi 3, ambayo inatoa malipo -3.
HATUA YA 2:
Andika usanidi wa elektroni kwa\(Co^{3+}\). \([Ar]3d^6\). Kuna elektroni 6.
HATUA YA 3:
Angalia ambapo sw liko juu ya mfululizo spectrochemical. Je, ina nguvu ya shamba kali? Inafanya hivyo, hivyo elektroni hizi zitakuwepo katika ngazi ya d na nishati ya juu ya kugawanyika kwa sababu ukubwa wa nishati ya kuunganisha ni chini ya nishati ya kugawanya shamba la kioo katika uwanja wa octahedral.
Utaona kwamba hakuna elektroni zisizo na nguvu wakati unapochora mchoro wa Theory ya Uwanja wa Crystal (CFT).
Ugumu huu hauna isoma zozote za kijiometri kwa sababu miundo ya cis-trans haiwezi kuundwa. Picha ya kioo haipatikani, ambayo inamaanisha kuwa enantiomers ni molekuli za chiral; ikiwa picha ya kioo imewekwa juu juu ya molekuli ya awali, basi hawatakuwa kamwe kikamilifu iliyokaa ili kutoa molekuli sawa.
A19.3.10
Ngumu haina elektroni yoyote isiyoharibika. Ngumu haina isomers yoyote ya kijiometri, lakini picha ya kioo haipatikani, kwa hiyo ina isoma ya macho.
Q19.3.11
Je, unatarajia Mg 3 [Cr (CN) 6] 2 kuwa diamagnetic au paramagnetic? Eleza hoja zako.
S19.3.11
Hatua ya kwanza ya kuamua magnetism ya tata ni kuhesabu hali ya oxidation ya chuma cha mpito. Katika kesi hiyo, chuma cha mpito ni Cr.
Kabla ya kufanya hivyo, tunahitaji kupata malipo ya ioni tata [Cr (CN) 6] 2 kutokana na kwamba hali ya oxidation ya Mg 3 ni 2+. Kutumia michango ya\(\displaystyle Mg^{2+}\) ion na [Cr (CN) 6] 2 tata, tunaona kwamba hali oxidation ya [Cr (CN) 6] 2, x, kuwa:
\(\displaystyle 3(+2)+2(x)=0\)
\(\displaystyle x=3\)
Sasa kwa kuwa tumepata malipo ya tata ya uratibu, tunaweza kupata malipo ya chuma cha mpito Cr kutokana na kwamba malipo ya CN ni -1. Tena, kwa kutumia michango tunapata hali ya oxidation ya Cr, y, kuwa:
\(\displaystyle y + 6(-1)=-3\)
\(\displaystyle y=3\)
Kwa hiyo, hali ya oxidation ya chuma cha mpito Cr ni\(\displaystyle Cr^{3+}\)
Kisha, kwa kutumia chuma cha mpito\(\displaystyle Cr^{3+}\) na meza ya mara kwa mara kama kumbukumbu, tunaweza kuamua usanidi wa elektroni wa\(\displaystyle Cr^{3+}\) kuwa\(\displaystyle [Ar]d^{3}\). Hii ina maana kwamba\(\displaystyle Cr^{3+}\) ina 3 elektroni unpaired katika sublevel 3d. Kwa hiyo, tunaona kwamba kwa kuwa angalau elektroni moja haifai (katika kesi hii elektroni zote 3 hazipatikani), Mg 3 [Cr (Cn) 6] 2 ni paramagnetic.
A19.3.11
a) Paramagnetic
Q19.3.12
Je, unatarajia chumvi ya ion dhahabu, Au +, kuwa rangi? Eleza.
S19.3.12
Hapana. Ions za rangi zina elektroni zisizo na uharibifu katika orbital yao ya nje. Sehemu iliyojaa d orbital, kwa mfano, inaweza kutoa rangi mbalimbali. Baada ya kukamilisha usanidi mzuri wa gesi, tunaona kwamba Au + ina usanidi wa [Xe] 4f 14 5d 10. Tangu Au + ina kabisa kujazwa d sublevel, tuna hakika kwamba chumvi yoyote ya ion dhahabu, Au + itakuwa colorless.
*Mfano wa ioni ya rangi itakuwa shaba (II). Cu 2+ ina usanidi wa elektroni wa [Ar] 3d 9. Ina elektroni moja isiyo na uharibifu. Copper (II) inaonekana bluu.
A19.3.12
Hapana. Au + ina kamili 5 d sublevel.
Q19.3.13
[CuCl 4] 2—ni kijani. [Cu (H 2 O) 6] 2+ ni bluu. Ambayo inachukua photons ya juu-nishati? Ambayo ni alitabiri kuwa kubwa kioo shamba splitting?
S19.3.13
Ingawa rangi inaweza kuonekana kwa namna fulani, ni halisi inachukua rangi tofauti, kinyume chake kwenye gurudumu la rangi. 
Katika kesi hii;
[CuCl 4] 2- inaonekana kijani lakini ni kinyume na nyekundu juu ya gurudumu rangi ambayo ni kufyonzwa na ni sifa ya wavelengths 620-800 nanometers.
[Cu (H 2 O) 6] 2+ inaonekana bluu lakini ni kinyume cha machungwa kwenye gurudumu la rangi ambayo inafyonzwa na ina sifa ya wavelengths 580-620 nanometers.
Wakati wa kuamua ambayo inachukua photons za juu za nishati, mtu lazima aangalie tata yenyewe. Nishati ya juu inaonyesha photon ya nishati ya juu iliyoingizwa na nishati ya chini inaonyesha photon ya chini ya nishati iliyoingizwa. Tunawezaje kuamua hili? Kwa kuangalia tata na zaidi hasa ligand masharti na eneo lake katika mfululizo spectrochemical.
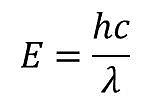

Ligandi zilizounganishwa ni Maji na klorini na tangu Maji ni ligand yenye nguvu kuliko klorini kulingana na mfululizo, pia ina nishati kubwa, inayoonyesha nishati ya juu. Hii ina maana kwamba tata [Cu (H 2 O) 6] 2+ inachukua photon ya nishati ya juu kwa sababu ya ligand yake yenye nguvu kuliko klorini.
Sehemu ya 2 ya swali hili pia inauliza ni ngumu gani inavyotabiriwa kuwa na ugawanyiko mkubwa wa kioo. Kuamua hili pia unatumia mfululizo wa spectrochemical na kuona ambayo ligand ina nguvu. Kwa kuwa H 2 O ni nguvu zaidi kuliko Cl - kwenye mfululizo wa spectrochemical, tunaweza kusema [Cu (H 2 O) 6] 2+ ina ugawanyiko wa juu wa kioo.
A19.3.13
a) [Cu (H 2 O) 6] 2+
b) [Cu (H 2 O) 6] 2+ ina juu kioo shamba splitting



