19.3: Mali ya macho na magnetic ya Misombo ya Uratibu
- Page ID
- 176690
- Eleza Nguzo ya msingi ya nadharia ya kioo shamba (CFT)
- Kutambua jiometri za Masi zinazohusiana na mifumo mbalimbali ya d-orbital splitting
- Kutabiri usanidi elektroni ya orbitals mgawanyiko d kwa kuchaguliwa atomi chuma mpito au ions
- Eleza mali ya spectral na magnetic kwa suala la dhana za CFT
Tabia ya misombo ya uratibu haiwezi kuelezewa kwa kutosha na nadharia zileile zinazotumiwa kwa kemia ya elementi ya kundi kuu Jiometri zilizoonekana za complexes za uratibu haziendani na orbitals zilizochanganywa kwenye chuma cha kati kinachoingiliana na orbitals ya ligand, kama ingekuwa inatabiriwa na nadharia ya dhamana ya valence. Rangi zilizoonekana zinaonyesha kwamba orbitals d mara nyingi hutokea katika viwango tofauti vya nishati badala ya yote kuwa degenerate, yaani, ya nishati sawa, kama ilivyo orbitals tatu p. Ili kuelezea utulivu, miundo, rangi, na mali za magnetic za complexes za chuma za mpito, mfano tofauti wa kuunganisha umeandaliwa. Kama vile valence dhamana nadharia anaelezea mambo mengi ya bonding katika kundi kuu kemia, kioo shamba nadharia ni muhimu katika kuelewa na kutabiri tabia ya complexes mpito chuma.
kioo uwanja nadharia
Ili kuelezea tabia iliyoonekana ya complexes za chuma za mpito (kama vile jinsi rangi zinavyojitokeza), mfano unaohusisha mwingiliano wa umeme kati ya elektroni kutoka ligandi na elektroni katika orbitali d zisizozalishwa za atomi ya kati ya chuma imeendelezwa. Mfano huu wa umeme ni nadharia ya shamba la kioo (CFT). Inatuwezesha kuelewa, kutafsiri, na kutabiri rangi, tabia ya magnetic, na miundo mingine ya misombo ya uratibu wa metali za mpito.
CFT inalenga katika elektroni nonbonding juu ya kati ya chuma ion katika complexes uratibu si juu ya vifungo chuma-ligand. Kama nadharia ya dhamana ya valence, CFT inaelezea sehemu tu ya hadithi ya tabia ya tata. Hata hivyo, anaelezea sehemu ambayo valence dhamana nadharia haina. Kwa fomu yake safi, CFT inapuuza ushirikiano wowote wa covalent kati ya ligands na ions za chuma. Wote ligand na chuma hutendewa kama mashtaka madogo madogo.
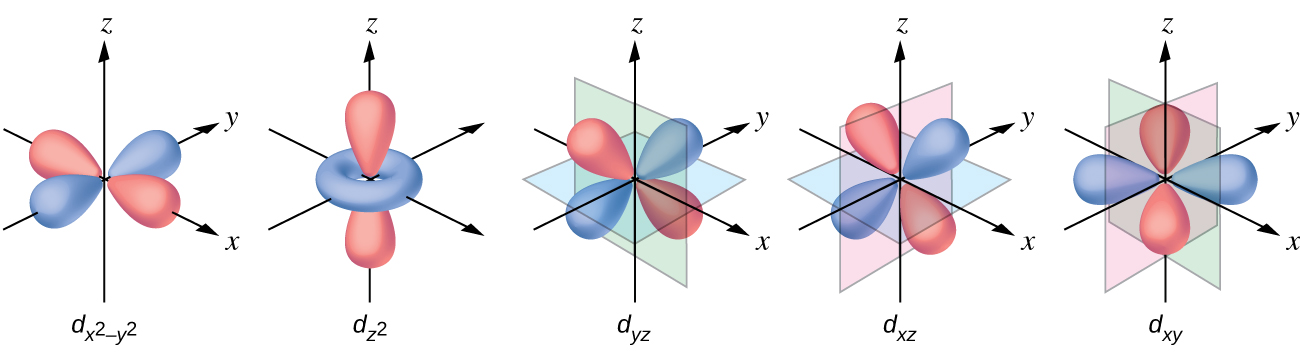
Elektroni zote ni hasi, hivyo elektroni zilizotolewa kutoka ligandi zitarudisha elektroni za chuma cha kati. Hebu tuchunguze tabia ya elektroni katika orbitals zisizosababishwa d katika tata ya octahedral. Orbitals tano d zinajumuisha mikoa ya lobe-umbo na hupangwa katika nafasi, kama inavyoonekana kwenye Mchoro\(\PageIndex{1}\). Katika tata ya octahedral, ligands sita huratibu pamoja na axes.
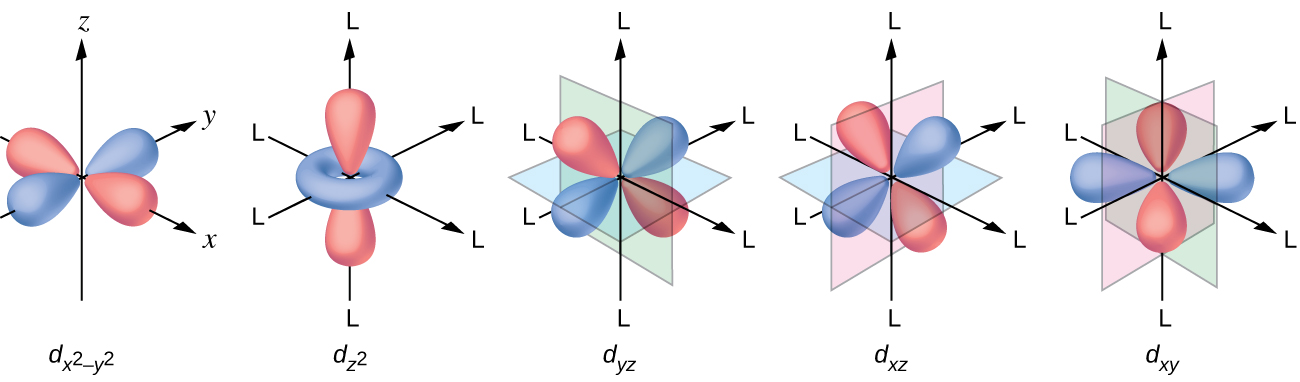
Katika ioni ya chuma isiyo na ngumu katika awamu ya gesi, elektroni zinasambazwa kati ya orbitali tano d kulingana na utawala wa Hund kwa sababu orbitali zote zina nishati sawa. Hata hivyo, wakati ligands kuratibu na ion ya chuma, nguvu za orbitals d si sawa.
Katika complexes octahedral, lobes katika mbili ya tano d orbitals,\(d_{z^2}\) na\(d_{x^2−y^2}\) orbitals, kuelekea ligands (Kielelezo\(\PageIndex{1}\)). Orbitals hizi mbili huitwa e g orbitals (ishara kweli inahusu ulinganifu wa orbitals, lakini tutatumia kama jina rahisi kwa orbitals hizi mbili katika tata octahedral). Orbitals nyingine tatu, d xy, d xz, na d yz orbitals, na lobes kwamba uhakika kati ya ligands na huitwa t 2 g orbitals (tena, ishara kweli inahusu kwa ulinganifu wa orbitals). Kama ligands sita inakaribia ion ya chuma pamoja na axes ya octahedron, mashtaka yao ya uhakika yanarudisha elektroni katika orbitals d ya ion ya chuma. Hata hivyo, repulsions kati ya elektroni katika orbitals e g (the\(d_{z^2}\) na\(d_{x^2−y^2}\) orbitals) na ligands ni kubwa kuliko repulsions kati ya elektroni katika orbitals t 2 g (d zy, d xz, na d yz orbitals) na ligands. Hii ni kwa sababu lobes ya e g orbitals uhakika moja kwa moja kwenye ligands, wakati lobes ya t 2 g orbitals uhakika kati yao. Kwa hiyo, elektroni katika mzunguko wa e g ya chuma katika tata ya octahedral zina uwezo mkubwa zaidi kuliko wale wa elektroni katika orbitals t 2 g. Tofauti katika nishati inaweza kuwakilishwa kama inavyoonekana katika Kielelezo\(\PageIndex{2}\).
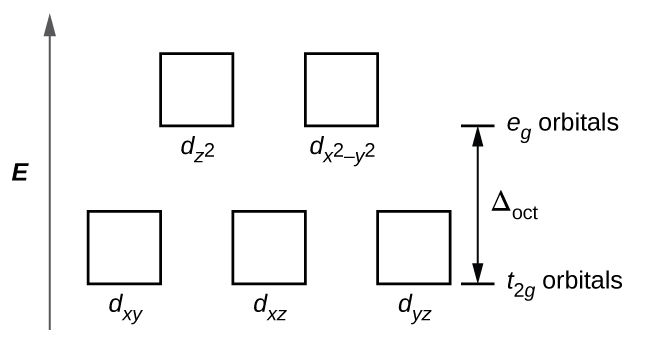
Tofauti kati ya nishati kati ya e g na t 2 g orbitals inaitwa shamba la kioo kugawanyika na inaonyeshwa na Δoct, ambapo oct inasimama kwa octahedral.
Ukubwa wa Δ oct inategemea mambo mengi, ikiwa ni pamoja na asili ya ligands sita ziko karibu na ioni ya kati ya chuma, malipo ya chuma, na kama chuma kinatumia 3 d, 4 d, au 5 d orbitals. Ligands tofauti huzalisha splittings tofauti za shamba la kioo. Kuongezeka kwa shamba la kioo lililozalishwa na ligands linaonyeshwa katika mfululizo wa spectrochemical, toleo fupi ambalo linatolewa hapa:
\[\large \underset{\textrm{a few ligands of the spectrochemical series, in order of increasing field strength of the ligand}}{\xrightarrow{\ce{I- <Br- <Cl- <F- <H2O<C2O4^2- <NH3<\mathit{en}<NO2- <CN-}}} \nonumber \]
Katika mfululizo huu, ligands upande wa kushoto husababisha splittings ndogo kioo shamba na ni dhaifu shamba ligands, ambapo wale juu ya haki kusababisha splittings kubwa na ni nguvu shamba ligands. Hivyo, thamani ya Δ oct kwa tata ya octahedral na ligands iodidi (I-) ni ndogo sana kuliko thamani Δ oct kwa chuma sawa na ligands ya cyanide (CN -).
Electroni katika orbitals d hufuata kanuni ya aufbau (“kujaza”), ambayo inasema kwamba orbitals itajazwa ili kutoa nishati ya chini kabisa, kama ilivyo katika kemia ya kikundi kikuu. Wakati elektroni mbili zinachukua orbital sawa, mashtaka kama hayo yanarudiana. Nishati inahitajika kuunganisha elektroni mbili katika orbital moja inaitwa nishati ya pairing (P). Electroni daima huchukua kila orbital katika kuweka degenerate kabla ya pairing. P ni sawa na ukubwa wa Δ oct. Wakati elektroni kujaza orbitals d, ukubwa wa jamaa wa Δ oct na P kuamua ambayo orbitals itakuwa ulichukua.
Katika [[Fe (CN) 6] 4, shamba lenye nguvu la ligandi sita za sianidi hutoa kubwa Δ Oktoba. Chini ya hali hizi, elektroni zinahitaji nishati kidogo kwa jozi kuliko zinahitaji kuwa na msisimko kwa orbitals e g (Δ oct> P). Elektroni sita 3 d ya jozi ya Fe 2 + ion katika orbitals tatu t 2 g (Kielelezo\(\PageIndex{3}\)). Complexes ambayo elektroni zimeunganishwa kwa sababu ya kugawanyika kwa shamba kubwa la kioo huitwa complexes za chini za spin kwa sababu idadi ya elektroni zisizoharibika (spins) hupunguzwa.
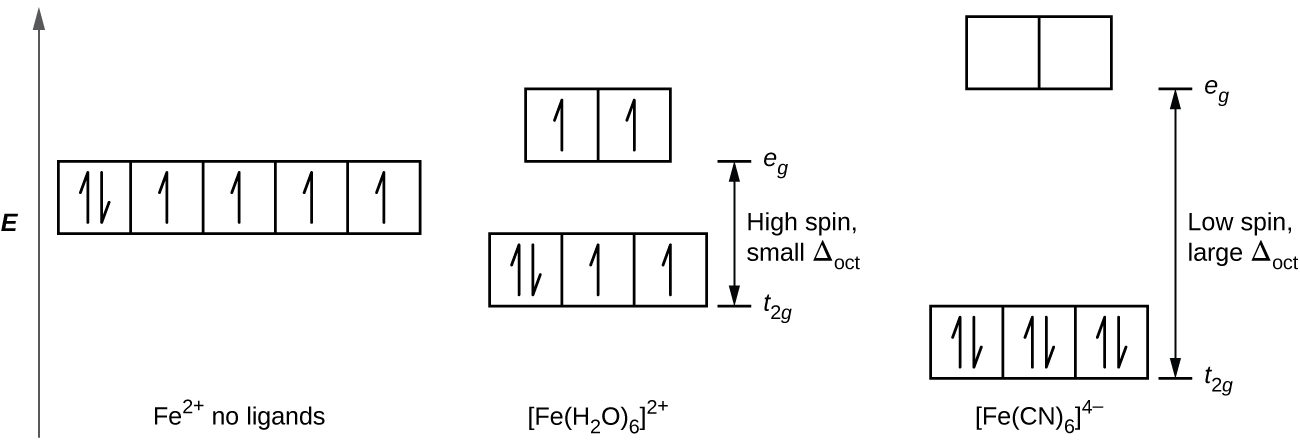
Katika [[Fe (H 2 O) 6] 2+, kwa upande mwingine, shamba dhaifu la molekuli za maji hutoa ugawanyiko mdogo wa shamba la kioo tu (Δ oct <P). Kwa sababu inahitaji nishati kidogo kwa elektroni kuchukua orbitals e g kuliko kuunganisha pamoja, kutakuwa na elektroni katika kila moja ya tano 3 d orbitals kabla ya pairing hutokea. Kwa elektroni sita d kwenye kituo cha chuma (II) katika [Fe (H 2 O) 6] 2+, kutakuwa na jozi moja ya elektroni na elektroni nne zisizo na nguvu (Kielelezo\(\PageIndex{3}\)). Complexes kama vile ioni ya [Fe (H 2 O) 6] 2+, ambamo elektroni hazipatikani kwa sababu ugawanyiko wa shamba la kioo si kubwa ya kutosha kuwafanya jozi, huitwa magumu ya juu-spin kwa sababu idadi ya elektroni zisizoharibika (spins) imepanuliwa.
Mstari sawa wa hoja unaonyesha kwa nini [Fe (CN) 6] 3 - ioni ni tata ya chini ya spin yenye elektroni moja tu isiyo na uwezo, ambapo ioni [Fe (H 2 O) 6] 3+ na [FeF 6] 3- ni magumu ya juu-spin yenye elektroni tano zisizo na nguvu.
Kutabiri idadi ya elektroni unpaired.
- K [3 CRI 6]
- [Cu (sw) 2 (H 2 O) 2] Cl 2
- Na 3 [Co (NO 2) 6]
Suluhisho
Magumu ni octahedral.
- Cr 3 + ina d 3 Configuration. Elektroni hizi zote zitakuwa zisizo na nguvu.
- Cu 2 + ni d 9, kwa hiyo kutakuwa na elektroni moja isiyo na uharibifu.
- Co 3 + ina d 6 valence elektroni, hivyo kugawanyika shamba kioo itaamua ngapi ni paired. Nitriti ni ligand yenye nguvu, hivyo tata itakuwa chini ya spin. Electroni sita zitakwenda katika orbitals t 2 g, na kuacha 0 bila kuharibika.
Ukubwa wa shamba la kioo kugawanyika huathiri tu utaratibu wa elektroni wakati kuna uchaguzi kati ya kuunganisha elektroni na kujaza orbitals ya juu-nishati. Kwa nini mazungumzo ya d -electron kutakuwa na tofauti kati ya maandalizi ya juu na ya chini ya spin katika complexes octahedral?
- Jibu
-
d 4, d 5, d 6, na d 7
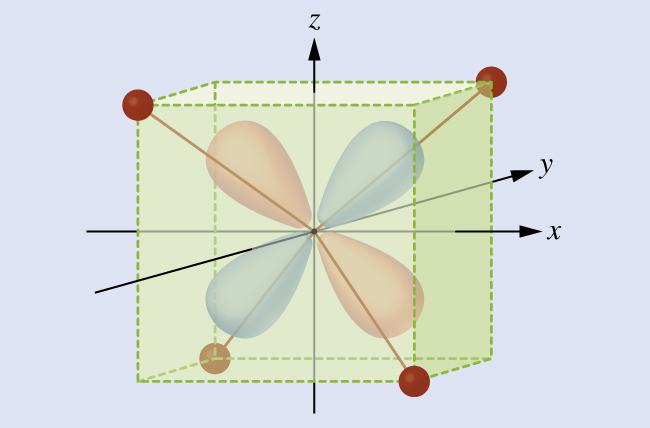
CFT inatumika kwa molekuli katika jiometri isipokuwa octahedral. Katika complexes octahedral, kumbuka kwamba lobes ya e g kuweka uhakika moja kwa moja kwenye ligands. Kwa complexes tetrahedral, orbitals d kubaki mahali, lakini sasa tuna ligands nne tu ziko kati ya axes (Kielelezo\(\PageIndex{4}\)). Hakuna mojawapo ya orbitals inayoelezea moja kwa moja kwenye ligands za tetrahedral. Hata hivyo, kuweka e g (pamoja na axes za Cartesian) huingilia na ligands chini ya kuweka t 2 g. Kwa kulinganisha na kesi ya octahedral, kutabiri mchoro wa nishati kwa orbitals d katika uwanja wa kioo wa tetrahedral. Ili kuepuka kuchanganyikiwa, octahedral e g kuweka inakuwa tetrahedral e kuweka, na kuweka octahedral t 2 g inakuwa t 2 kuweka.
Suluhisho
Kwa kuwa CFT inategemea repulsion umeme, orbitals karibu na ligands itakuwa destabilized na kukulia katika nishati jamaa na seti nyingine ya orbitals. Kugawanyika ni chini ya complexes octahedral kwa sababu kuingiliana ni chini, hivyo Δ tet kawaida ni ndogo\(\left(Δ_\ce{tet}=\dfrac{4}{9}Δ_\ce{oct}\right)\):
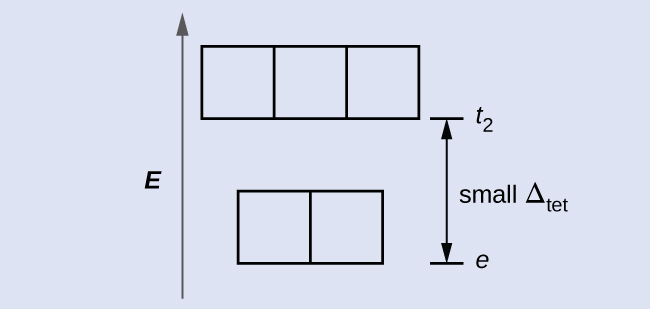
Eleza jinsi wengi unpaired elektroni tetrahedral d 4 ion itakuwa na.
- Jibu
-
4; kwa sababu Δ test ni ndogo, complexes yote ya tetrahedral ni spin ya juu na elektroni huingia kwenye orbitals t 2 kabla ya kuunganisha
Jiometri nyingine ya kawaida ni mpango wa mraba. Inawezekana kuzingatia jiometri ya mraba kama muundo wa octahedral na jozi ya ligands trans kuondolewa. Ligands zilizoondolewa zinadhaniwa kuwa kwenye z -axis. Hii inabadilisha usambazaji wa orbitals d, kama orbitals juu au karibu na z -axis kuwa imara zaidi, na wale walio juu au karibu na x- au y -axes kuwa chini imara. Hii inasababisha octahedral t 2 g na e g inaweka kugawanyika na inatoa muundo ngumu zaidi bila rahisi Δ oct. Mfano wa msingi ni:
Wakati wa magnetic wa Molekuli na Ions
Ushahidi wa majaribio ya vipimo vya magnetic unasaidia nadharia ya complexes ya juu na ya chini. Kumbuka kwamba molekuli kama O 2 zilizo na elektroni zisizoharibika ni paramagnetic. Dutu za paramagnetic zinavutiwa na mashamba ya magnetic. Complexes nyingi za chuma za mpito zina elektroni zisizo na uharibifu na hivyo ni paramagnetic. Molekuli kama vile N 2 na ioni kama vile Na + na [[Fe (CN) 6] 4—zisizo na elektroni zisizo na uharibifu ni diamagnetic. Dutu za diamagnetic zina tabia kidogo ya kupinduliwa na mashamba ya magnetic.
Wakati elektroni katika atomu au ioni inapoharibika, wakati wa sumaku kutokana na spin yake hufanya atomi nzima au ion paramagnetic. Ukubwa wa wakati wa magnetic wa mfumo ulio na elektroni zisizo na uharibifu unahusiana moja kwa moja na idadi ya elektroni hizo: idadi kubwa ya elektroni zisizoharibika, wakati mkubwa wa magnetic. Kwa hiyo, wakati wa magnetic uliozingatiwa hutumiwa kuamua idadi ya elektroni zisizo na uharibifu zilizopo. Kipimo cha magnetic cha chini cha spin d 6 [Fe (CN) 6] 4—inathibitisha kuwa chuma ni diamagnetic, wakati high-spin d 6 [Fe (H 2 O) 6] 2+ ina elektroni nne zisizo na nguvu na wakati wa magnetic ambayo unathibitisha utaratibu huu.
Rangi ya Complexes ya Chuma ya Mpito
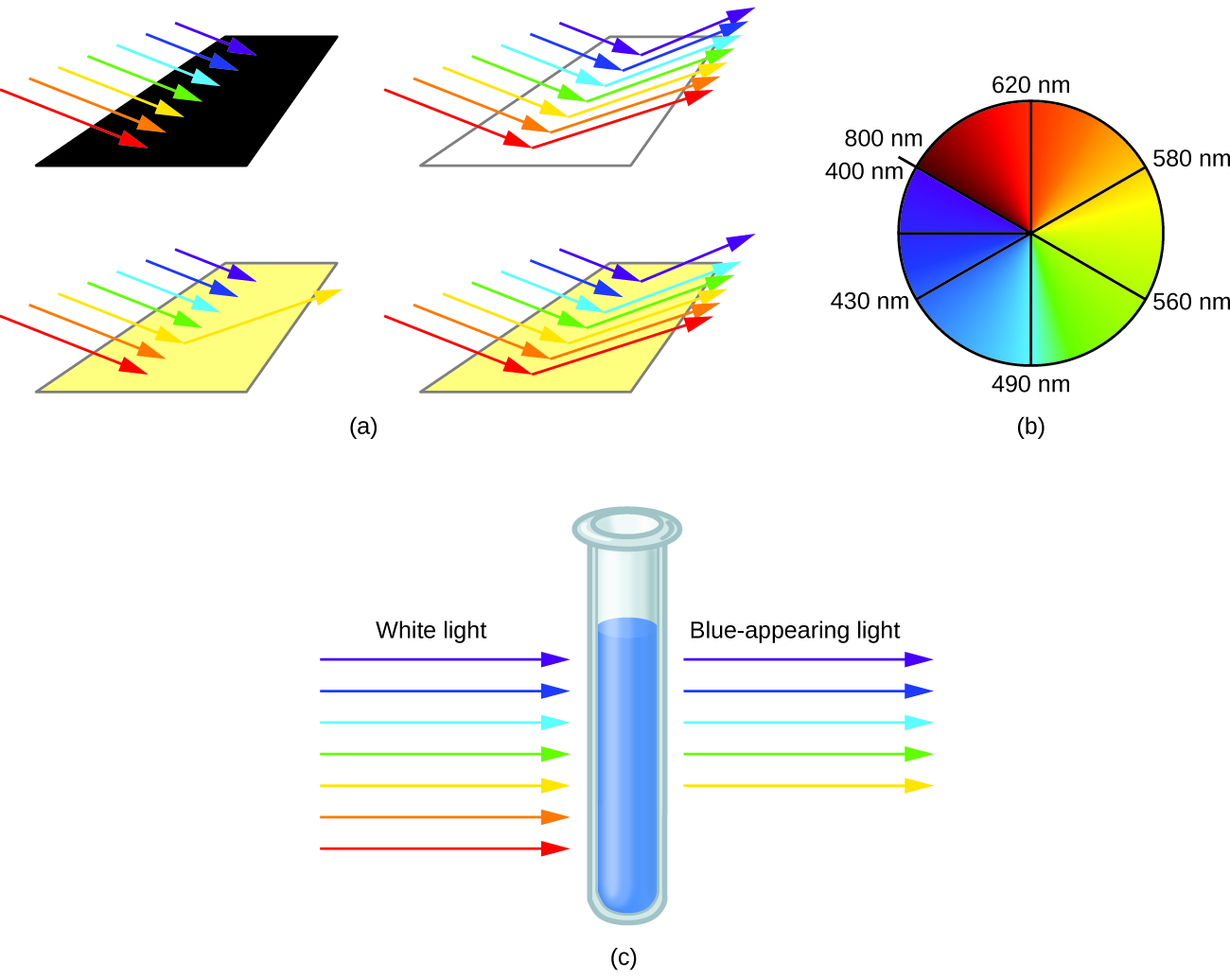
Wakati atomi au molekuli kunyonya mwanga katika frequency sahihi, elektroni zao ni msisimko kwa orbitals juu-nishati. Kwa atomi nyingi za kikundi kikuu na molekuli, fotoni zilizoingizwa ziko katika upeo wa ultraviolet wa wigo wa sumakuumeme, ambayo haiwezi kugunduliwa na jicho la mwanadamu. Kwa misombo ya uratibu, tofauti ya nishati kati ya orbitals d mara nyingi inaruhusu photons katika aina inayoonekana kufyonzwa.
Jicho la mwanadamu linaona mchanganyiko wa rangi zote, kwa kiwango cha sasa katika jua, kama mwanga mweupe. Rangi ya ziada, wale walio karibu na kila mmoja kwenye gurudumu la rangi, pia hutumiwa katika maono ya rangi. Jicho linaona mchanganyiko wa rangi mbili za ziada, kwa uwiano sahihi, kama mwanga mweupe. Vivyo hivyo, wakati rangi haipo kutoka kwenye mwanga mweupe, jicho linaona inayosaidia. Kwa mfano, wakati photons nyekundu zinachukuliwa kutoka kwenye mwanga mweupe, macho yanaona rangi ya kijani. Wakati photoni za violet zinaondolewa kwenye mwanga mweupe, macho yanaona njano ya limao. Rangi ya bluu ya matokeo ya [Cu (NH 3) 4] 2+ ion kwa sababu ion hii inachukua mwanga wa machungwa na nyekundu, na kuacha rangi ya ziada ya bluu na kijani (Kielelezo\(\PageIndex{5}\)).
Tata ya octahedral [Ti (H 2 O) 6] 3+ ina elektroni moja d. Ili kusisimua elektroni hii kutoka hali ya ardhi t 2 g orbital kwa e g orbital, tata hii inachukua mwanga kutoka 450 hadi 600 nm. Upeo wa kiwango cha juu unafanana na Δ oct na hutokea saa 499 nm. Tumia thamani ya Δ oct katika Joules na utabiri rangi gani ufumbuzi utaonekana.
Suluhisho
Kutumia equation ya Planck (rejea sehemu ya nishati ya umeme), tunahesabu:
\[v=\dfrac{c}{λ}\mathrm{\:so\:\dfrac{3.00×10^8\: m/s}{\dfrac{499\: nm×1\: m}{10^9\:nm}}=6.01×10^{14}\:Hz} \nonumber \]
\[E=hnu\mathrm{\:so\:6.63×10^{−34}\:\textrm{J⋅s}×6.01×10^{14}\:Hz=3.99×10^{−19}\:Joules/ion} \nonumber \]
Kwa sababu tata inachukua 600 nm (machungwa) kupitia 450 (bluu), indigo, violet, na wavelengths nyekundu zitatumiwa, na tata itaonekana zambarau.
Ngumu inayoonekana kijani, inachukua photons ya wavelengths gani?
- Jibu
-
nyekundu, 620-800 nm
Mabadiliko madogo katika nguvu za jamaa za orbitals ambazo elektroni zinabadilika kati zinaweza kusababisha mabadiliko makubwa katika rangi ya mwanga kufyonzwa. Kwa hiyo, rangi ya misombo ya uratibu hutegemea mambo mengi. Kama inavyoonekana katika Kielelezo\(\PageIndex{6}\), ions tofauti za chuma za maji zinaweza kuwa na rangi tofauti. Aidha, majimbo tofauti ya oxidation ya chuma moja yanaweza kuzalisha rangi tofauti, kama inavyoonekana kwa complexes ya vanadium katika kiungo hapa chini.

Ligands maalum zilizoratibiwa na kituo cha chuma pia huathiri rangi ya tata za uratibu. Kwa mfano, chuma (II) tata [Fe (H 2 O) 6] SO 4 inaonekana bluu-kijani kwa sababu high-spin tata inachukua photons katika wavelengths nyekundu (Kielelezo\(\PageIndex{7}\)). Kwa upande mwingine, chuma cha chini-spin (II) tata K 4 [Fe (CN) 6] kinaonekana rangi ya njano kwa sababu inachukua photoni za violet za juu-nishati.

Kwa ujumla, ligands yenye nguvu husababisha mgawanyiko mkubwa katika nguvu za orbitals d ya atomi ya kati ya chuma (kubwa Δ oct). Transition chuma uratibu misombo na ligands hizi ni njano, machungwa, au nyekundu kwa sababu wao kunyonya juu-nishati violet au bluu mwanga. Kwa upande mwingine, uratibu misombo ya metali mpito na ligandi dhaifu shamba mara nyingi bluu-kijani, bluu, au indigo kwa sababu kunyonya chini nishati njano, machungwa, au nyekundu mwanga.
Kiwanja cha uratibu wa ioni ya Cu + kina usanidi wa d 10, na orbitals zote za e g zinajazwa. Ili kusisimua elektroni kwa kiwango cha juu, kama vile 4 p orbital, photons ya nishati ya juu sana ni muhimu. Nishati hii inafanana na wavelengths fupi sana katika eneo la ultraviolet la wigo. Hakuna mwanga unaoonekana unafyonzwa, hivyo jicho halioni mabadiliko, na kiwanja kinaonekana nyeupe au isiyo rangi. Suluhisho iliyo na [Cu (CN) 2] - kwa mfano, haina rangi. Kwa upande mwingine, octahedral Cu 2 + complexes ina nafasi katika orbitals e g, na elektroni inaweza kuwa msisimko kwa ngazi hii. Wavelength (nishati) ya mwanga kufyonzwa inalingana na sehemu inayoonekana ya wigo, na Cu 2 + complexes ni karibu kila mara rangi-bluu, bluu-kijani violet, au njano (Kielelezo\(\PageIndex{8}\)). Ingawa CFT inaelezea kwa mafanikio mali nyingi za complexes za uratibu, maelezo ya molekuli orbital (zaidi ya upeo wa utangulizi uliotolewa hapa) wanatakiwa kuelewa kikamilifu tabia ya complexes ya uratibu.

Muhtasari
Nadharia ya shamba la Crystal inachukua mwingiliano kati ya elektroni kwenye chuma na ligandi kama athari rahisi ya umeme. Uwepo wa ligands karibu na ioni ya chuma hubadilisha nguvu za chuma d orbitals kuhusiana na nguvu zao katika ion bure. Wote rangi na mali ya magnetic ya ngumu inaweza kuhusishwa na kugawanyika kwa shamba hili la kioo. Ukubwa wa kugawanyika (Δ oct) inategemea asili ya ligands iliyounganishwa na chuma. Ligands yenye nguvu huzalisha kugawanyika kwa kiasi kikubwa na kupendelea complexes ya chini ya spin, ambayo orbitals t 2 g hujazwa kabisa kabla ya elektroni yoyote kuchukua e g orbitals. Ligands dhaifu shamba neema malezi ya complexes high-spin. The t 2 g na e g orbitals ni moja kwa moja ulichukua kabla yoyote ni mara mbili ulichukua.
faharasa
- kioo shamba kugawanyika (Δ oct)
- tofauti katika nishati kati ya seti ya t 2 g na e g au t na e seti ya orbitals
- kioo shamba nadharia
- mfano kwamba anaelezea nguvu ya orbitals katika metali mpito katika suala la mwingiliano umeme na ligands lakini haina ni pamoja na chuma ligand bonding
- Tunakwenda orbitals
- seti ya orbitals mbili d ambayo ni oriented juu ya axes Cartesian kwa complexes uratibu; katika complexes octahedral, wao ni ya juu katika nishati kuliko t 2 g orbitals
- isoma za kijiometri
- isoma ambazo hutofautiana kwa njia ambayo atomi zinaelekezwa katika nafasi jamaa kwa kila mmoja, na kusababisha mali tofauti za kimwili na kemikali
- high-spin tata
- tata ambayo elektroni kuongeza jumla ya elektroni spin kwa wingle wakazi wote wa orbitals kabla pairing elektroni mbili katika orbitals chini ya nishati
- tata ya chini-spin
- tata ambayo elektroni kupunguza jumla ya elektroni spin kwa pairing katika orbitals chini ya nishati kabla ya wakazi orbitals juu-nishati
- pairing nishati (P)
- nishati required mahali elektroni mbili na spins kinyume katika orbital moja
- spectrochemical mfululizo
- cheo ya ligands kulingana na ukubwa wa shamba kioo splitting wao kushawishi
- ligand yenye nguvu
- ligand ambayo husababisha splittings kubwa kioo shamba
- kwa 2 g orbitals
- seti ya orbitals tatu d iliyokaa kati ya axes Cartesian kwa complexes uratibu; katika complexes octahedral, wao ni dari katika nishati ikilinganishwa na orbitals e g kulingana na CFT
- ligand dhaifu
- ligand ambayo husababisha splittings ndogo kioo shamba


