18.4: Muundo na Mali ya jumla ya Nonmetals
- Page ID
- 176388
- Eleza muundo na mali ya nonmetals
Nonmetals ni vipengele vilivyo kwenye sehemu ya juu ya kulia ya meza ya mara kwa mara. Mali na tabia zao ni tofauti kabisa na zile za metali upande wa kushoto. Katika hali ya kawaida, zaidi ya nusu ya nonmetali ni gesi, moja ni kiowevu, na wengine ni pamoja na baadhi ya laini zaidi na ngumu zaidi ya yabisi. Nonmetals huonyesha aina nyingi za tabia za kemikali. Wao ni pamoja na tendaji zaidi na angalau tendaji ya vipengele, na wao huunda misombo mbalimbali ionic na covalent. Sehemu hii inatoa maelezo ya jumla ya mali na tabia za kemikali za nonmetali, pamoja na kemia ya vipengele maalum. Wengi wa nonmetali hizi ni muhimu katika mifumo ya kibiolojia.
Mara nyingi, mwenendo wa electronegativity hutuwezesha kutabiri aina ya bonding na majimbo ya kimwili katika misombo inayohusisha nonmetals. Tunajua kwamba electronegativity itapungua kama sisi hoja chini ya kundi fulani na kuongezeka kama sisi hoja kutoka kushoto kwenda kulia katika kipindi. Nonmetali zina electronegativities ya juu kuliko metali, na misombo iliyoundwa kati ya metali na nonmetali kwa ujumla ni ioniki katika asili kwa sababu ya tofauti kubwa katika electronegativity kati yao. Metali huunda cations, nonmetali huunda anions, na misombo inayosababisha ni yabisi chini ya hali ya kawaida. Kwa upande mwingine, misombo iliyoundwa kati ya nonmetali mbili au zaidi zina tofauti ndogo katika electronegativity kati ya atomi, na ushirikiano wa ushirikiano wa matokeo ya elektroni-ushirikiano. Dutu hizi huwa na molekuli katika asili na ni gesi, viowevu, au yabisi tete kwenye joto la kawaida na shinikizo.
Katika michakato ya kawaida ya kemikali, nonmetals hazifanyi ions monatomic chanya (cations) kwa sababu nguvu zao za ionization ni za juu sana. Ioni zote za monatomiki zisizo za metali ni anioni; mifano ni pamoja na ioni ya kloridi, Cl -, ioni nitridi, N 3-, na ioni ya selenidi, Se 2 -. Oxidation ya kawaida inasema kwamba nonmetals maonyesho katika misombo yao ionic na covalent ni inavyoonekana katika Kielelezo\(\PageIndex{1}\). Kumbuka kwamba kipengele kinaonyesha hali nzuri ya oxidation ikiwa ni pamoja na kipengele zaidi cha electronegative na kwamba inaonyesha hali mbaya ya oxidation ikiwa ni pamoja na kipengele cha chini cha electronegative.
Mwanachama wa kwanza wa kila kikundi cha nonmetal huonyesha tabia tofauti, kwa namna nyingi, kutoka kwa wanachama wengine wa kikundi. Sababu za hii ni pamoja na ukubwa mdogo, nishati kubwa ya ionization, na (muhimu zaidi) ukweli kwamba mwanachama wa kwanza wa kila kikundi ana orbitals nne tu za valence (moja 2 s na tatu 2 p) inapatikana kwa kuunganisha, wakati wanachama wengine wa kikundi wana tupu d orbitals katika zao valence shells, na kufanya uwezekano wa tano, sita, au vifungo hata zaidi karibu chembe ya kati. Kwa mfano, nitrojeni huunda NF 3 tu, ambapo fosforasi huunda PF 3 na PF 5.
Kumbuka kwamba kipengele kinaonyesha hali nzuri ya oxidation ikiwa ni pamoja na kipengele zaidi cha electronegative na kwamba inaonyesha hali mbaya ya oxidation ikiwa ni pamoja na kipengele cha chini cha electronegative.
Tofauti nyingine kati ya mwanachama wa kundi la kwanza na wanachama waliofuata ni uwezo mkubwa wa mwanachama wa kwanza kuunda vifungo π. Hii ni hasa kazi ya ukubwa mdogo wa mwanachama wa kwanza wa kila kikundi, ambayo inaruhusu uingiliano bora wa orbitals ya atomiki. Nonmetali, isipokuwa mwanachama wa kwanza wa kila kikundi, mara chache huunda π vifungo kwa nonmetali ambazo ni mwanachama wa kwanza wa kikundi. Kwa mfano, vifungo vya sulfuri-oksijeni π vinajulikana sana, ilhali sulfuri kwa kawaida haifanyi vifungo vya π imara kwa yenyewe.
Aina ya majimbo oxidation kuonyeshwa na wengi wa nonmetals ina maana kwamba wengi wa athari zao kemikali kuhusisha mabadiliko katika hali oxidation kupitia athari oxidation kupunguza. Kuna mambo matano ya jumla ya kemia ya kupunguza oksidi:
- Nonmetals oxidize metali nyingi. Hali ya oxidation ya chuma inakuwa chanya kama inakabiliwa na oxidation na ile ya nonmetal inakuwa hasi kama inapungua. Kwa mfano:
\[4 \underset{0}{\ce{Fe}} \left( s \right) + 3 \underset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \underset{+3}{\ce{Fe_2}} \underset{-2}{\ce{O_3}} \left( s \right) \nonumber \] - Isipokuwa nitrojeni na kaboni, ambayo ni mawakala maskini oxidizing, zaidi ya electronegative nonmetal oxidizes chini electronegative nonmetal au anion ya nonmetal:
\[\underset{0}{\ce{S}} \left( s \right) + \underset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \underset{+4}{\ce{S}} \underset{-2}{\ce{O_2}} \left( s \right) \nonumber \]
\[\underset{0}{\ce{Cl_2}} \left( g \right) + 2 \ce{I^-} \left( aq \right) \rightarrow \underset{0}{\ce{I_2}} \left( s \right) + 2 \ce{Cl^-} \left( aq \right) \nonumber \]
- Fluorini na oksijeni ni mawakala wenye nguvu zaidi ya vioksidishaji ndani ya makundi yao; kila huchochea vipengele vyote vilivyo chini yake katika kikundi. Katika kipindi chochote, wakala mwenye nguvu zaidi wa oxidizing ni katika kikundi cha 17. Nonmetal mara nyingi oxidizes kipengele kwamba uongo upande wake wa kushoto katika kipindi hicho. Kwa mfano:
\[2 \underset{0}{\ce{As}} \left( s \right) + 3 \underset{0}{\ce{Br_2}} \left( l \right) \rightarrow 2 \underset{+3}{\ce{As}} \underset{-1}{\ce{Br_3}} \left( s \right) \nonumber \]
- Nguvu isiyo ya kawaida ni kama wakala wa oksidi, ni vigumu zaidi kuimarisha anion iliyoundwa na nonmetal. Hii ina maana kwamba ions hasi imara zaidi huundwa na vipengele juu ya kikundi au katika kikundi cha 17 cha kipindi hicho.
- Fluorine na oksijeni ni mambo yenye nguvu zaidi ya oksidi inayojulikana. Fluorine haifanyi misombo ambayo inaonyesha hali nzuri za oxidation; oksijeni inaonyesha hali nzuri ya oxidation tu ikiwa ni pamoja na fluorine. Kwa mfano:\[2 \underset{0}{\ce{F_2}} \left( g \right) + 2 \ce{OH^-} \left( aq \right) \rightarrow \underset{+2}{\ce{O}} \underset{-1}{\ce{F_2}} \left( g \right) + 2 \ce{F^-} \left( aq \right) + \ce{H_2O} \left( l \right) \nonumber \]
Isipokuwa na gesi nyingi za heshima, fomu zote za nonmetali zinaunda misombo na oksijeni, hutoa oksidi za covalent. Wengi wa oksidi hizi ni tindikali, yaani, huguswa na maji ili kuunda oxyacids. Kumbuka kutoka sura ya asidi-msingi kwamba oxyacid ni asidi yenye hidrojeni, oksijeni, na kipengele kingine. Isipokuwa mashuhuri ni monoksidi kaboni, CO, oksidi ya nitrous, N 2 O, na oksidi ya nitriki, NO. Kuna sifa tatu za oksidi hizi za tindikali:
- Oxides kama vile SO 2 na N 2 O 5, ambapo nonmetal inaonyesha moja ya mataifa yake ya kawaida oxidation, ni asidi anhydrides na kuguswa na maji kuunda asidi na hakuna mabadiliko katika hali oxidation. Bidhaa hiyo ni oxyacid. Kwa mfano:\[\ce{SO2}(g)+\ce{H2O}(l)⟶\ce{H2SO3}(aq) \nonumber \]\[\ce{N2O5}(s)+\ce{H2O}(l)⟶\ce{2HNO3}(aq) \nonumber \]
- Wale oksidi kama vile NO 2 na ClO 2, ambapo nonmetal haina kuonyesha moja ya majimbo yake ya kawaida oxidation, pia kuguswa na maji. Katika athari hizi, nonmetal ni oxidized na kupunguzwa. Kwa mfano:\[3 \underset{+4}{\ce{N}} \ce{O_2} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow 2 \ce{H} \underset{+5}{\ce{N}} \ce{O_3} \left( aq \right) + \underset{+2}{\ce{N}} \ce{O} \left( g \right) \nonumber \] Majibu ambayo kipengele hicho ni kioksidishaji na kupunguzwa huitwa athari za kutofautiana.
- Nguvu ya asidi huongezeka kama electronegativity ya atomi kuu huongezeka. Ili kujifunza zaidi, angalia majadiliano katika sura ya kemia ya asidi-msingi.
Misombo ya hidrojeni ya binary ya nonmetali pia inaonyesha tabia ya tindikali katika maji, ingawa tu HCl, HbR, na HI ni asidi kali. Nguvu ya asidi ya misombo ya hidrojeni isiyo ya kawaida huongezeka kutoka kushoto kwenda kulia kwa kipindi na chini ya kikundi. Kwa mfano, amonia, NH 3, ni asidi dhaifu kuliko maji, H 2 O, ambayo ni dhaifu kuliko fluoride ya hidrojeni, HF. Maji, H 2 O, pia ni asidi dhaifu kuliko sulfidi hidrojeni, H 2 S, ambayo ni dhaifu kuliko selenide ya hidrojeni, H 2 Se. Tabia dhaifu ya tindikali ina maana tabia kubwa ya msingi.
Miundo ya Nonmetals
Miundo ya nonmetali inatofautiana sana na yale ya metali. Vyuma huangaza katika vitu vyenye karibu ambavyo havi na molekuli au vifungo vya covalent. Miundo isiyo ya kawaida ina vifungo vya covalent, na nonmetals nyingi zinajumuisha molekuli ya mtu binafsi. Electroni katika nonmetals ni localized katika vifungo covalent, wakati katika chuma, kuna delanication ya elektroni katika imara.
Gesi zenye heshima zote ni monatomiki, ambapo gesi zingine zisizo za metali - hidrojeni, nitrojeni, oksijeni, florini, na klorini-kawaida zipo kama molekuli diatomiki H 2, N 2, O 2, F 2, na Cl 2. Halojeni nyingine pia ni diatomiki; Br 2 ni kiowevu na I 2 ipo kama imara chini ya hali ya kawaida. Mabadiliko katika hali kama mtu huenda chini ya familia ya halogen hutoa mifano bora ya nguvu za kuongezeka kwa vikosi vya London vya london na kuongezeka kwa molekuli ya Masi na kuongezeka kwa polarizability.
Oksijeni ina allotropes mbili: O 2, dioksijeni, na O 3, ozoni. Phosphorus ina allotropes tatu za kawaida, ambazo hujulikana kwa rangi zao: nyeupe, nyekundu, na nyeusi. Sulfuri ina allotropes kadhaa. Pia kuna allotropes nyingi za kaboni. Watu wengi wanajua almasi, grafiti, na mkaa, lakini watu wachache wanajua ugunduzi wa hivi karibuni wa fullerenes, nanotubes kaboni, na graphene.
Maelezo ya mali ya kimwili ya nonmetals tatu ambazo ni tabia ya yabisi Masi kufuata.
Carbon
Kaboni hutokea katika hali isiyojumuishwa (ya msingi) katika aina nyingi, kama vile almasi, grafiti, mkaa, coke, kaboni nyeusi, graphene, na fullerene.
Diamond, inavyoonekana katika Kielelezo\(\PageIndex{2}\), ni nyenzo ngumu sana ya fuwele ambayo haina rangi na ya uwazi wakati safi. Kila atomu huunda vifungo vinne moja kwa atomi nyingine nne kwenye pembe za tetrahedroni (sp 3 hybridization); hii inafanya almasi kuwa molekuli kubwa. Vifungo moja vya kaboni-kaboni ni vikali sana, na, kwa sababu vinapanua katika kioo ili kuunda mtandao wa pande tatu, fuwele ni ngumu sana na zina pointi za kuyeyuka juu (~4400 °C).

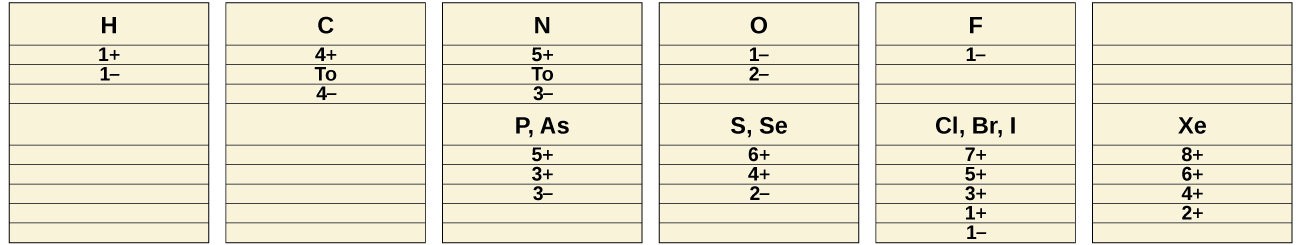
Grafiti, pia inavyoonekana katika Kielelezo\(\PageIndex{2}\), ni laini, slippery, kijivu-nyeusi imara ambayo inafanya umeme. Mali hizi zinahusiana na muundo wake, ambao una tabaka za atomi za kaboni, huku kila atomu ikizungukwa na atomi nyingine tatu za kaboni katika mpangilio wa mpango wa trigonal. Kila atomi ya kaboni katika grafiti huunda vifungo vitatu vya σ, moja kwa kila majirani zake wa karibu, kwa njia ya sp 2 -hybrid orbitals. Orbital p unhybridized juu ya kila atomi kaboni itaingiliana orbitals unhybridized juu ya atomi karibu kaboni katika safu moja ili kuunda π vifungo. Aina nyingi za resonance ni muhimu kuelezea muundo wa elektroniki wa safu ya grafiti; Kielelezo\(\PageIndex{3}\) unaeleza aina mbili za aina hizi.
Atomi ndani ya safu ya grafiti huunganishwa pamoja kwa ukali na vifungo σ na π; hata hivyo, majeshi kati ya tabaka ni dhaifu. Vikosi vya utawanyiko wa London vinashikilia Ili kujifunza zaidi, angalia majadiliano ya vikosi hivi dhaifu katika sura ya maji na yabisi. Majeshi dhaifu kati ya tabaka hutoa grafiti tabia ya laini, yenye rangi ambayo inafanya kuwa muhimu kama kile kinachoitwa “risasi” katika penseli na tabia ya slippery ambayo inafanya kuwa muhimu kama lubricant. Electroni zilizofanyika kwa uhuru katika vifungo vya π vinavyoweza kusonga ndani ya imara na zinawajibika kwa conductivity ya umeme ya grafiti.
Aina nyingine za kaboni ya msingi ni pamoja na kaboni nyeusi, mkaa, na coke. Kaboni nyeusi ni aina ya amorphous ya kaboni iliyoandaliwa na mwako usio kamili wa gesi asilia, CH 4. Inawezekana kuzalisha mkaa na coke kwa kupokanzwa kuni na makaa ya mawe, kwa mtiririko huo, kwa joto la juu bila kutokuwepo kwa hewa.
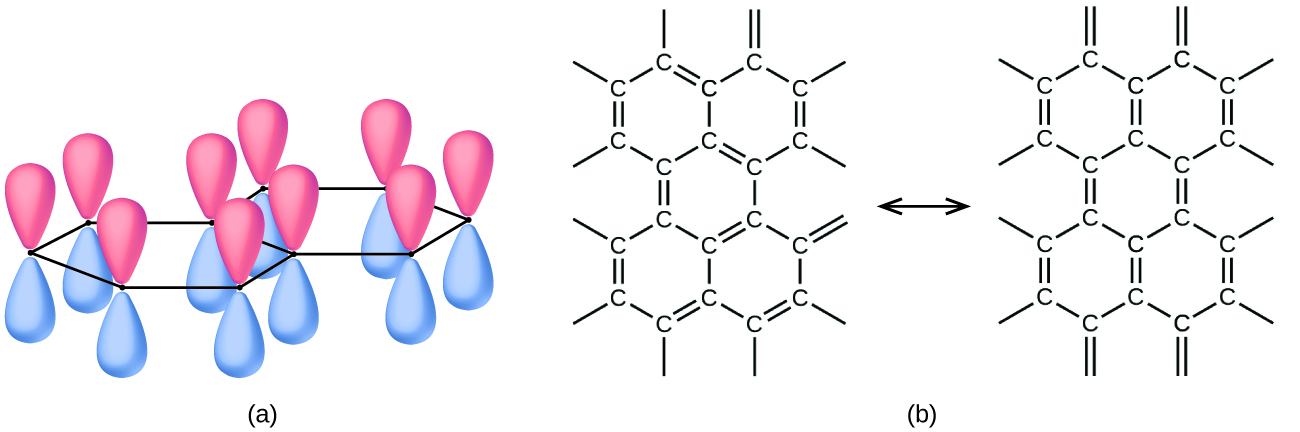
Hivi karibuni, aina mpya za molekuli za kaboni za msingi zimetambuliwa katika masizi yanayotokana na moto wa kuvuta sigara na katika mvuke zinazozalishwa wakati grafiti inapokanzwa kwa joto la juu sana katika utupu au katika heliamu. Moja ya aina hizi mpya, kwanza pekee na Profesa Richard Smalley na wafanyakazi wenzake katika Chuo Kikuu cha Rice, lina icosahedral (soka mpira-umbo) molekuli ambayo yana 60 carbon atomi, C 60. Hii ni buckminsterfullerene (mara nyingi huitwa mipira bucky) baada mbunifu Buckminster Fuller, ambaye iliyoundwa miundo domed, ambayo kuonekana sawa (Kielelezo\(\PageIndex{4}\)).
Nanotubes na Graphene
Graphene na nanotubes za kaboni ni allotropes mbili zilizogunduliwa hivi karibuni za kaboni. Fomu zote mbili hubeba uhusiano fulani na grafiti. Graphene ni safu moja ya grafiti (moja chembe nene), kama inavyoonekana katika Kielelezo\(\PageIndex{2}\) d, ambapo carbon nanotubes roll safu katika tube ndogo, kama mfano katika Kielelezo\(\PageIndex{5}\).

Graphene ni conductor nguvu sana, nyepesi, na ufanisi wa joto na umeme aligundua mwaka 2003. Kama ilivyo katika grafiti, atomi za kaboni huunda safu ya pete sita za membered na atomi za kaboni za sp 2 -zilizochanganywa kwenye pembe. Resonance imetulia mfumo na inaongoza kwa conductivity yake. Tofauti na grafiti, hakuna stacking ya tabaka kutoa muundo tatu-dimensional. Andre Geim na Kostya Novoselov katika Chuo Kikuu cha Manchester walishinda Tuzo ya Nobel ya 2010 ya Fizikia kwa kazi yao ya uanzilishi inayoashiria graphene.
Utaratibu rahisi zaidi wa kuandaa graphene ni kutumia kipande cha mkanda wa wambiso ili kuondoa safu moja ya graphene kutoka kwenye uso wa kipande cha grafiti. Njia hii inafanya kazi kwa sababu kuna nguvu dhaifu tu za usambazaji wa London kati ya tabaka katika grafiti. Mbinu mbadala ni kuweka safu moja ya atomi za kaboni juu ya uso wa nyenzo nyingine (ruthenium, iridium, au shaba) au kuunganisha kwenye uso wa carbide ya silicon kupitia sublimation ya silicon.
Kwa sasa hakuna matumizi ya kibiashara ya graphene. Hata hivyo, mali yake isiyo ya kawaida, kama vile uhamaji wa juu wa elektroni na conductivity ya mafuta, inapaswa kuifanya kuwa yanafaa kwa ajili ya utengenezaji wa vifaa vingi vya juu vya umeme na kwa maombi ya usimamizi wa mafuta.
Nanotubes za kaboni ni allotropes ya kaboni, ambayo ina muundo wa cylindrical. Kama grafiti na graphene, nanotubes zinajumuisha pete za atomi za kaboni za sp 2 -hybridized. Tofauti na grafiti na graphene, ambayo hutokea katika tabaka, tabaka hufunga ndani ya bomba na kushikamana pamoja ili kuzalisha muundo thabiti. Kuta za tube inaweza kuwa atomi moja au atomi nyingi nene.
Nanotubes za kaboni ni vifaa vyenye nguvu sana ambavyo ni vigumu kuliko almasi. Kulingana na sura ya nanotube, inaweza kuwa conductor au semiconductor. Kwa baadhi ya programu, fomu ya uendeshaji inafaa, wakati maombi mengine hutumia fomu ya semiconducting.
Msingi wa usanisi wa nanotubes za kaboni ni kizazi cha atomi za kaboni katika utupu. Inawezekana kuzalisha atomi za kaboni kwa kutokwa kwa umeme kupitia grafiti, uvukizi wa grafiti na laser, na kuharibika kwa kiwanja cha kaboni.
Nguvu za nanotubes za kaboni hatimaye zitasababisha baadhi ya maombi yao ya kusisimua zaidi, kama thread iliyotokana na nanotubes kadhaa itasaidia uzito mkubwa. Hata hivyo, maombi ya sasa tu kuajiri nanotubes wingi. Kuongezea kwa nanotubes kwa polima huboresha mali ya mitambo, mafuta, na umeme ya nyenzo nyingi. Kwa sasa kuna nanotubes katika baadhi ya sehemu baiskeli, skis, baseball popo, fimbo uvuvi, na surfboards.
Fosforasi
Jina fosforasi linatokana na maneno ya Kigiriki maana mwanga kuleta. Wakati fosforasi ilikuwa ya kwanza pekee, wanasayansi walibainisha kuwa iliwaka katika giza na kuchomwa moto wakati wa hewa. Fosforasi ni mwanachama pekee wa kundi lake ambalo halitokei katika hali isiyounganishwa katika asili; ipo katika aina nyingi za allotropiki. Tutazingatia aina mbili za aina hizo: fosforasi nyeupe na fosforasi nyekundu.
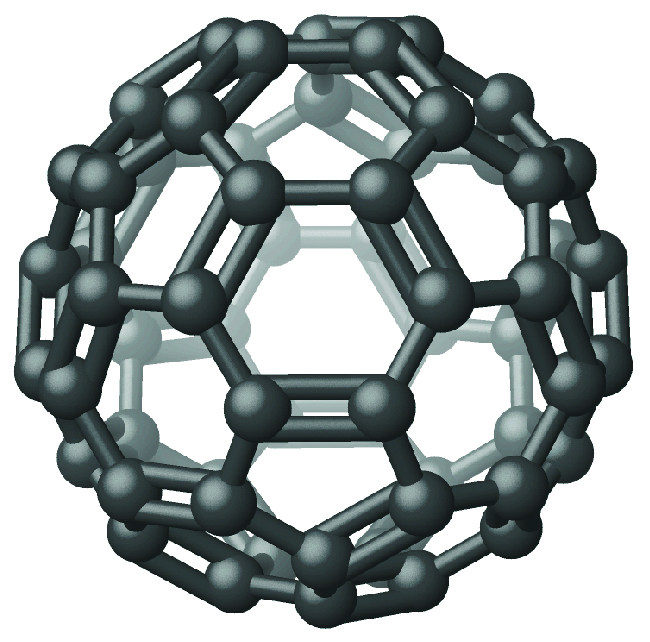
Fosforasi nyeupe ni nyeupe, nta imara ambayo huyeyuka saa 44.2 °C na majipu saa 280 °C Haiwezi mumunyifu katika maji, ni mumunyifu sana katika disulfidi kaboni, na hupasuka ndani ya moto hewani. Kama imara, kama kioevu, kama gesi, na katika suluhisho, fosforasi nyeupe ipo kama P 4 molekuli na atomi nne za fosforasi kwenye pembe za tetrahedron ya kawaida (Kielelezo\(\PageIndex{5}\)). Kila atomi ya fosforasi covalently vifungo kwa atomi nyingine tatu katika molekuli na vifungo moja covalent. Phosphorus nyeupe ni allotrope yenye nguvu zaidi na ni sumu sana.

Inapokanzwa fosforasi nyeupe hadi 270-300 °C kwa kutokuwepo kwa hewa huzaa fosforasi nyekundu. Fosforasi nyekundu ni denser, ina kiwango cha juu cha kiwango (~600 °C), ni kidogo sana tendaji, kimsingi ni nontoxic, na ni rahisi na salama kushughulikia kuliko fosforasi nyeupe. Muundo wake ni polymeric sana na inaonekana kuwa na mitandao mitatu ya P 4 tetrahedra iliyojiunga na vifungo vya P-P moja. Fosforasi nyekundu haipatikani katika vimumunyisho vinavyovunja fosforasi nyeupe. Wakati phosphorus nyekundu inapokanzwa, P 4 molekuli hutukuza kutoka imara.
Sulfuri
Allotropy ya sulfuri ni kubwa zaidi na ngumu zaidi kuliko ile ya kipengele kingine chochote. Sulfuri ni kiberiti kinachojulikana katika Biblia na sehemu zingine, na marejeo ya sulfuri hutokea katika historia iliyorekodiwa—hadi ugunduzi wa hivi karibuni kwamba ni sehemu ya anga ya Venus na ya Io, mwezi wa Jupiter. Allotrope ya kawaida na imara ya sulfuri ni njano, sulfuri ya rhombic, inayoitwa kwa sababu ya sura ya fuwele zake. Sulfuri ya Rhombic ni fomu ambayo allotropes nyingine zote zinarudi kwenye joto la kawaida. Fuwele za sulfuri ya rhombic huyeyuka saa 113 °C Baridi kioevu hiki hutoa sindano ndefu za sulfuri ya monoclinic. Fomu hii ni imara kutoka 96 °C hadi kiwango cha kuyeyuka, 119 °C Katika joto la kawaida, hatua kwa hatua inarudi kwenye fomu ya rhombic.
Sulfuri zote mbili za rhombic na monoclinic sulfuri zina S 8 molekuli ambazo atomi huunda pete za nane, zilizopigwa ambazo zinafanana na taji (Kielelezo\(\PageIndex{6}\)). Kila atomi ya sulfuri inaunganishwa kwa kila mmoja wa majirani zake wawili katika pete na vifungo vya S-S moja.
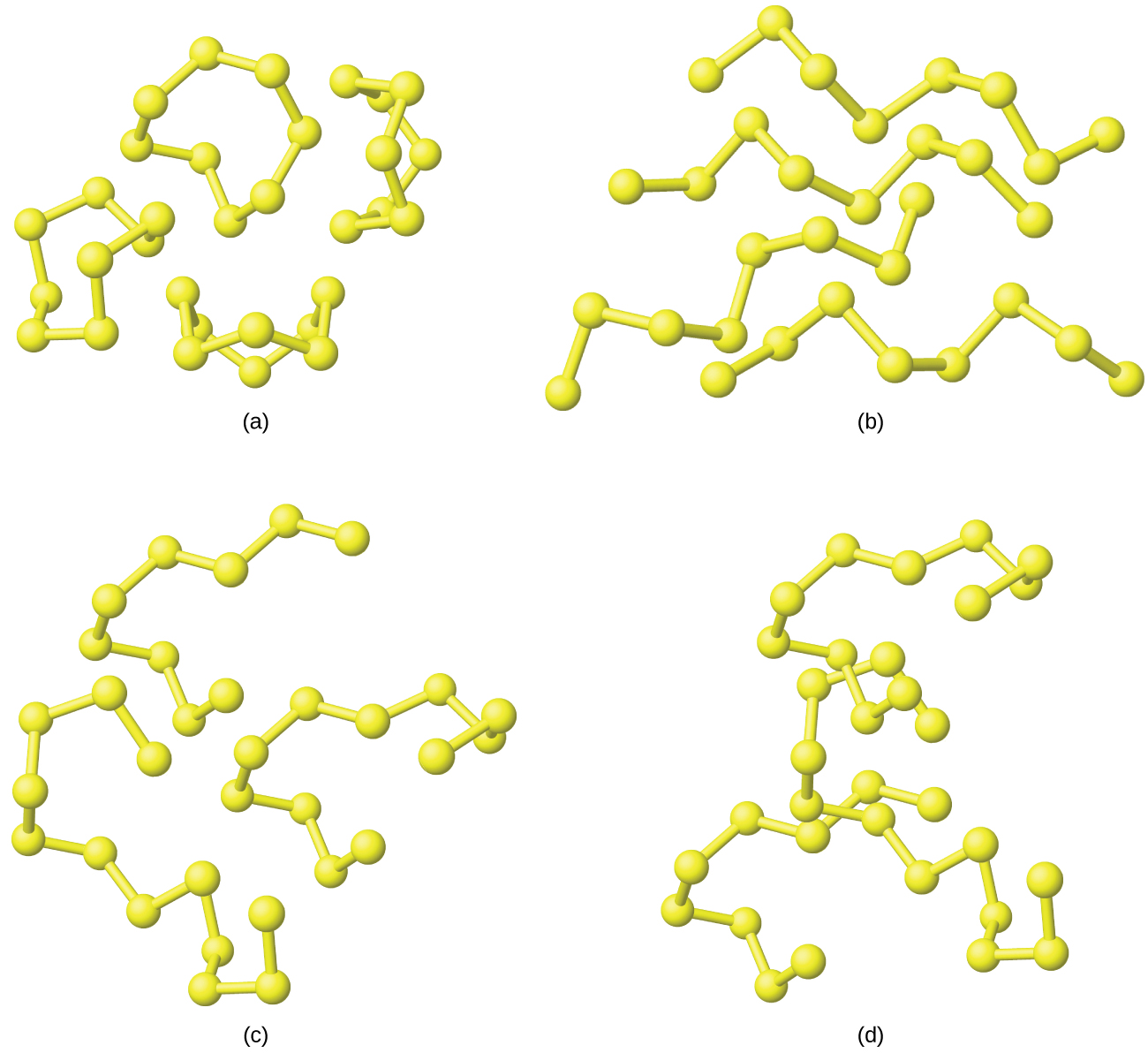
Wakati sulfuri ya rhombic inakayeyuka, kioevu cha rangi ya majani ni simu ya mkononi kabisa; viscosity yake ni ya chini kwa sababu molekuli S 8 kimsingi ni spherical na kutoa upinzani kiasi kidogo kama wao hoja nyuma ya kila mmoja. Wakati joto linapoongezeka, vifungo vya S-S katika kuvunja pete, na minyororo ya polymeric ya atomi za sulfuri matokeo. Minyororo hii huchanganya mwisho hadi mwisho, na kutengeneza minyororo bado ndefu ambayo inashirikiana. Kiowevu polepole huwa giza kwa rangi na kinakuwa kizito kiasi kwamba hatimaye (takriban 230 °C) hakimimina kirahisi. Atomi za kutetemeka kwenye ncha za minyororo ya atomi za sulfuri zinahusika na rangi nyekundu ya giza kwa sababu muundo wao wa elektroniki unatofautiana na zile za atomi za sulfuri ambazo zina vifungo kwa atomi mbili za kiberiti zilizo karibu. Hii inasababisha kunyonya mwanga tofauti na matokeo katika rangi tofauti inayoonekana. Baridi kioevu haraka hutoa molekuli ya amorphous ya mpira, inayoitwa sulfuri ya plastiki.
Majipu ya sulfuri saa 445 °C na huunda mvuke yenye molekuli S 2, S 6, na S 8; kwa takriban 1000 °C, wiani wa mvuke unalingana na formula S 2, ambayo ni molekuli ya paramagnetic kama O 2 yenye muundo sawa wa elektroniki na sulfuri dhaifu- sulfuri mara mbili dhamana.
Kama inavyoonekana katika mjadala huu, kipengele muhimu cha tabia ya kimuundo ya nonmetali ni kwamba elementi kawaida hutokea kwa elektroni nane katika maganda yao ya valence. Ikiwa ni lazima, vipengele vinaunda vifungo vya kutosha vya covalent ili kuongeza elektroni tayari zilizopo kuwa na octet. Kwa mfano, wanachama wa kikundi 15 wana elektroni tano za valence na zinahitaji elektroni tatu za ziada tu kujaza shells zao za valence. Mambo haya huunda vifungo vitatu vya covalent katika hali yao ya bure: vifungo vitatu katika molekuli ya N 2 au vifungo moja kwa atomi tatu tofauti katika arsenic na fosforasi. Mambo ya kikundi 16 yanahitaji elektroni mbili tu za ziada. Oksijeni huunda dhamana mbili katika molekuli ya O 2, na sulfuri, seleniamu, na tellurium huunda vifungo viwili vya moja katika pete na minyororo mbalimbali. Halojeni huunda molekuli ya diatomiki ambayo kila atomu inahusika katika dhamana moja tu. Hii hutoa elektroni inayohitajika ili kukamilisha octet kwenye atomi ya halogen. Gesi zenye heshima hazifanyi vifungo vya covalent kwa atomi nyingine za gesi nzuri kwa sababu tayari zina shell ya nje iliyojaa.
Muhtasari
Nonmetali zina miundo ambayo ni tofauti sana na zile za metali, hasa kwa sababu zina electronegativity kubwa na elektroni ambazo zimefungwa zaidi na atomi za mtu binafsi. Wengi wa oksidi zisizo za metali ni anhydrides asidi, maana yake ni kwamba huguswa na maji ili kuunda ufumbuzi wa tindikali. Miundo ya molekuli ni ya kawaida kwa wengi wa nonmetali, na kadhaa zina allotropes nyingi na tabia tofauti za kimwili.
faharasa
- asidi anhidridi
- kiwanja kwamba humenyuka na maji na kuunda asidi au ufumbuzi tindikali
- mmenyuko wa kutofautiana
- mmenyuko wa kemikali ambapo reactant moja ni wakati huo huo kupunguzwa na oxidized; ni wakala wa kupunguza na wakala wa oxidizing


