18.3: Muundo na Mali ya jumla ya Metalloids
- Page ID
- 176338
- Eleza maandalizi ya jumla, mali, na matumizi ya metalloids
- Eleza maandalizi, mali, na misombo ya boron na silicon
Mfululizo wa elementi sita zinazoitwa metalloidi hutenganisha metali kutoka kwa nonmetali katika meza ya mara kwa mara. Metalloids ni boroni, silicon, germanium, arsenic, antimoni, na tellurium. Elementi hizi hutazama metali; hata hivyo, hazifanyi umeme pamoja na metali hivyo ni semiconductors. Wao ni semiconductors kwa sababu elektroni zao zimefungwa zaidi kwa viini vyao kuliko zile za watendaji wa metali. Tabia zao za kemikali huanguka kati ya ile ya metali na nonmetali. Kwa mfano, metalloidi safi huunda fuwele za covalent kama zisizo za metali, lakini kama metali, kwa ujumla hazifanyi anioni za monatomiki. Tabia hii ya kati ni sehemu kutokana na maadili yao ya kati ya electronegativity. Katika sehemu hii, tutajadili kwa ufupi tabia ya kemikali ya metalloids na kukabiliana na mambo mawili - boroni na silicon-kwa undani zaidi.
Boroni ya metalloid inaonyesha kufanana sana na kaboni ya jirani yake na silicon ya jirani yake ya diagonal. Mambo yote matatu huunda misombo ya covalent. Hata hivyo, boroni ina tofauti moja tofauti kwa kuwa muundo wake wa 2 s 2 2 p 1 wa nje wa elektroni huipa elektroni moja chini ya valence kuliko ina orbitals valence. Ingawa boroni inaonyesha hali ya oxidation ya 3+katika sehemu nyingi za misombo yake imara, upungufu huu wa elektroni hutoa boroni na uwezo wa kuunda nyingine, wakati mwingine sehemu, hali za oxidation, ambazo hutokea, kwa mfano, katika hydrides ya boroni.
Silicon ina muundo wa elektroni wa valence 3 s 2 3 p 2, na kwa kawaida huunda miundo ya tetrahedral ambayo ni sp 3 iliyosababishwa na hali rasmi ya oxidation ya 4+. Tofauti kubwa kati ya kemia ya kaboni na silicon hutokana na nguvu ya jamaa ya dhamana ya kaboni-kaboni, uwezo wa kaboni kuunda vifungo imara yenyewe, na kuwepo kwa mizunguko tupu ya 3 d valence-shell katika silicon. Silicon ya tupu d orbitals na boron ya tupu p orbital kuwawezesha tetrahedral silicon misombo na trigonal planar boroni misombo kutenda kama Lewis asidi. Kaboni, kwa upande mwingine, haina mizunguko ya shell ya valence inapatikana; misombo ya kaboni ya tetrahedral haiwezi kutenda kama asidi ya Lewis. Germanium ni sawa na silicon katika tabia yake ya kemikali.
Arsenic na antimoni kwa ujumla huunda misombo ambayo hali ya oxidation ya 3+au 5+ imeonyeshwa; hata hivyo, arsenic inaweza kuunda arsenides na hali ya oxidation ya 3-. Vipengele hivi vinapunguza kidogo tu katika hewa kavu lakini husafirisha kwa urahisi wakati wa joto.
Tellurium inachanganya moja kwa moja na vipengele vingi. Misombo tellurium imara zaidi ni tellurides-chumvi ya Te 2- sumu na metali hai na lanthanides-na misombo na oksijeni, florini, na klorini, ambapo tellurium kawaida inaonyesha hali oxidation 2+au 4+. Ingawa misombo ya tellurium (VI) inajulikana (kwa mfano, teF 6), kuna upinzani uliowekwa kwa oxidation kwa hali hii ya juu ya kikundi cha oxidation.
Miundo ya Metalloids
Bonding covalent ni ufunguo wa miundo ya kioo ya metalloids. Katika suala hili, mambo haya yanafanana na nonmetals katika tabia zao.
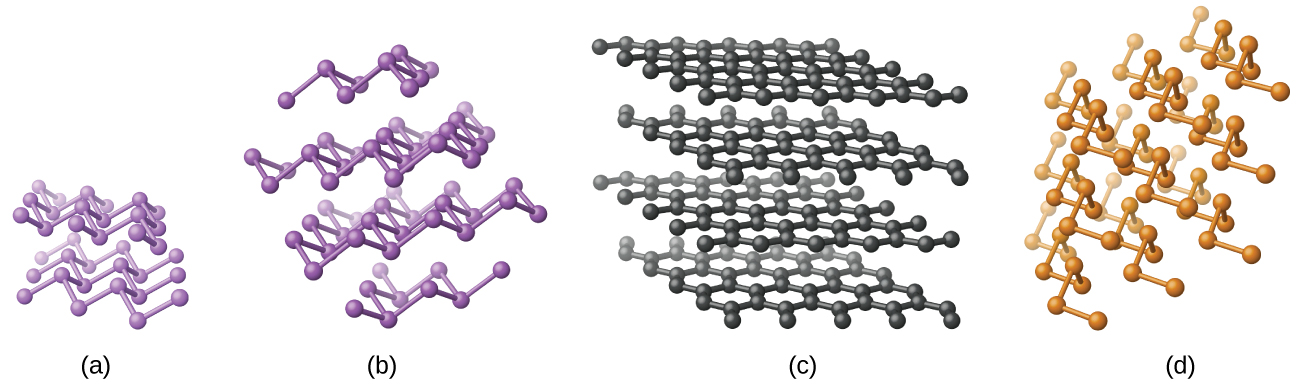
Silicon ya msingi, germanium, arsenic, antimoni, na tellurium ni lustrous, metallic-kuangalia yabisi. Silicon na germanium huangaza na muundo wa almasi. Kila atomu ndani ya kioo ina vifungo vya covalent kwa atomi nne za jirani kwenye pembe za tetrahedron ya kawaida. Fuwele za silicon na germanium ni kubwa, molekuli tatu-dimensional. Kuna allotropes kadhaa ya arsenic na safu imara zaidi kuwa kama na zenye karatasi puckered ya atomi arsenic. Kila atomi ya arsenic huunda vifungo vya covalent kwa atomi nyingine tatu ndani ya karatasi. Muundo wa kioo wa antimoni ni sawa na ule wa arsenic, wote umeonyeshwa kwenye Kielelezo\(\PageIndex{1}\). Miundo ya arsenic na antimoni ni sawa na muundo wa grafiti, iliyofunikwa baadaye katika sura hii. Tellurium huunda fuwele ambazo zina minyororo isiyo na mwisho ya atomi za tellurium. Kila atomu katika mnyororo hufunga kwa atomi nyingine mbili.
Video\(\PageIndex{1}\): Kuchunguza muundo wa kioo wa almasi ya ujazo.
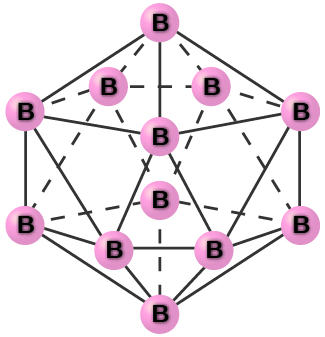
Boroni safi ya fuwele ni ya uwazi. Fuwele zinajumuisha icosahedra, kama inavyoonekana kwenye Mchoro\(\PageIndex{2}\), na atomi ya boron kila kona. Katika fomu ya kawaida ya boroni, pakiti ya icosahedra pamoja kwa namna inayofanana na kufunga kwa karibu zaidi ya nyanja. Vifungo vyote vya boroni-boroni ndani ya kila icosahedron vinafanana na ni takriban urefu wa 176pm. Katika aina tofauti za boroni, kuna mipangilio tofauti na uhusiano kati ya icosahedra.
Jina silicon linatokana na neno la Kilatini kwa jiwe, silex. Silicon ya metaloidi huunda kwa urahisi misombo iliyo na vifungo vya Si-O-Si, ambavyo vina umuhimu mkubwa katika ulimwengu wa madini. Uwezo huu wa kuunganisha ni kinyume na kaboni isiyo ya kawaida, ambao uwezo wa kuunda vifungo vya kaboni-kaboni huwapa umuhimu mkuu katika ulimwengu wa mimea na wanyama.
Matukio, Maandalizi, na Misombo ya Boron na Silicon
Boron hufanya chini ya 0.001% kwa uzito wa ukubwa wa dunia. Kwa asili, hutokea tu katika misombo na oksijeni. Boroni inasambazwa sana katika mikoa ya volkeno kama asidi boroni, B (OH) 3, na katika mikoa ya ziwa kavu, ikiwa ni pamoja na maeneo ya jangwa la California, kama borati na chumvi za oxyacids boroni, kama vile borax, Na 2 B 4 O 7 10H 2 O.
Watawala boroni ni kemikali ajizi katika joto la kawaida, kukabiliana na fluorini tu na oksijeni kuunda boroni trifluoride, BF 3, na oksidi boroni, B 2 O 3, kwa mtiririko huo. Katika joto la juu, boroni humenyuka na nonmetali zote, isipokuwa tellurium na gesi vyeo, na kwa karibu metali zote; ni oxidizes kwa B 2 O 3 wakati joto na kujilimbikizia nitriki au asidi sulfuriki. Boron haipatikani na asidi zisizo na oxidizing. Misombo mingi ya boroni huguswa kwa urahisi na maji ili kutoa asidi ya boroni, B (OH) 3 (wakati mwingine imeandikwa kama H 3 BO 3).
Kupunguza oksidi ya boroni na poda ya magnesiamu huunda boroni (95— 98.5% safi) kama poda ya kahawia, ya amofasi:
\[\ce{B2O3}(s)+\ce{3Mg}(s)⟶\ce{2B}(s)+\ce{3MgO}(s) \nonumber \]
Dutu ya amorphous ni nyenzo inayoonekana kuwa imara, lakini haina utaratibu wa muda mrefu kama imara ya kweli. Matibabu na asidi hidrokloric huondoa oxide ya magnesiamu. Utakaso zaidi wa boroni huanza na uongofu wa boroni safi katika trichloride ya boron. Hatua inayofuata ni joto la mchanganyiko wa trichloride ya boron na hidrojeni:
\[\ce{2BCl3}(g)+\ce{3H2}(g)\:\mathrm{\xrightarrow{1500\:°C}}\:\ce{2B}(s)+\ce{6HCl}(g) \hspace{20px} ΔH°=\mathrm{253.7\: kJ} \nonumber \]
Silicon hufanya karibu moja ya robo ya masi ya ukoko wa dunia—pili kwa wingi tu kwa oksijeni. Ukanda huo unajumuisha karibu kabisa madini ambayo atomi za silicon ziko katikati ya tetrahedron ya silicon-oksijeni, ambayo huunganisha kwa njia mbalimbali za kuzalisha, kati ya mambo mengine, minyororo, tabaka, na mifumo mitatu. Madini haya hufanya wingi wa miamba ya kawaida, udongo, na udongo. Aidha, vifaa kama vile matofali, keramik, na glasi zina vyenye misombo ya silicon.
Inawezekana kuzalisha silicon kwa kupunguza joto la juu la dioksidi ya silicon na mawakala wa kupunguza nguvu, kama vile kaboni na magnesiamu:
\[\ce{SiO2}(s)+\ce{2C}(s)\xrightarrow{Δ}\ce{Si}(s)+\ce{2CO}(g) \nonumber \]
\[\ce{SiO2}(s)+\ce{2Mg}(s)\xrightarrow{Δ}\ce{Si}(s)+\ce{2MgO}(s) \nonumber \]
Silicon safi sana ni muhimu kwa ajili ya utengenezaji wa vifaa vya umeme vya semiconductor. Utaratibu huu huanza na uongofu wa silicon safi kuwa tetrahalidi ya silicon, au silane (SiH 4), ikifuatiwa na kuharibika kwa joto la juu. Eneo la kusafisha, mfano katika Kielelezo\(\PageIndex{3}\), hukamilisha utakaso. Kwa njia hii, fimbo ya silicon inawaka kwa mwisho mmoja na chanzo cha joto kinachozalisha sehemu nyembamba ya silicon iliyoyeyuka. Kupunguza kasi kwa fimbo kupitia chanzo cha joto husababisha eneo la kuyeyuka kutoka mwisho mmoja wa fimbo hadi nyingine. Kama mkoa huu mwembamba, ulioyeyuka unakwenda, uchafu katika silicon hupasuka kwenye silicon ya kioevu na kuhamia na mkoa ulioyeyuka. Hatimaye, uchafu huhamia mwisho mmoja wa fimbo, ambayo hukatwa.
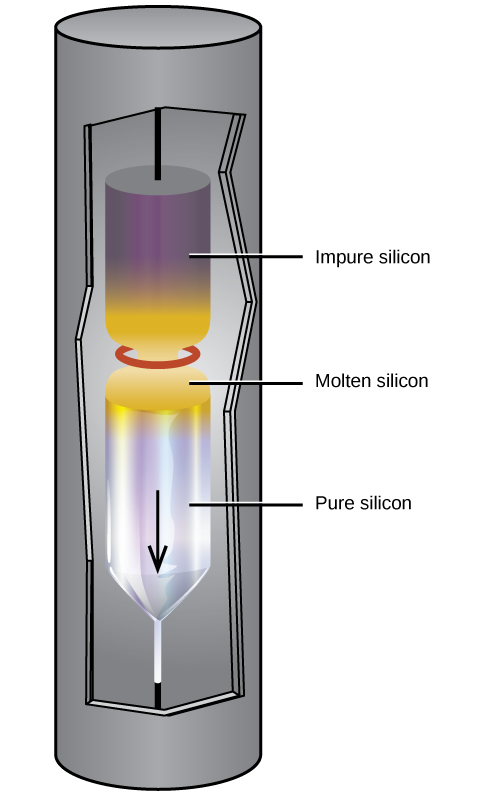
Silicon hii iliyosafishwa sana, isiyo na uchafu zaidi ya sehemu moja kwa sehemu milioni za silicon, ni kipengele muhimu zaidi katika sekta ya kompyuta. Silicon safi ni muhimu katika vifaa vya umeme vya semiconductor kama vile transistors, chips kompyuta, na seli za jua.
Kama baadhi ya metali, passivation ya silicon hutokea kutokana na malezi ya filamu nyembamba sana ya oksidi (hasa silicon dioxide, SiO 2). Dioksidi ya silicon ni mumunyifu katika msingi wa maji ya moto; hivyo, besi kali huharibu passivation. Uondoaji wa safu ya passivation inaruhusu msingi kufuta silicon, kutengeneza gesi ya hidrojeni na anions silicate. Kwa mfano:
\[\ce{Si}(s)+\ce{4OH-}(aq)⟶\ce{SiO4^4-}(aq)+\ce{2H2}(g) \nonumber \]
Silicon humenyuka na halojeni kwenye joto la juu, na kutengeneza tetrahalides tete, kama vile SiF 4.
Tofauti na kaboni, silicon haina kuunda vifungo mara mbili au tatu kwa urahisi. Misombo ya silicon ya formula ya jumla SiX 4, ambapo X ni kundi la electronegative sana, linaweza kutenda kama asidi Lewis kuunda silicon sita kuratibu. Kwa mfano, tetrafluoride ya silicon, SiF 4, humenyuka na fluoride ya sodiamu ili kutoa Na 2 [SiF 6], ambayo ina\(\ce{[SiF6]^2-}\) ion ya octahedral ambayo silicon ni sp 3 d 2 iliyosababishwa:
\[\ce{2NaF}(s)+\ce{SiF4}(g)⟶\ce{Na2SiF6}(s) \nonumber \]
Antimoni humenyuka kwa urahisi na kiasi stoichiometric ya fluorine, klorini, bromini, au iodini, kutoa trihalides au, pamoja na fluorine ziada au klorini, kutengeneza pentahalides SBF 5 na SBCl 5. Kulingana na stoichiometry, huunda antimoni (III) sulfidi, Sb 2 S 3, au antimoni (V) sulfidi wakati inapokanzwa na sulfuri. Kama inavyotarajiwa, asili ya metali ya kipengele ni kubwa zaidi kuliko ile ya arsenic, ambayo iko mara moja juu yake katika kikundi cha 15.
Boron na Silicon Halides
Trihalides ya Boron - BF 3, BCl 3, bBr 3, na BI 3 - inaweza kuandaliwa na mmenyuko wa moja kwa moja wa vipengele. Hizi molekuli zisizo na polar zina boroni na sp 2 hybridization na trigonal planar Masi jiometri. Misombo ya fluoride na kloridi ni gesi isiyo na rangi, bromidi ni kioevu, na iodidi ni imara nyeupe ya fuwele.
Isipokuwa kwa trifluoride boroni, trihalides boron urahisi hydrolyze katika maji kuunda asidi boroni na asidi sambamba hydrohalic. Boron trichloride humenyuka kulingana na equation:
\[\ce{BCl3}(g)+\ce{3H2O}(l)⟶\ce{B(OH)3}(aq)+\ce{3HCl}(aq) \nonumber \]
Boron trifluoride humenyuka na asidi hydrofluoric, kutoa suluhisho la asidi fluoroboric, HBF 4:
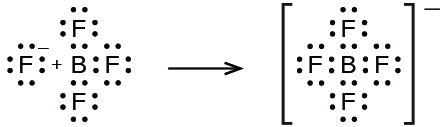
\[\ce{BF3}(aq)+\ce{HF}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{BF4-}(aq) \nonumber \]
Katika mmenyuko huu, molekuli ya BF 3 hufanya kama asidi ya Lewis (kibali cha jozi ya elektroni) na hukubali jozi ya elektroni kutoka kwa ion ya fluoride:
Tetrahalides zote za silicon, SiX 4, zimeandaliwa. Tetrachloride ya silicon inaweza kutayarishwa na klorini moja kwa moja kwenye joto la juu au kwa kupokanzwa dioksidi ya silicon na klorini
\[\ce{SiO2}(s)+\ce{2C}(s)+\ce{2Cl2}(g)\xrightarrow{Δ}\ce{SiCl4}(g)+\ce{2CO}(g) \nonumber \]
Silicon tetrachloride - covalent tetrahedral molekuli, ambayo ni nonpolar, chini ya kuchemsha (57° C), maji colorless. Inawezekana kuandaa tetrafluoride ya silicon kwa mmenyuko wa dioksidi ya silicon na asidi hydrofluoric:
\[\ce{SiO2}(s)+\ce{4HF}(g)⟶\ce{SiF4}(g)+\ce{2H2O}(l) \hspace{20px} ΔH°=\mathrm{−191.2\: kJ} \nonumber \]
Asidi ya hydrofluoric ni asidi pekee ya kawaida ambayo itachukua hatua na dioksidi ya silicon au silicates. Mmenyuko huu hutokea kwa sababu dhamana ya silicon-fluorini ni dhamana pekee ambayo silicon huunda ambayo ni nguvu zaidi kuliko dhamana ya silicon-oksijeni. Kwa sababu hii, inawezekana kuhifadhi asidi zote za kawaida, isipokuwa asidi hidrofluoric, katika vyombo vya kioo.
Isipokuwa kwa tetrafluoride ya silicon, halidi za silicon ni nyeti sana kwa maji. Baada ya yatokanayo na maji, SiCl 4 humenyuka haraka na makundi ya hidroksidi, kuchukua nafasi ya atomi zote nne za klorini kuzalisha asidi orthosilicic imara, Si (OH) 4 au H 4 SiO 4, ambayo polepole hutengana katika SiO 2.
Boroni na oksidi za Silicon na derivatives
Boroni huwaka saa 700 °C katika oksijeni, kutengeneza oksidi boroni, B 2 O 3. Oxydi ya boroni ni muhimu kwa ajili ya uzalishaji wa glasi ya borosilicate isiyoingilia joto, kama ile iliyoonyeshwa kwenye Kielelezo\(\PageIndex{4}\) na glasi fulani za macho. Oxydi ya boroni hupasuka katika maji ya moto ili kuunda asidi ya boroni, B (OH) 3:
\[\ce{B2O3}(s)+\ce{3H2O}(l)⟶\ce{2B(OH)3}(aq) \nonumber \]

Atomu ya boroni katika B (OH) 3 ni sp 2 iliyochanganywa na iko katikati ya pembetatu ya equilateral na atomi za oksijeni kwenye pembe. Katika imara B (OH) 3, bonding hidrojeni ina vitengo hivi vya triangular pamoja. Asidi ya boroni, inavyoonekana kwenye Kielelezo\(\PageIndex{5}\), ni asidi dhaifu sana ambayo haifanyi kazi kama wafadhili wa proton bali kama asidi ya Lewis, kukubali jozi ya elektroni isiyoshirikiwa kutoka kwa msingi wa Lewis OH -:
\[\ce{B(OH)3}(aq)+\ce{2H2O}(l)⇌\ce{B(OH)4-}(aq)+\ce{H3O+}(aq) \hspace{20px} K_\ce{a}=5.8×10^{−10} \nonumber \]
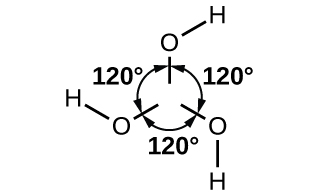
Inapokanzwa asidi boroni hadi 100 °C husababisha molekuli za maji kugawanyika kati ya jozi za makundi ya jirani -OH kuunda asidi metaboriki, HBO 2. Katika takriban 150 °C, nyongeza za uhusiano wa B-O-B zinaunda, kuunganisha vikundi vya BO 3 pamoja na atomi za oksijeni zilizoshirikiwa kuunda asidi ya tetrabori, H 2 B 4 O 7. Kupoteza maji kamili, kwa joto la juu, husababisha oksidi ya boroni.
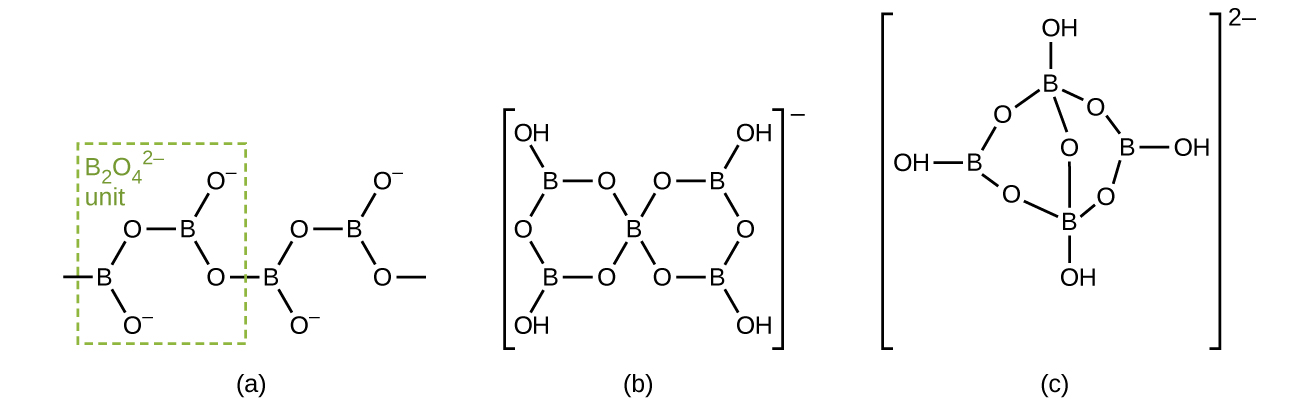
Borates ni chumvi za oxyacids ya boron. Borates kutokana na athari za msingi na oxyacid au kutoka fusion ya asidi boroni au oksidi ya boroni na oksidi ya chuma au hidroksidi. Anioni za borati zinatofautiana kutoka\(\ce{BO3^3-}\) ioni rahisi ya trigonal planar hadi spishi tata zenye minyororo na pete za atomi tatu na nne za boroni. Miundo ya anioni iliyopatikana katika CaB 2 O 4, K [B 5 O 6 (OH) 4] 2H 2 O (kawaida imeandikwa KB 5 O 8 4H 2 O) na Na 2 [B 4 O 5 (OH) 4] 8H 2 O (kawaida imeandikwa Na 2 B 4 O 7 10H 2 O) ni inavyoonekana katika Kielelezo\(\PageIndex{6}\). Kibiashara, borate muhimu zaidi ni borax, Na 2 [B 4 O 5 (OH) 4] 8H 2 O, ambayo ni sehemu muhimu ya sabuni baadhi ya kufulia. Wengi wa usambazaji wa borax huja moja kwa moja kutoka maziwa kavu, kama vile Searles Ziwa katika California, au ni tayari kutoka kernite, Na 2 B 4 the 7 4H 2 O.
Silicon dioksidi, silika, hutokea katika fomu zote za fuwele na za amorphous. Aina ya kawaida ya fuwele ya dioksidi ya silicon ni quartz, ngumu, brittle, wazi, isiyo na rangi imara. Ni muhimu kwa njia nyingi-kwa mapambo ya usanifu, vyombo vya semiprecious, na udhibiti wa mzunguko katika transmita za redio. Silika inachukua aina nyingi za fuwele, au polymorphs, kwa asili. Fuatilia kiasi cha Fe 3+katika quartz kutoa amethyst rangi yake ya rangi ya zambarau. Neno quartz hutumiwa pia kwa makala kama vile tubing na lenses ambazo hutengenezwa kutoka silika ya amorphous. Opal ni aina ya kawaida ya silika ya amorphous.
Tofauti katika muundo na mali ya kimwili kati ya dioksidi ya silicon na dioksidi kaboni ni ya kuvutia, kama ilivyoonyeshwa kwenye Kielelezo\(\PageIndex{7}\). Dioksidi kaboni imara (barafu kavu) ina molekuli moja ya CO 2 na kila moja ya atomi mbili za oksijeni zilizounganishwa na atomi ya kaboni kwa vifungo viwili. Vikosi vya intermolecular dhaifu sana vinashikilia molekuli pamoja katika kioo. Tete ya barafu kavu huonyesha vikosi hivi dhaifu kati ya molekuli. Kwa upande mwingine, dioksidi ya silicon ni mtandao wa covalent imara. Katika dioksidi ya silicon, kila atomi ya silicon inaunganisha atomi nne za oksijeni na vifungo moja kwa moja iliyoelekezwa kuelekea pembe za tetrahedron ya kawaida, na ISO 4 tetrahedra kushiriki atomi oksijeni. Mpangilio huu hutoa mtandao wa tatu, unaoendelea, wa silicon-oksijeni. Kioo cha quartz ni macromolekuli ya dioksidi ya silicon Tofauti kati ya misombo hii miwili ni uwezo wa kundinyota 14 elementi kuunda vifungo vya π vikali. Vipengele vya kipindi cha pili, kama vile kaboni, huunda vifungo vyenye nguvu sana vya π, ndiyo sababu dioksidi kaboni huunda molekuli ndogo zenye vifungo vikali viwili. Elementi zilizo chini ya kipindi cha pili, kama vile silicon, hazifanyi vifungo π kwa urahisi kama elementi za kipindi cha pili, na wakati zinaunda, vifungo vya π vina dhaifu kuliko yale yaliyoundwa na elementi za kipindi cha pili. Kwa sababu hii, dioksidi ya silicon haina vifungo π bali ni vifungo σ tu.

Katika 1600 °C, quartz inakayeyuka ili kutoa kiowevu cha viscous. Wakati kioevu kinapozidi, haipatikani kwa urahisi lakini kwa kawaida huwa supercools na huunda kioo, pia huitwa silika. SiO 4 tetrahedra katika silika kioo na mpangilio random tabia ya vinywaji supercooled, na kioo ina baadhi ya mali muhimu sana. Silika ni wazi sana kwa mwanga unaoonekana na ultraviolet. Kwa sababu hii, ni muhimu katika utengenezaji wa taa zinazotoa mionzi yenye matajiri katika mwanga wa ultraviolet na katika vyombo vingine vya macho vinavyofanya kazi na mwanga wa ultraviolet. Mgawo wa upanuzi wa glasi ya silika ni mdogo sana; kwa hiyo, mabadiliko ya joto ya haraka hayana kusababisha kupasuka. CorningWare na cookware nyingine za kauri zina silika ya amorphous.
Silicates ni chumvi zenye anions linajumuisha silicon na oksijeni. Katika karibu silicates zote, sp 3 -hybridized atomi silicon kutokea katika vituo vya tetrahedra na oksijeni katika pembe. Kuna tofauti katika uwiano wa silicon-to-oksijeni ambayo hutokea kwa sababu tetrahedra ya silicon-oksijeni inaweza kuwepo kama vitengo vya kipekee, vya kujitegemea au inaweza kugawana atomi za oksijeni kwenye pembe kwa njia mbalimbali. Aidha, kuwepo kwa cations mbalimbali huongezeka kwa idadi kubwa ya madini ya silicate. Keramik nyingi zinajumuisha silicates. Kwa kuingiza kiasi kidogo cha misombo mingine, inawezekana kurekebisha mali ya kimwili ya vifaa vya silicate ili kuzalisha keramik na sifa muhimu.
Muhtasari
Mambo boroni, silicon, germanium, arsenic, antimoni, na tellurium hutenganisha metali kutoka kwa nonmetals katika meza ya mara kwa mara. Mambo haya, inayoitwa metalloids au wakati mwingine semimetali, huonyesha mali ya metali zote mbili na zisizo za kawaida. Miundo ya vipengele hivi ni sawa kwa njia nyingi kwa wale wa nonmetals, lakini vipengele ni semiconductors umeme.
faharasa
- kidude
- nyenzo imara kama kioo ambacho hazina sehemu ya kurudia mara kwa mara kwa muundo wake wa tatu-dimensional; imara lakini si kioo
- borate
- kiwanja zenye vifungo boroni-oksijeni, kwa kawaida na makundi au minyororo kama sehemu ya muundo wa kemikali
- polymorph
- tofauti katika muundo fuwele kwamba matokeo katika mali mbalimbali ya kimwili kwa ajili ya kiwanja kusababisha
- silicate
- kiwanja kilicho na vifungo vya silicon-oksijeni, na tetrahedra ya silicate iliyounganishwa kwenye pete, karatasi, au mitandao mitatu, kulingana na mambo mengine yanayohusika katika malezi ya misombo


