18.2: Matukio na Maandalizi ya Metali za Mwakilishi
- Page ID
- 176314
- Kutambua vyanzo vya asili vya metali mwakilishi
- Eleza michakato ya kupunguza electrolytic na kemikali kutumika kuandaa mambo haya kutoka vyanzo vya asili
Kwa sababu ya reactivity yao, hatuwezi kupata metali nyingi za mwakilishi kama vipengele vya bure katika asili. Hata hivyo, misombo iliyo na ions ya metali nyingi za mwakilishi ni nyingi. Katika sehemu hii, tutazingatia mbinu mbili za kawaida zinazotumiwa kutenganisha metali kutoka misombo hizi-electrolysis na kupunguza kemikali.
Metali hizi hutokea hasa katika madini, na lithiamu hupatikana katika madini ya silicate au phosphate, na sodiamu na potasiamu hupatikana katika amana za chumvi kutokana na uvukizi wa bahari za kale na katika silicates. Metali ya ardhi ya alkali hutokea kama silicates na, isipokuwa beryllium, kama carbonates na sulfates. Beryllium hutokea kama beryl madini, Kuwa 3 Al 2 Si 6 O 18, ambayo, pamoja na uchafu fulani, inaweza kuwa ama emerald jiwe au aquamarine. Magnesiamu iko katika maji ya bahari na, pamoja na metali nzito ya ardhi ya alkali, hutokea kama silicates, carbonates, na sulfates. Aluminium hutokea kwa kiasi kikubwa katika aina nyingi za udongo na katika bauxite, hidroksidi ya oksidi ya alumini isiyo safi. Kanuni ya bati ni cassiterite ya oksidi, SNO 2, na risasi ya kanuni na ores ya thallium ni sulfidi au bidhaa za hali ya hewa ya sulfidi. Metali iliyobaki ya mwakilishi hutokea kama uchafu katika zinki au ores alumini.
Electrolysis
Ions ya metali katika makundi ya 1 na 2, pamoja na alumini, ni vigumu sana kupunguza; kwa hiyo, ni muhimu kuandaa vipengele hivi kwa electrolysis, mchakato muhimu unaojadiliwa katika sura ya electrochemistry. Kwa kifupi, electrolysis inahusisha kutumia nishati ya umeme ili kuendesha athari mbaya za kemikali hadi kukamilika; ni muhimu katika kutengwa kwa metali tendaji katika fomu zao safi. Sodiamu, alumini, na magnesiamu ni mifano ya kawaida.
Maandalizi ya Sodiamu
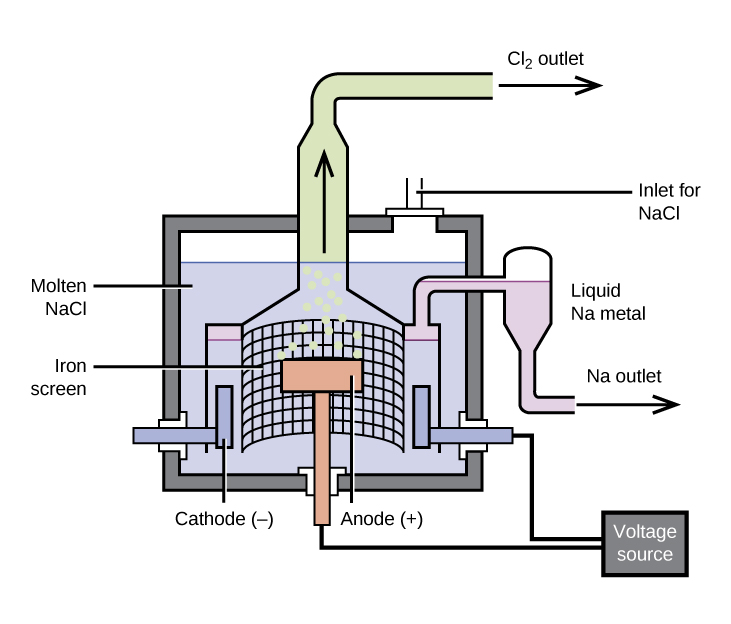
Njia muhimu zaidi kwa ajili ya uzalishaji wa sodiamu ni electrolysis ya kloridi ya sodiamu iliyoyeyuka; kuweka-up ni kiini cha Downs, kilichoonyeshwa kwenye Mchoro\(\PageIndex{1}\). Majibu yanayohusika katika mchakato huu ni:
\[\ce{2NaCl}(l)\:\mathrm{\underset{600\:°C}{\xrightarrow{electrolysis}}}\:\ce{2Na}(l)+\ce{Cl2}(g) \nonumber \]
Kiini cha electrolysis kina kloridi ya sodiamu iliyoyeyuka (kiwango cha kuyeyuka 801 °C), ambayo kloridi ya kalsiamu imeongezwa ili kupunguza kiwango cha kuyeyuka hadi 600 °C (athari ya colligative). Kifungu cha sasa cha moja kwa moja kupitia seli husababisha ions za sodiamu kuhamia kwenye cathode iliyosababishwa vibaya na kuchukua elektroni, kupunguza ions kwa chuma cha sodiamu. Ions ya kloridi huhamia kwenye anode yenye kushtakiwa vyema, kupoteza elektroni, na hupata oxidation kwa gesi ya klorini. Menyu ya jumla ya seli hutoka kwa kuongeza athari zifuatazo:
\ [kuanza {align}
&\ textrm {katika cathode:}\ ce {2Na+} +\ ce {2e-}\ ce {2Na} (l)\\
&\ textrm {katika anode:}\ ce {2Cl-}\ ce {Cl2} (g) +\ ce {2e-}\\
&\ textrm {mabadiliko ya jumla:}\ ce {2Na+} +\ ce {2Cl-}\ ce {2Na} (l) +\ ce {Cl2} (g)
\ mwisho {align}\ namba\]
Kugawanyika kwa sodiamu iliyosafishwa na klorini huzuia upya. Sodiamu ya kioevu, ambayo ni ndogo kuliko kloridi ya sodiamu iliyoyeyuka, inaelea juu ya uso na inapita ndani ya mtoza. Klorini ya gesi inakwenda kwenye mizinga ya kuhifadhi. Klorini pia ni bidhaa muhimu.
Maandalizi ya Aluminium
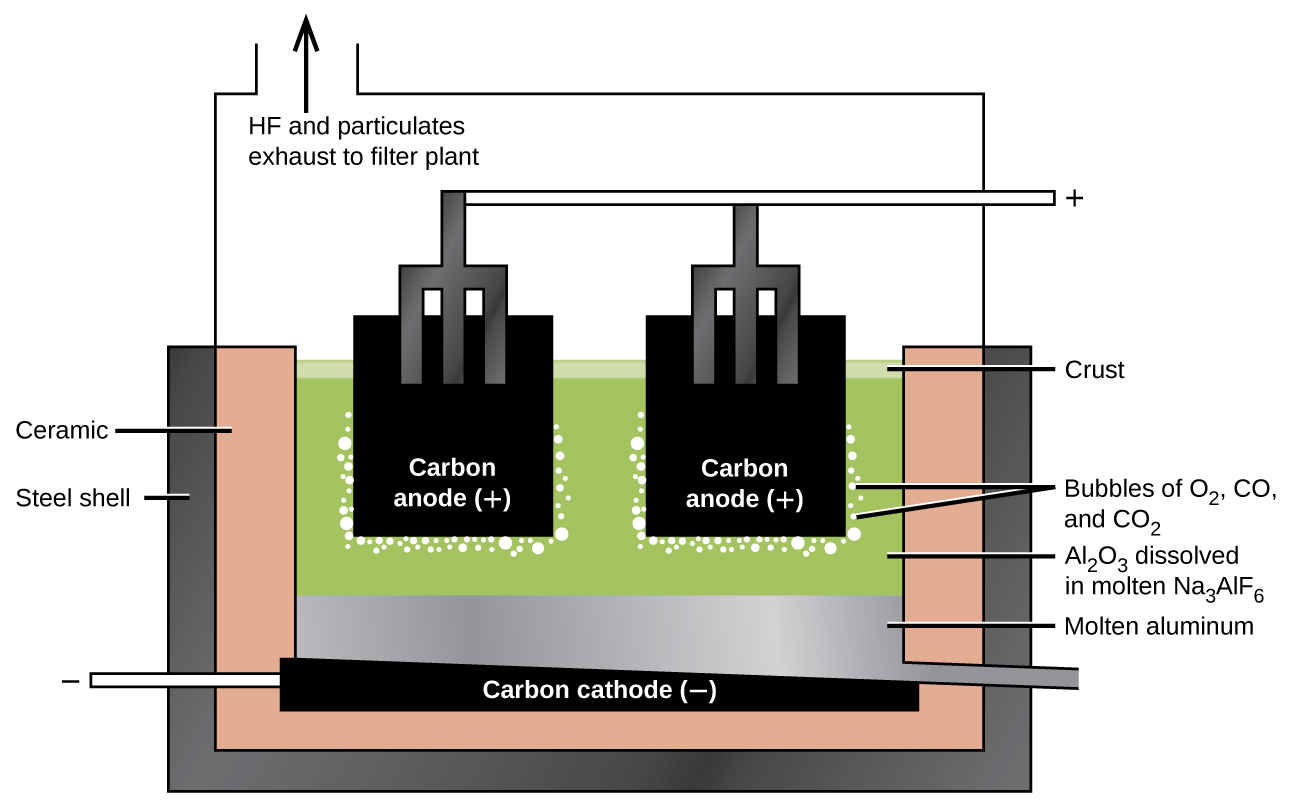
Maandalizi ya alumini hutumia mchakato uliobuniwa mwaka 1886 na Charles M. Hall, ambaye alianza kufanya kazi juu ya tatizo wakati mwanafunzi katika Chuo cha Oberlin huko Ohio. Paul L. T. Héroult aligundua mchakato kwa kujitegemea mwezi mmoja au miwili baadaye nchini Ufaransa. Kwa heshima kwa wavumbuzi wawili, kiini hiki cha electrolysis kinajulikana kama kiini cha Hall—Héroult. Kiini cha Hall—Héroult ni kiini cha electrolysis kwa ajili ya uzalishaji wa alumini. Kielelezo\(\PageIndex{2}\) unaeleza kiini Hall-Héroult.
Uzalishaji wa alumini huanza na utakaso wa bauxite, chanzo cha kawaida cha alumini. Tabia ya bauxite, ALO (OH), na hidroksidi ya moto ya sodiamu hutengeneza aluminate ya sodiamu, wakati udongo na uchafu mwingine hubakia bila kufutwa:
\[\ce{AlO(OH)}(s)+\ce{NaOH}(aq)+\ce{H2O}(l)⟶\ce{Na[Al(OH)4]}(aq) \nonumber \]
Baada ya kuondolewa kwa uchafu na filtration, kuongeza asidi kwa aluminate inaongoza kwa reprecipitation ya hidroksidi alumini:
\[\ce{Na[Al(OH)4]}(aq)+\ce{H3O+}(aq)⟶\ce{Al(OH)3}(s)+\ce{Na+}(aq)+\ce{2H2O}(l) \nonumber \]
Hatua inayofuata ni kuondoa hidroksidi ya alumini iliyosababishwa na filtration. Inapokanzwa hidroksidi hutoa oksidi ya alumini, Al 2 O 3, ambayo hupasuka katika mchanganyiko wa cryolite, Na 3 alF 6, na fluoride ya kalsiamu, CaF 2. Electrolysis ya ufumbuzi huu unafanyika katika kiini kama ile inavyoonekana katika Kielelezo\(\PageIndex{2}\). Kupunguza ions alumini kwa chuma hutokea kwenye cathode, wakati oksijeni, monoxide kaboni, na dioksidi kaboni huunda kwenye anode.
Maandalizi ya Magnesiamu
Magnesiamu ni metali nyingine ambayo imetengwa kwa kiasi kikubwa na electrolysis. Maji ya bahari, ambayo ina takriban 0.5% ya kloridi ya magnesiamu, hutumika kama chanzo kikubwa cha magnesiamu. Kuongezea hidroksidi ya kalsiamu kwa maji ya bahari hupunguza hidroksidi ya magnesi Ongezeko la asidi hidrokloriki kwa hidroksidi ya magnesiamu, ikifuatiwa na uvukizi wa suluhisho la maji yenye maji, huacha kloridi safi Electrolysis ya kloridi ya magnesiamu iliyosafishwa hufanya magnesiamu kioevu na gesi ya klorini:
\[\ce{MgCl2}(aq)+\ce{Ca(OH)2}(aq)⟶\ce{Mg(OH)2}(s)+\ce{CaCl2}(aq) \nonumber \]
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)⟶\ce{MgCl2}(aq)+\ce{2H2O}(l) \nonumber \]
\[\ce{MgCl2}(l)⟶\ce{Mg}(l)+\ce{Cl2}(g) \nonumber \]
Baadhi ya vifaa vya uzalishaji wamehamia mbali na electrolysis kabisa. Katika sehemu inayofuata, tutaona jinsi mchakato wa Pidgeon unasababisha kupunguza kemikali ya magnesiamu.
Kemikali Kupunguza
Inawezekana kutenganisha metali nyingi za mwakilishi kwa kupunguza kemikali kwa kutumia vipengele vingine kama mawakala wa kupunguza. Kwa ujumla, kupunguza kemikali ni ghali sana kuliko electrolysis, na kwa sababu hii, kupunguza kemikali ni njia ya kuchagua kwa kutengwa kwa vipengele hivi. Kwa mfano, inawezekana kuzalisha potasiamu, rubidium, na cesium kwa kupunguza kemikali, kama inawezekana kupunguza kloridi zilizoyeyushwa za metali hizi na chuma cha sodiamu. Hii inaweza kuwa ya kushangaza kutokana na kwamba metali hizi ni tendaji zaidi kuliko sodiamu; hata hivyo, metali zilizoundwa ni tete zaidi kuliko sodiamu na zinaweza kutumiwa kwa ajili ya kukusanya. Kuondolewa kwa mvuke wa chuma husababisha mabadiliko katika usawa ili kuzalisha chuma zaidi (kupitia kanuni ya Le Chatelier). Uzalishaji wa magnesiamu, zinki, na bati hutoa mifano ya ziada ya kupunguza kemikali.
Maandalizi ya Magnesiamu
Mchakato wa Pidgeon unahusisha mmenyuko wa oksidi ya magnesiamu na silicon ya msingi katika joto la juu ili kuunda magnesiamu safi:
\[\ce{Si}(s)+\ce{2MgO}(s)\xrightarrow{Δ}\ce{SiO2}(s)+\ce{2Mg}(g) \nonumber \]
Ingawa mmenyuko huu ni mbaya kwa suala la thermodynamics, kuondolewa kwa mvuke wa magnesiamu zinazozalishwa inachukua faida ya kanuni ya Le Chatelier ili kuendelea na maendeleo ya mbele ya majibu. Zaidi ya 75% ya uzalishaji wa magnesiamu duniani, hasa nchini China, hutoka kwa mchakato huu.
Maandalizi ya Zinc
Ores za zinki huwa na sulfidi ya zinki, oksidi ya zinki, au carbonate ya Baada ya kujitenga kwa misombo hii kutoka kwa ores, inapokanzwa hewa hubadilisha ore kwa oksidi ya zinki na moja ya athari zifuatazo:
\[\ce{2ZnS}(s)+\ce{3O2}(g)\xrightarrow{Δ}\ce{2ZnO}(s)+\ce{2SO2}(g) \nonumber \]
\[\ce{ZnCO3}(s)\xrightarrow{Δ}\ce{ZnO}(s)+\ce{CO2}(g) \nonumber \]
Kaboni, kwa namna ya makaa ya mawe, hupunguza oksidi ya zinki ili kuunda mvuke wa zinki:
\[\ce{ZnO}(s)+\ce{C}(s)⟶\ce{Zn}(g)+\ce{CO}(g) \nonumber \]
Zinki zinaweza kufutwa (kiwango cha kuchemsha 907 °C) na kufupishwa. Zinki hii ina uchafu wa cadmium (767 °C), chuma (2862 °C), risasi (1750 °C), na arseniki (613 °C). Upyaji wa makini hutoa zinki safi. Arsenic na cadmium hutenganishwa kutoka zinki kwa sababu zina pointi za chini za kuchemsha. Kwa joto la juu, zinki hutolewa kutokana na uchafu mwingine, hasa risasi na chuma.
Maandalizi ya Tin
Kupunguza tayari kwa oksidi ya bati (IV) na makaa ya moto ya campfire akaunti kwa ujuzi wa bati katika ulimwengu wa kale. Katika mchakato wa kisasa, kuchomwa kwa ores za bati zenye SNO 2 huondoa uchafu kama arsenic na sulfuri kama oksidi tete. Matibabu ya nyenzo iliyobaki na asidi hidrokloric huondoa oksidi za metali nyingine. Inapokanzwa madini yaliyotakaswa na kaboni kwenye joto la juu ya 1000 °C hutoa bati:
\[\ce{SnO2}(s)+\ce{2C}(s)\xrightarrow{Δ}\ce{Sn}(s)+\ce{2CO}(g) \nonumber \]
Bati iliyochombwa hukusanya chini ya tanuru na hutolewa na kutupwa katika vitalu.
Muhtasari
Kwa sababu ya reactivity yao ya kemikali, ni muhimu kuzalisha metali ya mwakilishi katika fomu zao safi kwa kupunguza kutoka kwa misombo ya kawaida. Electrolysis ni muhimu katika uzalishaji wa sodiamu, potasiamu, na alumini. Kupunguza kemikali ni njia ya msingi ya kutengwa kwa magnesiamu, zinki, na bati. Taratibu zinazofanana ni muhimu kwa metali nyingine za mwakilishi.
faharasa
- kupunguza kemikali
- njia ya kuandaa chuma mwakilishi kwa kutumia wakala kupunguza
- Downs kiini
- electrochemical kiini kutumika kwa ajili ya maandalizi ya kibiashara ya metali sodium (na klorini) kutoka kuyeyuka sodiamu
- Hall—Héroult kiini
- vifaa vya electrolysis vinavyotumiwa kutenganisha chuma safi cha alumini kutoka suluhisho la alumini katika cryolite iliyoyeyuka
- Mchakato wa njiwa
- mchakato wa kupunguza kemikali kutumika kuzalisha magnesiamu kupitia mmenyuko mafuta ya oksidi magnesiamu na silicon


