18.1: Periodicity
- Page ID
- 176370
- Kuainisha vipengele
- Fanya utabiri kuhusu mali ya mara kwa mara ya vipengele vya mwakilishi
Tunaanza sehemu hii kwa kuchunguza tabia za metali za mwakilishi kuhusiana na nafasi zao katika meza ya mara kwa mara. Lengo la msingi la sehemu hii litakuwa matumizi ya periodicity kwa metali mwakilishi.
Inawezekana kugawanya vipengele katika vikundi kulingana na usanidi wao wa elektroni. Mambo ya mwakilishi ni mambo ambapo orbitals s na p ni kujaza. Mambo ya mpito ni elementi ambako orbitali d (vikundi 3—11 kwenye meza ya mara kwa mara) vinajaza, na metali za mpito za ndani ni elementi ambako orbitali f hujaza. Orbitals d kujaza na mambo katika kundi 11; Kwa hiyo, vipengele katika kundi 12 kuhitimu kama vipengele mwakilishi kwa sababu elektroni mwisho inaingia s orbital. Vyuma kati ya vipengele vya mwakilishi ni metali za mwakilishi. Tabia ya metali inatokana na uwezo wa elementi wa kupoteza elektroni zake za nje za valence na matokeo katika conductivity ya juu ya mafuta na umeme, kati ya mali nyingine za kimwili na kemikali. Kuna 20 nonradioactive mwakilishi metali katika makundi 1, 2, 3, 12, 13, 14, na 15 ya meza ya mara kwa mara (mambo kivuli katika njano katika Kielelezo\(\PageIndex{1}\)). Elementi za mionzi copernicium, flerovium, polonium, na livermorium pia ni metali lakini ziko zaidi ya upeo wa sura hii.
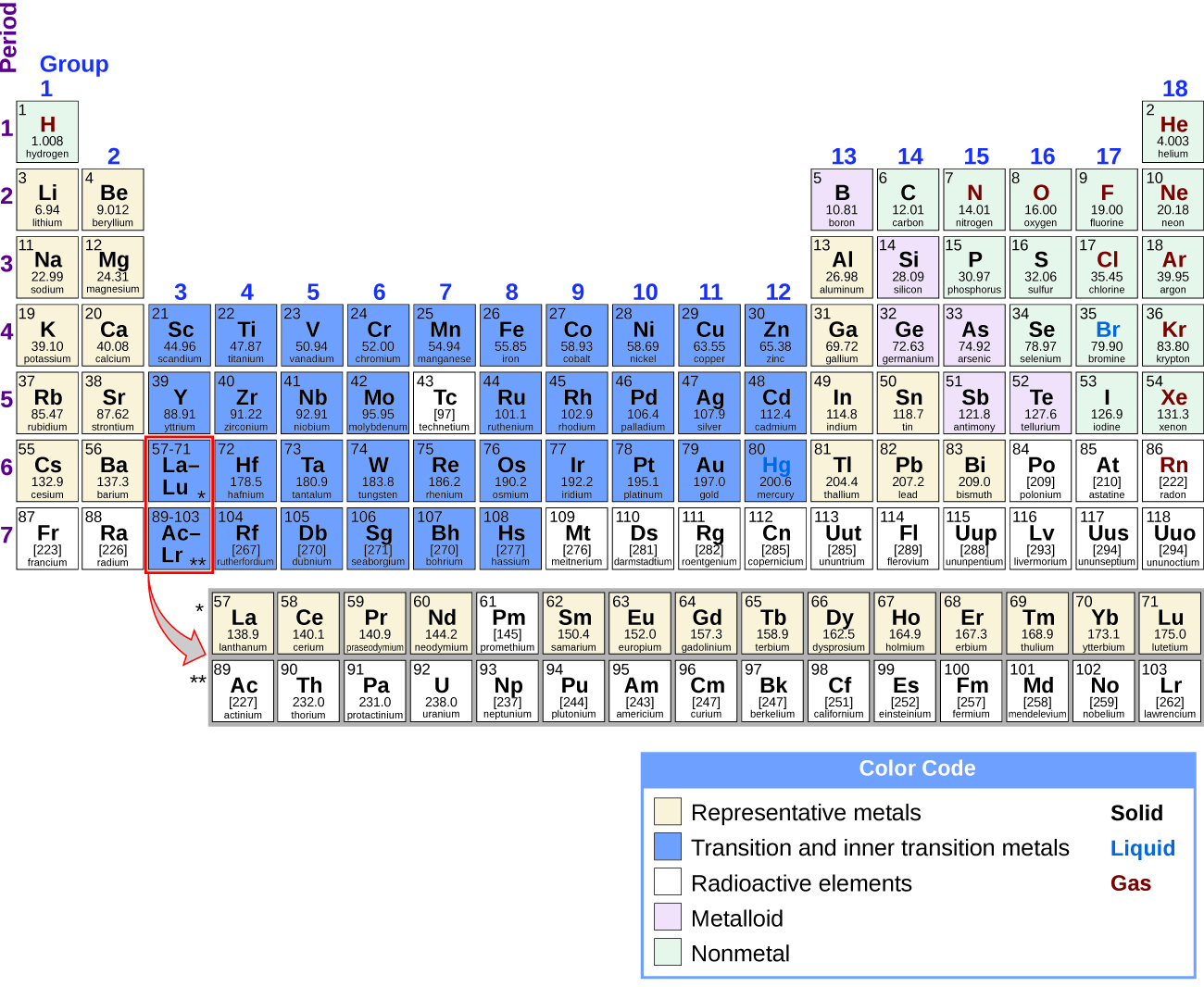
Mbali na metali ya mwakilishi, baadhi ya vipengele vya mwakilishi ni metalloids. Metaloidi ni elementi ambayo ina mali ambayo ni kati ya zile za metali na nonmetali; elementi hizi ni kawaida semiconductors. Vipengele vya mwakilishi vilivyobaki ni nonmetals. Tofauti na metali, ambayo kwa kawaida huunda cations na misombo ionic (zenye vifungo ionic), nonmetals huwa na kuunda anions au misombo ya Masi. Kwa ujumla, mchanganyiko wa chuma na nonmetal hutoa chumvi. Chumvi ni kiwanja cha ionic kilicho na cations na anions.
Chumvi ni kiwanja cha ionic kilicho na cations na anions.
Wengi wa metali mwakilishi wala kutokea kwa kawaida katika hali uncombined kwa sababu urahisi kuguswa na maji na oksijeni katika hewa. Hata hivyo, inawezekana kutenganisha berili ya msingi, magnesiamu, zinki, cadmium, zebaki, alumini, bati, na kuongoza kutoka kwa madini yao ya kawaida yanayotokea na kuitumia kwa sababu huitikia polepole sana na hewa. Sehemu ya sababu kwa nini vipengele hivi huguswa polepole ni kwamba vipengele hivi huguswa na hewa ili kuunda mipako ya kinga. Kuundwa kwa mipako hii ya kinga ni passivation. Mipako ni filamu isiyo ya ufanisi ya oksidi au kiwanja kingine. Magnesiamu ya msingi, alumini, zinki, na bati ni muhimu katika utengenezaji wa vitu vingi vya kawaida, ikiwa ni pamoja na waya, cookware, foil, na vitu vingi vya kaya na vya kibinafsi. Ingawa beryllium, cadmium, zebaki, na risasi zinapatikana kwa urahisi, kuna mapungufu katika matumizi yao kwa sababu ya sumu yao.
Kikundi cha 1: Madini ya Alkali
Madini ya alkali lithiamu, sodiamu, potasiamu, rubidium, cesium, na francium hufanya kikundi 1 cha meza ya mara kwa mara. Ingawa hidrojeni iko katika kikundi cha 1 (na pia katika kundi la 17), ni nonmetali na inastahili kuzingatia tofauti baadaye katika sura hii. Jina la chuma la alkali linataja ukweli kwamba metali hizi na oksidi zao huguswa na maji ili kuunda ufumbuzi wa msingi (alkali).
Mali ya metali ya alkali ni sawa na kila mmoja kama inavyotarajiwa kwa elementi katika familia moja. Metali ya alkali ina radii atomia kubwa na nishati ya ionization ya kwanza ya chini kabisa katika vipindi vyake. Mchanganyiko huu hufanya iwe rahisi sana kuondoa elektroni moja katika shell ya nje (valence) ya kila mmoja. Hasara rahisi ya elektroni hii ya valence ina maana kwamba metali hizi huunda urahisi cations imara na malipo ya 1+. Reactivity yao huongezeka kwa kuongezeka kwa idadi ya atomiki kutokana na urahisi wa kupoteza elektroni ya valence pekee (kupungua kwa nishati ya ionization). Kwa kuwa oxidation ni rahisi, reverse, kupunguza, ni vigumu, ambayo inaelezea kwa nini ni vigumu kutenganisha vipengele. Metali ya alkali imara ni laini sana; lithiamu, iliyoonyeshwa kwenye Kielelezo\(\PageIndex{2}\), ina wiani wa chini kabisa wa chuma chochote (0.5 g/cm 3).

Metali za alkali zote huguswa kwa nguvu na maji ili kuunda gesi ya hidrojeni na suluhisho la msingi la hidroksidi ya chuma. Hii inamaanisha kuwa ni rahisi kuimarisha kuliko hidrojeni. Kwa mfano, majibu ya lithiamu na maji ni:
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
Metali za alkali huitikia moja kwa moja na nonmetali zote (isipokuwa gesi zenye heshima) ili kuzalisha misombo ya ioniki ya binary iliyo na ioni za chuma 1+. Metali hizi ni tendaji sana kwamba ni muhimu kuepuka kuwasiliana na unyevu na oksijeni katika hewa. Kwa hiyo, wao ni kuhifadhiwa katika vyombo muhuri chini ya mafuta ya madini, kama inavyoonekana katika Kielelezo\(\PageIndex{3}\), ili kuzuia kuwasiliana na hewa na unyevu. Metali safi haipo kamwe bure (isiyounganishwa) katika asili kutokana na reactivity yao ya juu. Aidha, reactivity hii ya juu inafanya kuwa muhimu kuandaa metali kwa electrolysis ya misombo ya chuma ya alkali.

Tofauti na metali nyingine nyingi, reactivity na softness ya metali alkali hufanya metali hizi hazifai kwa matumizi ya kimuundo. Hata hivyo, kuna maombi ambapo reactivity ya metali alkali ni faida. Kwa mfano, uzalishaji wa metali kama vile titani na zirconium hutegemea, kwa sehemu, juu ya uwezo wa sodiamu kupunguza misombo ya metali hizi. Utengenezaji wa misombo mingi ya kikaboni, ikiwa ni pamoja na rangi fulani, madawa ya kulevya, na manukato, hutumia kupunguza kwa lithiamu au sodiamu.
Sodiamu na misombo yake hutoa rangi ya njano mkali kwa moto, kama inavyoonekana kwenye Mchoro\(\PageIndex{4}\). Kupitisha kutokwa kwa umeme kupitia mvuke ya sodiamu pia hutoa rangi hii. Katika hali zote mbili, hii ni mfano wa wigo wa chafu kama ilivyojadiliwa katika sura ya muundo wa elektroniki. Mitaani wakati mwingine hutumia taa za mvuke za sodiamu kwa sababu mvuke wa sodiamu hupenya ukungu bora kuliko mwanga mwingine. Hii ni kwa sababu ukungu hauenezi mwanga wa manjano kadri unavyowatawanya nuru nyeupe. Metali nyingine za alkali na chumvi zao pia hutoa rangi kwa moto. Lithiamu inajenga rangi nyekundu, nyekundu, wakati wengine huunda rangi ya rangi, violet.
Video\(\PageIndex{1}\): Video hii inaonyesha athari za metali za alkali na maji.
Kikundi cha 2: Metali za Dunia za alkali
Metali za ardhi za alkali (beryllium, magnesiamu, kalsiamu, strontium, bariamu, na radium) hufanya kundi la 2 la meza ya mara kwa mara. Jina la chuma la alkali linatokana na ukweli kwamba oksidi za wanachama nzito wa kikundi huguswa na maji ili kuunda ufumbuzi wa alkali. Malipo ya nyuklia yanaongezeka wakati wa kwenda kutoka kikundi 1 hadi kikundi cha 2. Kwa sababu ya ongezeko hili la malipo, atomi za metali za dunia za alkali ni ndogo na zina nguvu za ionization za kwanza kuliko metali za alkali ndani ya kipindi hicho. Nishati ya ionization ya juu hufanya metali za dunia za alkali zisizo tendaji kuliko metali za alkali; hata hivyo, bado ni vipengele vya tendaji sana. Reactivity yao huongezeka, kama inavyotarajiwa, na ukubwa wa kuongezeka na kupungua kwa nishati ya ionization. Katika athari za kemikali, metali hizi hupoteza elektroni zote za valence kuunda misombo ambayo zinaonyesha hali ya oxidation ya 2+. Kutokana na reactivity yao ya juu, ni kawaida kuzalisha metali ya ardhi ya alkali, kama metali ya alkali, na electrolysis. Ingawa nguvu za ionization ni za chini, metali mbili zilizo na nguvu za ionization za juu (beryllium na magnesiamu) hufanya misombo inayoonyesha baadhi ya wahusika wa covalent. Kama metali ya alkali, metali nzito ya alkali ya ardhi hutoa rangi kwa moto. Kama ilivyo katika metali ya alkali, hii ni sehemu ya wigo wa chafu wa vipengele hivi. Calcium na strontium huzalisha vivuli vya rangi nyekundu, wakati bariamu hutoa rangi ya kijani.
Magnésiamu ni chuma cha fedha-nyeupe ambacho kina malleable na ductile kwenye joto la juu. Passivation inapungua reactivity ya chuma magnesiamu. Baada ya kuambukizwa na hewa, safu ya kushikamana kwa ukali ya aina ya oksicarbonate ya magnesiamu juu ya uso wa chuma na inhibitisha mmenyuko zaidi. (Carbonate hutoka kwa mmenyuko wa dioksidi kaboni katika anga.) Magnesiamu ni nyepesi zaidi ya metali za miundo inayotumiwa sana, ndiyo sababu uzalishaji wa magnesiamu ni kwa aloi nyepesi.
Magnesiamu (Kielelezo\(\PageIndex{5}\)), kalsiamu, strontium, na bariamu huguswa na maji na hewa. Kwa joto la kawaida, bariamu inaonyesha majibu yenye nguvu zaidi. Bidhaa za mmenyuko na maji ni hidrojeni na hidroksidi ya chuma. Kuundwa kwa gesi ya hidrojeni inaonyesha kuwa metali nzito ya alkali ya ardhi ni mawakala bora wa kupunguza (kwa urahisi zaidi iliyooksidishwa) kuliko hidrojeni. Kama inavyotarajiwa, metali hizi huguswa na asidi zote mbili na nonmetali ili kuunda misombo ya ioniki. Tofauti na chumvi nyingi za metali za alkali, chumvi nyingi za kawaida za metali za alkali hazipatikani katika maji kwa sababu ya nguvu za juu za kimiani za misombo hii, iliyo na ioni ya chuma ya divalent.

Nguvu ya kupunguza nguvu ya magnesiamu ya moto ni muhimu katika kuandaa metali fulani kutoka kwa oksidi zao. Hakika, mshikamano wa magnesiamu kwa oksijeni ni mkubwa sana kwamba magnesiamu inayowaka inachukua na dioksidi kaboni, huzalisha kaboni ya msingi
\[\ce{2Mg}(s)+\ce{CO2}(g)⟶\ce{2MgO}(s)+\ce{C}(s) \nonumber \]
Kwa sababu hii, kizima cha moto cha CO 2 hakitazima moto wa magnesiamu. Zaidi ya hayo, mwanga mweupe wa kipaji unaotokana na kuchomwa magnesiamu hufanya kuwa muhimu katika moto na moto.
Kikundi cha 12 Vyuma
Elementi katika kundi la 12 ni elementi za mpito; hata hivyo, elektroni ya mwisho iliyoongezwa si elektroni d, bali elektroni s. Tangu elektroni ya mwisho aliongeza ni s elektroni, elementi hizi zinahitimu kama metali mwakilishi, au metali baada ya mpito. Kikundi 12 elementi huishi zaidi kama metali za dunia za alkali kuliko metali za mpito. Kundi la 12 lina vipengele vinne vya zinki, cadmium, zebaki, na copernicium. Kila moja ya elementi hizi ina elektroni mbili katika ganda lake la nje (ns 2). Wakati atomi za metali hizi zinaunda cations na malipo ya 2+, ambapo elektroni mbili za nje zinapotea, zina usanidi wa elektroni wa gesi ya pseudo-noble. Mercury wakati mwingine ni ubaguzi kwa sababu pia inaonyesha hali ya oxidation ya 1+katika misombo ambayo ina\(\ce{Hg2^2+}\) ion diatomic. Katika fomu zao za msingi na katika misombo, cadmium na zebaki ni sumu.
Zinc ni tendaji zaidi katika kundi la 12, na zebaki ni tendaji ndogo zaidi. (Hii ni kinyume cha mwenendo wa reactivity wa metali ya vikundi 1 na 2, ambapo reactivity huongezeka chini ya kikundi. Ongezeko la reactivity na kuongezeka kwa idadi ya atomiki hutokea tu kwa metali katika vikundi 1 na 2.) Reactivity kupungua ni kutokana na malezi ya ions na Configuration pseudo-noble gesi na mambo mengine ambayo ni zaidi ya upeo wa majadiliano haya. Tabia za kemikali za zinki na cadmium zinafanana kabisa lakini zinatofautiana na zile za zebaki.
Zinki na cadmium zina uwezo wa kupunguza chini kuliko hidrojeni, na, kama metali za alkali na metali za dunia za alkali, zitazalisha gesi ya hidrojeni wakati wanaitikia na asidi. Majibu ya zinki na asidi hidrokloric, iliyoonyeshwa kwenye Kielelezo\(\PageIndex{6}\), ni:

Zinc ni chuma cha silvery ambacho huharibu haraka kuonekana kwa rangi ya bluu-kijivu. Mabadiliko haya ya rangi yanatokana na mipako ya kuzingatia ya carbonate ya msingi, Zn 2 (OH) 2 CO 3, ambayo inachukua chuma ili kuzuia kutu zaidi. Kiini kavu na betri za alkali zina anode ya zinki. Shaba (Cu na Zn) na baadhi ya shaba (Cu, Sn, na wakati mwingine Zn) ni aloi muhimu za zinki. Karibu nusu ya uzalishaji wa zinki hutumikia kulinda chuma na metali nyingine kutokana na kutu. Ulinzi huu unaweza kuchukua fomu ya anode ya sadaka (pia inajulikana kama anode ya galvaniki, ambayo ni njia ya kutoa ulinzi wa cathodic kwa metali mbalimbali) au kama mipako nyembamba juu ya chuma kilichohifadhiwa. Steel ya mabati ni chuma na mipako ya kinga ya zinki.
Anodes za dhabihu
Anode ya dhabihu, au anode ya galvanic, ni njia ya kutoa ulinzi wa cathodic wa metali mbalimbali. Ulinzi wa Cathodic inahusu kuzuia kutu kwa kubadili chuma cha kutu ndani ya cathode. Kama cathode, chuma hupinga kutu, ambayo ni mchakato wa oxidation. Uharibifu hutokea kwenye anode ya dhabihu badala ya kwenye cathode.
Ujenzi wa mfumo kama huo huanza na kiambatisho cha chuma cha kazi zaidi (uwezekano wa kupunguza hasi zaidi) kwa chuma kinachohitaji ulinzi. Attachment inaweza kuwa moja kwa moja au kupitia waya. Ili kukamilisha mzunguko, daraja la chumvi ni muhimu. Daraja hili la chumvi mara nyingi ni maji ya bahari au maji ya chini. Mara mzunguko ukamilika, oxidation (kutu) hutokea kwenye anode na sio cathode.
Anodes ya kawaida ya dhabihu ni magnesiamu, alumini, na zinki. Magnesiamu ina uwezo wa kupunguza hasi zaidi ya tatu na hutumikia bora wakati daraja la chumvi halifanyi kazi kwa sababu ya ukolezi wa chini wa electrolyte kama vile maji safi. Zinc na alumini hufanya kazi vizuri katika maji ya chumvi kuliko magnesiamu. Aluminium ni nyepesi kuliko zinki na ina uwezo wa juu; hata hivyo, mipako ya oksidi inaweza passivate alumini. Katika hali maalum, vifaa vingine ni muhimu. Kwa mfano, chuma italinda shaba.
Mercury ni tofauti sana na zinki na cadmium. Mercury ni chuma pekee ambacho ni kiowevu saa 25 °C metali nyingi hutengana katika zebaki, na kutengeneza ufumbuzi unaoitwa amalgamu (tazama kipengele kwenye Amalgamu), ambazo ni aloi za zebaki zenye metali nyingine moja au zaidi. Mercury, inavyoonekana katika Kielelezo\(\PageIndex{7}\), ni kipengele kisicho na nguvu ambacho ni vigumu zaidi kuimarisha kuliko hidrojeni. Hivyo, haina kuondoa hidrojeni kutoka asidi; hata hivyo, itakuwa kuguswa na asidi kali oxidizing, kama vile asidi nitriki:
\[\ce{Hg}(l)+\ce{HCl}(aq)⟶\textrm{no reaction} \nonumber \]
\[\ce{3Hg}(l)+\ce{8HNO3}(aq)⟶\ce{3Hg(NO3)2}(aq)+\ce{4H2O}(l)+\ce{2NO}(g) \nonumber \]
NO wazi awali sumu haraka hupata oxidation zaidi kwa nyekundu kahawia NO 2.

Misombo ya zebaki nyingi hutengana wakati hasira. Misombo ya zebaki nyingi zina zebaki na hali ya 2+-oxidation. Wakati kuna ziada kubwa ya zebaki, inawezekana kuunda misombo iliyo na\(\ce{Hg2^2+}\) ion. Misombo yote ya zebaki ni sumu, na ni muhimu kutumia huduma kubwa katika awali yao.
Amalgam ni aloi ya zebaki yenye metali moja au zaidi. Hii ni sawa na kuzingatia chuma kuwa alloy ya chuma na metali nyingine. Metali nyingi zitaunda amalgam na zebaki, isipokuwa kuu kuwa chuma, platinamu, tungsten, na tantalum. Kutokana na masuala ya sumu na zebaki, kumekuwa na kupungua kwa kiasi kikubwa kwa matumizi ya amalgamu. Kihistoria, amalgamu zilikuwa muhimu katika seli za electrolytic na katika uchimbaji wa dhahabu. Amalgamu ya metali ya alkali bado hupata matumizi kwa sababu ni mawakala wa kupunguza nguvu na rahisi kushughulikia kuliko metali safi ya alkali. Watazamaji walikuwa na tatizo walipopata dhahabu iliyogawanyika vizuri. Walijifunza kuwa kuongeza zebaki kwenye sufuria zao zilikusanya dhahabu ndani ya zebaki ili kuunda amalgam kwa ukusanyaji rahisi. Kwa bahati mbaya, hasara ya kiasi kidogo cha zebaki zaidi ya miaka kushoto mito mingi katika California unajisi na zebaki. Madaktari wa meno hutumia amalgamu zilizo na fedha na metali nyingine ili kujaza miamba. Kuna sababu kadhaa za kutumia amalgam ikiwa ni pamoja na gharama nafuu, urahisi wa kudanganywa, na uhai mrefu ikilinganishwa na vifaa vingine. Amalgamu ya meno ni takriban 50% ya zebaki kwa uzito, ambayo, katika miaka ya hivi karibuni, imekuwa wasiwasi kutokana na sumu ya zebaki.
Baada ya kuchunguza data bora zinazopatikana, Utawala wa Chakula na Dawa (FDA) unaona kujazwa kwa misingi ya amalgamu kuwa salama kwa watu wazima na watoto zaidi ya umri wa miaka sita. Hata kwa kujaza nyingi, viwango vya zebaki katika wagonjwa hubakia chini ya viwango vya chini kabisa vinavyohusishwa na madhara. Uchunguzi wa kliniki haujapata uhusiano wowote kati ya amalgamu ya meno na matatizo ya kiafya. Masuala ya afya hayawezi kuwa sawa katika kesi za watoto chini ya sita au wanawake wajawazito. Hitimisho la FDA linalingana na maoni ya Shirika la Ulinzi wa Mazingira (EPA) na Vituo vya Udhibiti wa Magonjwa (CDC). Kuzingatia afya pekee ni kwamba baadhi ya watu ni mzio wa amalgam au moja ya vipengele vyake.
Kikundi cha 13
Kundi la 13 lina boroni ya metali na alumini ya metali, galliamu, indiamu, na thalliamu. Kipengele cha mwanga zaidi, boron, ni semiconducting, na misombo yake ya binary huwa na covalent na si ionic. Elementi zilizobaki za kikundi ni metali, lakini oksidi zao na hidroksidi hubadilisha wahusika. Oksidi na hidroksidi za alumini na galliamu zinaonyesha tabia zote za tindikali na za msingi. Dutu hii, kama hizi mbili, ambayo itaitikia na asidi na besi zote mbili ni amphoteric. Tabia hii inaonyesha mchanganyiko wa tabia zisizo za metali na metali za elementi hizi mbili. Indiamu na oksidi za thalliamu na hidroksidi zinaonyesha tabia ya msingi tu, kwa mujibu wa tabia ya wazi ya metali ya vipengele hivi viwili. Kiwango cha kuyeyuka kwa galliamu ni cha chini sana (takriban 30 °C) na kitayeyuka mkononi mwako.
Aluminium ni amphoteric kwa sababu itaitikia na asidi na besi zote mbili. Mmenyuko wa kawaida na asidi ni:
\[\ce{2Al}(s)+\ce{6HCl}(aq)⟶\ce{2AlCl3}(aq)+\ce{3H2}(g) \nonumber \]
Bidhaa za mmenyuko wa alumini na msingi hutegemea hali ya majibu, na zifuatazo kuwa uwezekano mmoja:
\[\ce{2Al}(s)+\ce{2NaOH}(aq)+\ce{6H2O}(l)⟶\ce{2Na[Al(OH)4]}(aq)+\ce{3H2}(g) \nonumber \]
Kwa asidi zote na besi, mmenyuko na alumini huzalisha gesi ya hidrojeni.
Vipengele vya kikundi 13 vina usanidi wa elektroni wa shell ya valence ya ns 2 np 1. Aluminium kawaida hutumia elektroni zake zote za valence wakati humenyuka, kutoa misombo ambayo ina hali ya oxidation ya 3+. Ingawa wengi wa misombo hii ni covalent, wengine, kama vile AlF 3 na Al 2 (SO 4) 3, ni ionic. Ufumbuzi wa maji ya chumvi za alumini una cation\(\ce{[Al(H2O)6]^3+}\), iliyofupishwa kama Al 3 + (aq). Gallium, indium, na thallium pia huunda misombo ya ionic iliyo na M 3+ ions. Vipengele hivi vitatu havionyeshe tu hali ya oxidation inayotarajiwa ya 3+kutoka kwa elektroni tatu za valence lakini pia hali ya oxidation (katika kesi hii, 1+) ambayo ni mbili chini ya thamani inayotarajiwa. Jambo hili, athari ya jozi ya inert, inahusu malezi ya ion imara na hali ya oxidation mbili chini kuliko inavyotarajiwa kwa kikundi. Jozi ya elektroni ni valence s orbital kwa mambo hayo. Kwa ujumla, athari ya jozi ya inert ni muhimu kwa vipengele vya chini vya p -block. Katika suluhisho la maji, ioni ya Tl + (aq) imara zaidi kuliko Tl 3 + (aq). Kwa ujumla, metali hizi zitaitikia kwa hewa na maji ili kuunda ioni 3+; hata hivyo, thalliamu humenyuka kutoa derivatives ya thallium (I). Metali za kikundi 13 zote huguswa moja kwa moja na nonmetali kama vile sulfuri, fosforasi, na halojeni, na kutengeneza misombo ya binary.
Metali za kikundi 13 (Al, Ga, In, na Tl) zote ni tendaji. Hata hivyo, passivation hutokea kama filamu ngumu, ngumu, nyembamba ya aina ya oksidi ya chuma juu ya kufidhiliwa na hewa. Kuvunjika kwa filamu hii kunaweza kukabiliana na passivation, kuruhusu chuma kuitikia. Njia moja ya kuharibu filamu ni kufungua chuma kilichopigwa kwa zebaki. Baadhi ya chuma hupasuka katika zebaki ili kuunda amalgam, ambayo hutoa safu ya kinga ya oksidi ili kufungua chuma kwa majibu zaidi. Kuundwa kwa amalgam inaruhusu chuma kuitikia na hewa na maji.
Video\(\PageIndex{2}\): Ingawa ni oxidized kwa urahisi, passivation ya alumini inafanya kuwa muhimu sana kama nyenzo zenye nguvu, nyepesi. Kwa sababu ya malezi ya amalgam, zebaki ni babuzi kwa vifaa vya miundo vinavyotengenezwa kwa alumini. Video hii inaonyesha jinsi uaminifu wa boriti ya alumini unaweza kuharibiwa na kuongeza kiasi kidogo cha zebaki ya msingi.
Matumizi muhimu zaidi ya alumini ni katika viwanda vya ujenzi na usafiri, na katika utengenezaji wa makopo ya alumini na foil alumini. Matumizi haya yanategemea upepesi, ushupavu, na nguvu za chuma, pamoja na upinzani wake kwa kutu. Kwa sababu alumini ni conductor bora ya joto na kupinga kutu, ni muhimu katika utengenezaji wa vyombo vya kupikia.
Aluminium ni wakala mzuri sana wa kupunguza na inaweza kuchukua nafasi ya mawakala wengine wa kupunguza katika kutengwa kwa metali fulani kutoka kwa oksidi zao. Ingawa ghali zaidi kuliko kupunguzwa kwa kaboni, alumini ni muhimu katika kutengwa kwa Mo, W, na Cr kutoka kwa oksidi zao.
Kikundi cha 14
Wanachama wa metali wa kundi 14 ni bati, risasi, na flerovium. Carbon ni nonmetal ya kawaida. Mambo yaliyobaki ya kikundi, silicon na germanium, ni mifano ya semimetali au metalloids. Tin na risasi huunda cations imara ya divalent, Sn 2 + na Pb 2 +, na vioksidishaji inasema mbili chini ya hali ya kikundi cha oxidation ya 4+. Utulivu wa hali hii ya oxidation ni matokeo ya athari ya jozi ya inert. Tin na risasi pia huunda misombo ya covalent na hali rasmi ya 4+-oxidation. Kwa mfano, SnCl 4 na PBCl 4 ni maji ya chini ya kuchemsha covalent.

Tin humenyuka kwa urahisi na nonmetali na asidi kuunda misombo ya bati (II) (kuonyesha kuwa ni rahisi zaidi iliyooksidishwa kuliko hidrojeni) na kwa nonmetali kuunda bati (II) au bati (IV) misombo (Kielelezo\(\PageIndex{8}\)), kulingana na hali ya stoichiometry na majibu. Kiongozi ni chini ya tendaji. Ni rahisi tu kuimarisha kuliko hidrojeni, na oxidation kawaida inahitaji asidi iliyojilimbikizia moto.
Wengi wa mambo haya yapo kama allotropes. Allotropes ni aina mbili au zaidi za kipengele sawa katika hali sawa ya kimwili na mali tofauti za kemikali na kimwili. Kuna allotropes mbili za kawaida za bati. Allotropes hizi ni kijivu (brittle) bati na bati nyeupe. Kama ilivyo kwa allotropes nyingine, tofauti kati ya aina hizi za bati ni katika mpangilio wa atomi. Bati nyeupe ni imara juu ya 13.2 °C na inaweza kubadilika kama metali nyingine. Kwa joto la chini, bati ya kijivu ni fomu imara zaidi. Bati ya kijivu ni brittle na huelekea kuvunja poda. Kwa hiyo, makala zilizofanywa kwa bati zitatengana katika hali ya hewa ya baridi, hasa ikiwa spell baridi ni ndefu. Mabadiliko yanaendelea polepole kutoka doa ya asili, na bati kijivu ambayo hutengenezwa kwanza huchochea mabadiliko zaidi. Kwa njia, athari hii ni sawa na kuenea kwa maambukizi katika mwili wa mimea au wanyama, na kusababisha watu kuwaita mchakato huu ugonjwa wa bati au wadudu wa bati.
Matumizi kuu ya bati ni katika mipako ya chuma ili kuunda chuma cha sahani ya bati, ambayo hufanya bati katika makopo ya bati. Alloys muhimu ya bati ni shaba (Cu na Sn) na solder (Sn na Pb). Kiongozi ni muhimu katika betri kuongoza kuhifadhi katika magari.
Kikundi cha 15
Bismuth, mwanachama mzito zaidi wa kikundi cha 15, ni chuma cha chini cha tendaji kuliko metali nyingine za mwakilishi. Ni urahisi anatoa tatu ya elektroni zake tano valence kwa nonmetals kazi ili kuunda ion tri-chanya, Bi 3 +. Inaunda misombo na hali ya kikundi cha oxidation ya 5+tu wakati wa kutibiwa na mawakala wenye nguvu ya oksidi. Utulivu wa hali ya 3+-oxidation ni mfano mwingine wa athari ya jozi ya inert.
Muhtasari
Sehemu hii inalenga katika upimaji wa vipengele vya mwakilishi. Hizi ni elementi ambako elektroni zinaingia orbitals s na p. Mambo ya mwakilishi hutokea katika vikundi 1, 2, na 12—18. Mambo haya ni metali mwakilishi, metalloids, na nonmetals. Metali ya alkali (kundi 1) ni tendaji sana, kwa urahisi kuunda ions na malipo ya 1+ kuunda misombo ionic ambayo kwa kawaida ni mumunyifu katika maji, na kuguswa kwa nguvu na maji kuunda gesi hidrojeni na ufumbuzi msingi wa hidroksidi chuma. Elektroni za nje za metali za dunia za alkali (kundi la 2) ni ngumu zaidi kuondoa kuliko elektroni ya nje ya metali za alkali, na kusababisha metali ya kundi la 2 kuwa chini ya tendaji kuliko zile zilizo katika kikundi 1. Mambo haya huunda kwa urahisi misombo ambayo metali huonyesha hali ya oxidation ya 2+. Zinc, cadmium, na zebaki (kundi la 12) kwa kawaida huonyesha hali ya kikundi cha oxidation ya 2+ (ingawa zebaki pia inaonyesha hali ya oxidation ya 1+katika misombo iliyo na\(\ce{Hg2^2+}\)). Aluminium, gallium, indium, na thallium (kikundi 13) ni rahisi kuimarisha kuliko hidrojeni. Aluminium, gallium, na indium hutokea kwa hali ya oxidation 3+ (hata hivyo, thallium pia hutokea kama ion Tl +). Tin na fomu ya risasi imara cations divalent na misombo covalent ambayo metali kuonyesha hali 4+-oxidation.
faharasa
- alkali ardhi chuma
- yoyote ya metali (beryllium, magnesiamu, kalsiamu, strontium, bariamu, na radium) wanaomiliki kundi la 2 la meza ya mara kwa mara; wao ni tendaji, metali divalent ambayo huunda oksidi za msingi
- allotropes
- aina mbili au zaidi ya kipengele hicho, katika hali hiyo ya kimwili, na miundo tofauti ya kemikali
- bismuth
- nzito mwanachama wa kundi 15; chuma chini tendaji kuliko metali nyingine mwakilishi
- chuma (mwakilishi)
- atomi ya vipengele vya metali ya makundi 1, 2, 12, 13, 14, 15, na 16, ambayo huunda misombo ya ionic kwa kupoteza elektroni kutoka kwa s zao za nje au p
- metaloidi
- kipengele ambacho kina mali ambazo ni kati ya zile za metali na nonmetals; mambo haya ni kawaida semiconductors
- passivation
- metali yenye filamu isiyo ya kinga ya oksidi au kiwanja kingine ambacho kinajenga kizuizi kwa athari za kemikali; kuondolewa kimwili au kemikali ya filamu ya kupitisha inaruhusu metali kuonyesha reactivity yao ya kemikali inayotarajiwa
- kipengele cha mwakilishi
- kipengele ambapo orbitals s na p ni kujaza
- mwakilishi wa chuma
- chuma kati ya mambo ya mwakilishi


