18.5: Matukio, Maandalizi, na Misombo ya Hidrojeni
- Page ID
- 176394
- Eleza mali, maandalizi, na misombo ya hidrojeni
Hidrojeni ni elementi tele zaidi katika ulimwengu. Jua na nyota nyingine zinajumuisha kwa kiasi kikubwa hidrojeni. Wanaastronomia wanakadiria kuwa 90% za atomi ulimwenguni ni atomi za hidrojeni. Hidrojeni ni sehemu ya misombo zaidi kuliko elementi nyingine yoyote. Maji ni kiwanja kikubwa cha hidrojeni kinachopatikana duniani. Hidrojeni ni sehemu muhimu ya mafuta ya petroli, madini mengi, selulosi na wanga, sukari, mafuta, mafuta, pombe, asidi, na maelfu ya vitu vingine.
Kwa joto la kawaida, hidrojeni ni gesi isiyo na rangi, isiyo na harufu, isiyo na sumu, yenye gesi isiyo na sumu yenye molekuli ya diatomic H 2. Hidrojeni inaundwa na isotopi tatu, na tofauti na elementi nyingine, isotopi hizi zina majina tofauti na alama za kemikali: protiamu, 1 H, deuterium, 2 H (au “D”), na tritium 3 H (au “T”). Katika sampuli ya asili ya hidrojeni, kuna atomi moja ya deuteriamu kwa kila atomi 7000 H na atomi moja ya tritiamu ya mionzi kwa kila atomi 10 18 H. Mali za kemikali za isotopi tofauti zinafanana sana kwa sababu zina miundo ya elektroni zinazofanana, lakini zinatofautiana katika baadhi ya mali za kimwili kwa sababu ya raia zao za atomia tofauti. Deuterium ya msingi na tritiamu zina shinikizo la chini la mvuke kuliko hidrojeni ya kawaida. Kwa hiyo, wakati hidrojeni ya kioevu inapoenea, isotopu nzito hujilimbikizia katika sehemu za mwisho za kuenea. Electrolysis ya maji nzito, D 2 O, hutoa deuterium. Tritium nyingi hutoka kwa athari za nyuklia.
Maandalizi ya Hidrojeni
Hidrojeni ya msingi lazima iwe tayari kutoka kwa misombo kwa kuvunja vifungo vya kemikali. Njia za kawaida za kuandaa hidrojeni hufuata.
Kutoka Steam na Carbon au Hidrokaboni
Maji ni chanzo cha bei nafuu na kikubwa zaidi cha hidrojeni. Kupitisha mvuke juu ya coke (aina chafu ya kaboni ya msingi) kwenye 1000 °C hutoa mchanganyiko wa monoksidi kaboni na hidrojeni inayojulikana kama gesi ya maji:
\[\ce{C}(s)+\ce{H2O}(g)\:\mathrm{\xrightarrow{1000\:°C}}\:\underset{\Large\mathrm{water\: gas}}{\ce{CO}(g)+\ce{H2}(g)} \nonumber \]
Gesi ya maji ni kama mafuta ya viwanda. Inawezekana kuzalisha hidrojeni ya ziada kwa kuchanganya gesi ya maji na mvuke mbele ya kichocheo cha kubadili CO kwa CO 2. Tabia hii ni majibu ya mabadiliko ya gesi ya maji.
Inawezekana pia kuandaa mchanganyiko wa hidrojeni na monoksidi kaboni kwa kupitisha hidrokaboni kutoka gesi asilia au mafuta ya petroli na mvuke juu ya kichocheo cha msingi cha nikeli. Propane ni mfano wa reactant hydrocarbon:
\[\ce{C3H8}(g)+\ce{3H2O}(g)\:\mathrm{\underset{catalyst}{\xrightarrow{900\:°C}}}\:\ce{3CO}(g)+\ce{7H2}(g) \nonumber \]
Electrolysis
Aina za hidrojeni wakati umeme wa sasa wa moja kwa moja unapita kupitia maji (electrolysis) iliyo na electrolyte kama H 2 SO 4, (Kielelezo\(\PageIndex{1}\).) Bubbles ya fomu ya hidrojeni kwenye cathode, na oksijeni huongezeka kwenye anode. Mmenyuko wavu ni:
\[\ce{2H2O}(l)+\ce{electrical\: energy}⟶\ce{2H2}(g)+\ce{O2}(g) \nonumber \]

Mitikio ya Vyuma na Acids
Hii ndiyo njia rahisi zaidi ya maabara ya kuzalisha hidrojeni. Vyuma vyenye uwezo wa kupunguza chini hupunguza ioni ya hidrojeni katika asidi za kuondokana ili kuzalisha gesi ya hidrojeni na chumvi za chuma. Kwa mfano, kama inavyoonekana katika Kielelezo\(\PageIndex{2}\), chuma katika asidi hidrokloriki ya diluted hutoa gesi ya hidrojeni na chuma (II) kloridi:
\[\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{2Cl-}(aq)⟶\ce{Fe^2+}(aq)+\ce{2Cl-}(aq)+\ce{H2}(g)+\ce{2H2O}(l) \nonumber \]

Mitikio ya Hydrides ya Ionic Metal na Maji
Inawezekana kuzalisha hidrojeni kutokana na mmenyuko wa hydrides ya metali ya kazi, ambayo ina H - anion ya msingi sana, na maji:
\[\ce{CaH2}(s)+\ce{2H2O}(l)⟶\ce{Ca^2+}(aq)+\ce{2OH-}(aq)+\ce{2H2}(g) \nonumber \]
Metal hydrides ni ghali lakini vyanzo rahisi vya hidrojeni, hasa ambapo nafasi na uzito ni mambo muhimu. Wao ni muhimu katika mfumuko wa bei wa jackets za maisha, rafts ya maisha, na balloons ya kijeshi.
Athari
Chini ya hali ya kawaida, hidrojeni haipatikani kemikali, lakini inapokanzwa, inaingia katika athari nyingi za kemikali.
Theluthi mbili ya uzalishaji wa hidrojeni duniani ni kujitolea kwa utengenezaji wa amonia, ambayo ni mbolea na kutumika katika utengenezaji wa asidi nitriki. Kiasi kikubwa cha hidrojeni ni muhimu pia katika mchakato wa hidrojeni, kujadiliwa katika sura ya kemia ya kikaboni.
Inawezekana kutumia hidrojeni kama mafuta yasiyo ya kuchukiza. Mmenyuko wa hidrojeni na oksijeni ni mmenyuko mkubwa sana, ikitoa 286 kJ ya nishati kwa mole ya maji yaliyoundwa. Hidrojeni huwaka bila mlipuko chini ya hali ya kudhibit Mwenge wa oksijeni-hidrojeni, kwa sababu ya joto kubwa la mwako wa hidrojeni, unaweza kufikia joto hadi 2800 °C Moto wa moto wa tochi hii ni muhimu katika kukata karatasi nene za metali nyingi. Kioevu hidrojeni pia ni muhimu roketi mafuta (Kielelezo\(\PageIndex{3}\)).

Atomi ya hidrojeni isiyojumuishwa ina kiini na elektroni moja ya valence katika orbital ya 1 s. Hifadhi ya n = 1 ya valence ina uwezo wa elektroni mbili, na hidrojeni inaweza kuchukua nafasi mbili katika meza ya mara kwa mara. Inawezekana kufikiria hidrojeni kikundi 1 elementi kwa sababu hidrojeni inaweza kupoteza elektroni kuunda cation, H +. Inawezekana pia kuzingatia hidrojeni kuwa elementi ya kikundi 17 kwa sababu inahitaji elektroni moja tu kujaza orbital yake ya valence ili kuunda ioni ya hidridi, H -, au inaweza kushiriki elektroni ili kuunda dhamana moja, ya covalent. Kwa kweli, hidrojeni ni kipengele cha pekee ambacho kinastahili mahali pake katika meza ya mara kwa mara.
Majibu na Elements
Wakati wa joto, hidrojeni humenyuka na metali za kikundi 1 na kwa Ca, Sr, na Ba (metali inayofanya kazi zaidi katika kikundi cha 2). Misombo inayotengenezwa ni fuwele, hidridi ioniki zilizo na anion ya hidridi, H -, wakala wa kupunguza nguvu na msingi wenye nguvu, ambao humenyuka kwa nguvu na maji na asidi nyingine ili kuunda gesi ya hidrojeni.
Athari za hidrojeni na nonmetali kwa ujumla huzalisha misombo ya hidrojeni tindikali na hidrojeni katika hali ya 1+ Athari huwa zaidi ya exothermic na yenye nguvu kama electronegativity ya ongezeko la nonmetal. Hidrojeni humenyuka na nitrojeni na sulfuri tu wakati wa joto, lakini humenyuka kwa kiasi kikubwa na fluorine (kutengeneza HF) na, chini ya hali fulani, na klorini (kutengeneza HCl). Mchanganyiko wa hidrojeni na oksijeni hupuka ikiwa hupuuzwa. Kwa sababu ya asili ya kulipuka ya mmenyuko, ni muhimu kutumia tahadhari wakati wa kushughulikia hidrojeni (au gesi nyingine yoyote inayowaka) ili kuepuka kuundwa kwa mchanganyiko wa kulipuka katika nafasi iliyofungwa. Ingawa hidridi nyingi za nonmetali ni tindikali, amonia na fosfini (PH 3) ni asidi dhaifu sana na kwa ujumla hufanya kazi kama besi. Kuna muhtasari wa athari hizi za hidrojeni na vipengele katika Jedwali\(\PageIndex{1}\).
| Mlinganyo wa jumla | Maoni |
|---|---|
| \(\ce{MH\: or\: MH2⟶MOH\: or\: M(OH)2 + H2}\) | hydrides ionic na kundi 1 na Ca, Sr, na Bar |
| \(\ce{H2 + C⟶ (no\: reaction)}\) | |
| \(\ce{3H2 + N2 ⟶ 2NH3}\) | inahitaji shinikizo la juu na joto; mavuno ya chini |
| \(\ce{2H2 + O2 ⟶ 2H2O}\) | exothermic na uwezekano wa kulipuka |
| \(\ce{H2 + S ⟶ H2S}\) | inahitaji inapokanzwa; mavuno ya chini |
| \(\ce{H2 + X2 ⟶ 2HX}\) | X = F, Cl, Br, na mimi; kulipuka na F 2; mavuno ya chini na mimi 2 |
Majibu na Misombo
Hidrojeni hupunguza oksidi za moto za metali nyingi, na kuundwa kwa mvuke wa chuma na maji. Kwa mfano, kupita hidrojeni juu ya CUO yenye joto huunda shaba na maji. Hidrojeni inaweza pia kupunguza ions za chuma katika baadhi ya oksidi za chuma kwa majimbo ya chini ya oxidation:
\[\ce{H2}(g)+\ce{MnO2}(s)\xrightarrow{Δ}\ce{MnO}(s)+\ce{H2O}(g) \nonumber \]
Hidrojeni misombo
Mbali na gesi nzuri, kila aina ya nonmetals huchanganywa na hidrojeni. Kwa ufupi, tutajadili misombo michache tu ya hidrojeni ya nonmetals hapa.
Nitrojeni hidrojeni
Amonia, NH 3, huunda kawaida wakati nyenzo yoyote ya kikaboni iliyo na nitrojeni hutengana kwa kutokuwepo kwa hewa. Maandalizi ya maabara ya amonia ni kwa majibu ya chumvi ya amonia yenye msingi wenye nguvu kama vile hidroksidi ya sodiamu. Masikio ya asidi-msingi na ioni ya amonia dhaifu hutoa amonia, iliyoonyeshwa kwenye Kielelezo\(\PageIndex{4}\). Amonia pia huunda wakati nitridi za ionic zinaguswa na maji. Ioni ya nitridi ni msingi mkubwa zaidi kuliko ioni ya hidroksidi:
\[\ce{Mg3N2}(s)+\ce{6H2O}(l)⟶\ce{3Mg(OH)2}(s)+\ce{2NH3}(g) \nonumber \]
Uzalishaji wa kibiashara wa amonia ni kwa mchanganyiko wa moja kwa moja wa vipengele katika mchakato wa Haber s:
\[\ce{N2}(g)+\ce{3H2}(g)\xrightleftharpoons{\ce{catalyst}}\ce{2NH3}(g) \hspace{20px} ΔH°=\mathrm{−92\: kJ} \nonumber \]
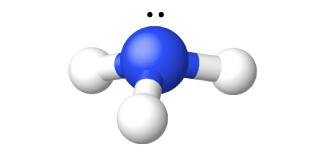
Amonia ni gesi isiyo na rangi yenye harufu kali, yenye pungent. Salamu za harufu hutumia harufu hii yenye nguvu. Amonia ya gesi huchafua kwa urahisi kutoa kioevu isiyo na rangi ambayo huchemka saa -33 °C Kutokana na kuunganisha hidrojeni ya intermolecular, enthalpy ya uvukizi wa amonia ya kioevu ni kubwa kuliko ile ya kioevu kingine chochote isipokuwa maji, hivyo amonia ni muhimu kama friji. Amonia ni mumunyifu kabisa katika maji (658 L katika STP hupasuka katika 1 L H 2 O).
Mali ya kemikali ya amonia ni kama ifuatavyo:
- Amonia hufanya kama msingi wa Brønsted, kama ilivyojadiliwa katika sura ya kemia ya asidi-msingi. Ioni ya amonia ni sawa na ukubwa wa ion ya potasiamu; misombo ya ions mbili inaonyesha kufanana nyingi katika miundo yao na umumunyifu.
- Amonia inaweza kuonyesha tabia ya tindikali, ingawa ni asidi dhaifu zaidi kuliko maji. Kama asidi nyingine, amonia humenyuka na metali, ingawa ni dhaifu sana kwamba joto la juu ni muhimu. Hidrojeni na (kulingana na stoichiometry) amidi (chumvi za\(\ce{NH2-}\)), imides (chumvi za NH 2 -), au nitridi (chumvi za N 3-) huunda.
- Atomu ya nitrojeni katika amonia ina hali yake ya chini kabisa ya oksidi (3-) na hivyo haipatikani na kupunguzwa. Hata hivyo, inaweza kuwa oxidized. Amonia huwaka katika hewa, kutoa NO na maji. Amonia ya moto na ion ya amonia ni mawakala wa kupunguza kazi. Ya riba hasa ni oxidations ya ion amonia na nitriti ion,\(\ce{NO2-}\), kutoa nitrojeni safi na nitrate ion kutoa oksidi nitrojeni, N 2 O.
- Kuna idadi ya misombo ambayo tunaweza kufikiria derivatives ya amonia kupitia uingizwaji wa atomi moja au zaidi ya hidrojeni na atomi nyingine au kikundi cha atomi. Derivations isokaboni ni pamoja na kloriamu, NH 2 Cl, na hydrazine, N 2 H 4:
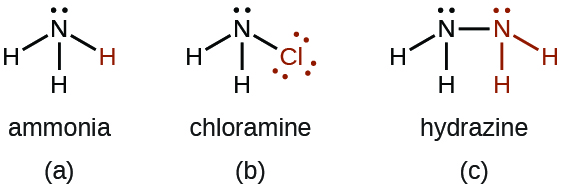
Chloramine, NH 2 Cl, matokeo ya mmenyuko wa hypochlorite ya sodiamu, NaOCl, na amonia katika suluhisho la msingi. Kwa uwepo wa ziada kubwa ya amonia kwa joto la chini, kloriamu humenyuka zaidi ili kuzalisha hydrazine, N 2 H 4:
\[\ce{NH3}(aq)+\ce{OCl-}(aq)⟶\ce{NH2Cl}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{NH2Cl}(aq)+\ce{NH3}(aq)+\ce{OH-}(aq)⟶\ce{N2H4}(aq)+\ce{Cl-}(aq)+\ce{H2O}(l) \nonumber \]
Hydrazine isiyo na maji ni imara licha ya nishati yake nzuri ya malezi:
\[\ce{N2}(g)+\ce{2H2}(g)⟶\ce{N2H4}(l) \hspace{20px} ΔG^\circ_\ce{f}=\mathrm{149.2\:kJ\:mol^{−1}} \nonumber \]
Hydrazine ni kiowevu cha fuming, isiyo na rangi ambacho kina tabia fulani za kimwili zinazofanana sana na zile za H 2 O (huyeyuka kwenye 2 °C, chemsha kwenye 113.5 °C, na ina wiani kwenye 25 °C ya 1.00 g/ml). Inawaka haraka na kabisa katika hewa na mageuzi makubwa ya joto:
\[\ce{N2H4}(l)+\ce{O2}(g)⟶\ce{N2}(g)+\ce{2H2O}(l) \hspace{20px} ΔH°=\mathrm{−621.5\:kJ\:mol^{−1}} \nonumber \]
Kama amonia, hydrazine ni msingi wa Brønsted na msingi wa Lewis, ingawa ni dhaifu kuliko amonia. Humenyuka na asidi kali na huunda mfululizo wa chumvi ambazo zina\(\ce{N2H5+}\) na\(\ce{N2H6^2+}\) ions, kwa mtiririko huo. Baadhi ya makombora hutumia hydrazine kama fueli.
Fosforasi Hidrojeni
Hydride muhimu zaidi ya fosforasi ni phosphine, PH 3, analog ya gesi ya amonia kwa suala la formula na muundo. Tofauti na amonia, haiwezekani kuunda phosphine kwa umoja wa moja kwa moja wa vipengele. Kuna njia mbili za maandalizi ya phosphine. Njia moja ni kwa hatua ya asidi kwenye phosphide ionic. Njia nyingine ni kutofautiana kwa fosforasi nyeupe na msingi wa kujilimbikizia moto ili kuzalisha phosphine na ion hidrojeni phosphite:
\[\ce{AlP}(s)+\ce{3H3O+}(aq)⟶\ce{PH3}(g)+\ce{Al^3+}(aq)+\ce{3H2O}(l) \nonumber \]
\[\ce{P4}(s)+\ce{4OH-}(aq)+\ce{2H2O}(l)⟶\ce{2HPO3^2-}(aq)+\ce{2PH3}(g) \nonumber \]
Phosphine ni gesi isiyo na rangi, yenye sumu sana, ambayo ina harufu kama ile ya samaki ya kuoza. Joto hutengana kwa urahisi phosphine\((\ce{4PH3}⟶\ce{P4}+\ce{6H2})\), na kiwanja huwaka hewa. Matumizi makubwa ya phosphine ni kama fumigant kwa nafaka na usindikaji wa semiconductor. Kama amonia, fosfini ya gesi huunganisha na halidi za hidrojeni za gesi, na kutengeneza misombo ya phosphonium kama PH 4 Cl na PH 4 I. phosphine ni msingi dhaifu sana kuliko amonia; kwa hiyo, misombo hii hutengana katika maji, na hakuna PH 3 inakimbia kutoka suluhisho.
Sulfuri Hidrojeni
Sulfidi ya hidrojeni, H 2 S, ni gesi isiyo na rangi ambayo inawajibika kwa harufu mbaya ya mayai yaliyooza na ya chemchemi nyingi za moto. Sulfidi ya hidrojeni ni sumu kama sianidi ya hidrojeni; kwa hiyo, ni muhimu kutumia huduma kubwa katika kuitunza. Sulfidi hidrojeni ni ya udanganyifu hasa kwa sababu inapooza mishipa ya kunusa; baada ya mfiduo mfupi, mtu hana harufu.
Uzalishaji wa sulfidi hidrojeni kwa mmenyuko wa moja kwa moja wa vipengele (H 2 + S) haufai kwa sababu mavuno ni ya chini. Njia bora zaidi ya maandalizi ni mmenyuko wa sulfidi ya chuma na asidi ya kuondokana. Kwa mfano:
\[\ce{FeS}(s)+\ce{2H3O+}(aq)⟶\ce{Fe^2+}(aq)+\ce{H2S}(g)+\ce{2H2O}(l) \nonumber \]
Ni rahisi oxidize sulfuri katika sulfidi za chuma na sulfidi hidrojeni, na kufanya sulfidi za chuma na H 2 S mawakala mzuri wa kupunguza. Katika ufumbuzi wa tindikali, sulfidi hidrojeni inapunguza Fe 3 +\(\ce{MnO4-}\) hadi Fe 2 +, hadi Mn 2 +,\(\ce{Cr2O7^2-}\) hadi Cr 3 +, na HNO 3 hadi NO 2. Sulfuri katika H 2 S kawaida husababishwa na sulfuri ya msingi, isipokuwa ziada kubwa ya wakala wa oksidi iko. Katika hali hiyo, sulfidi inaweza kuimarisha\(\ce{SO3^2-}\) au\(\ce{SO4^2-}\) (au SO 2 au SO 3 kwa kutokuwepo kwa maji):
\[\ce{2H2S}(g)+\ce{O2}(g)⟶\ce{2S}(s)+\ce{2H2O}(l) \nonumber \]
Utaratibu huu wa oksidi unasababisha kuondolewa kwa sulfidi hidrojeni inayopatikana katika vyanzo vingi vya gesi asilia. Amana ya sulfuri katika mikoa ya volkeno inaweza kuwa matokeo ya oxidation ya H 2 S iliyopo katika gesi za volkeno.
Sulfidi hidrojeni ni asidi dhaifu ya diprotiki ambayo hupasuka ndani ya maji ili kuunda asidi hidrosulfuriki. Asidi ionizes katika hatua mbili, kutoa ions sulfidi hidrojeni, HS -, katika hatua ya kwanza na ions sulfidi, S 2-, katika pili. Kwa kuwa sulfidi hidrojeni ni asidi dhaifu, ufumbuzi wa maji ya sulfidi mumunyifu na sulfidi hidrojeni ni ya msingi:
\[\ce{S^2-}(aq)+\ce{H2O}(l)⇌\ce{HS-}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{HS-}(aq)+\ce{H2O}(l)⇌\ce{H2S}(g)+\ce{OH-}(aq) \nonumber \]
Misombo ya Hidrojeni ya
Misombo ya binary yenye hidrojeni tu na halogen ni halidi hidrojeni. Kwa joto la kawaida, halidi hidrojeni safi HF, HCl, HbR, na HI ni gesi.
Kwa ujumla, inawezekana kuandaa halides kwa mbinu za jumla zinazotumiwa kuandaa asidi nyingine. Fluorini, klorini, na bromini huguswa moja kwa moja na hidrojeni ili kuunda halide ya hidrojeni husika. Hii ni mmenyuko muhimu kibiashara kwa kuandaa kloridi hidrojeni na bromidi hidrojeni.
Mmenyuko wa asidi-msingi kati ya asidi isiyo na nguvu isiyo na nguvu na halide ya chuma itazalisha halide ya hidrojeni. Kutoroka kwa halide ya hidrojeni ya gesi husababisha majibu ya kukamilika. Kwa mfano, njia ya kawaida ya kuandaa fluoride ya hidrojeni ni kwa kupokanzwa mchanganyiko wa fluoride ya kalsiamu, CaF 2, na asidi iliyojilimbikizia sulfuriki:
\[\ce{CaF2}(s)+\ce{H2SO4}(aq)⟶\ce{CaSO4}(s)+\ce{2HF}(g) \nonumber \]
Fluoride ya hidrojeni ya gesi pia ni kwa bidhaa katika maandalizi ya mbolea za phosphate na mmenyuko wa fluoroapatite, Ca 5 (PO 4) 3 F, na asidi ya sulfuriki. Majibu ya asidi ya sulfuriki iliyojilimbikizia na chumvi ya kloridi hutoa kloridi ya hidrojeni wote kibiashara na katika maabara.
Mara nyingi, kloridi ya sodiamu ni kloridi ya uchaguzi kwa sababu ni kloridi ya gharama kubwa zaidi. Bromidi ya hidrojeni na iodidi hidrojeni haiwezi kutayarishwa kwa kutumia asidi sulfuriki kwa sababu asidi hii ni wakala wa oksidi anayeweza kuoksidisha wote bromidi na iodidi. Hata hivyo inawezekana kuandaa bromidi zote mbili za hidrojeni na iodidi hidrojeni kwa kutumia asidi kama vile asidi fosforasi kwa sababu ni wakala dhaifu wa oksidi. Kwa mfano:
\[\ce{H3PO4}(l)+\ce{Br-}(aq)⟶\ce{HBr}(g)+\ce{H2PO4-}(aq) \nonumber \]
Halidi zote za hidrojeni ni mumunyifu sana katika maji, na kutengeneza asidi hydrohalic. Isipokuwa fluoride ya hidrojeni, ambayo ina dhamana yenye nguvu ya hidrojeni ya fluoride, ni asidi kali. Majibu ya asidi hidrohali na metali, hidroksidi za chuma, oksidi, au kabonati huzalisha chumvi za halidi. Chumvi nyingi za kloridi hupumzika katika maji. AgCl, PbCl 2, na Hg 2 Cl 2 ni tofauti za kawaida zilizokutana.
Ions halide hutoa vitu mali zinazohusiana na X - (aq). Ions nzito za halide (Cl -, Br -, na I -) zinaweza kutenda kama mawakala wa kupunguza, na halojeni nyepesi au mawakala wengine wa oksidi watawasha oxidize:
\ [ce {Cl2} (aq) +\ ce {2e-}\ ce {2Cl-} (aq)\ nafasi {20px} E° =\ hesabu {1.36\: V}\
\ ce {Br2} (aq) +\ ce {2e-}\ ce {2Br-} (aq)\ hspace {20px} E° =\ hesabu m {1.09\: V}
\\ ce {I2} (aq) +\ ce {2e-}\ ce {2I-} (aq)\ nafasi {20px} E°=\ hesabu {0.54\ :V}\ hakuna idadi\]
Kwa mfano, bromini oxidizes iodini:
\[\ce{Br2}(aq)+\ce{2HI}(aq)⟶\ce{2HBr}(aq)+\ce{I2}(aq) \hspace{20px} E°=\mathrm{0.55\:V} \nonumber \]
Asidi ya hydrofluoric ni ya kipekee katika athari zake na mchanga (silicon dioksidi) na kioo, ambayo ni mchanganyiko wa silicates:
\[\ce{SiO2}(s)+\ce{4HF}(aq)⟶\ce{SiF4}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{CaSiO3}(s)+\ce{6HF}(aq)⟶\ce{CaF2}(s)+\ce{SiF4}(g)+\ce{3H2O}(l) \nonumber \]
Tetrafluoride ya silicon yenye tete inatoka kutokana na athari hizi. Kwa sababu fluoride hidrojeni mashambulizi kioo, inaweza baridi au etch kioo na hutumiwa etch alama juu ya thermometers, burets, na glasi nyingine.
Matumizi makubwa zaidi ya fluoride ya hidrojeni ni katika uzalishaji wa hydrochlorofluorokaboni kwa refrigerants, katika plastiki, na katika propellants. Matumizi ya pili kwa ukubwa ni katika utengenezaji wa cryolite, Na 3 AlF 6, ambayo ni muhimu katika uzalishaji wa alumini. Asidi pia ni muhimu katika uzalishaji wa fluoridi nyingine isokaboni (kama vile BF 3), ambayo hutumika kama kichocheo katika awali ya viwanda ya misombo fulani ya kikaboni.
Asidi hidrokloriki ni kiasi cha gharama nafuu. Ni asidi muhimu na inayofaa katika sekta na ni muhimu kwa ajili ya utengenezaji wa kloridi za chuma, rangi, gundi, glucose, na kemikali nyingine mbalimbali. Kiasi kikubwa pia ni muhimu kwa uanzishaji wa visima vya mafuta na kama pombe ya kachumbari - asidi inayotumiwa kuondoa mipako ya oksidi kutoka chuma au chuma ambayo ni kuwa mabati, bati, au enameled. Kiasi cha asidi hydrobromic na asidi hydroiodic kutumika kibiashara ni muhimu kwa kulinganisha.
Muhtasari
Hidrojeni ni elementi tele zaidi katika ulimwengu na kemia yake ni ya kipekee kweli. Ingawa ina reactivity ya kemikali ambayo ni sawa na ile ya metali ya alkali, hidrojeni ina mali nyingi za kemikali sawa za nonmetali na electronegativity ya chini. Inaunda hidridi ionic na metali hai, misombo ya covalent ambayo ina hali ya oxidation ya 1- na vipengele vya chini vya electronegative, na misombo ya covalent ambayo ina hali ya oxidation ya 1+ na nonmetali zaidi ya electronegative. Humenyuka kwa ukali na oksijeni, fluorini, na klorini, chini kwa urahisi na bromini, na kwa urahisi sana na iodini, sulfuri, na nitrojeni. Hidrojeni inapunguza oksidi za metali na uwezo wa kupunguza chini kuliko chromium kuunda chuma na maji. Halidi ya hidrojeni yote ni tindikali wakati kufutwa katika maji.
faharasa
- Mchakato wa Haber
- mchakato mkuu wa viwanda uliotumiwa kuzalisha amonia kutoka nitrojeni na hidrojeni; inahusisha matumizi ya kichocheo cha chuma na joto la juu na shinikizo
- halidi ya hidrojeni
- binary kiwanja sumu kati ya hidrojeni na halojeni: HF, HCl, HbR, na HI
- HYDROGENATION
- kuongeza ya hidrojeni (H 2) ili kupunguza kiwanja


