17.3: Uwezo wa Kupunguza Standard
- Page ID
- 176048
- Kuamua uwezekano wa kiwango cha seli kwa athari za kupunguza oxidation
- Tumia uwezekano wa kupunguza kiwango ili kuamua wakala bora wa oxidizing au kupunguza kutoka kati ya uchaguzi kadhaa iwezekanavyo
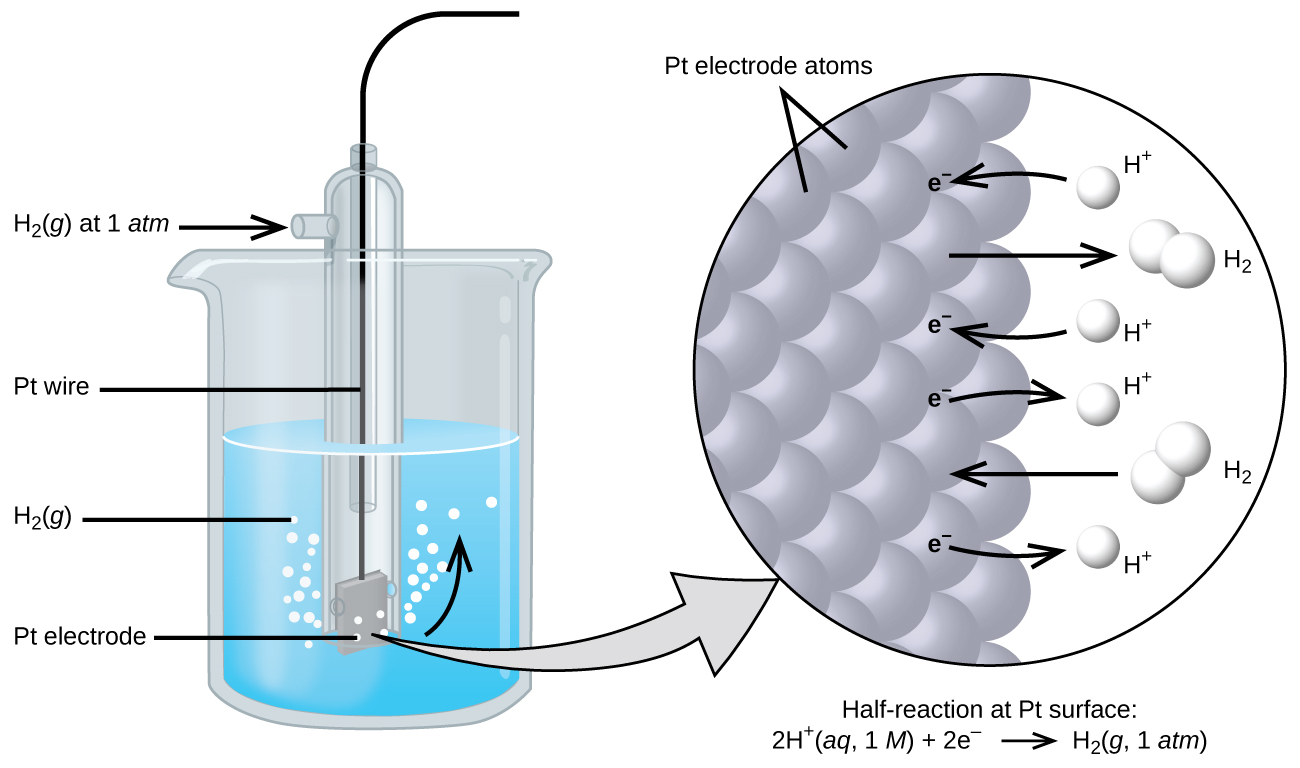
Uwezo wa seli husababishwa na tofauti katika uwezo wa umeme kwa kila electrode. Wakati haiwezekani kuamua uwezo wa umeme wa electrode moja, tunaweza kugawa electrode thamani ya sifuri na kisha kuitumia kama kumbukumbu. Electrode iliyochaguliwa kama sifuri inavyoonekana kwenye Mchoro 17.4.1 na inaitwa electrode ya kawaida ya hidrojeni (SHE). SHE ina atm 1 ya gesi ya hidrojeni iliyopigwa kupitia suluhisho la 1 M HCl, kwa kawaida kwenye joto la kawaida. Platinum, ambayo ni inert ya kemikali, hutumiwa kama electrode. Kupunguza nusu mmenyuko waliochaguliwa kama kumbukumbu ni
\[\ce{2H+}(aq,\: 1\:M)+\ce{2e-}⇌\ce{H2}(g,\:1\: \ce{atm}) \hspace{20px} E°=\mathrm{0\: V} \nonumber \]
E° ni uwezo wa kupunguza kiwango. Superscript “°” kwenye E inaashiria hali ya kawaida (1 bar au 1 atm kwa gesi, 1 M kwa solutes). Voltage hufafanuliwa kama sifuri kwa joto zote.
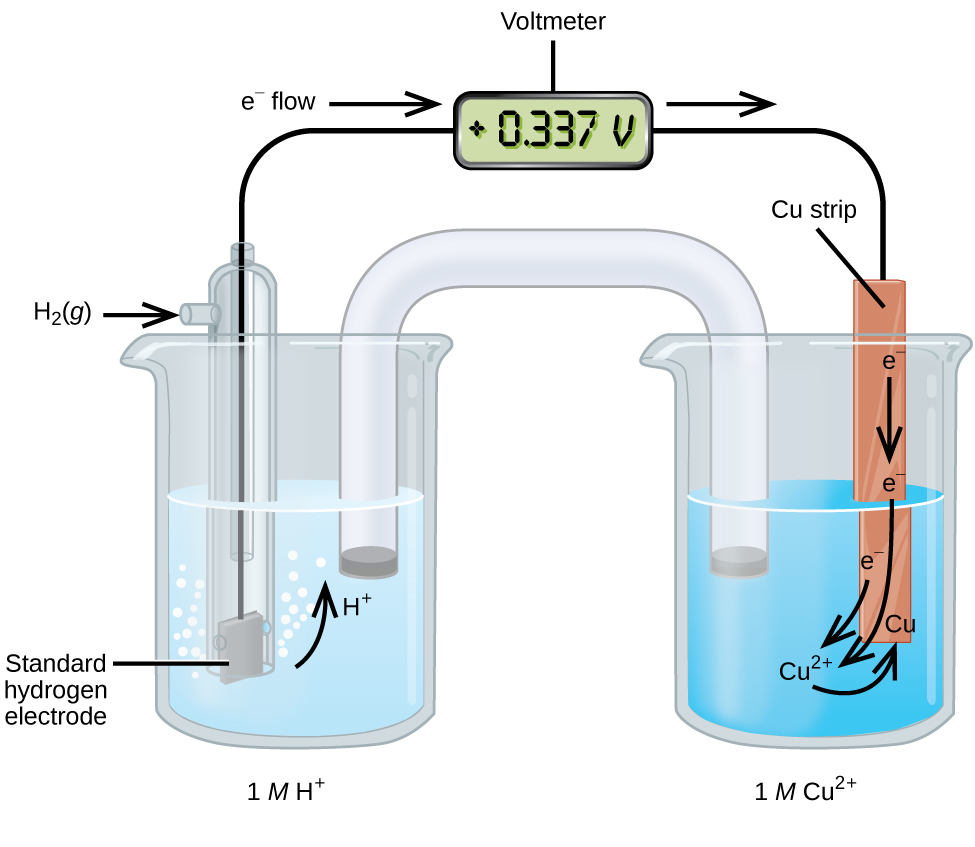
Kiini cha galvanic kilicho na SHE na Cu 2 + /Cu nusu kiini kinaweza kutumika kuamua uwezekano wa kupunguza kiwango cha Cu 2 + (Kielelezo\(\PageIndex{2}\)). Katika notation ya seli, mmenyuko ni
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\:1\:M)║\ce{Cu^2+}(aq,\:1\:M)│\ce{Cu}(s) \nonumber \]
Electroni hutoka kutoka anode hadi cathode. Athari, ambazo zinabadilishwa, ni
\ [kuanza {align*}
&\ textrm {Anode (oxidation):}\ ce {H2} (g)\ ce {2H +} (aq) +\ ce {2e-}\
&\ textrm {Cathode (kupunguza):}\ ce {Cu ^ 2+} (aq) +\ ce {2e-}\ ce {Cu} (s)\\
&\ overline {\ maandishi {Kwa ujumla:}\ ce {Cu ^ 2+} (aq) +\ ce {H2} (g)\ ce {2H +} (aq) +\ ce {Cu} (s)}
\ mwisho {align* }\ nambari isiyo\]
Uwezo wa kupunguza kiwango unaweza kuamua kwa kuondoa uwezekano wa kupunguza kiwango cha majibu yanayotokea kwenye anode kutoka kwa uwezo wa kupunguza kiwango cha majibu yanayotokea kwenye cathode. Ishara ndogo ni muhimu kwa sababu oxidation ni reverse ya kupunguza.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.34\: V}=E^\circ_{\ce{Cu^2+/Cu}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Cu^2+/Cu}}−0=E^\circ_{\ce{Cu^2+/Cu}} \nonumber \]
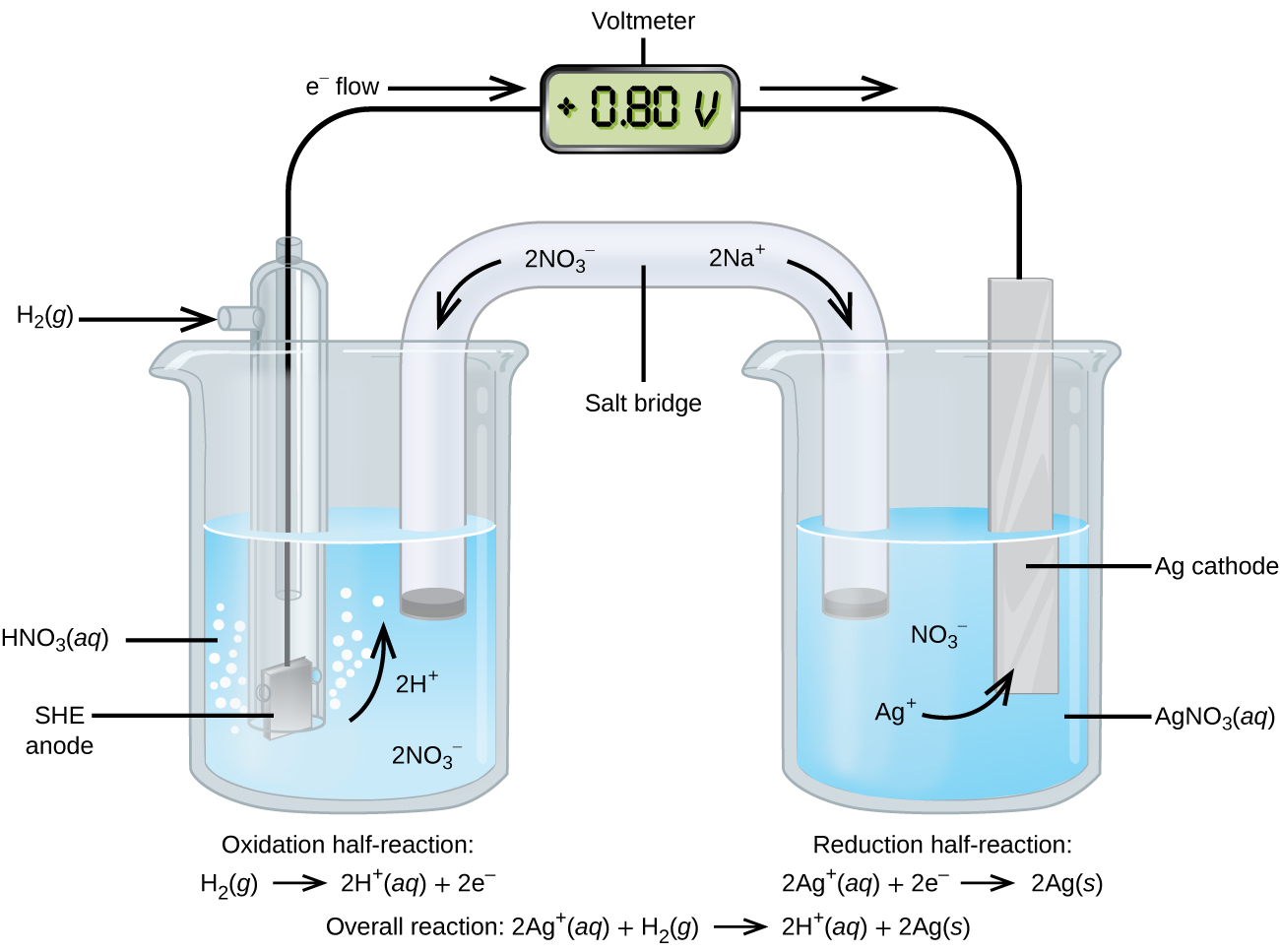
Kutumia SHE kama kumbukumbu, uwezekano mwingine wa kupunguza kiwango unaweza kuamua. Fikiria kiini inavyoonekana katika Kielelezo\(\PageIndex{2}\), ambapo
\[\ce{Pt}(s)│\ce{H2}(g,\:1\: \ce{atm})│\ce{H+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Electroni kati yake kutoka kushoto kwenda kulia, na athari ni
\ [kuanza {align*}
&\ textrm {anode (oxidation):}\ ce {H2} (g)\ ce {2H +} (aq) +\ ce {2e-}\\
&\ textrm {cathode (kupunguza):}\ ce {2Ag} (s)\\
&\ overline {\ maandishi {jumla:}\ ce {2Ag +} (aq) +\ ce {H2} (g)\ ce {2H +} (aq) +\ ce {2Ag} (s)}
\ mwisho {align*} \ nambari isiyo\]
Uwezo wa kupunguza kiwango unaweza kuamua kwa kuondoa uwezekano wa kupunguza kiwango cha majibu yanayotokea kwenye anode kutoka kwa uwezo wa kupunguza kiwango cha majibu yanayotokea kwenye cathode. Ishara ndogo inahitajika kwa sababu oxidation ni reverse ya kupunguza.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode} \nonumber \]
\[\mathrm{+0.80\: V}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{H+/H2}}=E^\circ_{\ce{Ag+/Ag}}−0=E^\circ_{\ce{Ag+/Ag}} \nonumber \]
Ni muhimu kutambua kwamba uwezekano hauwezi mara mbili kwa mmenyuko wa cathode.
SHE ni hatari sana na haitumiwi mara kwa mara katika maabara. Umuhimu wake kuu ni kwamba ilianzisha sifuri kwa uwezekano wa kupunguza kiwango. Mara baada ya kuamua, uwezekano wa kupunguza kiwango unaweza kutumika kuamua kiwango kiini uwezo\(E^\circ_\ce{cell}\), kwa kiini chochote. Kwa mfano, kwa kiini kinachofuata:
\[\ce{Cu}(s)│\ce{Cu^2+}(aq,\:1\:M)║\ce{Ag+}(aq,\:1\:M)│\ce{Ag}(s) \nonumber \]
\ [kuanza {align*}
&\ textrm {anode (oxidation):}\ ce {Cu} (s)\ ce {Cu ^ 2+} (aq) +\ ce {2e-}\
&\ textrm {cathode (kupunguza):}\ ce {2Ag} (s)\\
&\ overline {\ textrm {ujumla:}\ ce {Cu} (s) +\ ce {2Ag +} (aq)\ ce {Cu ^ 2+} (aq) +\ ce {2Ag} (s)}
\ mwisho { align*}\ nonumber\]
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{Cu^2+/Cu}}=\mathrm{0.80\: V−0.34\: V=0.46\: V} \nonumber \]
Tena, kumbuka kwamba wakati wa kuhesabu\(E^\circ_\ce{cell}\), uwezekano wa kupunguza kiwango daima hubakia sawa hata wakati majibu ya nusu yanaongezeka kwa sababu. Uwezekano wa kupunguza kiwango kwa athari za kupunguza kuchaguliwa zinaonyeshwa katika Jedwali\(\PageIndex{1}\). Orodha kamili zaidi hutolewa katika Majedwali P1 au P2.
| Nusu-mmenyuko | E° (V) |
|---|---|
| \(\ce{F2}(g)+\ce{2e-}⟶\ce{2F-}(aq)\) | +2.866 |
| \(\ce{PbO2}(s)+\ce{SO4^2-}(aq)+\ce{4H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)\) | +1.69 |
| \(\ce{MnO4-}(aq)+\ce{8H+}(aq)+\ce{5e-}⟶\ce{Mn^2+}(aq)+\ce{4H2O}(l)\) | +1.507 |
| \(\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s)\) | +1.498 |
| \(\ce{Cl2}(g)+\ce{2e-}⟶\ce{2Cl-}(aq)\) | +1.35827 |
| \(\ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-}⟶\ce{2H2O}(l)\) | +1.229 |
| \(\ce{Pt^2+}(aq)+\ce{2e-}⟶\ce{Pt}(s)\) | +1.20 |
| \(\ce{Br2}(aq)+\ce{2e-}⟶\ce{2Br-}(aq)\) | +1.0873 |
| \(\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s)\) | +0.7996 |
| \(\ce{Hg2^2+}(aq)+\ce{2e-}⟶\ce{2Hg}(l)\) | +0.7973 |
| \(\ce{Fe^3+}(aq)+\ce{e-}⟶\ce{Fe^2+}(aq)\) | +0.771 |
| \(\ce{MnO4-}(aq)+\ce{2H2O}(l)+\ce{3e-}⟶\ce{MnO2}(s)+\ce{4OH-}(aq)\) | +0.558 |
| \(\ce{I2}(s)+\ce{2e-}⟶\ce{2I-}(aq)\) | +0.5355 |
| \(\ce{NiO2}(s)+\ce{2H2O}(l)+\ce{2e-}⟶\ce{Ni(OH)2}(s)+\ce{2OH-}(aq)\) | +0.49 |
| \(\ce{Cu^2+}(aq)+\ce{2e-}⟶\ce{Cu}(s)\) | +0.34 |
| \(\ce{Hg2Cl2}(s)+\ce{2e-}⟶\ce{2Hg}(l)+\ce{2Cl-}(aq)\) | +0.26808 |
| \(\ce{AgCl}(s)+\ce{e-}⟶\ce{Ag}(s)+\ce{Cl-}(aq)\) | +0.22233 |
| \(\ce{Sn^4+}(aq)+\ce{2e-}⟶\ce{Sn^2+}(aq)\) | +0.151 |
| \(\ce{2H+}(aq)+\ce{2e-}⟶\ce{H2}(g)\) | 0.00 |
| \(\ce{Pb^2+}(aq)+\ce{2e-}⟶\ce{Pb}(s)\) | -0.1262 |
| \(\ce{Sn^2+}(aq)+\ce{2e-}⟶\ce{Sn}(s)\) | -0.1375 |
| \(\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s)\) | -0.257 |
| \(\ce{Co^2+}(aq)+\ce{2e-}⟶\ce{Co}(s)\) | -0.28 |
| \(\ce{PbSO4}(s)+\ce{2e-}⟶\ce{Pb}(s)+\ce{SO4^2-}(aq)\) | -0.3505 |
| \(\ce{Cd^2+}(aq)+\ce{2e-}⟶\ce{Cd}(s)\) | -0.4030 |
| \(\ce{Fe^2+}(aq)+\ce{2e-}⟶\ce{Fe}(s)\) | -0.447 |
| \(\ce{Cr^3+}(aq)+\ce{3e-}⟶\ce{Cr}(s)\) | -0.744 |
| \(\ce{Mn^2+}(aq)+\ce{2e-}⟶\ce{Mn}(s)\) | -1.185 |
| \(\ce{Zn(OH)2}(s)+\ce{2e-}⟶\ce{Zn}(s)+\ce{2OH-}(aq)\) | -1.245 |
| \(\ce{Zn^2+}(aq)+\ce{2e-}⟶\ce{Zn}(s)\) | -0.7618 |
| \(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\) | -1.662 |
| \(\ce{Mg^2+}(aq)+\ce{2e-}⟶\ce{Mg}(s)\) | -2.372 |
| \(\ce{Na+}(aq)+\ce{e-}⟶\ce{Na}(s)\) | -2.71 |
| \(\ce{Ca^2+}(aq)+\ce{2e-}⟶\ce{Ca}(s)\) | -2.868 |
| \(\ce{Ba^2+}(aq)+\ce{2e-}⟶\ce{Ba}(s)\) | -2.912 |
| \(\ce{K+}(aq)+\ce{e-}⟶\ce{K}(s)\) | -2.931 |
| \(\ce{Li+}(aq)+\ce{e-}⟶\ce{Li}(s)\) | -3.04 |
Majedwali kama haya hufanya iwezekanavyo kuamua uwezo wa seli ya kawaida kwa athari nyingi za kupunguza oxidation.
Je, ni uwezo wa seli ya kawaida kwa seli ya galvanic ambayo ina Au 3 +/Au na Ni 2 + /Ni nusu-seli? Tambua mawakala wa oxidizing na kupunguza.
Suluhisho
Kutumia Jedwali\(\PageIndex{1}\), athari zinazohusika katika kiini cha galvanic, zote zilizoandikwa kama kupunguza, ni
\[\ce{Au^3+}(aq)+\ce{3e-}⟶\ce{Au}(s) \hspace{20px} E^\circ_{\ce{Au^3+/Au}}=\mathrm{+1.498\: V} \nonumber \]
\[\ce{Ni^2+}(aq)+\ce{2e-}⟶\ce{Ni}(s) \hspace{20px} E^\circ_{\ce{Ni^2+/Ni}}=\mathrm{−0.257\: V} \nonumber \]
Seli za Galvanic zina uwezo wa seli nzuri, na athari zote za kupunguza zinarekebishwa. Mmenyuko katika anode itakuwa nusu ya majibu na uwezo mdogo au zaidi hasi kupunguza kiwango. Kurejesha mmenyuko kwenye anode (kuonyesha oxidation) lakini sio uwezo wake wa kupunguza kiwango hutoa:
\ [kuanza {align*}
&\ textrm {Anode (oxidation):}\ ce {Ni} (s)\ ce {Ni ^ 2+} (aq) +\ ce {2e-}\ nafasi {20px} E^\ circ_\ ce {E^\ circ_ {Ni ^ 2+/Ni}} =\ hesabu {0.257\: V}\\
&\ textrm {Cathode (kupunguza):}\ ce {Au ^ 3+} (aq) +\ ce {3e-}\ ce {Au} (s)\ nafasi {20px} E^\ circ_\ ce {cathode} =E^\ circ_ {\ ce {Au ^3+/Au}} =\ hesabu {+1.498\: V}
\ mwisho {align*}\ nonumber\]
Sababu ya kawaida ni sita, hivyo majibu ya jumla ni
Uwezekano wa kupunguza haukuongezwa na coefficients ya stoichiometric wakati wa kuhesabu uwezo wa seli, na uwezekano wa kupunguza kiwango cha kawaida lazima utumike.
\[E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=\mathrm{1.498\: V−(−0.257\: V)=1.755\: V} \nonumber \]
Kutoka kwa nusu ya athari, Ni ni oxidized, hivyo ni wakala wa kupunguza, na Au 3 + imepunguzwa, hivyo ni wakala wa oxidizing.
Kiini cha galvanic kina electrode ya Mg katika suluhisho la 1 M Mg (NO 3) 2 na electrode ya Ag katika suluhisho la 1 M AgNo 3. Tumia uwezo wa kiwango cha seli kwenye 25 °C.
- Jibu
-
\[\ce{Mg}(s)+\ce{2Ag+}(aq)⟶\ce{Mg^2+}(aq)+\ce{2Ag}(s) \hspace{20px} E^\circ_\ce{cell}=\mathrm{0.7996\: V−(−2.372\: V)=3.172\: V} \nonumber \]
Muhtasari
Kuweka uwezo wa electrode ya kawaida ya hidrojeni (SHE) kama volts zero inaruhusu uamuzi wa uwezekano wa kupunguza kiwango, E°, kwa nusu ya athari katika seli za electrochemical. Kama jina linamaanisha, uwezekano wa kupunguza kiwango hutumia majimbo ya kawaida (bar 1 au 1 atm kwa gesi; 1 M kwa solutes, mara nyingi saa 298.15 K) na huandikwa kama kupunguza (ambapo elektroni zinaonekana upande wa kushoto wa equation). Athari za kupunguza zinarekebishwa, hivyo uwezekano wa kiwango cha seli unaweza kuhesabiwa kwa kuondoa uwezekano wa kupunguza kiwango cha majibu kwenye anode kutoka kwa kupunguza kiwango cha majibu kwenye cathode. Wakati wa kuhesabu uwezo wa kiwango cha seli, uwezekano wa kupunguza kiwango haukuongezwa na coefficients ya stoichiometric katika usawa wa jumla wa usawa.
Mlinganyo muhimu
- \(E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}\)
faharasa
- kiwango kiini uwezo\( (E^\circ_\ce{cell})\)
- uwezo wa seli wakati reactants wote na bidhaa ziko katika majimbo yao ya kawaida (1 bar au 1 atm au gesi; 1 M kwa solutes), kwa kawaida saa 298.15 K; inaweza kuhesabiwa kwa kuondoa uwezo wa kupunguza kiwango cha nusu kwa mmenyuko wa anode kutoka kwa uwezo wa kupunguza kiwango cha nusu- majibu yanayotokea kwenye cathode
- kiwango electrode hidrojeni (SHE)
- electrode ina gesi ya hidrojeni inayovunjika kwa njia ya asidi hidrokloriki juu ya electrode ya platinum ya inert ambayo kupunguza kwa hali ya kawaida hupewa thamani ya 0 V; hatua ya kumbukumbu ya uwezekano wa kupunguza kiwango
- uwezo wa kupunguza kiwango (E°)
- thamani ya kupunguza chini ya hali ya kawaida (1 bar au 1 atm kwa gesi; 1 M kwa solutes) kwa kawaida saa 298.15 K; maadili yaliyowekwa kutumika kuhesabu uwezekano wa seli za kawaida


