17.4: Ulinganisho wa Nernest
- Page ID
- 176066
- Kuhusiana na uwezo wa seli na mabadiliko ya nishati ya bure
- Tumia equation ya Nernst kuamua uwezekano wa seli katika hali zisizo za kawaida
- Fanya mahesabu ambayo yanahusisha kubadili kati ya uwezekano wa seli, mabadiliko ya nishati ya bure, na usawa wa usawa
Sasa tutaongeza electrochemistry kwa kuamua uhusiano kati\(E^\circ_\ce{cell}\) na kiasi cha thermodynamics kama vile Δ G° (nishati ya bure ya Gibbs) na K (mara kwa mara ya usawa). Katika seli za galvanic, nishati ya kemikali inabadilishwa kuwa nishati ya umeme, ambayo inaweza kufanya kazi. Kazi ya umeme ni bidhaa ya malipo iliyohamishwa kuongezeka kwa tofauti tofauti (voltage):
\[\mathrm{electrical\: work=volts \times (charge\: in\: coulombs)=J} \nonumber \]
Malipo kwenye mole 1 ya elektroni hutolewa na mara kwa mara ya Faraday (F)
\[ \begin{align*} F &=\dfrac{6.022 \times 10^{23}\:e^-}{mol} \times \dfrac{1.602 \times 10^{−19}\:C}{e^-} \\[4pt] &=9.648 \times 10^4\:\dfrac{C}{mol} \\[4pt] &=9.648 \times 10^4\:\dfrac{J}{V⋅mol} \end{align*} \nonumber \]
Kwa hiyo
\[\mathrm{total\: charge=(number\: of\: moles\: of\: e^-)} \times F=nF \nonumber \]
Katika equation hii,\(n\) ni idadi ya moles ya elektroni kwa uwiano oxidation kupunguza majibu. Uwezo wa kiini kipimo ni uwezo wa kiwango cha juu ambacho kiini kinaweza kuzalisha na kinahusiana na kazi ya umeme (w ele) na
\[E_\ce{cell}=\dfrac{−w_\ce{ele}}{nF}\hspace{40px}\ce{or}\hspace{40px}w_\ce{ele}=−nFE_\ce{cell} \nonumber \]
Ishara mbaya ya kazi inaonyesha kwamba kazi ya umeme inafanywa na mfumo (kiini cha galvanic) kwenye mazingira. Katika sura ya awali, nishati ya bure ilifafanuliwa kama nishati iliyopatikana kufanya kazi. Hasa, mabadiliko katika nishati ya bure yalifafanuliwa kwa suala la kazi ya juu (\(w_{max}\)), ambayo, kwa mifumo ya electrochemical, ni\(w_{ele}\).
\[\begin{align*} ΔG&=w_\ce{max}=w_\ce{ele} \\[4pt] &=−nFE_\ce{cell} \end{align*} \nonumber \]
Tunaweza kuthibitisha ishara ni sahihi wakati sisi kutambua kwamba\(n\) na\(F\) ni constants chanya na kwamba seli galvanic, ambayo kuwa na uwezo chanya seli, kuhusisha athari hiari. Hivyo, athari za hiari, ambazo zina\(ΔG < 0\), lazima ziwe nazo\(E_{cell} > 0\). Kama reactants wote na bidhaa ni katika mataifa yao ya kawaida, hii inakuwa
\[ΔG°=−nFE^\circ_\ce{cell} \nonumber \]
Hii inatoa njia ya kuhusisha uwezo wa kiwango kiini kwa constants msawazo, tangu
\[ΔG°=−RT\ln K \nonumber \]
\[−nFE^\circ_\ce{cell}=−RT\ln K \nonumber \]
au
\[ E^\circ_\ce{cell}=\dfrac{RT}{nF}\ln K \nonumber \]
Mara nyingi, athari za electrochemical zinaendeshwa kwa joto la kawaida (298.15 K). Kukusanya maneno katika mavuno haya ya joto
\[\begin{align*} E^\circ_\ce{cell}&=\dfrac{RT}{nF}\:\ln K \\[4pt] &=\dfrac{\left(8.314\:\dfrac{\ce{J}}{\textrm{K⋅mol}}\right)(298.15\:K)}{n \times 96,485\: \textrm{C/V⋅mol}}\:\ln K \\[4pt] &=\dfrac{\mathrm{0.0257\: V}}{n}\:\ln K \end{align*} \nonumber \]
\(n\)wapi idadi ya moles ya elektroni. Logarithm katika equations inayohusisha uwezekano wa seli mara nyingi huonyeshwa kwa kutumia msingi 10 logarithms (yaani,\(\log_{10}\) au tu\(\log\)), ambayo hubadilisha mara kwa mara kwa sababu ya 2.303:
\[E^\circ_\ce{cell}=\dfrac{\mathrm{0.0592\: V}}{n}\:\log K \nonumber \]
Hivyo, ikiwa Δ G°, K, au\(E^\circ_\ce{cell}\) inajulikana au inaweza kuhesabiwa, kiasi kingine mbili kinaweza kuamua kwa urahisi. Mahusiano yanaonyeshwa graphically katika Kielelezo\(\PageIndex{1}\).
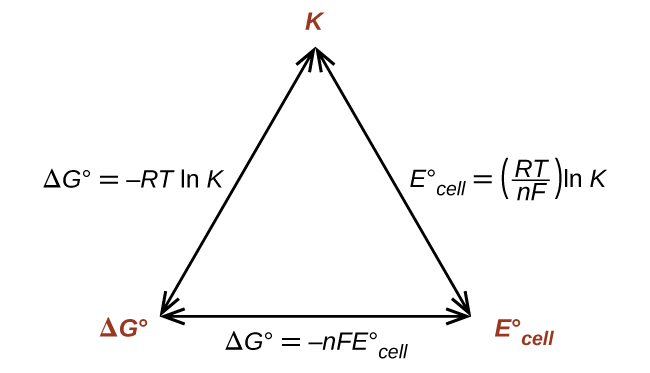
Kutokana na kiasi chochote, nyingine mbili zinaweza kuhesabiwa.
Kiwango cha Gibbs cha mabadiliko ya nishati ya bure na msawazo ni nini kwa majibu yafuatayo kwenye 25 °C?
\[\ce{2Ag+}(aq)+\ce{Fe}(s)⇌\ce{2Ag}(s)+\ce{Fe^2+}(aq) \nonumber \]
Hivyo lution
Mmenyuko unahusisha mmenyuko wa kupunguza oxidation, hivyo uwezo wa kiwango cha seli unaweza kuhesabiwa kwa kutumia data katika Jedwali P1.
\ [kuanza {align*}
&\ textrm {anode (oxidation):}\ ce {Fe} (s)\ ce {Fe ^ 2+} (aq) +\ ce {2e-}\ nafasi {40px} E^\ mduara {\ ce {Fe ^ 2+/Fe}} =\ hesabu {-0.447\: V}\\
namba\\\ textrm {cathode (kupunguza):} 2\ mara (\ ce {Ag+} (aq) +\ ce {e-}\ ce {Ag} (s)\ nafasi {40px} E^\ mduara {\ ce {Ag+/Ag}} =\ hesabu {0.796\ : V}\ namba\\
&E^\ circ_\ ce {kiini} =E^\ circ_\ ce {cathode} -E^\ circ_\ ce {anode} =E^\ circ_ {\ ce {Ag+/Ag}}} -E ^\ circ_ {Fe ^ 2+/Fe}} =\ hesabu {+1.247\ V}\ nonumber
\ mwisho {align*}\ nonumber\]
Kumbuka kwamba uwezo wa seli kwa cathode hauzidi kuongezeka kwa mbili wakati wa kuamua uwezo wa seli ya kawaida. Kwa n = 2, mara kwa mara ya usawa ni basi
\[E^\circ_\ce{cell}=\dfrac{\mathrm{0.0592\: V}}{n}\:\log K \nonumber \]
\[\begin{align*} K&=10^{n \times E^\circ_\ce{cell}/\mathrm{0.0592\: V}} \\[4pt] &=10^{2 \times \mathrm{1.247\: V/0.0592\: V}} \\[4pt] &=10^{42.128} \\[4pt] &=1.3 \times 10^{42}\end{align*} \nonumber \]
Nishati ya kawaida ya bure ni basi
\[ΔG°=−nFE^\circ_\ce{cell} \nonumber \]
\[ΔG°=\mathrm{−2 \times 96,485\:\dfrac{J}{\textrm{V⋅mol}} \times 1.247\: V=−240.6\:\dfrac{kJ}{mol}} \nonumber \]
Angalia jibu lako: Uwezo wa kiwango kiini chanya unamaanisha mmenyuko wa hiari, hivyo mabadiliko ya nishati ya bure ya kawaida yanapaswa kuwa hasi, na mara kwa mara ya usawa inapaswa kuwa> 1.
Je! Ni mabadiliko gani ya nishati ya bure ya Gibbs na mara kwa mara ya usawa kwa majibu yafuatayo kwenye joto la kawaida? Je, mmenyuko wa pekee?
\[\ce{Sn}(s)+\ce{2Cu^2+}(aq)⇌\ce{Sn^2+}(aq)+\ce{2Cu+}(aq) \nonumber \]
- Jibu
-
Kwa hiari; n = 2;\(E^\circ_\ce{cell}=\mathrm{+0.291\: V}\);\(ΔG°=\mathrm{−56.2\:\dfrac{kJ}{mol}}\);\(K = 6.8 \times 10^9\).
Sasa kwa kuwa uhusiano umefanywa kati ya nishati ya bure na uwezo wa seli, viwango vya nonstandard hufuata. Kukumbuka kwamba
\[ΔG=ΔG°+RT\ln Q \nonumber \]
\(Q\)wapi quotient ya majibu (angalia sura juu ya misingi ya usawa). Kubadilisha uwezo wa seli:
\[−nFE_\ce{cell}=−nFE^\circ_\ce{cell}+RT\ln Q \label{nernst1A} \]
au
\[E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{RT}{nF}\:\ln Q \label{nernst1B} \]
Equation\ ref {Nernst1b} ni equation ya jumla ya Nernst ambayo inatumika kwa joto lolote. Hata hivyo, inaweza kuwa rahisi kwa athari zinazotokea saa 25 °C (298.15 K) kwa kuandika tena kama
\[E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0257\: V}}{n}\:\ln Q \label{nernst2A} \]
au
\[ E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0592\: V}}{n}\log_{10} Q \label{nernst2B} \]
Ikiwa hali ya joto si 298.15 K, ni muhimu kurejesha uwezo na Equation\ ref {NernSt1B}. Kwa equation ya Nernst, inawezekana kuhesabu uwezo wa seli katika hali zisizo za kawaida. Marekebisho haya ni muhimu kwa sababu uwezekano wa kuamua chini ya hali tofauti utakuwa na maadili tofauti.
Fikiria majibu yafuatayo kwenye joto la kawaida:
\[\ce{Co}(s)+\ce{Fe^2+}(aq,\:1.94\:M)⟶\ce{Co^2+}(aq,\: 0.15\:M)+\ce{Fe}(s) \nonumber \]
Je! Mchakato huu ni wa pekee?
Suluhisho
Kuna njia mbili za kutatua tatizo. Ikiwa maelezo ya thermodynamic katika Jedwali T1 yalipatikana, unaweza kuhesabu mabadiliko ya nishati ya bure. Ikiwa mabadiliko ya nishati ya bure ni hasi, mchakato huo ni wa pekee. Njia nyingine, ambayo tutatumia, inahitaji habari kama ile iliyotolewa katika Jedwali P1. Kutumia data hizo, uwezo wa seli unaweza kuamua. Ikiwa uwezo wa seli ni chanya, mchakato huo ni wa pekee. Kukusanya taarifa kutoka Jedwali P1 na tatizo,
\ [kuanza {align*}
&\ textrm {Anode (oxidation):}\ ce {Co} (s)\ ce {Co ^ 2+} (aq) +\ ce {2e-}\ nafasi {40px} E^\ mduara {\ ce {Co ^ 2+/Co}} =\ hesabu {-0.28\: V}\\
&\ maandishi {Cathode (kupunguza):}\ ce {Fe ^ 2+} (aq) +\ ce {2e-}\ ce {Fe} (s)\ nafasi {40px} E^\ circ_ {Fe ^ 2+/Fe}} =\ hesabu {-0.447\: V}\\
&E^\ mduara\ ce {kiini} =E^\ circ_\ ce {cathode} -E ^\ circ_\ ce {anode} =\ hesabu {-0.447\: V-0.28\: V) =18-0.17\: V}
\ mwisho {align*}\ hakuna idadi\]
Mchakato huo sio kwa hiari chini ya hali ya kawaida. Kutumia equation Nernst na viwango alisema katika tatizo na\(n = 2\),
\[Q=\ce{\dfrac{[Co^2+]}{[Fe^2+]}}=\dfrac{0.15\:M}{1.94\:M}=0.077 \nonumber \]
Sasa tunaweza kuingiza hizi katika Nernst Equation katika joto la kawaida (Equation\ ref {Nernst2b})
\[\begin{align*} E_\ce{cell} &=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0592\: V}}{n}\:\log Q \\[4pt] &=\mathrm{−0.17\: V−\dfrac{0.0592\: V}{2}\:\log 0.077} \\[4pt] &=\mathrm{−0.17\: V+0.033\: V=−0.14\: V} \end{align*} \nonumber \]
Mchakato huu ni (bado) usio na kawaida.
Je! Ni uwezo gani wa seli kwa majibu yafuatayo kwenye joto la kawaida?
\[\ce{Al}(s)│\ce{Al^3+}(aq,\:0.15\:M)║\ce{Cu^2+}(aq,\:0.025\:M)│\ce{Cu}(s) \nonumber \]
Je! Ni maadili gani ya n na Swali kwa majibu ya jumla? Je, mmenyuko wa pekee chini ya hali hizi?
- Jibu
-
n = 6; Q = 1440; E kiini = +1.97 V, kwa hiari.
Hatimaye, tutaangalia kwa kifupi aina maalum ya seli inayoitwa kiini cha ukolezi. Katika kiini cha mkusanyiko, electrodes ni nyenzo sawa na seli za nusu hutofautiana tu katika mkusanyiko. Kwa kuwa moja au vyumba vyote viwili si vya kawaida, uwezekano wa seli hautakuwa sawa; kwa hiyo, kutakuwa na tofauti tofauti, ambayo inaweza kuamua kwa msaada wa equation ya Nernst.
Je, ni uwezo wa seli ya kiini cha ukolezi kilichoelezwa na
\[\ce{Zn}(s)│\ce{Zn^2+}(aq,\: 0.10\:M)║\ce{Zn^2+}(aq,\: 0.50\:M)│\ce{Zn}(s) \nonumber \]
Hivyo lution
Kutokana na taarifa iliyotolewa:
\ [kuanza {align*}
&\ textrm {Anode:}\ ce {Zn} (s)\ ce {Zn ^ 2+} (q,\: 0.10\: M) +\ ce {2e-}\ nafasi {40px} E^\ mduara\\ ce {anode} =\ hesabu {-0.7618\: V}\\
&\ maandishi {Cathode:}\ ce {Zn ^ 2+} (aq,\: 0.50\: M) +\ ce {2e-}\ ce {Zn} (s)\ hnafasi {40px} E^\ mduara\\ ce {cathode} =\ hesabu {-0.7618\: V}\\
& amp;\ overline {\ maandishi {Kwa ujumla:}\ ce {Zn ^ 2+} (q,\: 0.50\: M)\ ce {Zn ^ 2+} (aq,\: 0.10\: M)\ nafasi {40px} E^\ mduara\ ce {kiini} =\ hisabati {0.000\: V}}
\ mwisho {align*}\ nambari\]
Uwezo wa kiwango cha seli ni sifuri kwa sababu anode na cathode huhusisha mmenyuko huo; tu mkusanyiko wa Zn 2 + mabadiliko. Kubadilisha katika equation ya Nernst,
\[E_\ce{cell}=\mathrm{0.000\: V−\dfrac{0.0592\: V}{2}\:\log\dfrac{0.10}{0.50}=+0.021\: V} \nonumber \]
na mchakato ni hiari katika hali hizi.
Angalia jibu lako: Katika kiini cha mkusanyiko, uwezo wa kiini wa kawaida utakuwa sifuri. Ili kupata uwezo wa seli chanya (mchakato wa hiari) quotient ya majibu Swali lazima iwe <1. Swali <1 katika kesi hii, hivyo mchakato huo ni wa pekee.
Ni thamani gani ya Q kwa seli ya awali ya mkusanyiko ingeweza kusababisha voltage ya 0.10 V? Ikiwa mkusanyiko wa ion ya zinki kwenye cathode ilikuwa 0.50 M, ni mkusanyiko gani kwenye anode?
- Jibu
-
Q = 0.00042; [Zn 2 +] paka = 2.1\ mara 10 -4 M.
Muhtasari
Kazi ya umeme (w ele) ni hasi ya bidhaa ya malipo ya jumla (Q) na uwezo wa seli (E kiini). Malipo ya jumla yanaweza kuhesabiwa kama idadi ya moles ya elektroni (n) mara ya mara kwa mara ya Faraday (F = 96,485 C/mol e -). Kazi ya umeme ni kazi ya juu ambayo mfumo unaweza kuzalisha na hivyo ni sawa na mabadiliko katika nishati ya bure. Hivyo, chochote ambacho kinaweza kufanywa na au kwa mabadiliko ya nishati ya bure kinaweza pia kufanywa au kwa uwezo wa seli. Equation ya Nernst inahusiana uwezo wa seli katika hali zisizo za kawaida kwa logarithm ya quotient ya majibu. Seli za ukolezi hutumia uhusiano huu na kuzalisha uwezo wa seli chanya kwa kutumia nusu-seli zinazotofautiana tu katika mkusanyiko wa solutes zao.
Mlinganyo muhimu
- \(E^\circ_\ce{cell}=\dfrac{RT}{nF}\:\ln K\)
- \(E^\circ_\ce{cell}=\dfrac{\mathrm{0.0257\: V}}{n}\:\ln K=\dfrac{\mathrm{0.0592\: V}}{n}\:\log K \hspace{40px} \mathrm{(at\: 298.15\:\mathit{K})}\)
- \(E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{RT}{nF}\:\ln Q \hspace{40px} \textrm{(Nernst equation)}\)
- \(E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{\mathit{0.0257\: V}}{n}\:\ln Q=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0592\: V}}{n}\:\log Q \hspace{40px} \mathrm{(at\: 298.15\:\mathit{K})}\)
- Δ G = - NfE kiini
- \(ΔG^∘=−nFE^\circ_\ce{cell}\)
- \(w_\ce{ele}=w_\ce{max}=−nFE_\ce{cell}\)
faharasa
- mkusanyiko kiini
- kiini cha galvanic ambacho seli mbili za nusu ni sawa isipokuwa kwa mkusanyiko wa solutes; kwa hiari wakati mmenyuko wa jumla ni dilution ya solute
- kazi ya umeme (w le)
- hasi ya malipo ya jumla mara uwezo wa seli; sawa na w max kwa mfumo, na hivyo ni sawa na mabadiliko ya nishati ya bure (Δ G)
- Mara kwa mara ya Faraday (F)
- malipo juu ya 1 ml ya elektroni; F = 96,485 C/mol e -
- Nernest equation
- equation ambayo inahusiana logarithm ya quotient mmenyuko (Q) kwa uwezo nonstandard seli; inaweza kutumika kuhusisha constants usawa na uwezo kiwango kiini


