16.4: Gibbs Nishati
- Page ID
- 175810
- Kufafanua Gibbs bure nishati, na kuelezea uhusiano wake na spontaneity
- Tumia mabadiliko ya kawaida ya nishati ya bure kwa mchakato kwa kutumia nguvu za kawaida za malezi kwa ajili ya majibu na bidhaa zake
- Tumia mabadiliko ya kawaida ya nishati ya bure kwa mchakato kwa kutumia senthalpies ya malezi na entropies kwa reactants na bidhaa zake
- Eleza jinsi joto huathiri upepo wa michakato fulani.
- Kuhusiana na mabadiliko ya nishati ya bure ya kiwango kwa constants usawa
Moja ya changamoto za kutumia sheria ya pili ya thermodynamics kuamua kama mmenyuko wa kemikali ni hiari ni kwamba ni lazima tueleze mabadiliko ya entropy kwa mfumo na mabadiliko ya entropy kwa mazingira. Changamoto ya pili wakati wa kufanya kazi na mmenyuko wa kemikali ni kwamba tunahitaji kuzingatia kuchanganya vitu, suala ambalo halitokei wakati wa kuchunguza mabadiliko ya awamu kama dutu safi. Njia mbadala inayohusisha mali mpya ya thermodynamic iliyoelezwa kwa suala la mali ya mfumo tu ilianzishwa mwishoni mwa karne ya kumi na tisa na mtaalamu wa hisabati wa Marekani Josiah Willard Gibbs. Mali hii mpya inaitwa nishati ya bure ya Gibbs (\(G\)) (au tu nishati ya bure), na inafafanuliwa kwa suala la enthalpy ya mfumo na entropy kama ifuatavyo:
\[G=H−TS \nonumber \]
Nishati ya bure ni kazi ya serikali, na kwa joto la mara kwa mara na shinikizo, mabadiliko ya kawaida ya nishati ya bure (ΔG°) yanaweza kuonyeshwa kama yafuatayo:
\[ΔG^º_\ce{sys}=ΔH^º_\ce{sys}−TΔS^º_\ce{sys} \nonumber \]
(Kwa ajili ya unyenyekevu, subscript “sys” itaondolewa tangu sasa.) Tunaweza kuelewa uhusiano kati ya mali hii ya mfumo na spontaneity ya mchakato kwa kukumbuka awali inayotokana pili sheria kujieleza:
\[ΔS_\ce{univ}=ΔS+\dfrac{q_\ce{surr}}{T} \nonumber \]
Sheria ya kwanza inahitaji kwamba\(q_{surr} = −q_{sys}\), na kwa shinikizo la mara kwa mara\(q_{sys} = ΔH\), na hivyo maneno haya yanaweza kuandikwa upya kama ifuatavyo:
\[ΔS_\ce{univ}=ΔS−\dfrac{ΔH}{T} \nonumber \]
ΔH ni mabadiliko ya enthalpy ya mfumo. Kuzidisha pande zote mbili za equation hii kwa -T, na upya upya hutoa yafuatayo:
\[−TΔS_\ce{univ}=ΔH−TΔS \nonumber \]
Kulinganisha usawa huu kwa uliopita kwa mabadiliko ya nishati ya bure inaonyesha uhusiano wafuatayo:
\[ΔG=−TΔS_\ce{univ} \label{6} \]
Mabadiliko ya nishati ya bure kwa hiyo ni kiashiria cha kuaminika cha upepo wa mchakato, kuwa moja kwa moja kuhusiana na kiashiria kilichotambuliwa hapo awali,\(ΔS_{univ}\). \(\PageIndex{1}\)Jedwali linafupisha uhusiano kati ya upepo wa mchakato na ishara za hesabu za viashiria hivi.
| \(ΔS_{univ} > 0\) | Δ G <0 | hatua kuwaka katika mwelekeo mbele, kama ilivyoandikwa, kufikia msawazo |
| \(ΔS_{univ} < 0\) | Δ G > 0 |
isiyo ya kawaida katika mwelekeo wa mbele, kama ilivyoandikwa, lakini hatua kuwaka katika mwelekeo reverse, kama ilivyoandikwa, kufikia msawazo |
| \(ΔS_{univ} = 0\) | Δ G = 0 | kubadilishwa (kwa usawa) |
Kuhesabu Bure Nishati Mabadiliko
Nishati ya bure ni kazi ya serikali, hivyo thamani yake inategemea tu hali ya majimbo ya awali na ya mwisho ya mfumo ambao wamepata mabadiliko fulani. Njia rahisi na ya kawaida ya hesabu ya mabadiliko ya nishati ya bure kwa mabadiliko ya kimwili na athari za kemikali ni kwa kutumia mchanganyiko unaopatikana sana wa data ya hali ya kawaida ya thermodynamic. Njia moja inahusisha matumizi ya enthalpies ya kawaida na entropies kukokotoa mabadiliko ya nishati ya bure ya kiwango kulingana na uhusiano wafuatayo kama ilivyoonyeshwa katika Mfano\(\PageIndex{1}\).
\[ ΔG°=ΔH°−TΔS° \label{7} \]
Ni muhimu kuelewa kwamba kwa mabadiliko ya awamu,\(\Delta G^º\) inakuambia kama mabadiliko ya awamu ni ya pekee au la; itatokea, au kutokea. Kwa athari za kemikali,\(\Delta G^º\) inakuambia kiwango cha mmenyuko. Kwa maneno mengine,\(\Delta G^º\) kwa majibu inakuambia ni kiasi gani cha bidhaa kitakuwapo katika usawa. Mitikio na\(\Delta G^º\) <0 inachukuliwa kuwa bidhaa-iliyopendekezwa katika usawa; kutakuwa na bidhaa zaidi kuliko majibu wakati mmenyuko unafikia usawa. Mitikio\(\Delta G^º\) na> 0 inachukuliwa kuwa ya kujibua-iliyopendekezwa katika usawa; kutakuwa na majibu zaidi kuliko bidhaa wakati mmenyuko unafikia usawa.
Tumia data ya kawaida ya enthalpy na entropy kutoka kwenye Majedwali T1 au T2 ili kuhesabu mabadiliko ya nishati ya bure kwa uvukizi wa maji kwenye joto la kawaida (298 K). Thamani ya computed kwa ΔG° inasema nini kuhusu upepo wa mabadiliko haya ya kimwili kwa dutu safi?
Suluhisho
Mchakato wa maslahi ni yafuatayo:
\[\ce{H2O}(l)⟶\ce{H2O}(g) \label{\(\PageIndex{8}\)} \]
Mabadiliko ya kiwango katika nishati ya bure yanaweza kuhesabiwa kwa kutumia equation ifuatayo:
\[ΔG^\circ_{298}=ΔH°−TΔS° \label{\(\PageIndex{9}\)} \]
Kutoka Majedwali T1 au T2, hapa ni data:
| Dutu | \(ΔH^\circ_\ce{f}\ce{(kJ/mol)}\) | \(S^\circ_{298}\textrm{(J/K⋅mol)}\) |
|---|---|---|
| H 2 O (l) | \ (ΔH^\ circ_\ ce {f}\ ce {(KJ/mol)}\)” style="text-align:katikati; ">18-286.83 | \ (S^\ circ_ {298}\ textrm {(J/kmol)}\)” style="Nakala-align:katikati; "> 70.0 |
| H 2 O (g) | \ (ΔH^\ circ_\ ce {f}\ ce {(KJ/mol)}\)” style="text-align:katikati; ">18-241.82 | \ (S^\ circ_ {298}\ textrm {(J/kmol)}\)” style="Nakala-align:katikati; "> 188.8 |
Kuchanganya saa 298 K:
\[\begin{align*} ΔH°&=ΔH^\circ_{298}=ΔH^\circ_\ce{f}(\ce{H2O}(g))−ΔH^\circ_\ce{f}(\ce{H2O}(l)) \\[4pt] &=[−241.82\: kJ−(−285.83)]\:kJ/mol \\[4pt] &=44.01\: kJ/mol \\[4pt] ΔS° &=ΔS^\circ_{298}=S^\circ_{298}(\ce{H2O}(g))−S^\circ_{298}(\ce{H2O}(l)) \\[4pt] &=188.8\:J/mol⋅K−70.0\:J/K \\[4pt] &=118.8\:J/mol⋅K \end{align*} \nonumber \]
kisha utumie Equation\ ref {7}:
\[ΔG°=ΔH°−TΔS° \nonumber \]
Kubadili kila kitu ndani ya kJ na kuchanganya saa 298 K:
\[\begin{align*}ΔG^\circ_{298} &=ΔH°−TΔS° \\[4pt] &=44.01\: kJ/mol−(298\: K×118.8\:J/mol⋅K)×\dfrac{1\: kJ}{1000\: J} \end{align*} \nonumber \]
\[\mathrm{44.01\: kJ/mol−35.4\: kJ/mol=8.6\: kJ/mol} \nonumber \]
Katika 298 K (25° C)\(ΔG^\circ_{298}>0\), na hivyo kuchemsha ni nonspecifically (si hiari) katika 298 K.
Tumia data ya kawaida ya enthalpy na entropy kutoka kwenye Majedwali T1 au T2 ili kuhesabu mabadiliko ya nishati ya bure ya kawaida kwa majibu yaliyoonyeshwa hapa (298 K). Thamani ya computed kwa ΔG° inasema nini kuhusu kiwango cha mmenyuko huu katika 298 K?
\[\ce{C2H6}(g)⟶\ce{H2}(g)+\ce{C2H4}(g) \nonumber \]
- Jibu
-
\(ΔG^\circ_{298}=\mathrm{102.0\: kJ/mol}\); mmenyuko ni reactant-Maria katika usawa saa 25 °C Kutakuwa\(\ce{H2}(g)\) na\(\ce{C2H6}(g)\) zaidi na\(\ce{C2H4}(g) \) katika usawa
Mabadiliko ya nishati ya bure yanaweza pia kutumia nishati ya bure ya malezi\( (ΔG^\circ_\ce{f})\), kwa kila moja ya majibu na bidhaa zinazohusika katika mmenyuko. Nishati ya bure ya malezi ni mabadiliko ya nishati ya bure ambayo yanaambatana na malezi ya mole moja ya dutu kutoka kwa vipengele vyake katika majimbo yao ya kawaida. Sawa na enthalpies ya kawaida ya malezi,\( (ΔG^\circ_\ce{f})\) ni kwa ufafanuzi sifuri kwa vitu vya msingi chini ya hali ya hali ya kawaida. Mbinu ya kompyuta mabadiliko ya nishati ya bure kwa mmenyuko kwa kutumia mbinu hii ni sawa na ile iliyoonyeshwa hapo awali kwa mabadiliko ya entalpy na entropy. Kwa majibu
\[m\ce{A}+n\ce{B}⟶x\ce{C}+y\ce{D}, \nonumber \]
kiwango bure mabadiliko ya nishati katika joto la kawaida inaweza kuwa mahesabu kama
\[ \begin{align} ΔG^\circ_{298}&=ΔG° \\[4pt] &=∑νΔG^\circ_{298}(\ce{products})−∑νΔG^\circ_{298}(\ce{reactants})\\[4pt] &=[xΔG^\circ_\ce{f}(\ce{C})+yΔG^\circ_\ce{f}(\ce{D})]−[mΔG^\circ_\ce{f}(\ce{A})+nΔG^\circ_\ce{f}(\ce{B})]. \end{align} \nonumber \]
Fikiria uharibifu wa zebaki ya njano (II) oksidi.
\[\ce{HgO}(s,\,\ce{yellow})⟶\ce{Hg}(l)+ \ce{ 1/2 O2(g)} \nonumber \]
Tumia mabadiliko ya nishati ya bure ya kawaida kwenye joto la kawaida\(ΔG^\circ_{298}\), kwa kutumia:
- nguvu za kawaida za malezi na
- entalpies ya kawaida ya malezi na entropies ya kawaida.
Je! Matokeo yanaonyesha mmenyuko wa kuwa bidhaa-iliyopendekezwa au yanayopendekezwa katika usawa?
Suluhisho
Takwimu zinazohitajika zinapatikana katika Majedwali T1 au T2 na zinaonyeshwa hapa.
| Kiwanja | \(ΔG^\circ_\ce{f}\:\mathrm{(kJ/mol)}\) | \(ΔH^\circ_\ce{f}\:\mathrm{(kJ/mol)}\) | \(S^\circ_{298}\:\textrm{(J/K⋅mol)}\) |
|---|---|---|---|
| Mboga (s, njano) | \ (ΔG^\ circ_\ ce {f}\:\ mathrm {(KJ/mol)}\)” style="text-align:katikati; ">-58.43 | \ (ΔH^\ circ_\ ce {f}\:\ mathrm {(KJ/mol)}\)” style="text-align:katikati; ">-90.46 | \ (S^\ circ_ {298}\:\ textrm {(J/kmol)}\)” style="Nakala-align:katikati; "> 71.13 |
| Hg (l) | \ (ΔG^\ circ_\ ce {f}\:\ mathrm {(KJ/mol)}\)” style="text-align:katikati; "> 0 | \ (ΔH^\ circ_\ ce {f}\:\ mathrm {(KJ/mol)}\)” style="text-align:katikati; "> 0 | \ (S^\ circ_ {298}\:\ textrm {(J/kmol)}\)” style="text-align:katikati; "> 75.9 |
| O 2 (g) | \ (ΔG^\ circ_\ ce {f}\:\ mathrm {(KJ/mol)}\)” style="text-align:katikati; "> 0 | \ (ΔH^\ circ_\ ce {f}\:\ mathrm {(KJ/mol)}\)” style="text-align:katikati; "> 0 | \ (S^\ circ_ {298}\:\ textrm {(J/kmol)}\)” style="text-align:katikati; "> 205.2 |
(a) Kutumia nguvu za bure za malezi:
\[ \begin{align*} ΔG^\circ_{298}&=∑νGS^\circ_{298}(\ce{products})−∑νΔG^\circ_{298}(\ce{reactants}) \\[4pt] &=\left[1ΔG^\circ_{298}\ce{Hg}(l)+\dfrac{1}{2}ΔG^\circ_{298}\ce{O2}(g)\right]−1ΔG^\circ_{298}\ce{HgO}(s,\,\ce{yellow}) \\[4pt] & \mathrm{=\left[1\:mol(0\: kJ/mol)+\dfrac{1}{2}mol(0\: kJ/mol)\right]−1\: mol(−58.43\: kJ/mol)=58.43\: kJ/mol} \end{align*} \nonumber \]
(b) Kutumia enthalpies na entropies ya malezi:
\[\begin{align*}ΔH^\circ_{298}&=∑νΔH^\circ_{298}(\ce{products})−∑νΔH^\circ_{298}(\ce{reactants}) \\[4pt] &=\left[1ΔH^\circ_{298}\ce{Hg}(l)+\dfrac{1}{2}ΔH^\circ_{298}\ce{O2}(g)\right]−1ΔH^\circ_{298}\ce{HgO}(s,\,\ce{yellow}) \\[4pt] &\mathrm{=[1\: mol(0\: kJ/mol)+\dfrac{1}{2}mol(0\: kJ/mol)]−1\: mol(−90.46\: kJ/mol)=90.46\: kJ/mol} \\[4pt] ΔS^\circ_{298} &=∑νΔS^\circ_{298}(\ce{products})−∑νΔS^\circ_{298}(\ce{reactants}) \\[4pt] &=\left[1ΔS^\circ_{298}\ce{Hg}(l)+\dfrac{1}{2}ΔS^\circ_{298}\ce{O2}(g)\right]−1ΔS^\circ_{298}\ce{HgO}(s,\,\ce{yellow}) \\[4pt] & \mathrm{=\left[1\: mol(75.9\: J/mol\: K)+\dfrac{1}{2}mol(205.2\: J/mol\: K)\right]−1\: mol(71.13\: J/mol\: K)=107.4\: J/mol\: K} \end{align*} \nonumber \]
basi tunaweza kutumia Equation\ ref7} moja kwa moja:
\[\begin{align*}ΔG°&=ΔH°−TΔS°\\[4pt] &=\mathrm{90.46\: kJ−298.15\: K×107.4\: J/K⋅mol×\dfrac{1\: kJ}{1000\: J}} \\[4pt] &=\mathrm{(90.46−32.01)\:kJ/mol=58.45\: kJ/mol} \end{align*} \nonumber \]
Njia zote mbili za kuhesabu mabadiliko ya nishati ya bure ya kiwango saa 25 °C hutoa thamani sawa ya namba (kwa takwimu tatu muhimu), na zote mbili zinatabiri kuwa mchakato huu unaathiriwa kwa usawa kwenye joto la kawaida.
Tumia ΔG° kwa kutumia (a) nguvu za bure za malezi na (b) enthalpies ya malezi na entropies (Majedwali T1 au T2). Je, matokeo yanaonyesha mmenyuko wa kuwa bidhaa zinazopendekezwa au reactant-zinazopendekezwa katika usawa saa 25 °C?
\[\ce{C2H4}(g)⟶\ce{H2}(g)+\ce{C2H2}(g) \nonumber \]
- Jibu
-
141.5 KJ/mol, reactant-iliyopendekezwa katika usawa
Utegemezi wa Joto la Spontaneity na Kiwango cha Majibu
Kama ilivyoonyeshwa hapo awali katika sehemu ya sura hii juu ya entropy, upepo wa mchakato unaweza kutegemea joto la mfumo. Mabadiliko ya awamu, kwa mfano, yataendelea kwa hiari katika mwelekeo mmoja au nyingine kulingana na joto la dutu katika swali. Kwa namna hiyo, lakini sio sawa, baadhi ya athari za kemikali zinaweza kubadili kutoka kuwa bidhaa-iliyopendekezwa katika usawa, kuwa majibu yanayopendekezwa katika usawa, kulingana na joto.
Thamani ya\(\Delta G^º\) namba ya daima inategemea joto. Katika sehemu hii sisi ni kuamua kama au ishara ya\(\Delta G^º\) ni tegemezi kwa joto.
Ili kuonyesha dhana hii, equation inayohusiana na mabadiliko ya nishati ya bure kwa mabadiliko ya entalpy na entropy kwa mchakato inachukuliwa:
\[ ΔG^º=ΔH^º−TΔS^º \nonumber \]
Kiwango cha mchakato, kama inavyoonekana katika ishara ya hesabu ya mabadiliko yake ya kawaida ya nishati ya bure, ni kisha kuamua na ishara za mabadiliko ya enthalpy na entropy na, wakati mwingine, joto kamili. Kwa kuwa T ni joto kabisa (Kelvin), linaweza tu kuwa na maadili mazuri. Kwa hiyo uwezekano wa nne zipo kuhusiana na ishara za mabadiliko ya enthalpy na entropy:
- Wote Δ H º na Δ S º ni chanya. Hali hii inaelezea mchakato wa endothermic unaohusisha ongezeko la entropy ya mfumo. Katika kesi hii, Δ G º itakuwa hasi ikiwa ukubwa wa neno T Δ S º ni kubwa kuliko Δ H º. Ikiwa neno T Δ S º ni chini ya Δ H º, mabadiliko ya nishati ya bure yatakuwa chanya. Mchakato huo ni bidhaa-iliyopendekezwa kwa usawa katika joto la juu na reactant-iliyopendekezwa katika usawa kwa joto la chini.
- Wote Δ H º na Δ S º ni hasi. Hali hii inaelezea mchakato wa exothermic unaohusisha kupungua kwa entropy ya mfumo. Katika kesi hii, Δ G º itakuwa hasi ikiwa ukubwa wa muda wa T Δ S º ni chini ya Δ H º. Ikiwa ukubwa wa T Δ S º mrefu ni mkubwa kuliko Δ H º, mabadiliko ya nishati ya bure yatakuwa chanya. Mchakato huo ni bidhaa-iliyopendekezwa kwa usawa kwa joto la chini na reactant-iliyopendekezwa katika usawa katika joto la juu.
- Δ H º ni chanya na Δ S º ni hasi. Hali hii inaelezea mchakato wa endothermic unaohusisha kupungua kwa entropy ya mfumo. Katika kesi hii, Δ G º itakuwa chanya bila kujali joto. Mchakato huo ni reactant-Maria katika usawa katika joto zote.
- Δ H º ni hasi na Δ S º ni chanya. Hali hii inaelezea mchakato wa exothermic unaohusisha ongezeko la entropy ya mfumo. Katika kesi hii, Δ G º itakuwa hasi bila kujali joto. Mchakato huo ni bidhaa-iliyopendekezwa kwa usawa wakati wote wa joto.
Matukio haya manne ni muhtasari katika Jedwali\(\PageIndex{1}\)
|
Ishara ya\(\Delta H^o\) |
Ishara ya\(\Delta S^o\) |
Ishara ya\(\Delta G^o\) |
Joto Utegemezi wa\(\Delta G^o\) |
|---|---|---|---|
| \ (\ Delta H ^ O\) ">- | \ (\ Delta S ^ O\) ">+ | \ (\ Delta G ^ O\) ">- | \ (\ Delta G ^ O\) ">Ishara ya\(\Delta G^o\) haitegemei joto.Majibu ni bidhaa Maria katika usawa katika joto zote. |
| \ (\ Delta H ^ O\) ">+ | \ (\ Delta S ^ O\) ">- | \ (\ Delta G ^ O\) ">+ | \ (\ Delta G ^ O\) ">Ishara ya\(\Delta G^o\) haitegemei joto.Majibu yanapendekezwa kwa usawa wakati wote wa joto. |
| \ (\ Delta H ^ O\) ">- | \ (\ Delta S ^ O\) ">- | \ (\ Delta G ^ O\) ">- au + | \ (\ Delta G ^ O\) ">Ishara ya\(\Delta G^o\) haina hutegemea joto. Majibu yatakuwa ya bidhaa-iliyopendekezwa kwa usawa katika joto la chini. |
| \ (\ Delta H ^ O\) ">+ | \ (\ Delta S ^ O\) ">+ | \ (\ Delta G ^ O\) ">- au + | \ (\ Delta G ^ O\) ">
Ishara ya\(\Delta G^o\) haina hutegemea joto. Majibu yatakuwa ya bidhaa-iliyopendekezwa kwa usawa katika joto la chini. |
Mwako usio kamili wa kaboni unaelezewa na equation ifuatayo:
\[\ce{2C}(s)+\ce{O2}(g)⟶\ce{2CO}(g) \nonumber \]
Je! Ishara\(\Delta G^º\) ya mchakato huu inategemea joto?
Suluhisho
Michakato ya mwako ni exothermic (\(ΔH^º < 0\)). Mmenyuko huu unahusisha ongezeko la entropy kutokana na ongezeko la kuandamana kwa kiasi cha aina za gesi (faida halisi ya mole moja ya gesi,\(ΔS^º > 0\)). Kwa hiyo mmenyuko ni bidhaa-Maria katika usawa (\(ΔG^º < 0\)) katika joto zote.
Popular kemikali mkono joto kuzalisha joto na hewa oxidation ya chuma:
\[\ce{4Fe}(s)+\ce{3O2}(g)⟶\ce{2Fe2O3}(s) \nonumber \]
Je! Ishara\(\Delta G^o\) ya mchakato huu inategemea joto?
- Jibu
-
Δ H º na Δ S º wote ni hasi; mmenyuko ni bidhaa-iliyopendekezwa kwa usawa kwa joto la chini.
Wakati wa kuzingatia hitimisho iliyotolewa kuhusu utegemezi wa joto wa ishara ya Δ G º, ni muhimu kukumbuka nini maneno “juu” na “chini” yanamaanisha. Kwa kuwa maneno haya ni vivumishi, hali ya joto katika swali huhesabiwa kuwa ya juu au ya chini ikilinganishwa na joto fulani la kumbukumbu. Mchakato unaojitikiwa-unaopendekezwa kwa usawa kwenye joto moja lakini bidhaa iliyopendekezwa katika usawa kwenye joto jingine lazima iwe na mabadiliko katika “kiwango” (kama inavyoonekana na Δ G º yake) kadiri halijoto inatofautiana. Hii inaonyeshwa wazi na uwasilishaji wa kielelezo wa usawa wa mabadiliko ya nishati ya bure, ambayo Δ G º imepangwa kwenye mhimili y dhidi ya T kwenye mhimili x:
\[ΔG^º=ΔH^º−TΔS^º \nonumber \]
\[y=b+mx \nonumber \]
Mpango huo umeonyeshwa kwenye Kielelezo\(\PageIndex{2}\). Mchakato ambao mabadiliko ya entalpy na entropy ni ya ishara sawa ya hesabu itaonyesha utegemezi wa joto kwa ishara ya Δ G º kama ilivyoonyeshwa na mistari miwili ya njano katika njama. Kila mstari huvuka kutoka kwenye uwanja mmoja wa upepo (chanya au hasi Δ G º) hadi nyingine kwa joto ambalo ni tabia ya mchakato unaohusika. Joto hili linawakilishwa na x -intercept ya mstari, yaani, thamani ya T ambayo Δ G º ni sifuri:
\[ΔG^º=0=ΔH^º−TΔS^º \nonumber \]
\[T=\dfrac{ΔH^º}{ΔS^º} \nonumber \]
Hivyo, kusema mchakato ni bidhaa-iliyopendekezwa katika usawa kwenye joto la “juu” au “chini” inamaanisha joto ni juu au chini, kwa mtiririko huo, joto ambalo Δ G º kwa mchakato ni sifuri.
Katika majadiliano haya, tumetumia maelezo mawili tofauti kwa maana ya ishara ya Δ G º. Unapaswa kuwa na ufahamu wa maana ya kila maelezo.
a) Kiwango cha mmenyuko: Maelezo haya hutumiwa kutabiri uwiano wa bidhaa na viwango vya reactant katika usawa. Katika maelezo haya, tunatumia neno la thermodynamic Δ G º kutuambia habari sawa na mara kwa mara ya usawa, K. wakati Δ G º < 0, K > 1, na majibu yatakuwa ya bidhaa iliyopendekezwa kwa usawa. Wakati Δ G º > 0, K<1, na mmenyuko ni reactant-Maria katika usawa. Wakati Δ G º = 0, K =1, na majibu yatakuwa na kiasi sawa cha bidhaa na majibu katika usawa. Katika hali zote, mmenyuko utaunda mchanganyiko wa bidhaa na majibu katika usawa. Tunatumia ishara na ukubwa wa Δ G º kutuambia ni kiasi gani cha bidhaa kitafanywa ikiwa majibu yanaruhusiwa kufikia usawa.
b) Spontaneity: Maelezo haya ni ngumu zaidi kwa sababu inahusisha tafsiri mbili tofauti za jinsi majibu katika hali ya kawaida hutokea. Tafsiri moja inahusisha mchakato wa nadharia ambao majibu yanaendelea kutoka hatua ya mwanzo ya reactants safi hadi hatua ya kumaliza ya bidhaa safi, na vitu vyote vilivyotengwa katika vyombo vyao chini ya hali ya hali ya kawaida. Katika pili, tafsiri ya kweli zaidi, majibu huanza na majibu yote na bidhaa zote katika hali yao ya kawaida katika chombo kimoja. Sisi kisha kuruhusu mchanganyiko huu maalum kuguswa infinitesimally ndogo kiasi ili tuweze kupata kiwango cha mabadiliko katika nishati bure kwa heshima na kiwango cha majibu wakati reactants wote na bidhaa ni mchanganyiko na (kimsingi) katika majimbo yao ya kawaida. Ingawa kila tafsiri inaelezea hali tofauti ya majibu, thamani ya tofauti katika nishati ya bure na thamani ya kiwango cha mabadiliko katika nishati ya bure ni namba sawa. Ikiwa Δ G º <0, tunasema kuwa mmenyuko ni wa pekee, maana yake ni kwamba mmenyuko utaendelea katika mwelekeo wa mbele, kama ilivyoandikwa, kuunda bidhaa safi katika hali yao ya kawaida. Ikiwa Δ G º > 0, tunasema kuwa mmenyuko hauna maana, maana kwamba mmenyuko utaendelea katika mwelekeo wa nyuma, kama ilivyoandikwa, ili kuunda majibu safi katika hali yao ya kawaida. Ikiwa Δ G º = 0, tunasema kwamba wala majibu wala bidhaa zinapendekezwa kuundwa.
Matibabu ya kina ya maana ya ΔGº yanaweza kupatikana katika karatasi, “Nishati ya bure dhidi ya kiwango cha mmenyuko” na Richard S. Treptow, Journal of Chemical Education, 1996, Volume 73 (1), 51-54.
Kama ilivyoelezwa katika sura ya vinywaji na yabisi, kiwango cha kuchemsha cha kioevu ni joto ambalo awamu zake imara na kioevu ziko katika usawa (yaani, wakati uvukizi na condensation hutokea kwa viwango sawa). Tumia habari katika Majedwali T1 au T2 ili kukadiria kiwango cha kuchemsha cha maji.
Suluhisho
Mchakato wa maslahi ni mabadiliko ya awamu yafuatayo:
Wakati mchakato huu ni katika usawa, Δ G = 0, hivyo zifuatazo ni kweli:
\[0=ΔH°−TΔS°\hspace{40px}\ce{or}\hspace{40px}T=\dfrac{ΔH°}{ΔS°} \nonumber \]
Kutumia data ya kawaida ya thermodynamic kutoka Majedwali T1 au T2,
\ [kuanza {align*}
ΔH&=ΔH^\ CIRC_\ ce {f} (\ ce {H2O} (g) -ΔH ^\ circ_\ ce {f} (\ ce {H2O} (l)\ nonumber\\
&=\ hesabu {-241.82\: KJ/mol- (-285.83\: KJ/mol) =44.01\: KJ/mol}\ nonumber
\ mwisho {align*}\ nonumber\]
\ [kuanza {align*}
ΔS°&=ΔS^\ circ_ {298} (\ ce {H2O} (g) -ΔS^\ circ_ {298} (\ ce {H2O} (l)\ hakuna idadi\\
&=\ hesabu {188.8\: J/Kmol-70.0\: J/Kmol=118.8\: J/kmol}\ nonumber
\ mwisho {align*}\ nonumber\]
\[T=\dfrac{ΔH°}{ΔS°}=\mathrm{\dfrac{44.01×10^3\:J/mol}{118.8\:J/K⋅mol}=370.5\:K=97.3\:°C} \nonumber \]
Thamani iliyokubaliwa kwa kiwango cha kawaida cha kuchemsha maji ni 373.2 K (100.0 °C), na hivyo hesabu hii iko katika makubaliano ya kuridhisha. Kumbuka kwamba maadili ya enthalpy na entropy mabadiliko data kutumika walikuwa inayotokana na data standard katika 298 K (Majedwali T1 au T2.). Ikiwa unataka, unaweza kupata matokeo sahihi zaidi kwa kutumia mabadiliko ya entalpy na entropy yaliyowekwa kwenye (au angalau karibu na) kiwango halisi cha kuchemsha.
Tumia habari katika Majedwali T1 au T2 ili kukadiria kiwango cha kuchemsha cha CS 2.
- Jibu
-
313 K (thamani iliyokubaliwa 319 K).
Nishati ya bure na Msawazo
Mabadiliko ya nishati ya bure kwa mchakato yanaweza kutazamwa kama kipimo cha nguvu yake ya kuendesha gari. Thamani hasi kwa Δ G inawakilisha nguvu ya kuendesha gari ya mwisho kwa mchakato katika mwelekeo wa mbele, wakati thamani nzuri inawakilisha nguvu ya kuendesha gari kwa mchakato katika mwelekeo wa nyuma. Wakati Δ G ni sifuri, nguvu za kuendesha gari mbele na za nyuma ni sawa, na hivyo mchakato hutokea kwa njia zote mbili kwa kiwango sawa (mfumo ni katika usawa).
Katika sura ya usawa quotient majibu, Q, ilianzishwa kama kipimo rahisi cha hali ya mfumo wa usawa. Kumbuka kwamba Q ni thamani ya namba ya kujieleza kwa hatua ya wingi kwa mfumo, na kwamba unaweza kutumia thamani yake kutambua mwelekeo ambao mmenyuko utaendelea ili kufikia usawa. Wakati Q ni mdogo kuliko mara kwa mara ya usawa, K, mmenyuko utaendelea katika mwelekeo wa mbele mpaka usawa ufikiwe na Q = K. Kinyume chake, kama Swali > K, mchakato utaendelea katika mwelekeo wa nyuma mpaka usawa unapatikana.
Mabadiliko ya nishati ya bure kwa mchakato unaofanyika na majibu na bidhaa zilizopo chini ya hali isiyo ya kawaida, Δ G, inahusiana na mabadiliko ya kawaida ya nishati ya bure, Δ G°, kulingana na usawa huu:
\[ΔG=ΔG°+RT\ln Q \label{eq10A} \]
R ni mara kwa mara ya gesi (8.314 J/K mol), T ni kelvin au joto kabisa, na Q ni quotient ya majibu. Tunaweza kutumia equation hii kutabiri spontaneity kwa ajili ya mchakato chini ya kuweka yoyote kutokana na hali kama mfano katika Mfano\(\PageIndex{1}\).
Je! Ni mabadiliko gani ya nishati ya bure kwa mchakato ulioonyeshwa hapa chini ya hali maalum?
T = 25 °C,\(P_{\ce{N2}}=\mathrm{0.870\: atm}\),\(P_{\ce{H2}}=\mathrm{0.250\: atm}\), na\(P_{\ce{NH3}}=\mathrm{12.9\: atm}\)
\[\ce{2NH3}(g)⟶\ce{3H2}(g)+\ce{N2}(g) \hspace{20px} ΔG°=\mathrm{33.0\: kJ/mol} \nonumber \]
Suluhisho la Marekani
Equation\ ref {Eq10a} inahusiana na mabadiliko ya nishati ya bure kwa mabadiliko ya nishati ya kawaida ya bure na quotient ya majibu na inaweza kutumika moja kwa moja:
\[\begin{align*} ΔG&=ΔG°+RT\ln Q \\[4pt] &=\mathrm{33.0\:\dfrac{kJ}{mol}+\left(8.314\:\dfrac{J}{mol\: K}×298\: K×\ln\dfrac{(0.250^3)×0.870}{12.9^2}\right)}\\[4pt] &=\mathrm{9680\:\dfrac{J}{mol}\:or\: 9.68\: kJ/mol} \end{align*} \nonumber \]
Kwa kuwa thamani ya computed kwa Δ G ni chanya, majibu ni yasiyo ya kawaida chini ya hali hizi. Majibu yataendelea katika mwelekeo wa nyuma ili kufikia usawa.
Tathmini mabadiliko ya nishati ya bure kwa mmenyuko huo huo kwenye 875 °C katika mchanganyiko wa 5.00 L iliyo na 0.100 mol ya kila gesi. Je, mmenyuko wa pekee chini ya hali hizi?
- Jibu
-
Δ G = -47 kJ; ndiyo, majibu yanaendelea katika mwelekeo wa mbele, kama ilivyoandikwa, kufikia usawa.
Kwa mfumo wa usawa, Q = K na Δ G = 0, na Equation\ ref {Eq10a} inaweza kuandikwa kama
\[ \underbrace{0=ΔG°+RT\ln K}_{\text{at equilibrium}} \nonumber \]
\[ΔG°=−RT\ln K \label{eq4A} \]
au kwa njia nyingine
\[K=e^{−\frac{ΔG°}{RT}} \label{eq4B} \]
Aina hii ya equation hutoa kiungo muhimu kati ya mali hizi mbili muhimu za thermodynamic, na inaweza kutumika kupata constants ya usawa kutoka kwa mabadiliko ya kawaida ya nishati ya bure na kinyume chake. Mahusiano kati ya mabadiliko ya kawaida ya nishati ya bure na usawa wa usawa ni muhtasari katika Jedwali\(\PageIndex{1}\).
| K | ΔG° | Maoni |
|---|---|---|
| <1 | > 0 | Reactants ni nyingi zaidi katika usawa. |
| = 1 | = 0 | Wafanyabiashara na bidhaa ni sawa sana katika usawa. |
| > 1 | <0 | Bidhaa ni nyingi zaidi katika usawa. |
Kutokana na kwamba nguvu za kawaida za malezi ya Ag + (aq), Cl - (aq), na AgCl (s) ni 77.1 kJ/mol, -131.2 kJ/mol, na -109.8 KJ/mol, kwa mtiririko huo, mahesabu ya bidhaa umumunyifu, K sp, kwa AgCl.
Suluhisho
Majibu ya maslahi ni yafuatayo:
\[\ce{AgCl}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+][Cl- ]} \nonumber \]
Mabadiliko ya nishati ya bure ya kawaida kwa mmenyuko huu ni ya kwanza computed kwa kutumia nguvu ya kawaida ya malezi kwa reactants na bidhaa zake:
\[ \begin{align*} ΔG° =ΔG^\circ_{298} &=[ΔG^\circ_\ce{f}(\ce{Ag+}(aq))+ΔG^\circ_\ce{f}(\ce{Cl-}(aq))]−[ΔG^\circ_\ce{f}(\ce{AgCl}(s))] \\[4pt] &=[77.1\: kJ/mol−131.2\: kJ/mol]−[−109.8\: kJ/mol] \\[4pt] &=55.7\: kJ/mol \end{align*} \nonumber \]
Mara kwa mara ya usawa kwa mmenyuko huenda ikatokana na mabadiliko yake ya kawaida ya nishati ya bure kupitia Equation\ ref {Eq4b}:
\[\begin{align*} K_\ce{sp}&=e^{−\dfrac{ΔG°}{RT}}=\exp\left(−\dfrac{ΔG°}{RT}\right) \\[4pt] &=\mathrm{\exp\left(−\dfrac{55.7×10^3\:J/mol}{8.314\:J/mol⋅K×298.15\:K}\right)}\\&=\mathrm{\exp(−22.470)=e^{−22.470}=1.74×10^{−10}} \end{align*} \nonumber \]
Tumia data ya thermodynamic iliyotolewa katika Jedwali T1 au T2 ili kuhesabu mara kwa mara ya usawa kwa kujitenga kwa tetroksidi ya dinitrojeni saa 25 °C.
\[\ce{NO}_{2(g)} \rightleftharpoons \ce{N_2O}_{4(g)} \nonumber \]
- Jibu
-
K = 6.9
Ili kuonyesha zaidi uhusiano kati ya dhana hizi mbili muhimu za thermodynamic, fikiria uchunguzi kwamba athari zinaendelea kuwaka katika mwelekeo ambao hatimaye huanzisha usawa. Kama inaweza kuonyeshwa kwa kupanga mabadiliko ya nishati ya bure dhidi ya kiwango cha mmenyuko (kwa mfano, kama inavyoonekana katika thamani ya Q), usawa umeanzishwa wakati nishati ya bure ya mfumo inapunguzwa (Kielelezo\(\PageIndex{3}\)). Kama mfumo ni sasa na reactants na bidhaa zilizopo katika kiasi nonequiliquarium (Q), majibu itaendelea kuwaka katika mwelekeo muhimu ili kuanzisha usawa.
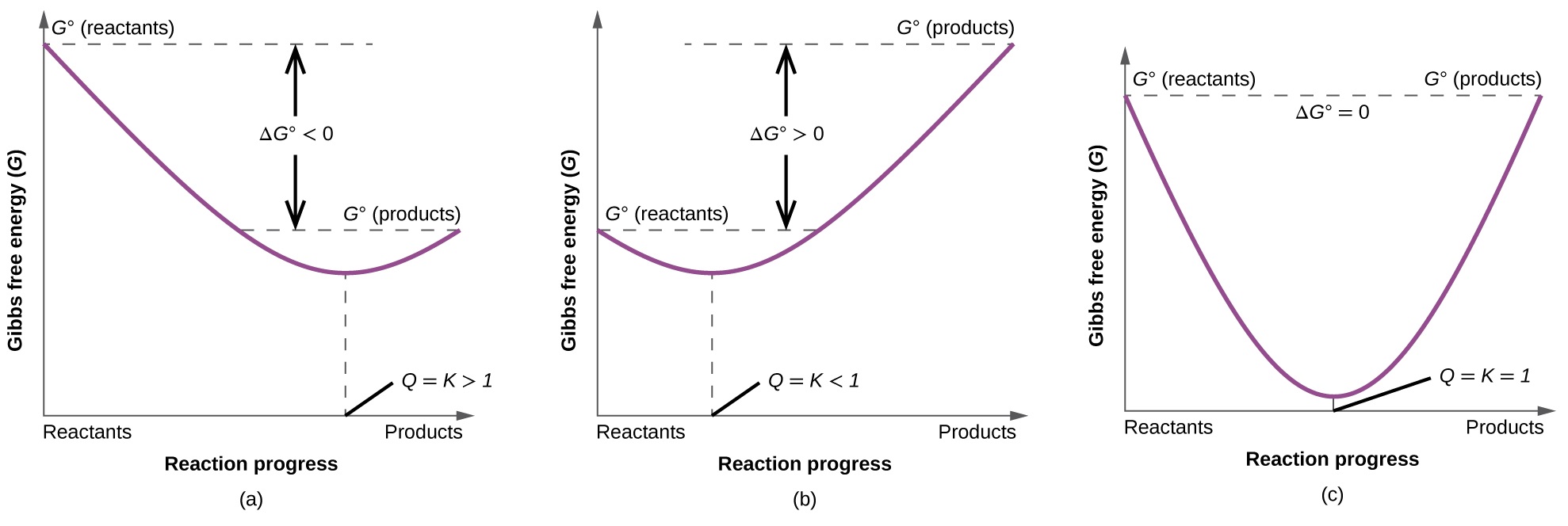
Muhtasari
Gibbs bure nishati (G) ni kazi hali defined kuhusiana na kiasi mfumo tu na inaweza kutumika kutabiri spontaneity ya mchakato. Thamani hasi kwa Δ G inaonyesha kwamba mchakato utaendelea katika mwelekeo wa mbele ili kufikia usawa; chanya Δ G inaonyesha kwamba mchakato utaendelea katika mwelekeo wa nyuma ili kufikia usawa; na Δ G ya sifuri inaonyesha kwamba mfumo uko usawa. Thamani hasi kwa Δ G º ina maana kwamba mmenyuko ni bidhaa-iliyopendekezwa kwa usawa. Thamani nzuri ya Δ G º ina maana kwamba mmenyuko ni majibu yanayopendekezwa katika usawa. Ikiwa Δ G º ni sawa na 0 (tukio la kawaida), mmenyuko una kiasi sawa cha reactants na bidhaa kwa usawa.Idadi ya mbinu za kuhesabu mabadiliko ya nishati ya bure zinawezekana.
Mlinganyo muhimu
- Δ G = Δ H ∙ T Δ S
- Δ G = Δ G° + RT juu ya Q
- Δ G° = - RT ln L
faharasa
- Gibbs bure mabadiliko ya nishati (G)
- mali ya thermodynamic inavyoelezwa kwa suala la mfumo wa enthalpy na entropy; michakato yote ya hiari inahusisha kupungua kwa G
- mabadiliko ya nishati ya bure ya kawaida (Δ G°)
- mabadiliko katika nishati ya bure kwa mchakato unaotokea chini ya hali ya kawaida (shinikizo la bar 1 kwa gesi, mkusanyiko wa 1 M kwa ufumbuzi)
- nishati ya kawaida ya malezi\( (ΔG^\circ_\ce{f})\)
- mabadiliko katika nishati ya bure inayoongozana na malezi ya mole moja ya dutu kutoka kwa vipengele vyake katika majimbo yao ya kawaida


