14.7: Titrations ya Asidi-Msingi
- Page ID
- 176934
- Tafsiri curves ya titration kwa mifumo yenye nguvu na dhaifu ya asidi-msingi
- Compute sampuli pH katika hatua muhimu za titration
- Eleza kazi ya viashiria vya asidi-msingi
Kama inavyoonekana katika sura juu ya stoichiometry ya athari za kemikali, titrations inaweza kutumika kwa quantitatively kuchambua ufumbuzi kwa asidi yao au viwango vya msingi. Katika sehemu hii, tutazingatia mabadiliko katika viwango vya aina za tindikali na za msingi zilizopo katika suluhisho wakati wa mchakato wa titration.
Titration Curves
Hapo awali, tulipojifunza athari za asidi-msingi katika suluhisho, tulilenga tu juu ya hatua ambayo asidi na msingi walikuwa sawa na stoichiometrically. Hakuna kuzingatia iliyotolewa kwa pH ya suluhisho kabla, wakati, au baada ya neutralization.
Titration hufanyika kwa 25.00 ml ya 0.100 M HCl (asidi kali) na 0.100 M ya msingi wa nguvu NaOH Curve ya titration inavyoonekana kwenye Mchoro\(\PageIndex{1}\). Tumia pH kwa kiasi hiki cha ufumbuzi wa msingi ulioongezwa:
- 0.00 ml
- 12.50 ml
- 25.00 ml
- 37.50 ml
Suluhisho
Kwa kuwa HCl ni asidi kali, tunaweza kudhani kwamba yote yanatenganisha. Mkusanyiko wa awali wa H 3 O + ni\(\ce{[H3O+]_0}=0.100\:M\). Wakati ufumbuzi wa msingi unaongezwa, pia hutenganisha kabisa, kutoa OH - ions. H 3 O + na OH - ions neutralize kila mmoja, hivyo tu wale wawili ambao walikuwa katika ziada kubaki, na mkusanyiko wao huamua pH. Hivyo, suluhisho la awali ni tindikali (pH <7), lakini hatimaye ioni zote za hidroniamu zilizopo kutoka kwa asidi ya awali zimefutwa, na suluhisho inakuwa neutral. Kama msingi zaidi unaongezwa, suluhisho hugeuka msingi.
Jumla ya awali ya ions hydronium ni:
\[\mathrm{n(H^+)_0=[H_3O^+]_0×0.02500\: L=0.002500\: mol} \nonumber \]
Mara baada ya X ml ya ufumbuzi wa msingi wa 0.100- M huongezwa, idadi ya moles ya ions OH - iliyoletwa ni:
Kiasi cha jumla kinakuwa:
\[V=\mathrm{(25.00\: mL+X\: mL)\left(\dfrac{1\: L}{1000\: mL}\right)} \nonumber \]
Idadi ya moles ya H 3 O + inakuwa:
\[\mathrm{n(H^+)=n(H^+)_0-n(OH^-)_0=0.002500\: mol-0.100\:\mathit{M}×X\: mL×\left(\dfrac{1\: L}{1000\: mL}\right)} \nonumber \]
Mkusanyiko wa H 3 O + ni:
\[\mathrm{[H_3O^+]=\dfrac{n(H^+)}{V}=\dfrac{0.002500\: mol-0.100\:\mathit{M}×X\: mL×\left(\dfrac{1\: L}{1000\: mL}\right)}{(25.00\: mL+X\: mL)\left(\dfrac{1\: L}{1000\: mL}\right)}} \nonumber \]
\[\mathrm{=\dfrac{0.002500\: mol×\left(\dfrac{1000\: mL}{1\: L}\right)-0.100\:\mathit{M}×X\: mL}{25.00\: mL+X\: mL}} \nonumber \]
na ufafanuzi wa\(\mathrm{pH}\):
\[\mathrm{pH=−\log([H_3O^+])} \label{phdef} \]
Mahesabu yaliyotangulia yanafanya kazi ikiwa\(\mathrm{n(H^+)_0-n(OH^-)_0>0}\) na hivyo n (H +) > 0. Wakati\(\mathrm{n(H^+)_0=n(OH^-)_0}\), H 3 O + ions kutoka asidi na OH - ions kutoka msingi pande neutralize. Kwa hatua hii, ions tu ya hydronium iliyoachwa ni wale kutoka kwa autoionization ya maji, na hakuna chembe za OH - za kuzipunguza. Kwa hiyo, katika kesi hii:
\[\ce{[H3O+]}=\ce{[OH- ]},\:\ce{[H3O+]}=K_\ce{w}=1.0\times 10^{-14};\:\ce{[H3O+]}=1.0\times 10^{-7} \nonumber \]
\[\mathrm{pH=-log(1.0\times 10^{-7})=7.00} \nonumber \]
Hatimaye, wakati\(\mathrm{n(OH^-)_0>n(H^+)_0}\), haitoshi H 3 O + ions ili kuondokana na ions zote za OH -, na badala yake\(\mathrm{n(H^+)=n(H^+)_0-n(OH^-)_0}\), tunahesabu:\(\mathrm{n(OH^-)=n(OH^-)_0-n(H^+)_0}\)
Katika kesi hii:
\[\mathrm{[OH^-]=\dfrac{n(OH^-)}{\mathit{V}}=\dfrac{0.100\:\mathit{M}×X\: mL×\left(\dfrac{1\: L}{1000\: mL}\right)-0.002500\: mol}{(25.00\: mL+X\: mL)\left(\dfrac{1\: L}{1000\: mL}\right)}} \nonumber \]
\[\mathrm{=\dfrac{0.100\:\mathit{M}×X\: mL-0.002500\: mol×\left(\dfrac{1000\: mL}{1\: L}\right)}{25.00\: mL+X\: mL}} \nonumber \]
kisha kutumia ufafanuzi wa\(pOH\) na uhusiano wake na\(pH\) katika joto la kawaida solutios yenye maji (Equation\ ref {phdef}):
\[\begin{align} pH &=14-pOH \nonumber \\&=14+\log([OH^-]) \nonumber\end{align} \nonumber \]
Hebu sasa tuchunguze kesi nne maalum zilizowasilishwa katika tatizo hili:
(a) X = 0 ml
\[\mathrm{[H_3O^+]=\dfrac{n(H^+)}{\mathit{V}}=\dfrac{0.002500\: mol×\left(\dfrac{1000\: mL}{1\: L}\right)}{25.00\: mL}=0.1\:\mathit{M}} \nonumber \]
kisha kutumia ufafanuzi wa\(pH\) (Equation\ ref {phdef}):
\[\begin{align} pH &= −\log(0.100) \nonumber \\ &= 1.000 \nonumber\end{align} \nonumber \]
(b) X = 12.50 ml
\[\mathrm{[H_3O^+]=\dfrac{n(H^+)}{\mathit{V}}=\dfrac{0.002500\: mol×\left(\dfrac{1000\: mL}{1\: L}\right)-0.100\:\mathit{M}×12.50\: mL}{25.00\: mL+12.50\: mL}=0.0333\:\mathit{M}} \nonumber \]
kisha kutumia ufafanuzi wa\(pH\) (Equation\ ref {phdef}):
\[ \begin{align} pH &= −\log(0.0333) \nonumber \\ &= 1.477 \nonumber\end{align} \nonumber \]
(c) X = 25.00 ml
Kwa kuwa kiasi na viwango vya ufumbuzi wa asidi na msingi ni sawa:
\[\mathrm{n(H^+)_0=n(OH^-)_0} \nonumber \]
na
\[pH = 7.000 \nonumber \]
kama ilivyoelezwa hapo awali.
(d) X = 37.50 ml
Katika kesi hii:
\[\mathrm{n(OH^-)_0>n(H^+)_0} \nonumber \]
\[\mathrm{[OH^-]=\dfrac{n(OH^-)}{\mathit{V}}=\dfrac{0.100\:\mathit{M}×35.70\: mL-0.002500\: mol×\left(\dfrac{1000\: mL}{1\: L}\right)}{25.00\: mL+37.50\: mL}=0.0200\:\mathit{M}} \nonumber \]
kisha kutumia ufafanuzi wa\(pH\) (Equation\ ref {phdef}):
\[ \begin{align}[pH = 14 − pOH \nonumber\\ &= 14 + \log([OH^{−}]) \nonumber \\ &= 14 + \log(0.0200) \nonumber \\ &= 12.30 \nonumber \end{align} \nonumber \]
Tumia pH kwa titration kali ya asidi/imara ya msingi kati ya 50.0 ml ya 0.100 M HNO 3 (aq) na 0.200 M NaOH (titrant) kwa kiasi kilichoorodheshwa cha msingi ulioongezwa:
- 0.00 mL,
- 15.0 mL,
- 25.0 ml, na
- 40.0 ml.
- Jibu
-
0.00:1.000
- Jibu b
-
15.0:1.5111
- Jibu c
-
25.0:7e. Usifute maandishi haya kwanza.
- Jibu d
-
40.0:12.523
Katika Mfano\(\PageIndex{1}\), tulihesabu pH kwa pointi nne wakati wa titration. Jedwali\(\PageIndex{1}\) linaonyesha mlolongo wa kina wa mabadiliko katika pH ya asidi kali na asidi dhaifu katika titration na NaOH.
| Kiasi cha 0.100 M NaOH Aliongeza (mL) | Moles ya NaOH Aliongeza | PH Maadili 0.100 M HCl 1 | PH Maadili 0.100 M\(CH_3CO_2H\) 2 |
|---|---|---|---|
| 0.0 | 0.0 | 1.00 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 2.87 |
| 5.0 | 0.00050 | 1.18 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 4.14 |
| 10.0 | 0.00100 | 1.37 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 4.57 |
| 15.0 | 0.00150 | 1.60 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 4.92 |
| 20.0 | 0.00200 | 1.95 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 5.35 |
| 22.0 | 0.00220 | 2.20 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 5.61 |
| 24.0 | 0.00240 | 2.69 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 6.13 |
| 24.5 | 0.00245 | 3.00 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 6.44 |
| 24.9 | 0.00249 | 3.70 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 7.14 |
| 25.0 | 0.00250 | 7.00 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 8.72 |
| 25.1 | 0.00251 | 10.30 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 10.30 |
| 25.5 | 0.00255 | 11.00 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 11.00 |
| 26.0 | 0.00260 | 11.29 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 11.29 |
| 28.0 | 0.00280 | 11.75 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 11.75 |
| 30.0 | 0.00300 | 11.96 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 11.96 |
| 35.0 | 0.00350 | 12.22 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 12.22 |
| 40.0 | 0.00400 | 12.36 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 12.36 |
| 45.0 | 0.00450 | 12.46 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 12.46 |
| 50.0 | 0.00500 | 12.52 | \ (CH_3CO_2H\) 2" style="Nakala-align:katikati; "> 12.52 |
\ (CH_3CO_2H\) 2" style="Nakala-align:katikati; ">
|
|||
Athari rahisi zaidi ya asidi-msingi ni yale ya asidi kali yenye msingi wa nguvu. Jedwali\(\PageIndex{1}\) linaonyesha data kwa titration ya sampuli 25.0-ml ya 0.100 M asidi hidrokloriki na 0.100 M hidroksidi ya sodiamu. Maadili ya pH kipimo baada nyongeza mfululizo wa kiasi kidogo cha NaOH ni waliotajwa katika safu ya kwanza ya meza hii, na ni graphid katika Kielelezo\(\PageIndex{1}\), katika fomu inayoitwa Curve titration. PH huongezeka polepole kwa mara ya kwanza, huongezeka kwa kasi katika sehemu ya katikati ya pembe, na kisha huongezeka polepole tena. Hatua ya kufuta (iko katikati ya sehemu ya wima ya curve) ni hatua ya ulinganifu wa titration. Inaonyesha wakati kiasi sawa cha asidi na msingi zipo. Kwa titration ya asidi kali na msingi imara, hatua ya ulinganifu hutokea kwa pH ya 7.00 na pointi kwenye Curve ya titration inaweza kuhesabiwa kwa kutumia suluhisho stoichiometry (Jedwali\(\PageIndex{1}\) na Kielelezo\(\PageIndex{1}\)).
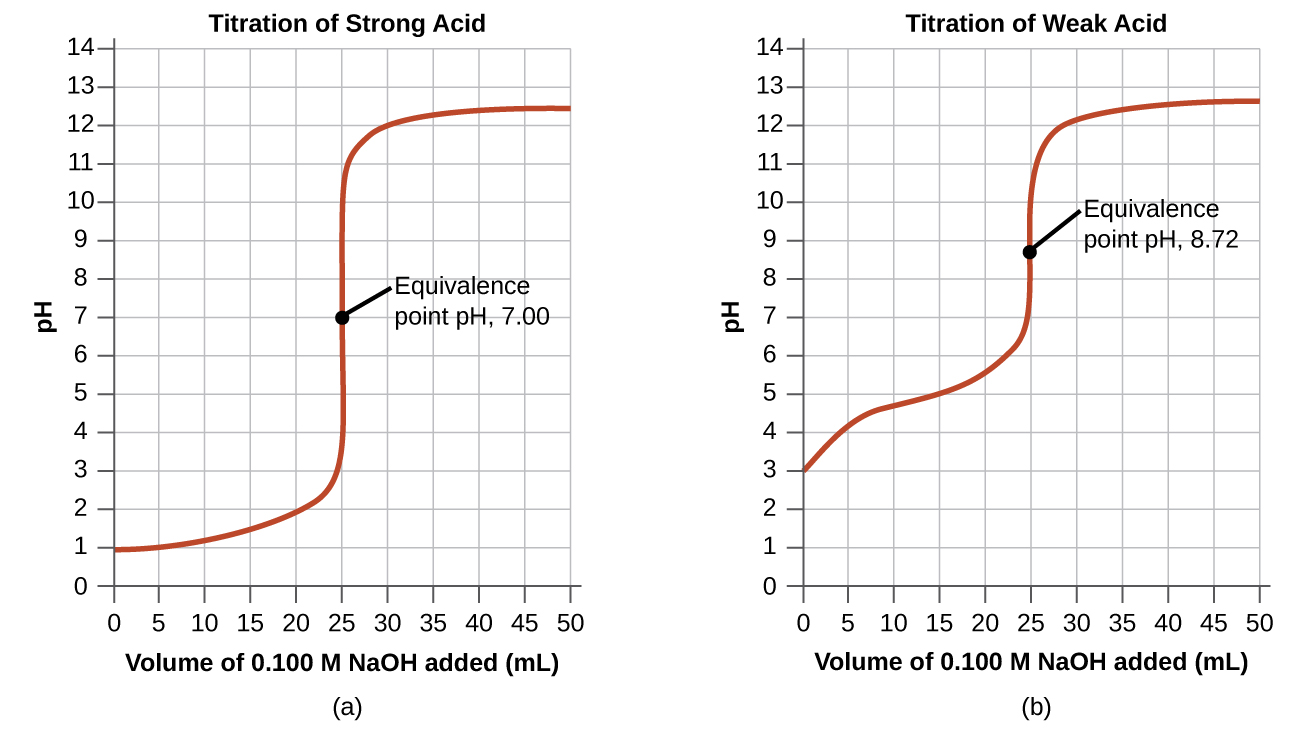
Titration ya asidi dhaifu na msingi imara (au ya msingi dhaifu na asidi kali) ni ngumu zaidi kuliko ile iliyojadiliwa tu, lakini inafuata kanuni sawa za jumla. Hebu tuchunguze titration ya 25.0 ml ya 0.100 M asidi asidi (asidi dhaifu) na 0.100 M hidroksidi ya sodiamu na kulinganisha Curve ya titration na ile ya asidi kali. Jedwali\(\PageIndex{1}\) anatoa maadili pH wakati wa titration, Kielelezo\(\PageIndex{1b}\) inaonyesha Curve titration.
Ingawa kiasi cha awali na molarity ya asidi ni sawa, kuna tofauti muhimu kati ya curves mbili za titration. Curve ya titration kwa asidi dhaifu huanza kwa thamani ya juu (chini ya tindikali) na inaendelea maadili ya juu ya pH hadi kiwango cha ulinganifu. Hii ni kwa sababu asidi asidi ni asidi dhaifu, ambayo ni sehemu tu ionized. PH katika hatua ya ulinganifu pia ni ya juu (8.72 badala ya 7.00) kutokana na hidrolisisi ya acetate, msingi dhaifu unaofufua pH:
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(l)+\ce{OH-}(aq) \nonumber \]
Baada ya hatua ya ulinganifu, curves mbili zinafanana kwa sababu pH inategemea ziada ya ioni ya hidroksidi katika matukio yote mawili.
Curve ya titration iliyoonyeshwa kwenye Kielelezo\(\PageIndex{1b}\) ni kwa titration ya 25.00 ml ya 0.100 M CH 3 CO 2 H na 0.100 M NaOH. Majibu yanaweza kuwakilishwa kama:
\[\ce{CH3CO2H + OH- ⟶ CH3CO2- + H2O} \nonumber \]
- Je, ni pH ya awali kabla ya kiasi chochote cha ufumbuzi wa NaOH umeongezwa? K = 1.8 × 10 -5 kwa CH 3 CO 2 H.
- Pata pH baada ya 25.00 ml ya suluhisho la NaOH imeongezwa.
- Pata pH baada ya 12.50 ml ya suluhisho la NaOH imeongezwa.
- Pata pH baada ya 37.50 ml ya suluhisho la NaOH imeongezwa.
Suluhisho
(a) Kutokana kwamba kiasi kilichotenganishwa ni chache ikilinganishwa na 0.100 M, tunaona kwamba:
\[K_\ce{a}=\ce{\dfrac{[H3O+][CH3CO2- ]}{[CH3CO2H]}}≈\ce{\dfrac{[H3O+]^2}{[CH3CO2H]_0}} \nonumber \]
na
\[\ce{[H3O+]}=\sqrt{K_\ce{a}×\ce{[CH3CO2H]}}=\sqrt{1.8\times 10^{-5}×0.100}=1.3\times 10^{-3} \nonumber \]
\[\mathrm{pH=-\log(1.3\times 10^{-3})=2.87} \nonumber \]
(b) Baada ya 25.00 ml ya NaOH ni aliongeza, idadi ya moles ya NaOH na CH 3 CO 2 H ni sawa kwa sababu kiasi cha ufumbuzi na viwango vyao ni sawa. Yote ya CH 3 CO 2 H imebadilishwa kuwa\(\ce{CH3CO2-}\). Mkusanyiko wa\(\ce{CH3CO2-}\) ion ni:
\[\mathrm{\dfrac{0.00250\: mol}{0.0500\: L}=0.0500\: \ce{MCH3CO2-}} \nonumber \]
Msawazo ambao unapaswa kuzingatia sasa ni usawa wa msingi kwa\(\ce{CH3CO2-}\):
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
hivyo tunapaswa kuamua K b kwa msingi kwa kutumia bidhaa ya ioni mara kwa mara kwa maji:
\[K_\ce{b}=\ce{\dfrac{[CH3CO2H][OH- ]}{[CH3CO2- ]}} \nonumber \]
\[K_\ce{a}=\ce{\dfrac{[CH3CO2- ][H+]}{[CH3CO2H]}},\textrm{ so }\ce{\dfrac{[CH3CO2H]}{[CH3CO2- ]}}=\dfrac{\ce{[H+]}}{K_\ce{a}}. \nonumber \]
Tangu K w = [H +] [OH -]:
\[\begin{align} K_\ce{b} &=\dfrac{\ce{[H+][OH- ]}}{K_\ce{a}} \\ &=\dfrac{K_\ce{w}}{K_\ce{a}} \\ &=\dfrac{1.0\times 10^{-14}}{1.8\times 10^{-5}} \\ &=5.6\times 10^{-10} \end{align} \nonumber \]
Hebu tuonyeshe mkusanyiko wa kila bidhaa za mmenyuko huu, CH 3 CO 2 H na OH - kama x. Kutumia dhana kwamba x ni ndogo ikilinganishwa na 0.0500 M\(K_\ce{b}=\dfrac{x^2}{0.0500\:M}\), na kisha:
\[\ce{pOH}=-\log(5.3\times 10^{-6})=5.28 \nonumber \]
\[\ce{pH}=14.00−5.28=8.72 \nonumber \]
Kumbuka kwamba pH katika hatua ya ulinganifu wa titration hii ni kubwa zaidi kuliko 7.
(c) Katika (a), 25.00 ml ya suluhisho la NaOH iliongezwa, na hivyo kwa kawaida kila CH 3 CO 2 H ilibadilishwa kuwa\(\ce{CH3CO2-}\). Katika kesi hiyo, 12.50 ml tu ya suluhisho la msingi imeanzishwa, na hivyo nusu tu ya CH 3 CO 2 H inabadilishwa kuwa\(\ce{CH3CO2-}\). Jumla ya awali ya idadi ya moles ya CH 3 CO 2 H ni 0.02500L × 0.100 M = 0.00250 mol, na hivyo baada ya kuongeza NaOH, idadi ya moles ya CH 3 CO 2 H na wote\(\ce{CH3CO2-}\) ni takriban sawa na\(\mathrm{\dfrac{0.00250\: mol}{2}=0.00125\: mol}\), na viwango ni sawa.
Kwa kuwa kiasi cha msingi ulioongezwa ni ndogo kuliko kiasi cha awali cha asidi, hatua ya ulinganifu haijawahi kufikiwa, suluhisho linabakia buffer, na tunaweza kutumia equation ya Henderson-Hasselbalch:
(kama viwango vya\(\ce{CH3CO2-}\) na CH 3 CO 2 H ni sawa)
Hivyo:
\[\ce{pH}=−\log(1.8\times 10^{−5})=4.74 \nonumber \]
(pH = p K a katika hatua ya nusu katika titration ya asidi dhaifu)
(d) Baada ya 37.50 ml ya NaOH imeongezwa, kiasi cha NaOH ni 0.03750 L × 0.100 M = 0.003750 mol NaOH. Kwa kuwa hii imepita hatua ya ulinganifu, ions ya hidroksidi ya ziada itafanya suluhisho la msingi, na tunaweza tena kutumia mahesabu ya stoichiometric kuamua pH:
Hivyo:
Kumbuka kuwa matokeo haya ni sawa na kwa mfano wa nguvu wa asidi-nguvu ya msingi wa titration iliyotolewa, kwa kuwa kiasi cha msingi wa nguvu kilichoongezwa husababisha ufumbuzi uliopita hatua ya ulinganifu.
Tumia pH kwa titration dhaifu ya asidi/nguvu ya msingi kati ya 50.0 ml ya 0.100 M HCOOH (aq) (asidi ya formic) na 0.200 M NaOH (titrant) kwa kiasi kilichoorodheshwa cha msingi ulioongezwa:
- 0.00 mL,
- 15.0 mL,
- 25.0 ml, na
- 30.0 ml.
- Jibu
-
0.00 ml: 2.37
- Jibu b
-
15.0 ml: 3.92
- Jibu c
-
25.00 ml: 8.29
- Jibu d
-
30.0 ml: 12.097
Viashiria vya Asidi-Msingi
Dutu fulani za kikaboni hubadilisha rangi katika suluhisho la kuondokana wakati mkusanyiko wa ioni ya hidroniamu unafikia thamani fulani. Kwa mfano, phenolphthalein ni dutu isiyo na rangi katika suluhisho lolote la maji yenye mkusanyiko wa ioni ya hidroniamu zaidi ya 5.0 × 10 -9 M (pH <8.3). Katika ufumbuzi wa msingi zaidi ambapo mkusanyiko wa ioni ya hidroniamu ni chini ya 5.0 × 10 -9 M (pH> 8.3), ni nyekundu au nyekundu. Vipengele kama vile phenolphthalein, ambayo inaweza kutumika kuamua pH ya suluhisho, huitwa viashiria vya asidi-msingi. Viashiria vya msingi vya asidi ni ama asidi za kikaboni dhaifu au misingi dhaifu ya kikaboni.
Msawazo katika suluhisho la kiashiria cha asidi-msingi methyl machungwa, asidi dhaifu, inaweza kuwakilishwa na equation ambayo tunatumia\(\ce{HIn}\) kama uwakilishi rahisi kwa molekuli tata ya machungwa ya methyl:
\[\underbrace{\ce{HIn (aq)}}_{\ce{red}}+\ce{H2O (l)}⇌\ce{H3O^{+} (aq)}+\underbrace{\ce{In^{-} (aq)}}_{\ce{yellow}} \nonumber \]
\[K_\ce{a}=\ce{\dfrac{[H3O+][In- ]}{[HIn]}}=4.0\times 10^{−4} \nonumber \]
Anion ya machungwa ya methyl,, ni njano, na fomu isiyo ya kawaida\(\ce{HIn}\), ni nyekundu.\(\ce{In^{-}}\) Tunapoongeza asidi kwa suluhisho la machungwa ya methyl, mkusanyiko wa ioni ya hidronium hubadilisha usawa kuelekea fomu nyekundu isiyo na nonionized, kwa mujibu wa kanuni ya Le Chatelier. Ikiwa tunaongeza msingi, tunabadilisha usawa kuelekea fomu ya njano. Tabia hii ni sawa kabisa na hatua ya buffers.
Rangi ya kiashiria ni matokeo inayoonekana ya uwiano wa viwango vya aina mbili Katika - na\(\ce{HIn}\). Kama wengi wa kiashiria (kawaida kuhusu 60-90% au zaidi) ni sasa kama\(\ce{In^{-}}\), basi tunaona rangi ya\(\ce{In^{-}}\) ion, ambayo itakuwa njano kwa methyl machungwa. Ikiwa wengi hupo kama\(\ce{HIn}\), basi tunaona rangi ya\(\ce{HIn}\) molekuli: nyekundu kwa machungwa ya methyl. Kwa methyl machungwa, tunaweza kupanga upya equation kwa K a na kuandika:
\[\mathrm{\dfrac{[In^-]}{[HIn]}=\dfrac{[substance\: with\: yellow\: color]}{[substance\: with\: red\: color]}=\dfrac{\mathit{K}_a}{[H_3O^+]}} \label{ABeq2} \]
Equation\ ref {AbeQ2} inatuonyesha jinsi uwiano wa\(\ce{\dfrac{[In- ]}{[HIn]}}\) inatofautiana na mkusanyiko wa ioni ya hidroniamu. Maneno hapo juu yanayoelezea usawa wa kiashiria yanaweza kupangwa upya:
\[ \begin{align} \dfrac{[H_3O^+]}{\mathit{K}_a} &=\dfrac{[HIn]}{[In^- ]} \\[8pt] \log\left(\dfrac{[H_3O^+]}{\mathit{K}_a}\right) &= \log\left(\dfrac{[HIn]}{[In^- ]}\right) \\[8pt] \log([H_3O^+])-\log(\mathit{K}_a) &=-\log\left(\dfrac{[In^-]}{[HIn]}\right) \\[8pt] -pH+p\mathit{K}_a & =-\log\left(\dfrac{[In^-]}{[HIn]}\right) \\[8pt] pH &=p\mathit{K}_a+\log\left(\dfrac{[In^-]}{[HIn]}\right) \end {align} \nonumber \]
au kwa ujumla
\[pH=p\mathit{K}_a+\log\left(\dfrac{[base]}{[acid]}\right) \label{HHeq} \]
Equation\ ref {hHeQ} ni sawa na equation ya Henderson-Hasselbalch, ambayo inaweza kutumika kuelezea usawa wa viashiria.
Wakati [H 3 O +] ina thamani sawa ya namba kama K a, uwiano wa [In -] hadi [Hin]] ni sawa na 1, maana yake ni kwamba asilimia 50 ya kiashiria iko katika umbo nyekundu (Hin) na 50% iko katika fomu ya ioniki ya njano (In -), na suluhisho linaonekana machungwa katika rangi. Wakati mkusanyiko wa ioni ya hidronium huongezeka hadi 8 × 10 -4 M (pH ya 3.1), suluhisho hugeuka nyekundu. Hakuna mabadiliko katika rangi yanaonekana kwa ongezeko lolote zaidi katika mkusanyiko wa ioni ya hidronium (kupungua kwa pH). Katika mkusanyiko wa ioni ya hidronium ya 4 × 10 -5 M (pH ya 4.4), zaidi ya kiashiria iko katika fomu ya ionic ya njano, na kupungua zaidi kwa mkusanyiko wa ioni ya hidronium (ongezeko la pH) hauzalishi mabadiliko ya rangi inayoonekana. Kiwango cha pH kati ya 3.1 (nyekundu) na 4.4 (njano) ni muda wa mabadiliko ya rangi ya machungwa ya methyl; mabadiliko ya rangi yanayotamkwa hufanyika kati ya maadili haya ya pH.
Kuna viashiria vingi vya asidi-msingi vinavyofunika maadili mbalimbali ya pH na inaweza kutumika kuamua pH takriban ya suluhisho isiyojulikana kwa mchakato wa kuondoa. Viashiria vya Universal na karatasi ya pH zina mchanganyiko wa viashiria na kuonyesha rangi tofauti katika PHs tofauti. Kielelezo\(\PageIndex{2}\) hutoa viashiria kadhaa, rangi zao, na vipindi vyao vya mabadiliko ya rangi.
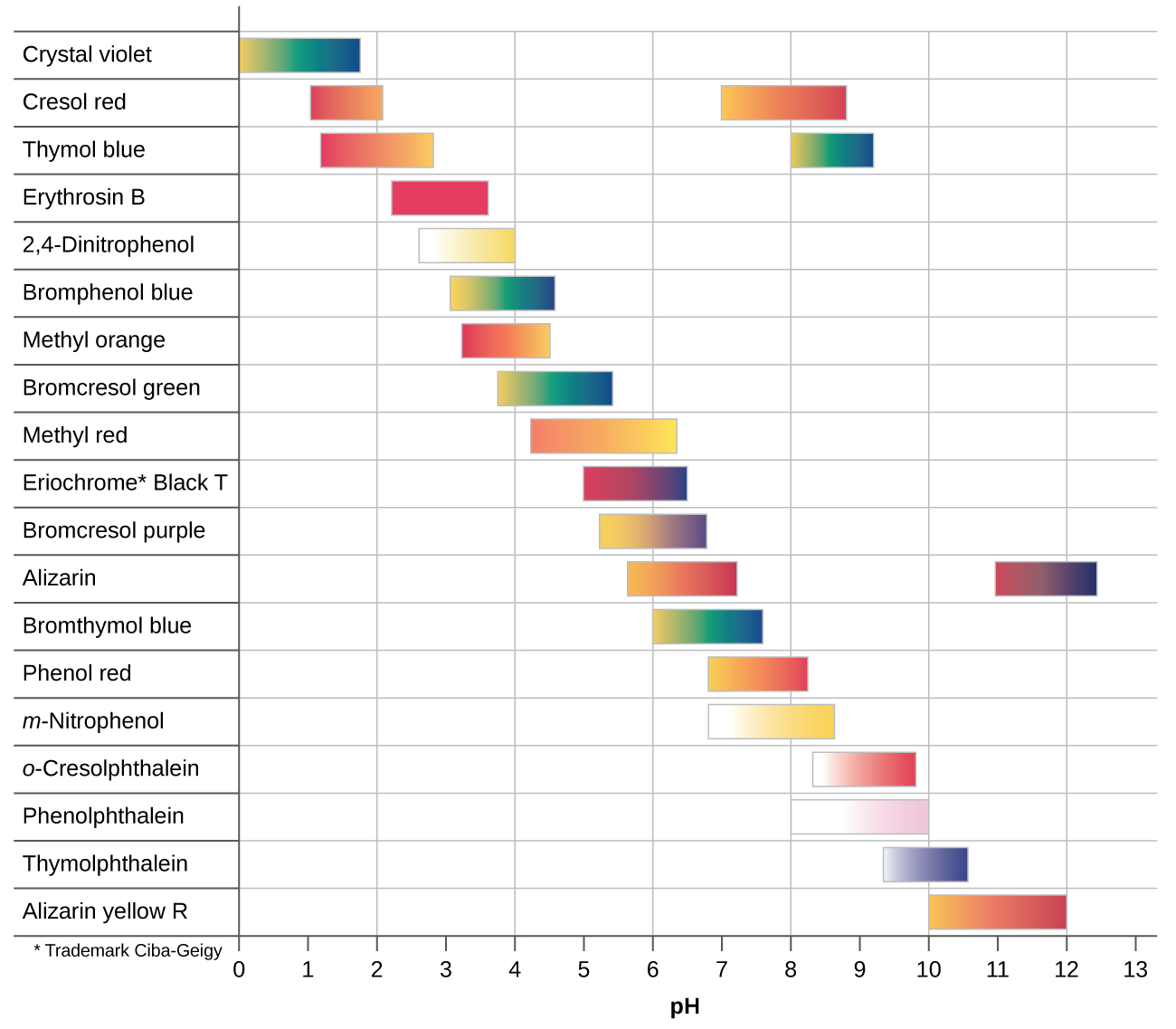
Curves ya titration hutusaidia kuchukua kiashiria ambacho kitatoa mabadiliko mkali wa rangi kwenye hatua ya ulinganifu. Uchaguzi bora utakuwa kiashiria ambacho kina muda wa mabadiliko ya rangi ambayo inaunganisha pH kwenye hatua ya ulinganifu wa titration.
Vipindi vya mabadiliko ya rangi ya viashiria vitatu vinaonyeshwa kwenye Kielelezo\(\PageIndex{3}\). Vipengele vya ulinganifu wa titration ya asidi kali na asidi dhaifu iko katika muda wa mabadiliko ya rangi ya phenolphthalein. Tunaweza kuitumia kwa titrations ya asidi ama nguvu na msingi imara au asidi dhaifu na msingi imara.
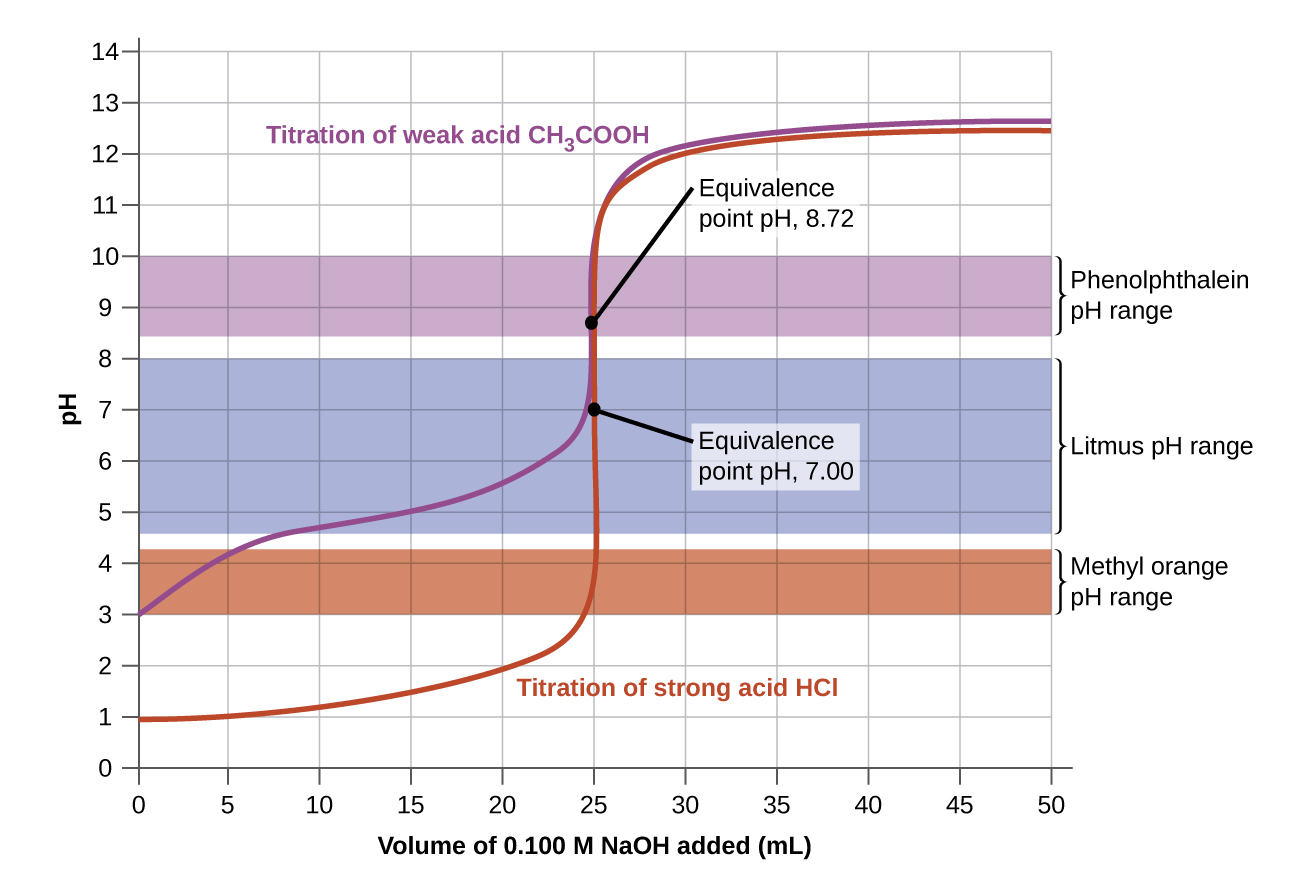
Litmus ni kiashiria kinachofaa kwa titration ya HCl, kwa sababu mabadiliko ya rangi yake hubadilisha alama ya usawa. Hata hivyo, hatupaswi kutumia litmus kwa titration ya CH 3 CO 2 H kwa sababu pH iko ndani ya muda wa mabadiliko ya rangi ya litmus wakati tu kuhusu 12 ml ya NaOH imeongezwa, na haitoi mpaka 25 ml imeongezwa. Mabadiliko ya rangi yatakuwa taratibu sana, yanayotokea wakati wa kuongeza 13 ml ya NaOH, na kufanya litmus haina maana kama kiashiria cha uhakika wa usawa.
Tunaweza kutumia machungwa ya methyl kwa titration ya HCl, lakini haiwezi kutoa matokeo sahihi sana: (1) Inakamilisha mabadiliko ya rangi yake kidogo kabla ya kufikia hatua ya ulinganifu (lakini karibu sana nayo, hivyo hii sio mbaya sana); (2) inabadilisha rangi, kama Kielelezo\(\PageIndex{2}\) kinaonyesha, wakati wa kuongeza karibu 0.5 ml ya NaOH, ambayo si mkali mabadiliko ya rangi kama ile ya litmus au phenolphthalein; na (3) huenda kutoka njano na machungwa na nyekundu, na kufanya kugundua endpoint sahihi changamoto zaidi kuliko colorless na mabadiliko pink ya phenolphthalein. Kielelezo\(\PageIndex{2}\) kinatuonyesha kwamba machungwa ya methyl itakuwa haina maana kabisa kama kiashiria cha CH 3 CO 2 H titration. Mabadiliko yake ya rangi huanza baada ya 1 ml ya NaOH imeongezwa na kuishia wakati karibu 8 ml imeongezwa. Mabadiliko ya rangi yanakamilika muda mrefu kabla ya hatua ya ulinganifu (ambayo hutokea wakati 25.0 ml ya NaOH imeongezwa) imefikiwa na hivyo haitoi dalili ya uhakika wa ulinganifu.
Sisi msingi uchaguzi wetu wa kiashiria juu ya pH mahesabu, pH katika hatua ya ulinganifu. Katika kiwango cha ulinganifu, kiasi cha equimolar cha asidi na msingi vimechanganywa, na hesabu inakuwa ile ya pH ya suluhisho la chumvi kutokana na titration.
Muhtasari
Curve ya titration ni grafu inayohusiana na mabadiliko katika pH ya suluhisho la tindikali au la msingi kwa kiasi cha titrant iliyoongezwa. Tabia za curve ya titration zinategemea ufumbuzi maalum unaozingatiwa. PH ya suluhisho katika hatua ya ulinganifu inaweza kuwa kubwa kuliko, sawa na, au chini ya 7.00. Uchaguzi wa kiashiria cha titration iliyotolewa inategemea pH inatarajiwa katika hatua ya ulinganifu wa titration, na mabadiliko ya rangi ya kiashiria.
faharasa
- kiashiria cha asidi-msingi
- asidi ya kikaboni au msingi ambao rangi hubadilika kulingana na pH ya suluhisho iliyo
- muda wa mabadiliko ya rangi
- mbalimbali katika pH ambayo mabadiliko ya rangi ya kiashiria hufanyika
- Curve ya titration
- mpango wa pH ya suluhisho la asidi au msingi dhidi ya kiasi cha msingi au asidi iliyoongezwa wakati wa titration


