14E: Usawa wa Asidi-Msingi (Mazoezi)
- Page ID
- 176935
14.1: Brønsted-Lowry Acids na Msingi
Q14.1.1
Andika milinganyo inayoonyesha NH 3 kama asidi ya conjugate na msingi wa conjugate.
S14.1.1
Mfano mmoja kwa NH 3 kama asidi ya conjugate:\(\ce{NH2- + H+ ⟶ NH3}\); kama msingi wa conjugate:\(\ce{NH4+}(aq)+\ce{OH-}(aq)⟶\ce{NH3}(aq)+\ce{H2O}(l)\)
Q14.1.2
Andika milinganyo inayoonyesha\(\ce{H2PO4-}\) kutenda wote kama asidi na kama msingi.
Q14.1.3
Onyesha kwa milinganyo inayofaa ya ioniki ya wavu kwamba kila aina zifuatazo zinaweza kutenda kama asidi ya Brønsted-Lowry:
- \(\ce{H3O+}\)
- HCl
- NH 3
- CH 3 CO 2 H
- \(\ce{NH4+}\)
- \(\ce{HSO4-}\)
S14.1.3
- \(\ce{H3O+}(aq)⟶\ce{H+}(aq)+ \ce{H_2O}_{(l)}\);
- \(\ce{HCl}(l)⟶\ce{H+}(aq)+\ce{Cl-}(aq)\);
- \(\ce{NH3}(aq)⟶\ce{H+}(aq)+\ce{NH2-}(aq)\);
- \(\ce{CH3CO2H}(aq)⟶\ce{H+}(aq)+\ce{CH3CO2-}(aq)\);
- \(\ce{NH4+}(aq)⟶\ce{H+}(aq)+\ce{NH3}(aq)\);
- \(\ce{HSO4-}(aq)⟶\ce{H+}(aq)+\ce{SO4^2-}(aq)\)
Q14.1.4
Onyesha kwa milinganyo inayofaa ya ioniki ya wavu kwamba kila aina zifuatazo zinaweza kutenda kama asidi ya Brønsted-Lowry:
- NO 3
- \(\ce{PH4+}\)
- H 2 S
- CH 3 CH 2 KIKOHOZI
- \(\ce{H2PO4-}\)
- HS -
Q14.1.5
Onyesha kwa milinganyo inayofaa ya ioniki ya wavu kwamba kila aina zifuatazo zinaweza kutenda kama msingi wa Brønsted-Lowry:
- H 2 O
- \(\ce{OH-}\)
- NH 3
- CN -
- S 2-
- \(\ce{H2PO4-}\)
S14.1.5
- \(\ce{H_2O}_{(l)} + \ce{H^+} (aq)⟶\ce{H3O+}(aq)\)
- \(\ce{OH-} (aq) + \ce{H^+} (aq)⟶ \ce{H_2O}_{(l)}\)
- \(\ce{NH3}(aq) + \ce{H^+} (aq)⟶\ce{NH4+}(aq)\);
- \(\ce{CN-}(aq) + \ce{H^+} (aq)⟶\ce{HCN}(aq)\)
- \(\ce{S^2-}(aq) + \ce{H^+} (aq)⟶\ce{HS-}(aq)\)
- \(\ce{H2PO4-}(aq) + \ce{H^+} (aq)⟶\ce{H3PO4}(aq)\)
Q14.1.6
Onyesha kwa milinganyo inayofaa ya ioniki ya wavu kwamba kila aina zifuatazo zinaweza kutenda kama msingi wa Brønsted-Lowry:
- HS -
- \(\ce{PO4^3-}\)
- \(\ce{NH2-}\)
- C 2 H 5 OH
- O 2
- \(\ce{H2PO4-}\)
Q14.1.7
Je! Ni asidi ya conjugate ya kila moja ya yafuatayo? Je, ni msingi wa conjugate wa kila mmoja?
- \(\ce{OH-}\)
- H 2 O
- \(\ce{HCO3-}\)
- NH 3
- \(\ce{HSO4-}\)
- H 2 O 2
- HS -
- \(\ce{H5N2+}\)
S14.1.7
H 2 O, O 2; H 3 O +,\(\ce{OH^-}\); H 2 CO 3\(\ce{NH4+}\),\(\ce{CO3^2-}\)\(\ce{NH2-}\);, H 2 HIVYO 4\(\ce{H3O2+}\),\(\ce{SO4^2-}\)\(\ce{HO2-}\); H 2 S; S 2;\(\ce{H6N2^2+}\), H 4 N 2
Q14.1.8
Je! Ni asidi ya conjugate ya kila moja ya yafuatayo? Je, ni msingi wa conjugate wa kila mmoja?
- H 2 S
- \(\ce{H2PO4-}\)
- PH 3
- HS -
- \(\ce{HSO3-}\)
- \(\ce{H3O2+}\)
- H 4 N 2
- SURA 3 OH
Q14.1.9
Tambua na uandike asidi ya Brønsted-Lowry, msingi wake wa conjugate, msingi wa Brønsted-Lowry, na asidi yake ya conjugate katika kila moja ya equations zifuatazo:
- \(\ce{HNO3 + H2O ⟶ H3O+ + NO3-}\)
- \(\ce{CN- + H2O ⟶ HCN + OH-}\)
- \(\ce{H2SO4 + Cl- ⟶ HCl + HSO4-}\)
- \(\ce{HSO4- + OH- ⟶ SO4^2- + H2O}\)
- \(\ce{O^2- + H2O ⟶ 2OH-}\)
- \(\ce{[Cu(H2O)3(OH)]+ + [Al(H2O)6]^3+ ⟶ [Cu(H2O)4]^2+ + [Al(H2O)5(OH)]^2+}\)
- \(\ce{H2S + NH2- ⟶ HS- + NH3}\)
S14.1.9
Maandiko ni asidi ya Brønsted-Lowry = BA; msingi wake wa conjugate = CB; Msingi wa Brønsted-Lowry = BB; asidi yake ya conjugate = CA. HNO 3 (BA), H 2 O (BB), H 3 O + (CA),\(\ce{NO3- (CB)}\); CN - (BB), H 2 O (BA), HCN (CA),\(\ce{OH^-}\) (CB); H 2 SO 4 (BA), Cl - (BB), HCL (CA),\(\ce{HSO4- (CB)}\);\(\ce{HSO4- (BA)}\), OH - (BB)\(\ce{SO4^2- (CB)}\), H 2 O (CA); O 2 (BB), H2O (BA)\(\ce{OH^-}\) (CB na CA); [Cu (H 2 O) 3 (OH)] + (BB), [Al (H 2 O) 6] 3+ (BA), [Cu (H 2 O) 4] 2+ (CA), [Al (H 2 O) 5 ( OH)] 2+ (CB); H 2 S (BA)\(\ce{NH2- (BB)}\), HS - (CB), NH 3 (CA)
Q14.1.10
Tambua na uandike asidi ya Brønsted-Lowry, msingi wake wa conjugate, msingi wa Brønsted-Lowry, na asidi yake ya conjugate katika kila moja ya equations zifuatazo:
- \(\ce{NO2- + H2O ⟶ HNO2 + OH-}\)
- \(\ce{HBr + H2O ⟶ H3O+ + Br-}\)
- \(\ce{HS- + H2O ⟶ H2S + OH-}\)
- \(\ce{H2PO4- + OH- ⟶HPO4^2- + H2O}\)
- \(\ce{H2PO4- + HCl ⟶ H3PO4 + Cl-}\)
- \(\ce{[Fe(H2O)5(OH)]^2+ + [Al(H2O)6]^3+ ⟶ [Fe(H2O)6]^3+ + [Al(H2O)5(OH)]^2+}\)
- \(\ce{CH3OH + H- ⟶ CH3O- + H2}\)
Q14.1.11
Aina ya amphiprotic ni nini? Eleza kwa milinganyo inayofaa.
S14.1.11
Spishi za amphiprotiki zinaweza ama kupata au kupoteza protoni katika mmenyuko wa kemikali, hivyo kutenda kama msingi au asidi. Mfano ni H 2 O.
- Kama asidi:\(\ce{H2O}(aq) + \ce{NH3}(aq) \rightleftharpoons \ce{NH4+}(aq) + \ce{OH-}(aq)\).
- Kama msingi:\(\ce{H2O}(aq) + \ce{HCl}(aq) \rightleftharpoons \ce{H3O+}(aq) + \ce{Cl-}(aq)\)
Q14.1.12
Hali ni ipi kati ya spishi zifuatazo ni amphiprotiki na kuandika milinganyo ya kemikali inayoonyesha tabia ya amphiprotiki ya spishi hizi:
- H 2 O
- \(\ce{H2PO4-}\)
- S 2-
- \(\ce{CO3^2-}\)
- \(\ce{HSO4-}\)
Q14.1.13
Hali ni ipi kati ya spishi zifuatazo ni amphiprotiki na kuandika milinganyo ya kemikali inayoonyesha tabia ya amphiprotiki ya spishi hizi.
- NH 3
- \(\ce{HPO4-}\)
- Br -
- \(\ce{NH4+}\)
- \(\ce{ASO4^3-}\)
S14.113
amphiprotic:\(\ce{NH3 + H3O+ ⟶ NH4OH + H2O}\),\(\ce{NH3 + OCH3- ⟶ NH2- + CH3OH}\);\(\ce{HPO4^2- + OH- ⟶ PO4^3- + H2O}\),\(\ce{HPO4^2- + HClO4 ⟶ H2PO4- + ClO4-}\); si amphiprotic: Br -;\(\ce{NH4+}\);\(\ce{AsO4^3-}\)
Q14.1.14
Je! Ionization binafsi ya maji endothermic au exothermic? Mara kwa mara ionization kwa maji (K w) ni\(2.9 \times 10^{-14}\) saa 40 °C na\(9.6 \times 10^{-14}\) saa 60 °C.
14.2: pH na PoH
Q14.2.1
Eleza kwa nini sampuli ya maji safi kwenye 40 °C haina upande wowote ingawa [H 3 O +] = 1.7 × 10 -7 M. K w ni 2.9 × 10 -14 saa 40 °C.
S14.2.1
Katika suluhisho la neutral [H 3 O +] = [OH -]. Katika 40 °C,
[H 3 O +] = [OH -] = (2.910 -14) 1/2 = 1.7 × 10 -7.
Q14.2.2
Mara kwa mara ionization kwa maji (K w) ni 2.9 × 10 -14 saa 40 °C. hesabu [H 3 O +], [OH ∙], pH, na PoH kwa maji safi kwenye 40 °C.
Q14.2.3
Mara kwa mara ionization kwa maji (K w) ni 9.614 × 10 -14 saa 60 °C. hesabu [H 3 O +], [OH ∙], pH, na PoH kwa maji safi kwenye 60 °C.
S14.2.3
x = 3.101 × 10 -7 M = [H 3 O +] = [OH ∙]
pH = -logi 3.101 × 10 -7 = - (-6.5085) = 6.5085
PoH = pH = 6.5085
Q14.2.4
Tumia pH na poH ya kila moja ya ufumbuzi wafuatayo saa 25° C ambayo vitu vinazidi kabisa:
- 0.200 m HCl
- 0.0143 m NaOH
- 3.0 M NO 3
- 0.0031 M Car (OH) 2
Q14.2.5
Tumia pH na poH ya kila moja ya ufumbuzi wafuatayo saa 25° C ambayo vitu vinazidi kabisa:
- 0.000259 M ChLo 4
- 0.12 m NaOH
- 0.000071 M Ba (OH) 2
- 2.5 M KOH
S14.2.5
pH = 3.587; poH = 10.413; pH = 0.68; PoH = 13.32; PoH = 3.85; pH = 10.15; pH = -0.40; PoH = 14.4
Q14.2.6
Je, ni pH na poH ya suluhisho la 2.0 M HCl, ambayo ionizes kabisa?
Q14.2.6
Je, ni viwango vya hidroniamu na hidroksidi ioni katika suluhisho ambalo pH ni 6.52?
S14.2.6
[H 3 O +] = 3.0 × 10 -7 M; [OH -] = 3.3 × 10 -8 M
Q14.2.7
Tumia mkusanyiko wa ioni ya hidrojeni na mkusanyiko wa ion ya hidroksidi katika divai kutoka pH Angalia hapa chini Kielelezo kwa taarifa muhimu.
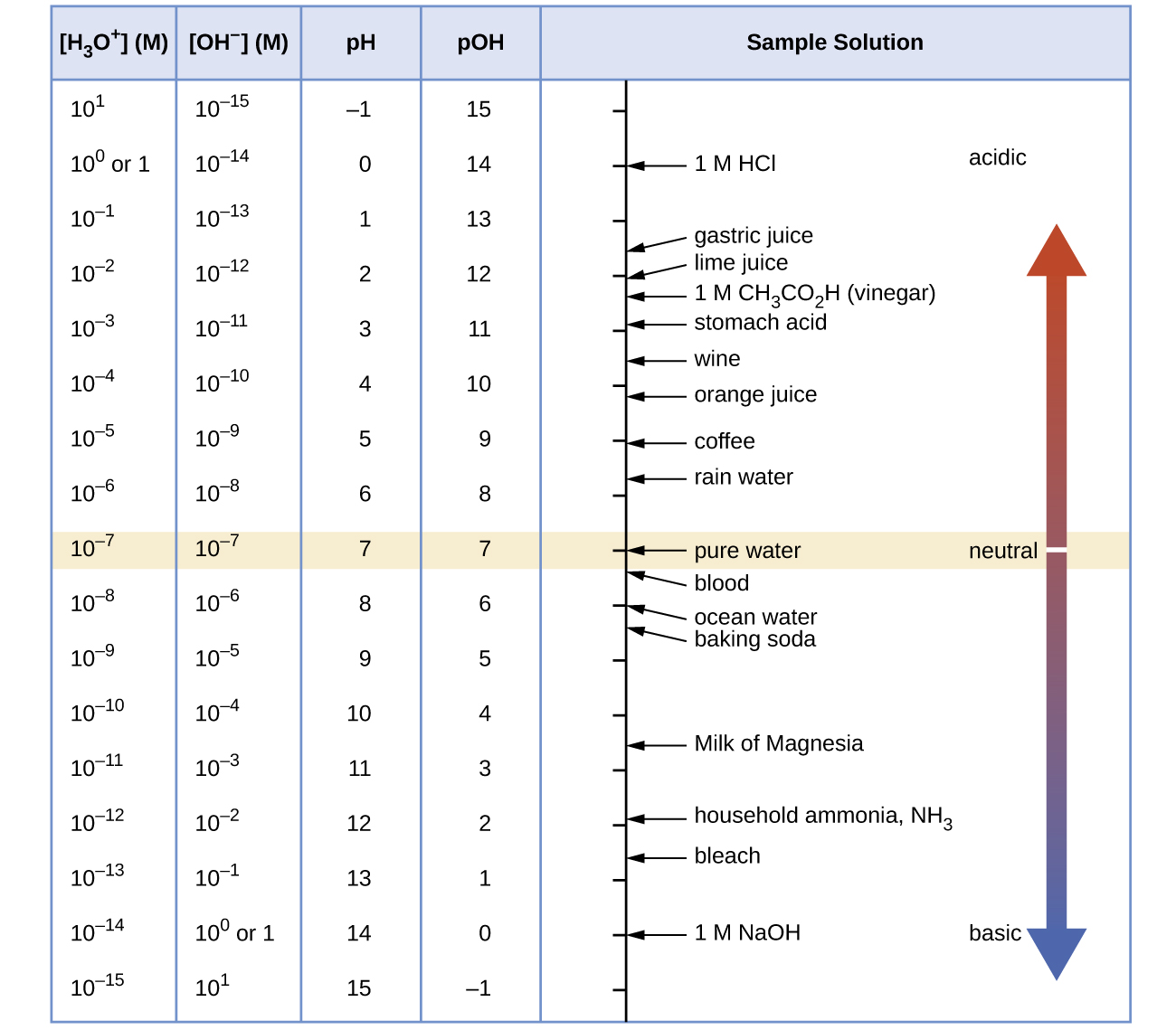
Q14.2.8
Tumia mkusanyiko wa ioni ya hidronium na mkusanyiko wa ioni ya hidroksidi katika juisi ya chokaa kutoka pH yake. Angalia Kielelezo kwa taarifa muhimu.
S14.2.9
[H 3 O +] = 1 × 10 -2 M; [OH ∙] = 1 × 10 -12 M
Q14.2.9
Mkusanyiko wa ioni ya hidroniamu katika sampuli ya maji ya mvua hupatikana kuwa 1.7 × 10 -6 M saa 25 °C Ni mkusanyiko gani wa ioni hidroksidi katika maji ya mvua?
Q14.2.10
Mkusanyiko wa ioni ya hidroksidi katika amonia ya kaya ni 3.2 × 10 1-3 M saa 25 °C Ni mkusanyiko gani wa ioni za hidroniamu katika suluhisho?
S14.2.10
[OH -] = 3.1 × 10 -12 M
14.3: Nguvu za Jamaa za Acids na Msingi
Q14.3.1
Eleza kwa nini mmenyuko wa neutralization wa asidi kali na msingi dhaifu hutoa ufumbuzi dhaifu wa tindikali.
Q14.3.2
Eleza kwa nini mmenyuko wa neutralization wa asidi dhaifu na msingi wenye nguvu hutoa ufumbuzi dhaifu wa msingi.
Chumvi ionizes katika suluhisho, lakini anion humenyuka kidogo na maji ili kuunda asidi dhaifu. Tabia hii pia huunda OH -, ambayo husababisha suluhisho kuwa msingi.
Q14.3.3
Tumia orodha hii ya misombo muhimu ya viwanda (na Kielelezo) kujibu maswali yafuatayo kuhusu: CaO, Ca (OH) 2, CH 3 CO 2 H, CO 2, HCl, H 2 CO 3, HF, HNO 2, HNO 3, H 3 PO 4 H 2 OS 4, NH 3, NaOH, Na 2 CO 3.
- Kutambua nguvu Brønsted-Lowry asidi na nguvu Brønsted-Lowry besi.
- Orodha ya misombo hiyo kwa kuwa inaweza kuishi kama asidi Brønsted-Lowry na nguvu za uongo kati ya wale wa H 3 O + na H 2 O.
- Orodha misombo wale kwa kuwa wanaweza kuishi kama besi Brønsted-Lowry na uwezo uongo kati ya wale wa H 2 O na OH -.
Q14.3.4
Harufu ya siki ni kutokana na kuwepo kwa asidi ya asidi, CH 3 CO 2 H, asidi dhaifu. Orodha, kwa utaratibu wa kushuka kwa mkusanyiko, aina zote za ionic na Masi zilizopo katika suluhisho la maji ya 1- M ya asidi hii.
S14.3.4
[H 2 O] > [CH 3 CO 2 H] >\(\ce{[H3O+]}\) ≈\(\ce{[CH3CO2- ]}\) > [OH ∙]
Q14.3.5
Amonia ya kaya ni suluhisho la msingi dhaifu NH 3 katika maji. Orodha, kwa utaratibu wa kushuka kwa mkusanyiko, aina zote za ionic na Masi zilizopo katika suluhisho la maji ya 1- M ya msingi huu.
Q14.3.4
Eleza kwa nini mara kwa mara ionization, K a, kwa H 2 SO 4 ni kubwa kuliko mara kwa mara ionization kwa H 2 SO 3.
S14.3.4
Hali ya oxidation ya sulfuri katika H 2 SO 4 ni kubwa kuliko hali ya oxidation ya sulfuri katika H 2 SO 3.
Q14.3.7
Eleza kwa nini mara kwa mara ionization, K a, kwa HI ni kubwa kuliko mara kwa mara ionization kwa HF.
Q14.3.8
Juisi ya tumbo, maji ya utumbo yanayotokana na tumbo, ina asidi hidrokloric, hCl. Maziwa ya Magnesia, kusimamishwa kwa Mg imara (OH) 2 katika katikati ya maji, wakati mwingine hutumiwa kuondokana na asidi ya tumbo ya ziada. Andika usawa kamili wa usawa kwa mmenyuko wa neutralization, na utambue jozi za msingi za asidi-msingi.
S14.3.8
\(\underset{\large\ce{BB}}{\ce{Mg(OH)2}(s)}+\underset{\large\ce{BA}}{\ce{HCl}(aq)}⟶\underset{\large\ce{CB}}{\ce{Mg^2+}(aq)}+\underset{\large\ce{CA}}{\ce{2Cl-}(aq)}+\underset{\:}{\ce{2H2O}(l)}\)
Q14.3.9
Asidi ya nitriki humenyuka na oksidi isiyo na shaba (II) ili kuunda nitrati ya shaba (II) ya mumunyifu, Cu (NO 3) 2, kiwanja ambacho kimetumika kuzuia ukuaji wa mwani katika mabwawa ya kuogelea. Andika usawa wa kemikali kwa mmenyuko wa suluhisho la maji ya HNO 3 na CUO.
Q14.3.10
Je, ni mara kwa mara ionization saa 25° C kwa asidi dhaifu\(\ce{CH3NH3+}\), asidi conjugate ya msingi dhaifu CH 3 NH 2, K b = 4.4 × 10 -4.
S14.3.10
\(K_\ce{a}=2.3×10^{−11}\)
Q14.3.11
Je, ni mara kwa mara ionization saa 25° C kwa asidi dhaifu\(\ce{(CH3)2NH2+}\), asidi conjugate ya msingi dhaifu (CH 3) 2 NH, K b = 7.4 × 10 -4?
Q14.3.12
Ni msingi gani, CH 3 NH 2 au (CH 3) 2 NH, ni msingi wenye nguvu zaidi? Ambayo asidi conjugate,\(\ce{(CH3)2NH2+}\) au (CH 3) 2 NH, ni asidi kali?
S14.3.12
Msingi wa nguvu au asidi kali ni moja na K kubwa au K a, kwa mtiririko huo. Katika mifano hii miwili, wao ni (CH 3) 2 NH na\(\ce{CH3NH3+}\).
Q14.3.3
Ambayo ni asidi yenye nguvu,\(\ce{NH4+}\) au HBro?
Q14.3.14
Ambayo ni msingi wenye nguvu, (CH 3) 3 N au\(\ce{H2BO3-}\)?
S14.3.14
triethylamine.
Q14.3.15
Kutabiri asidi katika kila jozi zifuatazo ni nguvu na kuelezea hoja yako kwa kila mmoja.
- H 2 O au HF
- B (OH) 3 au Al (OH) 3
- \(\ce{HSO3-}\)au\(\ce{HSO4-}\)
- NH 3 au H 2 S
- H 2 O au H 2 Te
Q14.3.16
Kutabiri ni kiwanja gani katika kila jozi zifuatazo za misombo ni tindikali zaidi na kuelezea mawazo yako kwa kila mmoja.
- \(\ce{HSO4-}\)au\(\ce{HSeO4-}\)
- NH 3 au H 2 O
- PH 3 au HI
- NH 3 au PH 3
- H 2 S au HbR
S14.3.16
- \(\ce{HSO4-}\); electronegativity ya juu ya ion kuu. H 2 O;
- NH 3 ni msingi na maji ni neutral, au kuamua kwa misingi ya K maadili. HI;
- PH 3 ni dhaifu kuliko HCl; HCl ni dhaifu kuliko HI. Hivyo, PH 3 ni dhaifu kuliko HI.
- PH 3; katika misombo ya binary ya hidrojeni na nonmetals, asidi huongezeka kwa kipengele cha chini katika kikundi.
- HbR; kwa kipindi, asidi huongezeka kutoka kushoto kwenda kulia; katika kikundi, huongezeka kutoka juu hadi chini. Br ni upande wa kushoto na chini ya S, hivyo HbR ni asidi kali.
Q14.3.17
Weka misombo katika kila makundi yafuatayo ili kuongeza asidi au msingi, kama ilivyoonyeshwa, na ueleze utaratibu unaowapa.
- asidi: HCl, HbR, HI
- msingi: H 2 O, OH -, H -, Cl -
- msingi: Mg (OH) 2, Si (OH) 4, ClO 3 (OH) (Dokezo: Mfumo pia inaweza kuandikwa kama HClo 4).
- asidi: HF, H 2 O, NH 3, CH 4
Q14.3.18
Weka misombo katika kila makundi yafuatayo ili kuongeza asidi au msingi, kama ilivyoonyeshwa, na ueleze utaratibu unaowapa.
- asidi: NaHSO 3, NaHSEO 3, NaHSO 4
- kimsingi:\(\ce{BrO2-}\)\(\ce{ClO2-}\),\(\ce{IO2-}\)
- asidi: HoCl, HobR, HOI
- asidi: HoCl, HoClo, HoClo 2, HoClo 3
- msingi:\(\ce{NH2-}\), HS -, The,\(\ce{PH2-}\)
- msingi: bro -,\(\ce{BrO2-}\),\(\ce{BrO3-}\),\(\ce{BrO4-}\)
S14.3.18
- NaHSEO 3 <NaHSO 3 <NaHSO 4; katika asidi ya polyoksi, kipengele cha kati cha electronegative zaidi, katika kesi hii-huunda asidi yenye nguvu. Idadi kubwa ya atomi za oksijeni kwenye atomi ya kati (ikitoa hali ya juu ya oxidation) pia inajenga kutolewa zaidi kwa atomi za hidrojeni, na kusababisha asidi kali. Kama chumvi, asidi huongezeka kwa namna ile ile.
- \(\ce{ClO2- < BrO2- < IO2-}\); msingi wa anions katika mfululizo wa asidi itakuwa kinyume cha asidi katika oxyacids yao. Asidi huongezeka kama electronegativity ya atomi kuu huongezeka. Cl ni electronegative zaidi ya Br, na mimi ni electronegative angalau ya tatu.
- HOI <HOBR <HoCl; katika mfululizo wa aina moja ya oksiacids, asidi huongezeka kadiri electronegativity ya atomi ya kati inavyoongezeka. Cl ni electronegative zaidi ya Br, na mimi ni electronegative angalau ya tatu.
- HoCl <HoClO <HoClO 2 <HoClO 3; katika mfululizo wa oksijeni ya elementi moja ya kati, asidi huongezeka kadiri idadi ya atomi za oksijeni inavyoongezeka (au kama hali ya oksidi ya atomi ya kati inavyoongezeka).
- \(\ce{HTe- < HS- << PH2- < NH2-}\);\(\ce{PH2-}\) na\(\ce{NH2-}\) ni anions ya besi dhaifu, hivyo hufanya kama besi kali kuelekea H +. \(\ce{HTe-}\)na HS - ni anions ya asidi dhaifu, hivyo wana tabia ya chini ya msingi. Katika kundi la mara kwa mara, kipengele cha electronegative zaidi kina anion ya msingi zaidi.
- \(\ce{BrO4- < BrO3- < BrO2- < BrO-}\); na idadi kubwa ya atomi za oksijeni (yaani, kama hali ya oxidation ya ioni kuu inavyoongezeka), asidi inayofanana inakuwa tindikali zaidi na anion hivyo chini ya msingi.
Q14.3.19
Wote HF na HCN ionize katika maji kwa kiwango kidogo. Ni ipi kati ya misingi ya conjugate, F - au CN-, ni msingi wenye nguvu? Angalia Jedwali.
Q14.3.20
Viungo vilivyotengenezwa na aspirini katika mwili ni asidi salicylic, C 6 H 4 OH (CO 2 H). Kikundi cha carboxyl (-CO 2 H) hufanya kama asidi dhaifu. Kikundi cha fenoli (kikundi cha OH kilichounganishwa na pete yenye kunukia) pia hufanya kama asidi lakini asidi dhaifu sana. Orodha, kwa utaratibu wa kushuka kwa mkusanyiko, aina zote za ionic na Masi zilizopo katika suluhisho la maji la 0.001- M la C 6 H 4 OH (CO 2 H).
\(\ce{[H2O] > [C6H4OH(CO2H)] > [H+]0 > [C6H4OH(CO2)- ] ≫ [C6H4O(CO2H)- ] > [OH- ]}\)
Tunawakilisha nini tunapoandika:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq)?\]
Q14.3.21
Eleza kwa nini mahesabu ya usawa si lazima kuamua viwango vya ionic katika ufumbuzi wa electrolytes fulani kali kama vile NaOH na HCl. Chini ya hali gani ni mahesabu ya usawa muhimu kama sehemu ya uamuzi wa viwango vya ions zote za electrolytes nyingine zenye nguvu katika suluhisho?
S14.3.21
Nguvu electrolytes ni 100% ionized, na, kwa muda mrefu kama ions sehemu si asidi dhaifu wala besi dhaifu, aina ionic sasa kutokana na dissociation ya electrolyte nguvu. Mahesabu ya usawa ni muhimu wakati moja (au zaidi) ya ions ni asidi dhaifu au msingi dhaifu.
Q14.3.22
Je, viwango vya ioni ya hidroniamu na ioni ya hidroksidi katika suluhisho la asidi au msingi katika maji moja kwa moja sawia au inversely sawia? Eleza jibu lako.
Q14.3.23
Nini mawazo mawili ya kawaida yanaweza kurahisisha hesabu ya viwango vya usawa katika suluhisho la asidi dhaifu?
S14.3.23
- Fikiria kwamba mabadiliko katika mkusanyiko wa awali wa asidi kama usawa umeanzishwa yanaweza kupuuzwa, hivyo ukolezi huu unaweza kudhaniwa mara kwa mara na sawa na thamani ya awali ya mkusanyiko wa asidi jumla.
- Tuseme tunaweza kupuuza mchango wa maji kwa mkusanyiko wa usawa wa H 3 O +.
Q14.3.24
Nini mawazo mawili ya kawaida yanaweza kurahisisha hesabu ya viwango vya usawa katika suluhisho la msingi dhaifu?
Q14.3.25
Ni ipi kati ya yafuatayo itaongeza asilimia ya NH 3 ambayo inabadilishwa kuwa ion ya amonia katika maji (Kidokezo: Matumizi ya kanuni ya Lechâtelier.)?
- nyongeza ya NaOH
- kuongeza ya HCl
- nyongeza ya NH 4 Cl
S14.3.25
Kuongezea kwa HCl
Q14.3.26
Ni ipi kati ya yafuatayo itaongeza asilimia ya HF ambayo inabadilishwa kuwa ioni ya fluoride katika maji?
- nyongeza ya NaOH
- kuongeza ya HCl
- nyongeza ya NaF
Q14.3.27
Je, ni athari kwa viwango vya\(\ce{NO2-}\), HNO 2, na OH - wakati zifuatazo zinaongezwa kwenye suluhisho la KNO 2 katika maji:
- HCl
- NO 2
- NaOH
- NaCl
- KUJUA
Equation kwa usawa ni:
\[\ce{NO2-}(aq)+\ce{H2O}(l)⇌\ce{HNO2}(aq)+\ce{OH-}(aq)\]S14.3.27
- Kuongeza HCl itaongeza H 3 O + ions, ambayo kisha itaitikia na ions OH -, kupunguza ukolezi wao. Msawazo utabadilika kwa haki, kuongeza mkusanyiko wa HNO 2, na kupunguza mkusanyiko wa\(\ce{NO2-}\) ions.
- Kuongeza HNO 2 huongeza mkusanyiko wa HNO 2 na mabadiliko ya usawa kwa upande wa kushoto, kuongeza mkusanyiko wa\(\ce{NO2-}\) ions na kupunguza mkusanyiko wa OH - ions.
- Kuongeza NaOH anaongeza OH - ions, ambayo hubadilisha usawa kwa upande wa kushoto, kuongeza mkusanyiko wa\(\ce{NO2-}\) ions na kupunguza viwango vya HNO 2.
- Kuongeza NaCl haina athari juu ya viwango vya ions.
- Kuongeza KNO 2 inaongeza\(\ce{NO2-}\) ions na mabadiliko ya usawa kwa haki, kuongeza viwango vya HNO 2 na OH - ion.
Q14.3.28
Je, ni athari gani juu ya mkusanyiko wa asidi hidrofluoriki, ioni ya hidroniamu, na ioni ya fluoride wakati zifuatazo zinaongezwa kwa ufumbuzi tofauti wa asidi hidrofluoriki?
- HCl
- KF
- NaCl
- KOH
- HF
Equation kwa usawa ni:
\[\ce{HF}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{F-}(aq)\]Q14.3.29
Kwa nini hydronium ion mkusanyiko katika suluhisho ambayo ni 0.10 M katika HCl na 0.10 M katika HCOOH kuamua na mkusanyiko wa HCl?
S14.3.29
Hii ni kesi ambayo suluhisho ina mchanganyiko wa asidi ya nguvu tofauti za ionization. Katika suluhisho, HCO 2 H ipo hasa kama molekuli ya HCO 2 H kwa sababu ionization ya asidi dhaifu inakandamizwa na asidi kali. Kwa hiyo, HCO 2 H inachangia kiasi kidogo cha ions hydronium kwa suluhisho. Asidi yenye nguvu, HCl, ni mtayarishaji mkuu wa ions za hidronium kwa sababu ni ionized kabisa. Katika suluhisho hilo, asidi yenye nguvu huamua mkusanyiko wa ioni za hidronium, na ionization ya asidi dhaifu ni fasta na [H 3 O +] zinazozalishwa na asidi kali.
Q14.3.30
Kutoka kwa viwango vya usawa uliotolewa, hesabu K a kwa kila asidi dhaifu na K b kwa kila besi dhaifu.
CH 3 CO 2 H:\(\ce{[H3O+]}\) = 1.34 × 10 -3 M;
\(\ce{[CH3CO2- ]}\)= 1.34 × 10 -3 M;[CH 3 CO 2 H] = 9.866 × 10 -2 M;
ClO -: [OH -] = 4.0 × 10 -4 M;
[ChLo] = 2.38 × 10 -5 M;
[ClO -] = 0.273 M;
HCO 2 H: [HCO 2 H] = 0.524 M;
\(\ce{[H3O+]}\)= 9.8 × 10 -3 M;\(\ce{[HCO2- ]}\) = 9.8 × 10 -3 M;\(\ce{C6H5NH3+ : [C6H5NH3+]}\)= 0.233 M;
[C 6 H 5 NH 2] = 2.3 × 10 -3 M;
\(\ce{[H3O+]}\)= 2.3 × 10 -3 MKutoka kwa viwango vya usawa uliotolewa, hesabu K a kwa kila asidi dhaifu na K b kwa kila besi dhaifu.
NH 3: [OH -] = 3.1 × 10 -3 M;
\(\ce{[NH4+]}\)= 3.1 × 10 -3 M;[NH 3] = 0.533 M;
HAKUNA 2:\(\ce{[H3O+]}\) = 0.01 M;
\(\ce{[NO2- ]}\)= 0.0438 M;[HAKUNA 2] = 1.07 M;
(CH 3) 3 N: [(CH 3) 3 N] = 0.25 M;
[(CH 3) 3 NH +] = 4.3 × 10 -3 M;[OH -] = 4.3 × 10 -3 M;
\(\ce{NH4+ : [NH4+]}\)= 0.100 M;
[NH 3] = 7.5 × 10 -6 M;
[H 3 O +] = 7.5 × 10 -6 M- \(K_\ce{b}=1.8×10^{−5};\)
- \(K_\ce{a}=4.5×10^{−4};\)
- \(K_\ce{b}=7.4×10^{−5};\)
- \(K_\ce{a}=5.6×10^{−10}\)
Q14.3.31
Kuamua K b kwa ioni ya nitriti,\(\ce{NO2-}\). Katika ufumbuzi wa 0.10- M msingi huu ni 0.0015% ionized.
Q14.3.32
Kuamua K a kwa hidrojeni sulfate ion,\(\ce{HSO4-}\). Katika ufumbuzi wa 0.10- M asidi ni 29% ionized.
S14.3.32
\(K_\ce{a}=1.2×10^{−2}\)
Q14.3.33
Tumia mara kwa mara ya ionization kwa kila asidi zifuatazo au besi kutoka kwa mara kwa mara ya ionization ya msingi wake wa conjugate au asidi conjugate:
- F -
- \(\ce{NH4+}\)
- \(\ce{AsO4^3-}\)
- \(\ce{(CH3)2NH2+}\)
- \(\ce{NO2-}\)
- \(\ce{HC2O4-}\)(kama msingi)
Q14.3.52
Tumia mara kwa mara ya ionization kwa kila asidi zifuatazo au besi kutoka kwa mara kwa mara ya ionization ya msingi wake wa conjugate au asidi conjugate:
- The - (kama msingi)
- \(\ce{(CH3)3NH+}\)
- \(\ce{HAsO4^3-}\)(kama msingi)
- \(\ce{HO2-}\)(kama msingi)
- \(\ce{C6H5NH3+}\)
- \(\ce{HSO3-}\)(kama msingi)
S14.3.52
- \(K_\ce{b}=4.3×10^{−12};\)
- \(K_\ce{a}=1.4×10^{−10};\)
- \(K_\ce{b}=1×10^{−7};\)
- \(K_\ce{b}=4.2×10^{−3};\)
- \(K_\ce{b}=4.2×10^{−3};\)
- \(K_\ce{b}=8.3×10^{−13}\)
Q14.3.53
Kwa nini kati ya ufumbuzi wafuatayo lazima tuchunguze ionization ya maji wakati wa kuhesabu pH au PoH?
- 3 × 10 18-8 M NO 3
- 0.10 g HCl katika 1.0 L ya suluhisho
- 0.00080 g NaOH katika 0.50 L ya suluhisho
- 1 × 10 -7 M Ca (OH) 2
- 0.0245 M NO 3
Q14.3.54
Ingawa wote NH 3 na C 6 H 5 NH 2 ni besi dhaifu, NH 3 ni asidi yenye nguvu zaidi kuliko C 6 H 5 NH 2. Ni ipi kati ya yafuatayo ni sahihi kwa usawa kwa suluhisho ambalo ni awali 0.10 M katika NH 3 na 0.10 M katika C 6 H 5 NH 2?
- \(\ce{[OH- ]}=\ce{[NH4+]}\)
- \(\ce{[NH4+]}=\ce{[C6H5NH3+]}\)
- \(\ce{[OH- ]}=\ce{[C6H5NH3+]}\)
- [NH 3] = [C 6 H 5 NH 2]
- wote a na b ni sahihi
ni taarifa sahihi.
Q14.3.55
Tumia mkusanyiko wa usawa wa asidi nonionized na ions zote katika suluhisho ambalo ni 0.25 M katika HCO 2 H na 0.10 M katika HClO.
Q14.3.56
Tumia mkusanyiko wa usawa wa asidi nonionized na ions zote katika suluhisho ambalo ni 0.134 M katika HNO 2 na 0.120 M katika HbrO.
S14.3.56
[H 3 O +] = 7.5 × 10 -3 M
[HNO 2] = 0.126 [OH -] = 1.3 × 10 -12 M [BRO-] = 3.2 × 10 -8 M [HBRO] = 0.120 MQ14.3.57
Tumia mkusanyiko wa usawa wa besi za nonionized na ions zote katika suluhisho ambalo ni 0.25 M katika CH 3 NH 2 na 0.10 M katika C 5 H 5 N (K b = 1.7 × 10 -9).
Q14.3.58
Tumia mkusanyiko wa usawa wa besi za nonionized na ions zote katika suluhisho ambalo ni 0.115 M katika NH 3 na 0.100 M katika C 6 H 5 NH 2.
S14.3.58
[OH -]\(\ce{[NO4+]}\) = 0.0014 M
[NH 3] = 0.144 M [H 3 O +] = 6.9 × 10 -12 M\(\ce{[C6H5NH3+]}\) = 3.9 × 10 -8 M [C 6 H 5 NH 2] = 0.100 MQ14.3.59
Kutumia K maadili katika Kiambatisho H, mahali\(\ce{Al(H2O)6^3+}\) katika eneo sahihi katika Kielelezo.
Q14.3.60
Tumia mkusanyiko wa aina zote za solute katika kila ufumbuzi wafuatayo wa asidi au besi. Fikiria kwamba ionization ya maji inaweza kupuuzwa, na kuonyesha kwamba mabadiliko katika viwango vya awali yanaweza kupuuzwa. Vipindi vya ionization vinaweza kupatikana katika Kiambatisho H na Kiambatisho I.
- 0.0092 M ChLo, asidi dhaifu
- 0.0784 M C 6 H 5 NH 2, msingi dhaifu
- 0.0810 M HCN, asidi dhaifu
- 0.11 M (CH 3) 3 N, msingi dhaifu
- 0.120 M\(\ce{Fe(H2O)6^2+}\) asidi dhaifu, K = 1.6 × 10 -7
S14.3.60
\(\ce{\dfrac{[H3O+][ClO- ]}{[HClO]}}=\dfrac{(x)(x)}{(0.0092−x)}≈\dfrac{(x)(x)}{0.0092}=3.5×10^{−8}\)
Kutatua kwa x hutoa 1.79 × 10 -5 M. Thamani hii ni chini ya 5% ya 0.0092, hivyo dhana kwamba inaweza kupuuzwa ni halali. Hivyo, viwango vya aina za solute katika usawa ni:
[H 3 O +] = [ClO] = 1.8 × 10 -5 M [HClO] = 0.00092 M [OH -] = 5.6 × 10 -10 m;
\(\ce{\dfrac{[C6H5NH3+][OH- ]}{[C6H5NH2]}}=\dfrac{(x)(x)}{(0.0784−x)}≈\dfrac{(x)(x)}{0.0784}=4.6×10^{−10}\)
Kutatua kwa x hutoa 6.01 × 10 -6 M.
Thamani hii ni chini ya 5% ya 0.0784, hivyo dhana kwamba inaweza kupuuzwa ni halali. Hivyo, viwango vya spishi za solute katika usawa ni:\(\ce{[CH3CO2- ]}\) = [OH ∙] = 6.0 × 10 -6 M [C 6 H 5 NH 2] = 0.00784 [H 3 O +] = 1.7× 10 -9 M;\(\ce{\dfrac{[H3O+][CN- ]}{[HCN]}}=\dfrac{(x)(x)}{(0.0810−x)}≈\dfrac{(x)(x)}{0.0810}=4×10^{−10}\) Kutatua kwa x anatoa 5.69 × 10 -6 M. Thamani hii ni chini ya 5% ya 0.0810, hivyo dhana kwamba inaweza kupuuzwa ni halali. Hivyo, viwango vya spishi za solute kwenye usawa ni: [H 3 O +] = [[CN ─] = 5.7 × 10 -6 M [HCN] = 0.0810 M [OH ∙] = 1.8 × 10 -9 M;\(\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}}=\dfrac{(x)(x)}{(0.11−x)}≈\dfrac{(x)(x)}{0.11}=7.4×10^{−5}\) Kutatua kwa x kunatoa 2.85 × 10 -3 M. Thamani hii ni chini ya 5% ya 0.11, hivyo dhana kwamba inaweza kupuuzwa ni halali. Hivyo, viwango vya spishi za solute kwenye usawa ni: [(CH 3) 3 NH +] = [OH -] = 2.9 × 10 —3 M [(CH 3) 3 N] = 0.11 M [H 3 O +] = 3.5 × 10 -12 M;\(\ce{\dfrac{[Fe(H2O)5(OH)+][H3O+]}{[Fe(H2O)6^2+]}}=\dfrac{(x)(x)}{(0.120−x)}≈\dfrac{(x)(x)}{0.120}=1.6×10^{−7}\) Kutatua kwa x hutoa 1.39 × 10 -4 M. Thamani hii ni chini ya 5% ya 0.120, hivyo dhana kwamba inaweza kupuuzwa ni halali. Hivyo, viwango vya spishi za solute kwenye usawa ni: [Fe (H 2 O) 5 (OH) +] = [H 3 O +] = 1.4 × 10 -4 M\(\ce{[Fe(H2O)6^2+]}\) = 0.120 M [OH ∙] = 7.2 × 10 -11 M
Q14.3.61
Asidi ya Propioniki, C 2 H 5 CO 2 H (K = 1.34 × 10 -5), hutumiwa katika utengenezaji wa propionate ya kalsiamu, kihifadhi cha chakula. Je, ni mkusanyiko wa ioni ya hydronium katika ufumbuzi wa 0.698- M wa C 2 H 5 CO 2 H?
Q14.3.62
Siki nyeupe ni 5.0% kwa ufumbuzi mkubwa wa asidi ya asidi katika maji. Ikiwa wiani wa siki nyeupe ni 1.007 g/cm 3, pH ni nini?
S14.3.62
pH = 2.41
Q14.3.63
Ionization mara kwa mara ya asidi lactic, CH 3 CH (OH) CO 2 H, asidi kupatikana katika damu baada ya zoezi strenuous, ni 1.36 × 10 -4. Ikiwa 20.0 g ya asidi lactic hutumiwa kufanya suluhisho kwa kiasi cha 1.00 L, ni mkusanyiko gani wa ioni ya hidronium katika suluhisho?
Q14.3.64
Nikotini, C 10 H 14 N 2, ni msingi ambao utakubali protoni mbili (K 1 = 7 × 10 -7, K 2 = 1.4 × 10 -11). Je, ni mkusanyiko wa kila aina iliyopo katika ufumbuzi wa 0.050- M wa nikotini?
S14.3.64
[C 10 H 14 N 2] = 0.049 M
[C 10 H 14 N 2 H +] = 1.9 × 10 -4 M\(\ce{[C10H14N2H2^2+]}\) = 1.4 × 10 -11 M [OH -] = 1.9 × 10 -4 M [H 3 O +] = 5.3 × 10 -11 MQ14.3.65
PH ya ufumbuzi wa 0.20- M wa HF ni 1.92. Kuamua K a kwa HF kutoka data hizi.
Q14.3.66
PH ya ufumbuzi wa 0.15- M\(\ce{HSO4-}\) ni 1.43. Kuamua K a kwa\(\ce{HSO4-}\) kutoka data hizi.
S14.3.66
\(K_\ce{a}=1.2×10^{−2}\)
Q14.3.67
PH ya ufumbuzi wa 0.10- M ya caffeine ni 11.16. Kuamua K b kwa caffeine kutoka data hizi:
\(\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq)\)Q14.3.68
PH ya suluhisho la amonia ya kaya, ufumbuzi wa 0.950 M wa NH 3, ni 11.612. Kuamua K b kwa NH 3 kutoka data hizi.
S14.3.68
\(K_\ce{b}=1.77×10^{−5}\)
14.4: Hidrolisisi ya Solutions ya Chumvi
Q14.4.1
Kuamua kama ufumbuzi wa maji ya chumvi zifuatazo ni tindikali, msingi, au neutral:
- Al (NO 3)
- RBI
- KHCO 2
- CH 3 NH 3 Br
Q14.4.2
Kuamua kama ufumbuzi wa maji ya chumvi zifuatazo ni tindikali, msingi, au neutral:
- FeCl 3
- K 2 CO 3
- NH 4 Br
- kClo 4
S14.4.2
tindikali; msingi; tindikali; neutral
Q14.4.3
Novocaine, C 13 H 21 O 2 N 2 Cl, ni chumvi ya procaine ya msingi na asidi hidrokloric. Mara kwa mara ionization kwa procaine ni 7 × 10 -6. Je! Ni suluhisho la novocaine tindikali au msingi? Je, ni [H 3 O +], [OH -], na pH ya suluhisho la 2.0% kwa wingi wa novocaine, kwa kuzingatia kwamba wiani wa suluhisho ni 1.0 g/ml.
14.5: Polyprotic Acids
Q15.5.1
Ni ipi kati ya viwango vifuatavyo vinavyoweza kuwa sawa katika hesabu ya viwango vya usawa katika suluhisho la 0.134- M la H 2 CO 3, asidi ya diprotic:
- \(\ce{[H3O+]}\),
- \([OH^−]\)
- \([H_2CO_3]\)
- \(\ce{[HCO3- ]}\)
- \(\ce{[CO3^2- ]}\)
Hakuna mahesabu yanahitajika kujibu swali hili.
S15.5.1
[H 3 O +] na\(\ce{[HCO3- ]}\) ni sawa, H 3 O + na\(\ce{HCO3-}\) ni sawa
Q15.5.2
Tumia mkusanyiko wa kila aina iliyopo katika ufumbuzi wa 0.050- M wa H 2 S.
Q15.5.3
Tumia mkusanyiko wa kila aina iliyopo katika ufumbuzi wa 0.010- M wa asidi ya phthalic, C 6 H 4 (CO 2 H) 2.
S15.5.3
\(\ce{C6H4(CO2H)2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H4(CO2H)(CO2)-}(aq) \hspace{20px} K_\ce{a}=1.1×10^{−3}\)
\(\ce{C6H4(CO2H)(CO2)}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H4(CO2)2^2-}(aq) \hspace{20px} K_\ce{a}=3.9×10^{−6}\)
[C 6 H 4 (CO 2 H) 2] 7.2 × 10 -3 M, [C 6 H 4 (CO 2 H) (CO 2 H) -] = [H 3 O +] 2.8 × 10 ¯ 3 M,\(\ce{[C6H4(CO2)2^2- ]}\) 3.9 × 10 -6 M, [OH -] 3.6 × 10 -12 M
Q15.5.4
Asidi ya salicylic, HOC 6 H 4 CO 2 H, na derivatives zake zimetumika kama kupunguza maumivu kwa muda mrefu. Asidi ya salicylic hutokea kwa kiasi kidogo katika majani, gome, na mizizi ya mimea fulani (hasa kihistoria katika gome la mti wa Willow). Extracts ya mimea hii imetumika kama dawa kwa karne nyingi. Asidi ilikuwa ya kwanza pekee katika maabara mwaka 1838.
- Vikundi vyote viwili vya kazi vya asidi salicylic ionize ndani ya maji, na K a = 1.0 × 10 -3 kwa kundi la —CO 2 H na 4.2 × 10 -13 kwa kundi la -OH. Je, ni pH ya suluhisho iliyojaa ya asidi (umumunyifu = 1.8 g/L).
- Aspirini iligunduliwa kama matokeo ya jitihada za kuzalisha derivative ya asidi salicylic ambayo haiwezi kuwa inakera tumbo la tumbo. Aspirini ni asidi acetylsalicylic, CH 3 CO 2 C 6 H 4 CO 2 H. -CO 2 H kundi kazi bado ni sasa, lakini asidi yake ni kupunguzwa, K = 3.0 × 10 -4. Je, ni pH ya suluhisho la aspirini yenye ukolezi sawa na ufumbuzi uliojaa wa asidi salicylic (Angalia Sehemu ya a).
- Chini ya hali fulani, aspirini humenyuka na maji na hufanya suluhisho la asidi salicylic na asidi asidi:
\[\ce{CH3CO2C6H4CO2H}(aq)+\ce{H2O}(l)⟶\ce{HOC6H4CO2H}(aq)+\ce{CH3CO2H}(aq)\]
- Ni ipi kati ya asidi salicylic asidi au asidi asidi hutoa ions zaidi ya hidronium katika suluhisho hilo?
- Je, ni viwango vya molekuli na ions katika suluhisho zinazozalishwa na hidrolisisi ya 0.50 g ya aspirini kufutwa katika maji ya kutosha kutoa 75 ml ya suluhisho?
Q15.5.5
Ioni The - ni spishi ya amphiprotiki; inaweza kutenda kama asidi au msingi.
- Je, ni K a kwa mmenyuko wa asidi ya The - na H 2 O?
- K b ni nini kwa majibu ambayo kazi ya The - kama msingi katika maji?
- Onyesha ikiwa ionization ya pili ya H 2 Te inaweza kupuuzwa katika hesabu ya [The -] katika suluhisho la 0.10 M la H 2 Te.
S15.5.5
- \(K_{\ce a2}=1×10^{−5};\)
- \(K_\ce{b}=4.3×10^{−12};\)
- \(\ce{\dfrac{[Te^2- ][H3O+]}{[HTe- ]}}=\dfrac{(x)(0.0141+x)}{(0.0141−x)}≈\dfrac{(x)(0.0141)}{0.0141}=1×10^{−5}\). Kutatua kwa x hutoa 1 × 10 -5 M. Kwa hiyo, ikilinganishwa na 0.014 M, thamani hii ni duni (0.071%).
14.6: Vikwazo
Q14.6.1
Eleza kwa nini buffer inaweza kuwa tayari kutoka mchanganyiko wa NH 4 Cl na NaOH lakini si kutoka NH 3 na NaOH.
Q14.6.2
Eleza kwa nini pH haibadilika kwa kiasi kikubwa wakati kiasi kidogo cha asidi au msingi kinaongezwa kwenye suluhisho ambalo lina kiasi sawa cha asidi H 3 PO 4 na chumvi ya msingi wake wa conjugate NaH 2 PO 4.
S14.6.2
Zaidi ya H 3 O + huondolewa hasa na majibu:
\(\ce{H3O+}(aq)+\ce{H2PO4-}(aq)⟶\ce{H3PO4}(aq)+\ce{H2O}(l)\)Msingi wa ziada huondolewa na majibu:\(\ce{OH-}(aq)+\ce{H3PO4}(aq)⟶\ce{H2PO4-}(aq)+\ce{H2O}(l)\)
Q14.6.3
Eleza kwa nini pH haibadilika kwa kiasi kikubwa wakati kiasi kidogo cha asidi au msingi kinaongezwa kwenye suluhisho ambalo lina kiasi sawa cha msingi NH 3 na chumvi ya asidi yake ya conjugate NH 4 Cl.
Q14.6.4
Je, ni [H 3 O +] katika suluhisho la 0.25 M CH 3 CO 2 H na 0.030 M NaCh 3 CO 2?
\(\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−5}\)
S14.6.4
[H 3 O +] = 1.5 × 10 -4 M
Q14.6.5
Je, ni [H 3 O +] katika suluhisho la 0.075 M HNO 2 na 0.030 M nano 2?
S14.6.6
\(\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) \hspace{20px} K_\ce{a}=4.5×10^{−5}\)Q14.6.6
Je, ni [OH -] katika suluhisho la 0.125 M CH 3 NH 2 na 0.130 M CH 3 NH 3 Cl?
S14.6.6
\(\ce{CH3NH2}(aq)+\ce{H2O}(l)⇌\ce{CH3NH3+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=4.4×10^{−4}\)[OH -] = 4.2 × 10 -4 M
Q14.6.7
Je, ni [OH -] katika suluhisho la 1.25 M NH 3 na 0.78 M NH 4 NO 3?
S14.6.7
\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=1.8×10^{−5}\)Q14.6.8
Ni mkusanyiko gani wa NH 4 NO 3 inahitajika kufanya [OH -] = 1.0 × 10 -5 katika ufumbuzi wa 0.200- M wa NH 3?
S14.6.8
[NH 4 NO 3] = 0.36 M
Q14.6.9A
Ni mkusanyiko gani wa NaF inahitajika kufanya [H 3 O +] = 2.3 × 10 -4 katika ufumbuzi wa 0.300- M wa HF?
Q14.6.9B
Athari gani juu ya mkusanyiko wa asidi asetiki, ioni hidronium, na ioni ya acetate wakati zifuatazo zinaongezwa kwa ufumbuzi wa buffer ya asidi ya asidi sawa ya asidi asetiki na acetate ya sodiamu:
- HCl
- KCH 3 CO 2
- NaCl
- KOH
- CH 3 CO 2 H
S14.6.10
- HCl iliyoongezwa itaongeza mkusanyiko wa H 3 O + kidogo, ambayo itachukua hatua\(\ce{CH3CO2-}\) na kuzalisha CH 3 CO 2 H katika mchakato. Hivyo,\(\ce{[CH3CO2- ]}\) hupungua na [CH 3 CO 2 H] huongezeka.
- KCH 3 CO 2 iliyoongezwa itaongeza mkusanyiko\(\ce{[CH3CO2- ]}\) ambao utaitikia na H 3 O + na kuzalisha CH 3 CO 2 H katika mchakato. Hivyo, [H 3 O +] hupungua kidogo na [CH 3 CO 2 H] huongezeka.
- NaCl iliyoongezwa haitakuwa na athari kwenye mkusanyiko wa ions.
- KOH iliyoongezwa itazalisha OH - ions, ambayo itaitikia na H 3 O +, hivyo kupunguza [H 3 O +]. Baadhi ya ziada ya CH 3 CO 2 H yatatenganisha, huzalisha\(\ce{[CH3CO2- ]}\) ions katika mchakato. Hivyo, [CH 3 CO 2 H] hupungua kidogo na\(\ce{[CH3CO2- ]}\) huongezeka.
- CH 3 CO 2 H iliyoongezwa itaongeza mkusanyiko wake, na kusababisha zaidi ya kujitenga na kuzalisha zaidi\(\ce{[CH3CO2- ]}\) na H 3 O + katika mchakato. Hivyo, [H 3 O +] huongezeka kidogo na\(\ce{[CH3CO2- ]}\) huongezeka.
Q14.6.11
Je! Ni athari gani juu ya mkusanyiko wa amonia, ioni ya hidroksidi, na ioni ya amonia wakati zifuatazo zinaongezwa kwenye ufumbuzi wa msingi wa buffer wa viwango sawa vya amonia na nitrati ya amonia:
- KI
- NH 3
- HI
- NaOH
- NH 4 Cl
Je, itakuwa pH ya suluhisho la buffer iliyoandaliwa kutoka 0.20 mol NH 3, 0.40 mol NH 4 NO 3, na maji ya kutosha kutoa 1.00 L ya suluhisho?
pH = 8.95
Tumia pH ya suluhisho la buffer iliyoandaliwa kutoka 0.155 mol ya asidi ya fosforasi, 0.250 mole ya KH 2 PO 4, na maji ya kutosha kufanya 0.500 L ya suluhisho.
Ni kiasi gani imara NaCh 3 CO 2 •3H 2 O lazima iongezwe kwa 0.300 L ya ufumbuzi wa asidi ya asidi ya 0.50- M ili kutoa buffer na pH ya 5.00? (Kidokezo: Fikiria mabadiliko kidogo katika kiasi kama imara imeongezwa.)
37 g (0.27 mol)
Masi gani ya NH 4 Cl lazima iongezwe kwa 0.750 L ya ufumbuzi wa 0.100- M wa NH 3 ili kutoa suluhisho la buffer na pH ya 9.26? (Kidokezo: Fikiria mabadiliko kidogo katika kiasi kama imara imeongezwa.)
Q14.6.1
Suluhisho la buffer linatayarishwa kutoka kwa kiasi sawa cha asidi ya asidi 0.200 M na acetate ya sodiamu 0.600 M. Tumia 1.80 × 10 -5 kama K a kwa asidi ya asidi.
- PH ya suluhisho ni nini?
- Je! Suluhisho la tindikali au la msingi?
Q14.6.1
Je, ni pH ya suluhisho inayosababisha wakati 3.00 ml ya 0.034 M HCl imeongezwa kwa 0.200 L ya buffer ya awali?
- pH = 5.222;
- Suluhisho ni tindikali. (c) pH = 5.221
Q14.6.1
Sampuli ya 5.36—g ya NH 4 Cl iliongezwa kwa 25.0 ml ya 1.00 M NaOH na suluhisho lililosababisha limeongezwa hadi 0.100 L.
- PH ya ufumbuzi huu wa buffer ni nini?
- Je! Suluhisho la tindikali au la msingi?
- Je, ni pH ya suluhisho inayosababisha wakati 3.00 ml ya 0.034 M HCl imeongezwa kwenye suluhisho?
Ni asidi gani katika [kiungo] inayofaa zaidi kwa ajili ya maandalizi ya suluhisho la buffer na pH ya 3.1? Eleza uchaguzi wako.
Ili kuandaa buffer bora kwa asidi dhaifu HA na chumvi yake, uwiano\(\dfrac{\ce{[H3O+]}}{K_\ce{a}}\) unapaswa kuwa karibu na 1 iwezekanavyo kwa hatua ya ufanisi ya buffer. Mkusanyiko wa [H 3 O +] katika buffer ya pH 3.1 ni [H 3 O +] = 10 -3.1 = 7.94 × 10 -4 M
Sasa tunaweza kutatua kwa K a ya asidi bora kama ifuatavyo:\(\dfrac{\ce{[H3O+]}}{K_\ce{a}}=1\)
\(K_\ce{a}=\dfrac{\ce{[H3O+]}}{1}=7.94×10^{−4}\)
Katika [kiungo], asidi iliyo karibu na K a hadi 7.94 × 10 -4 ni HF, na K a ya 7.2 × 10 -4.Ni asidi gani katika [kiungo] inayofaa zaidi kwa ajili ya maandalizi ya suluhisho la buffer na pH ya 3.7? Eleza uchaguzi wako.
Ni msingi gani katika [kiungo] unaofaa zaidi kwa ajili ya maandalizi ya suluhisho la buffer na pH ya 10.65? Eleza uchaguzi wako.
Kwa buffers na PHS> 7, unapaswa kutumia msingi dhaifu na chumvi yake. Buffer yenye ufanisi zaidi itakuwa na uwiano\(\dfrac{\ce{[OH- ]}}{K_\ce{b}}\) ambao ni karibu na 1 iwezekanavyo. PoH ya buffer ni 14.00 - 10.65 = 3.35. Kwa hiyo, [OH -] ni [OH -] = 10 -poh = 10 -3.35 = 4.467 × 10 -4 M.
Sasa tunaweza kutatua K b ya msingi bora kama ifuatavyo:\(\dfrac{\ce{[OH- ]}}{K_\ce{b}}=1\) K b = [OH -] = 4.47 × 10 -4 Katika [kiungo], msingi na K b karibu na 4.47 × 10 -4 ni CH 3 NH 2, na K b = 4.4 × 10 -4.Ni msingi gani katika [kiungo] unaofaa zaidi kwa ajili ya maandalizi ya suluhisho la buffer na pH ya 9.20? Eleza uchaguzi wako.
Q14.6.4
Saccharin, C 7 H 4 NSO 3 H, ni asidi dhaifu (K = 2.1 × 10 ї 2). Kama 0.250 L ya chakula cola na pH buffered ya 5.48 iliandaliwa kutoka 2.00 × 10 -3 g ya saccharide sodium, Na (C 7 H 4 NSO 3), ni nini viwango vya mwisho vya saccharine na saccharide sodiamu katika suluhisho?
S14.6.4
Masi ya molar ya saccharide ya sodiamu ni 205.169 g/mol. Kutumia vifupisho HA kwa saccharin na NaA kwa saccharide ya sodiamu idadi ya moles ya NaA katika suluhisho ni:
9.75 × 10 -6 mol. Hii ionizes awali kuunda ions saccharin, A-, na: [A -] = 3.9 × 10 -5 MQ14.6.5
Je, ni pH ya 1.000 L ya suluhisho la 100.0 g ya asidi glutamic (C 5 H 9 NO 4, asidi diprotic; K 1 = 8.5 × 10 -5, K 2 = 3.39 × 10 -10) ambayo imeongezwa 20.0 g ya NaOH wakati maandalizi ya glutamat monosodium, wakala ladha? PH ni nini wakati hasa 1 mol ya NaOH kwa mole ya asidi imeongezwa?
14.7: Titrations ya Asidi-Msingi
Q14.7.1
Eleza jinsi ya kuchagua kiashiria sahihi cha asidi-msingi kwa titration ya msingi dhaifu na asidi kali.
S14.7.1
Katika hatua ya ulinganifu katika titration ya msingi dhaifu na asidi kali, suluhisho la kusababisha ni tindikali kidogo kutokana na kuwepo kwa asidi conjugate. Kwa hiyo, chagua kiashiria kinachobadilisha rangi katika aina ya tindikali na mabano ya pH kwenye hatua ya ulinganifu. Methyl machungwa ni mfano mzuri.
Q14.7.2
Eleza kwa nini kiashiria cha asidi-msingi kinabadilisha rangi juu ya maadili mbalimbali ya pH badala ya pH maalum.
Q14.7.3
Kwa nini tunaweza kupuuza mchango wa maji kwa viwango vya H 3 O + katika ufumbuzi wa asidi zifuatazo:
- 0.0092 M ChLo, asidi dhaifu
- 0.0810 M HCN, asidi dhaifu
- 0.120 M\(\ce{Fe(H2O)6^2+}\) asidi dhaifu, K = 1.6 × 10 -7
lakini si mchango wa maji kwa mkusanyiko wa OH -?
S14.7.3
Katika suluhisho la asidi, chanzo pekee cha OH - ions ni maji. Tunatumia K w kuhesabu mkusanyiko. Ikiwa mchango kutoka kwa maji ulipuuzwa, ukolezi wa OH - utakuwa sifuri.
Q14.7.4
Tunaweza kupuuza mchango wa maji kwa mkusanyiko wa OH - katika suluhisho la besi zifuatazo:
0.0784 M C 6 H 5 NH 2, msingi dhaifu
0.11 M (CH 3) 3 N, msingi dhaifu
lakini si mchango wa maji kwa mkusanyiko wa H 3 O +?
Q14.7.5
Chora curve kwa mfululizo wa ufumbuzi wa HF. Plot [H 3 O +] jumla juu ya mhimili wima na mkusanyiko jumla ya HF (jumla ya viwango vya wote ionized na nonionized HF molekuli) juu ya mhimili usawa. Hebu mkusanyiko wa jumla wa HF hutofautiana kutoka 1 × 10 -10 M hadi 1 × 10 -2 M.
![Grafu inavyoonyeshwa ambayo ina jina la “Mpango wa [H subscript 3 O superscript +] Dhidi ya [H F].” Mhimili usio na usawa umeandikwa “[H F], M.” Mhimili huanza saa 10 superscript hasi 10 na inajumuisha alama kila 10 superscript vitengo 2 hadi 1.0. Mhimili wa wima umeandikwa “[H subscript 3 O superscript plus], M” na huanza saa 10 superscript hasi 10 na huongezeka kwa 10 superscript 2 hadi 1.0. Curve nyeusi huanza upande wa kushoto wa grafu saa (10 superscript hasi 10, 10 superscript hasi 7). Mstari unaendelea kwa usawa kwa thamani ya mhimili wa usawa wa 10 superscript hasi 8. Baada ya hayo, mstari huongezeka kwa kasi kwa kiwango cha kutosha kwa thamani zaidi ya 10 superscript hasi 3 kwa thamani ya usawa wa mhimili wa 10 superscript hasi 2.](http://cnx.org/resources/bbd3359c4d4d301b0f4471bd309310444779db56/CNX_Chem_14_07_Exercise5_img.jpg)
Q14.7.6
Chora Curve sawa na ile inavyoonekana katika Kielelezo kwa mfululizo wa ufumbuzi wa NH 3. Plot [OH -] kwenye mhimili wima na mkusanyiko wa jumla wa NH 3 (wote ionized na nonionized NH 3 molekuli) kwenye mhimili usawa. Hebu mkusanyiko wa jumla wa NH 3 hutofautiana kutoka 1 × 10 -10 M hadi 1 × 10 -2 M.
Q14.7.7
Tumia pH katika pointi zifuatazo katika titration ya 40 ml (0.040 L) ya 0.100 M asidi barbituric (K = 9.8 × 10 -5) na 0.100 M KOH.
- hakuna KOH aliongeza
- 20 ml ya ufumbuzi wa KOH aliongeza
- 39 ml ya ufumbuzi wa KOH aliongeza
- 40 ml ya ufumbuzi wa KOH aliongeza
- 41 ml ya ufumbuzi wa KOH aliongeza
S14.7.7
- pH = 2.50;
- pH = 4.01;
- pH = 5.60;
- pH = 8.35;
- pH = 11.08
Q14.7.8
Kiashiria cha dinitrophenol ni asidi yenye K a ya 1.1 × 10 -4. Katika ufumbuzi wa 1.0 × 10 -4 - M, hauna rangi katika asidi na njano katika msingi. Tumia kiwango cha pH juu ya ambayo huenda kutoka 10% ionized (isiyo na rangi) hadi 90% ionized (njano).


