14.6: Vikwazo
- Page ID
- 176944
- Eleza muundo na kazi ya buffers asidi-msingi
- Tumia pH ya buffer kabla na baada ya kuongeza asidi iliyoongezwa au msingi
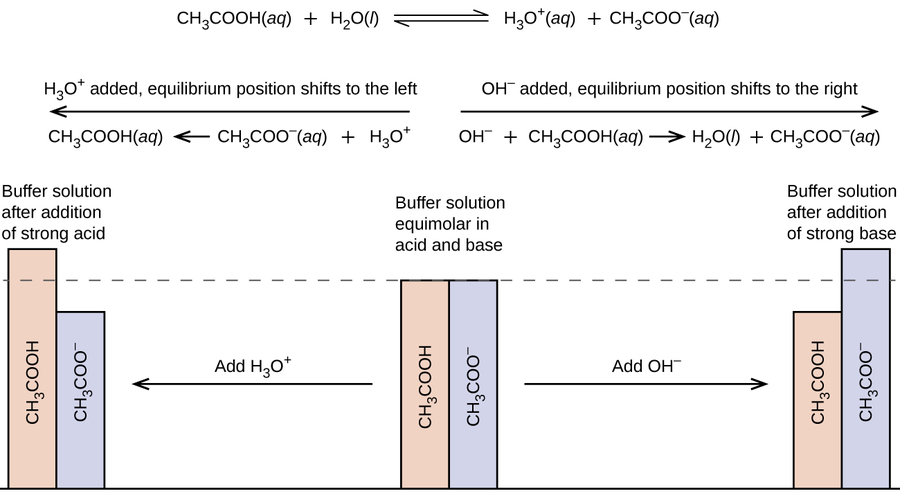
Mchanganyiko wa asidi dhaifu na msingi wake wa conjugate (au mchanganyiko wa msingi dhaifu na asidi yake ya conjugate) inaitwa suluhisho la buffer, au buffer. Ufumbuzi wa Buffer hupinga mabadiliko katika pH wakati kiasi kidogo cha asidi kali au msingi wa nguvu huongezwa (Kielelezo\(\PageIndex{1}\)). Suluhisho la asidi ya asidi (\(\ce{CH3COOH}\)na acetate ya sodiamu\(\ce{CH3COONa}\)) ni mfano wa buffer ambayo ina asidi dhaifu na chumvi yake. Mfano wa buffer ambayo ina msingi dhaifu na chumvi yake ni suluhisho la amonia (\(\ce{NH3(aq)}\)) na kloridi ya amonia (\(\ce{NH4Cl(aq)}\)).

Jinsi Buffers Kazi
Mchanganyiko wa asidi asetiki na acetate ya sodiamu ni tindikali kwa sababu K a ya asidi asetiki ni kubwa kuliko K b ya acetate yake ya msingi ya conjugate. Ni buffer kwa sababu ina asidi dhaifu na chumvi yake. Kwa hiyo, inachukua kuweka mkusanyiko wa ioni ya hidronium (na pH) karibu mara kwa mara kwa kuongeza kiasi kidogo cha asidi kali au msingi wa nguvu. Ikiwa tunaongeza msingi kama vile hidroksidi ya sodiamu, ions za hidroksidi huguswa na ions chache za hidronium zilizopo. Kisha zaidi ya asidi ya asidi humenyuka na maji, kurejesha mkusanyiko wa ioni ya hidroniamu karibu na thamani yake ya awali:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
PH inabadilika kidogo sana. Ikiwa tunaongeza asidi kama asidi hidrokloriki, ions nyingi za hidronium kutoka asidi hidrokloriki huchanganya na ions za acetate, na kutengeneza molekuli ya asidi ya asidi:
\[\ce{H3O+}(aq)+\ce{CH3CO2-}(aq)⟶\ce{CH3CO2H}(aq)+\ce{H2O}(l) \nonumber \]
Kwa hiyo, kuna ongezeko kidogo sana katika mkusanyiko wa ioni ya hydronium, na pH bado haibadilika (Kielelezo\(\PageIndex{2}\)).
Mchanganyiko wa amonia na kloridi ya amonia ni ya msingi kwa sababu K b kwa amonia ni kubwa kuliko K a kwa ioni ya amonia. Ni buffer kwa sababu pia ina chumvi ya msingi dhaifu. Ikiwa tunaongeza msingi (ions hidroksidi), ions za amonia katika buffer huguswa na ioni za hidroksidi kuunda amonia na maji na kupunguza mkusanyiko wa ioni ya hidroksidi karibu na thamani yake ya awali:
\[\ce{NH4+}(aq)+\ce{OH-}(aq)⟶\ce{NH3}(aq)+\ce{H2O}(l) \nonumber \]
Ikiwa tunaongeza asidi (ioni za hidronium), molekuli za amonia katika mchanganyiko wa buffer huguswa na ioni za hidronium ili kuunda ioni za amonia na kupunguza mkusanyiko wa ioni ya hidronium karibu na thamani yake ya awali:
\[\ce{H3O+}(aq)+\ce{NH3}(aq)⟶\ce{NH4+}(aq)+\ce{H2O}(l) \nonumber \]
Sehemu tatu za mfano zifuatazo zinaonyesha mabadiliko katika pH ambayo yanaambatana na kuongeza ya msingi kwa ufumbuzi wa buffered ya asidi dhaifu na ufumbuzi unbuffered ya asidi kali.
Vikwazo vya Acetate hutumiwa katika masomo ya biochemical ya enzymes na vipengele vingine vya kemikali vya seli ili kuzuia mabadiliko ya pH ambayo yanaweza kubadilisha shughuli za biochemical ya misombo hii.
- Tumia pH ya buffer ya acetate ambayo ni mchanganyiko na asidi 0.10 M asidi na 0.10 M acetate ya sodiamu.
- Tumia pH baada ya 1.0 ml ya 0.10 M NaOH imeongezwa kwa 100 ml ya buffer hii, kutoa suluhisho kwa kiasi cha 101 ml.
Suluhisho
- Tumia pH ya buffer ya acetate ambayo ni mchanganyiko na asidi 0.10 M asidi na 0.10 M acetate ya sodiamu.
Kuamua pH ya ufumbuzi wa buffer tunatumia hesabu ya kawaida ya usawa (kama ilivyoonyeshwa katika Mifano ya awali):
- Kuamua mwelekeo wa mabadiliko. Msawazo katika mchanganyiko wa H 3 O +,\(\ce{CH3CO2-}\), na CH 3 CO 2 H ni:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
Mara kwa mara ya usawa kwa CH 3 CO 2 H haipatikani, kwa hiyo tunaiangalia kwenye Jedwali E1: K a = 1.8 × 10 -5. Pamoja na [CH 3 CO 2 H]\(\ce{[CH3CO2- ]}\) = 0.10 M na [H 3 O +] = ~0 M, mabadiliko ya majibu kwa haki ya kuunda H 3 O +.
- Kuamua viwango vya x na usawa. Jedwali la mabadiliko na viwango ifuatavyo:
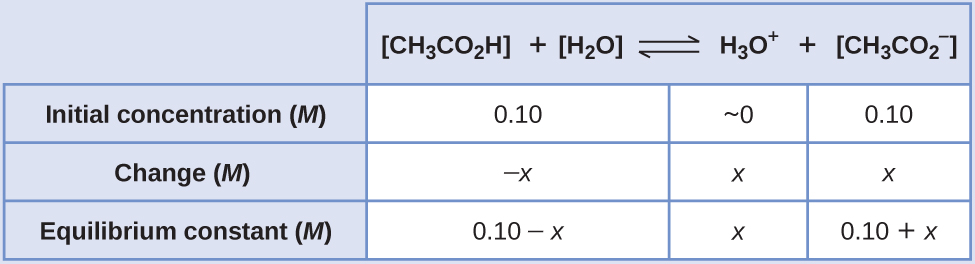
- Kuamua mwelekeo wa mabadiliko. Msawazo katika mchanganyiko wa H 3 O +,\(\ce{CH3CO2-}\), na CH 3 CO 2 H ni:
- Kutatua kwa x na viwango vya usawa. Tunapata:
\[x=1.8×10^{−5}\:M \nonumber \]
- na
\[\ce{[H3O+]}=0+x=1.8×10^{−5}\:M \nonumber \]
Hivyo:\[\mathrm{pH=−log[H_3O^+]=−log(1.8×10^{−5})} \nonumber \]
\[=4.74 \nonumber \]
4. Angalia kazi. Ikiwa tunahesabu viwango vyote vya usawa, tunaona kwamba thamani ya usawa wa mgawo wa mmenyuko, Q = K a.
(b) Kuhesabu pH baada 1.0 ml ya 0.10 M NaOH ni aliongeza kwa 100 ml ya buffer hii, kutoa suluhisho kwa kiasi cha 101 ml.
Kwanza, tunahesabu viwango vya mchanganyiko wa kati kutokana na mmenyuko kamili kati ya asidi katika buffer na msingi ulioongezwa. Kisha tunaamua viwango vya mchanganyiko katika usawa mpya:
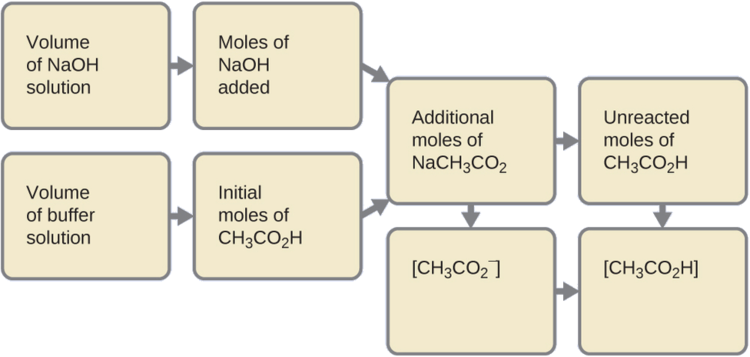
- Kuamua moles ya NaOH. Milita moja (0.0010 L) ya 0.10 M NaOH ina:
\[\mathrm{0.0010\cancel{L}×\left(\dfrac{0.10\:mol\: NaOH}{1\cancel{L}}\right)=1.0×10^{−4}\:mol\: NaOH} \nonumber \]
- Kuamua moles ya CH 2 CO 2 H. kabla ya majibu, 0.100 L ya ufumbuzi wa buffer ina:
\[\mathrm{0.100\cancel{L}×\left(\dfrac{0.100\:mol\:CH_3CO_2H}{1\cancel{L}}\right)=1.00×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
- Kutatua kwa kiasi cha NaCh 3 CO 2 zinazozalishwa. 1.0 × 10 -4 mol ya NaOH neutralizes 1.0 × 10 -4 mol ya CH 3 CO 2 H, na kuacha:
\[\mathrm{(1.0×10^{−2})−(0.01×10^{−2})=0.99×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
na kuzalisha 1.0 × 10 -4 mol ya NaCH 3 CO 2. Hii inafanya jumla ya:
[\ hesabu {(1.0×10^ {ї2}) + (0.01×10^ {ї2}) =1.01×10^ {ї2}\: mol\: Nach_3CO_2}\ hakuna idadi\]
4. Pata molarity ya bidhaa. Baada ya majibu, CH 3 CO 2 H na NaCh 3 CO 2 zinazomo katika 101 ml ya suluhisho la kati, hivyo:
\[\ce{[CH3CO2H]}=\mathrm{\dfrac{9.9×10^{−3}\:mol}{0.101\:L}}=0.098\:M \nonumber \]
\[\ce{[NaCH3CO2]}=\mathrm{\dfrac{1.01×10^{−2}\:mol}{0.101\:L}}=0.100\:M \nonumber \]
Sasa tunahesabu pH baada ya ufumbuzi wa kati, ambayo ni 0.098 M katika CH 3 CO 2 H na 0.100 M katika NaCh 3 CO 2, inakuja kwa usawa. Hesabu ni sawa na ile katika sehemu (a) ya mfano huu:

Mfululizo huu wa mahesabu hutoa pH = 4.75. Hivyo, kuongeza kwa msingi haubadilika pH ya suluhisho.
(c) Kwa kulinganisha, mahesabu ya pH baada 1.0 ml ya 0.10 M NaOH ni aliongeza kwa 100 ml ya ufumbuzi unbuffered ufumbuzi na pH ya 4.74 (1.8 × 10 -5 - M ufumbuzi wa HCl). Kiasi cha suluhisho la mwisho ni 101 ml.
Suluhisho
Hii 1.8 × 10 -5 - M ufumbuzi wa HCl ina sawa hidronium ion mkusanyiko kama 0.10- M ufumbuzi wa asetiki acid-sodium acetate buffer ilivyoelezwa katika sehemu (a) ya mfano huu. Suluhisho lina:
\(\mathrm{0.100\:L×\left(\dfrac{1.8×10^{−5}\:mol\: HCl}{1\:L}\right)=1.8×10^{−6}\:mol\: HCl} \)
Kama inavyoonekana katika sehemu (b), 1 ml ya 0.10 M NaOH ina 1.0 × 10 -4 mol ya NaOH. Wakati ufumbuzi wa NaOH na HCl umechanganywa, HCl ni reagent kikwazo katika mmenyuko. HCl yote humenyuka, na kiasi cha NaOH iliyobaki ni:
\( (1.0×10^{−4})−(1.8×10^{−6})=9.8×10^{−5}\:M \)
Mkusanyiko wa NaOH ni:
\(\dfrac{9.8×10^{−5}\:M\:\ce{NaOH}}{0.101\:\ce{L}}=9.7×10^{−4}\:M \)
PoH ya suluhisho hili ni:
\(\mathrm{pOH=−log[OH^- ]=−log(9.7×10^{−4})=3.01} \)PH ni:
\(\mathrm{pH=14.00−pOH=10.99} \)
PH inabadilika kutoka 4.74 hadi 10.99 katika suluhisho hili lisilo na kipimo. Hii inalinganishwa na mabadiliko ya 4.74 hadi 4.75 yaliyotokea wakati kiasi sawa cha NaOH kiliongezwa kwenye suluhisho la buffered iliyoelezwa katika sehemu (b).
Onyesha kuwa kuongeza 1.0 ml ya 0.10 M HCl hubadilisha pH ya 100 ml ya suluhisho la 1.8 × 10 -5 M HCl kutoka 4.74 hadi 3.00.
- Jibu
-
PH ya awali ya 1.8 × 10 -5 M HCl; pH = -logi [H 3 O +] = -logi [1.8 × 10 -5] = 4.74
Moles ya H 3 O + aliongeza kwa kuongeza 1.0 ml ya 0.10 M HCl: 0.10 moles/L × 0.0010 L = 1.0 × 10 -4 moles; pH ya mwisho baada ya kuongeza 1.0 ml ya 0.10 M HCl:
\[\mathrm{pH=−log[H_3O^+]=−log\left(\dfrac{total\: moles\:H_3O^+}{total\: volume}\right)=−log\left(\dfrac{1.0×10^{−4}\:mol+1.8×10^{−6}\:mol}{101\:mL\left(\dfrac{1\:L}{1000\:mL}\right)}\right)=3.00} \nonumber \]
Buffer Uwezo
Ufumbuzi wa Buffer hauna uwezo usio na ukomo wa kuweka pH mara kwa mara (Kielelezo\(\PageIndex{3}\)). Kama sisi kuongeza msingi sana kwa buffer kwamba asidi dhaifu ni nimechoka, hakuna zaidi buffering hatua kuelekea msingi inawezekana. Kwa upande mwingine, kama sisi kuongeza ziada ya asidi, msingi dhaifu itakuwa nimechoka, na hakuna hatua zaidi buffering kuelekea asidi yoyote ya ziada itakuwa inawezekana. Kwa kweli, hatuhitaji hata kutolea nje yote ya asidi au msingi katika buffer kwa overwhelm yake; hatua yake buffering itapungua kwa kasi kama sehemu fulani inakaribia kupungua.

Kielelezo\(\PageIndex{3}\): rangi ya kiashiria (machungwa ya methyl) inaonyesha kwamba kiasi kidogo cha asidi kilichoongezwa kwenye suluhisho la pH 8 (beaker upande wa kushoto) huathiri kidogo mfumo wa buffered (katikati ya beaker). Hata hivyo, kiasi kikubwa cha asidi kinachozidi uwezo wa ufumbuzi wa suluhisho na pH hubadilika sana (beaker upande wa kulia). (mikopo: mabadiliko ya kazi na Mark Ott) Uwezo wa buffer ni kiasi cha asidi au msingi ambayo inaweza kuongezwa kwa kiasi fulani cha suluhisho la buffer kabla ya mabadiliko ya pH kwa kiasi kikubwa, kwa kawaida kwa kitengo kimoja. Uwezo wa buffer unategemea kiasi cha asidi dhaifu na msingi wake wa conjugate ambao ni katika mchanganyiko wa buffer. Kwa mfano, 1 L ya suluhisho yaani 1.0 M katika asidi asetiki na 1.0 M katika acetate ya sodiamu ina uwezo mkubwa wa buffer kuliko 1 L ya suluhisho ambayo ni 0.10 M katika asidi asetiki na 0.10 M katika acetate ya sodiamu ingawa ufumbuzi wote wana pH sawa. Suluhisho la kwanza lina uwezo zaidi wa buffer kwa sababu ina asidi zaidi ya asidi na ioni ya acetate.
Uchaguzi wa Mchanganyiko wa Buffer inayofaa
Kuna sheria mbili muhimu za kidole kwa kuchagua mchanganyiko wa buffer:
- Mchanganyiko mzuri wa buffer unapaswa kuwa na viwango sawa vya vipengele vyake vyote. Suluhisho la buffer kwa ujumla limepoteza manufaa yake wakati sehemu moja ya jozi ya buffer ni chini ya 10% ya nyingine. Kielelezo\(\PageIndex{4}\) kinaonyesha asidi asidi-acetate ion buffer kama msingi ni aliongeza. PH ya awali ni 4.74. Mabadiliko ya kitengo cha pH 1 hutokea wakati ukolezi wa asidi ya asidi umepungua hadi 11% ya mkusanyiko wa ioni ya acetate.
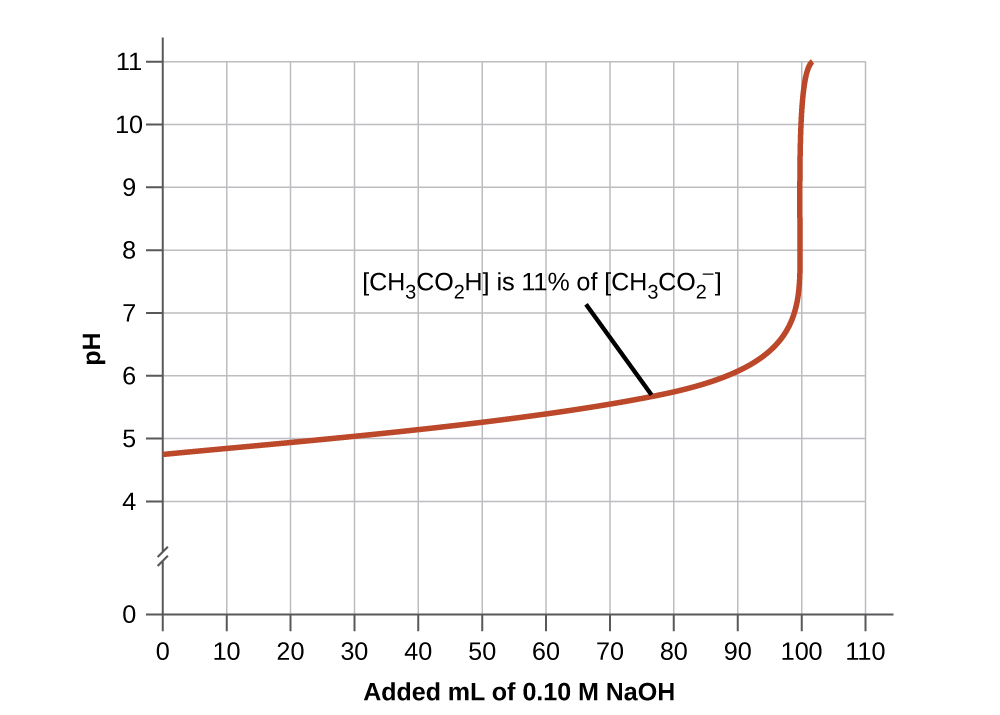
Kielelezo\(\PageIndex{4}\): Grafu, mfano wa hatua ya kupumua, inaonyesha mabadiliko ya pH kama kiasi cha ongezeko la ufumbuzi wa NaOH 0.10-M kinaongezwa kwa 100 ml ya suluhisho la buffer ambalo, awali,\([\ce{CH3CO2H}] = 0.10\: M\) na\(\ce{[CH3CO2^{-}]}=0.10\:M\).
- Asidi dhaifu na chumvi zao ni bora kama buffers kwa pH chini ya 7; besi dhaifu na chumvi zao ni bora kama buffers kwa PHs kubwa kuliko 7.
Damu ni mfano muhimu wa ufumbuzi buffered, na asidi kuu na ion kuwajibika kwa ajili ya hatua buffering kuwa asidi kaboni, H 2 CO 3, na ion bicarbonate,\(\ce{HCO3-}\). Wakati ziada ya ioni ya hidrojeni inaingia kwenye mkondo wa damu, huondolewa hasa na majibu:
\[\ce{H3O+}(aq)+\ce{HCO3-}(aq)⟶\ce{H2CO3}(aq)+\ce{H2O}(l) \nonumber \]
Wakati ziada ya ioni ya hidroksidi iko, huondolewa na majibu:
\[\ce{OH-}(aq)+\ce{H2CO3}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
PH ya damu ya binadamu inabakia karibu sana na 7.35, yaani, msingi kidogo. Tofauti ni kawaida chini ya 0.1 ya kitengo cha pH. Mabadiliko ya 0.4 ya kitengo cha pH ni uwezekano wa kuwa mbaya.
Henderson-Hasselbalch makadirio
Maneno ya mara kwa mara ya ionization kwa suluhisho la asidi dhaifu yanaweza kuandikwa kama:
\[K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}} \nonumber \]
Kupanga upya kutatua kwa [H 3 O +], tunapata:
\[\ce{[H3O+]}=K_\ce{a}×\ce{\dfrac{[HA]}{[A- ]}} \nonumber \]
Kuchukua logarithm hasi ya pande zote mbili za equation hii, tunawasili:
\[\mathrm{−log[H_3O^+]=−log\mathit{K}_a − log\dfrac{[HA]}{[A^- ]}} \nonumber \]
ambayo inaweza kuandikwa kama
\[\mathrm{pH=p\mathit{K}_a+log\dfrac{[A^- ]}{[HA]}} \nonumber \]
ambapo p K a ni hasi ya logarithm ya kawaida ya mara kwa mara ionization ya asidi dhaifu (p K a = -logi K a). Equation hii inahusiana pH, mara kwa mara ionization ya asidi dhaifu, na viwango vya asidi dhaifu na chumvi yake katika suluhisho la buffered. Wanasayansi mara nyingi hutumia maneno haya, inayoitwa makadirio ya Henderson-Hasselbalch, kuhesabu pH ya ufumbuzi wa buffer. Ni muhimu kutambua kwamba dhana ya “x ni ndogo” lazima iwe halali kutumia equation hii.
Lawrence Joseph Henderson (1878—1942) alikuwa daktari wa Marekani, mwanabiokemia na mwanafiziolojia, kwa jina chache tu kati ya shughuli zake nyingi. Alipata shahada ya matibabu kutoka Harvard na kisha alitumia miaka 2 kusoma huko Strasbourg, halafu sehemu ya Ujerumani, kabla ya kurudi kuchukua nafasi ya mhadhiri huko Harvard. Hatimaye akawa profesa huko Harvard na kufanya kazi huko maisha yake yote. Aligundua kuwa usawa wa asidi-msingi katika damu ya binadamu umewekwa na mfumo wa buffer uliofanywa na dioksidi kaboni iliyoharibiwa katika damu. Aliandika equation mwaka 1908 kuelezea mfumo wa buffer ya asidi kaboniki katika damu. Henderson alikuwa na maarifa mapana; pamoja na utafiti wake muhimu juu ya fiziolojia ya damu, pia aliandika juu ya marekebisho ya viumbe na fit yao na mazingira yao, juu ya sosholojia na juu ya elimu ya chuo kikuu. Pia alianzisha Maabara ya Uchovu, katika Shule ya Biashara ya Harvard, ambayo ilichunguza fiziolojia ya binadamu kwa lengo maalumu juu ya kazi katika sekta, mazoezi, na lishe.
Mwaka 1916, Karl Albert Hasselbalch (1874—1962), daktari na mwanakemia wa Denmark, alishiriki uandishi katika karatasi na Christian Bohr mwaka 1904 iliyoelezea athari ya Bohr, ambayo ilionyesha kuwa uwezo wa hemoglobini katika damu kumfunga na oksijeni ulihusishwa kinyume na asidi ya damu na mkusanyiko wa dioksidi kaboni. Kiwango cha pH kilianzishwa mwaka 1909 na Dane mwingine, Sørensen, na mwaka 1912, Hasselbalch alichapisha vipimo vya pH ya damu. Mwaka 1916, Hasselbalch alionyesha usawa wa Henderson kwa maneno ya logarithmic, kulingana na kiwango cha logarithmic cha pH, na hivyo equation ya Henderson-Hasselbalch ilizaliwa.
PH ya kawaida ya damu ya binadamu ni kuhusu 7.4. Mfumo wa buffer ya carbonate katika damu hutumia majibu yafuatayo ya usawa:
\[\ce{CO2}(g)+\ce{2H2O}(l)⇌\ce{H2CO3}(aq)⇌\ce{HCO3-}(aq)+\ce{H3O+}(aq) \nonumber \]
Mkusanyiko wa asidi ya kaboni, H 2 CO 3 ni takriban 0.0012 M, na mkusanyiko wa ioni ya carbonate ya hidrojeni\(\ce{HCO3-}\),, ni karibu 0.024 M. Kutumia equation ya Henderson-Hasselbalch na p K a ya asidi kaboniki kwenye joto la mwili, tunaweza kuhesabu pH ya damu:
\[\mathrm{pH=p\mathit{K}_a+\log\dfrac{[base]}{[acid]}=6.1+\log\dfrac{0.024}{0.0012}=7.4} \nonumber \]
Ukweli kwamba H 2 CO 3 mkusanyiko ni kiasi kikubwa chini kuliko ile ya\(\ce{HCO3-}\) ion inaweza kuonekana isiyo ya kawaida, lakini usawa huu ni kutokana na ukweli kwamba wengi wa mazao ya kimetaboliki yetu ambayo huingia damu yetu ni tindikali. Kwa hiyo, kuna lazima iwe na sehemu kubwa ya msingi kuliko asidi, ili uwezo wa buffer hautazidi.
Asidi ya Lactic huzalishwa katika misuli yetu tunapofanya mazoezi. Kama asidi lactic inaingia kwenye damu, inafutwa na\(\ce{HCO3-}\) ion, huzalisha H 2 CO 3. Enzyme kisha huharakisha kuvunjika kwa asidi ya kaboni ya ziada kwa dioksidi kaboni na maji, ambayo inaweza kuondolewa kwa kupumua. Kwa kweli, pamoja na madhara ya udhibiti wa mfumo wa buffering ya carbonate kwenye pH ya damu, mwili hutumia kupumua kudhibiti pH ya damu. Ikiwa pH ya damu itapungua sana, ongezeko la kupumua huondoa CO 2 kutoka damu kupitia mapafu inayoendesha mmenyuko wa usawa kama vile [H 3 O +] inapungua. Ikiwa damu ni alkali mno, kiwango cha chini cha pumzi huongeza mkusanyiko wa CO 2 katika damu, kuendesha gari mmenyuko wa usawa kwa njia nyingine, kuongeza [H +] na kurejesha pH inayofaa.
Muhtasari
Suluhisho iliyo na mchanganyiko wa asidi na msingi wake wa conjugate, au ya msingi na asidi yake ya conjugate, inaitwa suluhisho la buffer. Tofauti na kesi ya asidi, msingi, au suluhisho la chumvi, mkusanyiko wa ioni ya hidroniamu ya suluhisho la buffer haubadilika sana wakati kiasi kidogo cha asidi au msingi kinaongezwa kwenye suluhisho la buffer. Msingi (au asidi) katika buffer humenyuka na asidi iliyoongezwa (au msingi).
Mlinganyo muhimu
- p K a = -logi K a
- p K b = -logi K b
- \(\mathrm{pH=p\mathit{K}_a+\log\dfrac{[A^- ]}{[HA]}}\)
faharasa
- uwezo wa buffer
- kiasi cha asidi au msingi ambayo inaweza kuongezwa kwa kiasi cha suluhisho la buffer kabla ya pH yake inabadilika kwa kiasi kikubwa (kwa kawaida kwa kitengo kimoja cha pH)
- bafa
- mchanganyiko wa asidi dhaifu au msingi dhaifu na chumvi ya conjugate yake; pH ya buffer inakataa mabadiliko wakati kiasi kidogo cha asidi au msingi kinaongezwa
- Henderson-Hasselbalch equation
- equation kutumika kwa mahesabu ya pH ya ufumbuzi buffer
- Kuamua moles ya NaOH. Milita moja (0.0010 L) ya 0.10 M NaOH ina:


