14.3: Nguvu za Jamaa za Acids na Msingi
- Page ID
- 176928
- Tathmini nguvu za jamaa za asidi na besi kulingana na vipindi vyao vya ionization
- Rationalize mwenendo katika nguvu asidi-msingi kuhusiana na muundo Masi
- Kufanya mahesabu ya usawa kwa mifumo dhaifu ya asidi-msingi
Tunaweza cheo nguvu za asidi kwa kiwango ambacho wao ionize katika suluhisho la maji. Majibu ya asidi na maji hutolewa kwa maneno ya jumla:
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
Maji ni msingi ambao humenyuka na asidi\(\ce{HA}\),\(\ce{A^{−}}\) ni msingi wa conjugate wa asidi\(\ce{HA}\), na ion hidronium ni asidi conjugate ya maji. asidi nguvu mavuno 100% (au karibu sana hivyo) ya\(\ce{H3O+}\) na\(\ce{A^{−}}\) wakati asidi ionizes katika maji; Kielelezo\(\PageIndex{1}\) orodha asidi kadhaa nguvu. Asidi dhaifu hutoa kiasi kidogo cha\(\ce{H3O+}\) na\(\ce{A^{−}}\).
| sita kali kali | sita kali besi | ||
|---|---|---|---|
| \(\ce{HClO4}\) | asidi perchloric | \(\ce{LiOH}\) | lithiamu hidroxide |
| \(\ce{HCl}\) | asidi hidrokloriki | \(\ce{NaOH}\) | hidroksidi ya s |
| \(\ce{HBr}\) | asidi hydrobromic | \(\ce{KOH}\) | hidroksidi ya p |
| \(\ce{HI}\) | asidi hydroiodic | \(\ce{Ca(OH)2}\) | hidroksidi kalsi |
| \(\ce{HNO3}\) | asidi nitriki | \(\ce{Sr(OH)2}\) | hidroksidi ya stron |
| \(\ce{H2SO4}\) | asidi sulfuriki | \(\ce{Ba(OH)2}\) | hidroksidi ya bari |
Nguvu za jamaa za asidi zinaweza kuamua kwa kupima uwiano wao wa usawa katika ufumbuzi wa maji. Katika ufumbuzi wa mkusanyiko huo, asidi kali ionize kwa kiasi kikubwa, na hivyo mavuno viwango vya juu vya ions hidronium kuliko asidi dhaifu. Mara kwa mara ya usawa kwa asidi inaitwa mara kwa mara ya asidi-ionization, K a. Kwa majibu ya asidi\(\ce{HA}\):
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
tunaandika equation kwa mara kwa mara ionization kama:
\[K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}} \nonumber \]
ambapo viwango ni wale katika msawazo. Kama ilivyoelezwa katika sehemu ya constants msawazo, ingawa maji ni reactant katika mmenyuko, ni kutengenezea pia, hivyo shughuli zake ina thamani ya 1, ambayo haina mabadiliko ya thamani ya\(K_a\).
Ni kosa la kawaida kudai kwamba mkusanyiko wa molar wa kutengenezea ni kwa namna fulani kushiriki katika sheria ya usawa. Hitilafu hii ni matokeo ya kutokuelewana kwa thermodynamics ya suluhisho. Kwa mfano, mara nyingi hudaiwa kuwa K a = K eq [H 2 O] kwa ufumbuzi wa maji. Equation hii si sahihi kwa sababu ni tafsiri ya makosa ya equation sahihi K a = K eq (\(\textit{a}_{H_2O}\)). Kwa sababu\(\textit{a}_{H_2O}\) = 1 kwa suluhisho la kuondokana, K = K eq (1), au K = K eq.
Ya asidi kubwa, mkusanyiko mkubwa\(\ce{H3O+}\) na\(\ce{A^{−}}\) kuhusiana na ukolezi wa asidi isiyo na nonionized,\(\ce{HA}\).\(K_a\) Hivyo asidi yenye nguvu ina mara kwa mara ya ionization kubwa kuliko asidi dhaifu. Vipindi vya ionization huongezeka kama nguvu za ongezeko la asidi.
Takwimu zifuatazo juu ya vipindi vya asidi-ionization zinaonyesha utaratibu wa nguvu za asidi:\(\ce{CH3CO2H} < \ce{HNO2} < \ce{HSO4-}\)
\[ \begin{aligned} \ce{CH3CO2H}(aq) + \ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \quad &K_\ce{a}=1.8×10^{−5} \\[4pt] \ce{HNO2}(aq)+\ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) &K_\ce{a}=4.6×10^{-4} \\[4pt] \ce{HSO4-}(aq)+\ce{H2O}(l) &⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) & K_\ce{a}=1.2×10^{−2} \end{aligned} \nonumber \]
Kipimo kingine cha nguvu ya asidi ni ionization yake ya asilimia. Asilimia ionization ya asidi dhaifu ni uwiano wa mkusanyiko wa asidi ionized kwa mkusanyiko wa asidi ya awali, mara 100:
\[\% \:\ce{ionization}=\ce{\dfrac{[H3O+]_{eq}}{[HA]_0}}×100\% \label{PercentIon} \]
Kwa sababu uwiano unajumuisha mkusanyiko wa awali, ionization ya asilimia kwa suluhisho la asidi dhaifu iliyotolewa inatofautiana kulingana na ukolezi wa awali wa asidi, na kwa kweli hupungua kwa kuongezeka kwa ukolezi wa asidi.
Tumia asilimia ionization ya ufumbuzi wa 0.125- M ya asidi ya nitrous (asidi dhaifu), na pH ya 2.09.
Suluhisho
Asilimia ionization kwa asidi ni:
\[\ce{\dfrac{[H3O+]_{eq}}{[HNO2]_0}}×100 \nonumber \]
Equation kemikali kwa ajili ya dissociation ya asidi nitrous ni:
\[\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{NO2-}(aq)+\ce{H3O+}(aq). \nonumber \]
Tangu\(10^{−pH} = \ce{[H3O+]}\), tunaona kwamba\(10^{−2.09} = 8.1 \times 10^{−3}\, M\), ili asilimia ionization (Equation\ ref {Percent}) ni:
\[\dfrac{8.1×10^{−3}}{0.125}×100=6.5\% \nonumber \]
Kumbuka, logarithm 2.09 inaonyesha mkusanyiko wa ioni ya hydronium na takwimu mbili tu muhimu.
Tumia asilimia ionization ya ufumbuzi wa 0.10 M ya asidi ya asidi na pH ya 2.89.
- Jibu
-
1.3% ionized
Tunaweza kuweka uwezo wa besi kwa tabia yao ya kuunda ions hidroksidi katika suluhisho la maji. Majibu ya msingi wa Brønsted-Lowry na maji hutolewa na:
\[\ce{B}(aq)+\ce{H2O}(l)⇌\ce{HB+}(aq)+\ce{OH-}(aq) \nonumber \]
Maji ni asidi ambayo humenyuka na msingi,\(\ce{HB^{+}}\) ni asidi conjugate ya msingi\(\ce{B}\), na ion hidroksidi ni msingi conjugate ya maji. msingi nguvu mavuno 100% (au karibu sana hivyo) ya OH - na HB + wakati humenyuka na maji; Kielelezo\(\PageIndex{1}\) orodha besi kadhaa nguvu. Msingi dhaifu hutoa sehemu ndogo ya ions hidroksidi. Hidroksidi ioniki mumunyifu kama vile NaOH huchukuliwa kuwa besi kali kwa sababu hutenganisha kabisa wakati wa kufutwa katika maji.
Kama tulivyofanya na asidi, tunaweza kupima nguvu za jamaa za besi kwa kupima mara kwa mara yao ya msingi ya ionization (K b) katika ufumbuzi wa maji. Katika ufumbuzi wa mkusanyiko huo, besi zenye nguvu ionize kwa kiasi kikubwa, na hivyo huzaa viwango vya juu vya ioni ya hidroksidi kuliko kufanya besi dhaifu. Msingi wenye nguvu una mara kwa mara ya ionization kubwa kuliko msingi dhaifu. Kwa majibu ya msingi,\(\ce{B}\):
\[\ce{B}(aq)+\ce{H2O}(l)⇌\ce{HB+}(aq)+\ce{OH-}(aq), \nonumber \]
tunaandika equation kwa mara kwa mara ionization kama:
\[K_\ce{b}=\ce{\dfrac{[HB+][OH- ]}{[B]}} \nonumber \]
ambapo viwango ni wale katika msawazo. Tena, hatuoni maji katika equation kwa sababu maji ni kutengenezea na ina shughuli ya 1. Athari za kemikali na vipindi vya ionization ya besi tatu zilizoonyeshwa ni:
\[ \begin{aligned} \ce{NO2-}(aq)+\ce{H2O}(l) &⇌\ce{HNO2}(aq)+\ce{OH-}(aq) \quad &K_\ce{b}=2.17×10^{−11} \\[4pt] \ce{CH3CO2-}(aq)+\ce{H2O}(l) &⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) &K_\ce{b}=5.6×10^{−10} \\[4pt] \ce{NH3}(aq)+\ce{H2O}(l) &⇌\ce{NH4+}(aq)+\ce{OH-}(aq) &K_\ce{b}=1.8×10^{−5} \end{aligned} \nonumber \]
Jedwali la vipindi vya ionization ya besi dhaifu inaonekana katika Jedwali E2. Kama ilivyo na asidi, ionization ya asilimia inaweza kupimwa kwa ufumbuzi wa msingi, lakini itatofautiana kulingana na mara kwa mara ya ionization ya msingi na mkusanyiko wa awali wa suluhisho.
Fikiria athari za ionization kwa jozi ya msingi ya asidi-msingi,\(\ce{HA − A^{−}}\):
\[\ce{HA}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{A-}(aq) \nonumber \]
na\(K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}}\).
\[\ce{A-}(aq)+\ce{H2O}(l)⇌\ce{OH-}(aq)+\ce{HA}(aq) \nonumber \]
na\(K_\ce{b}=\ce{\dfrac{[HA][OH]}{[A- ]}}\).
Kuongeza equations hizi mbili za kemikali hutoa equation kwa autoionization kwa maji:
\[\begin{align*} \cancel{\ce{HA}(aq)}+\ce{H2O}(l)+\cancel{\ce{A-}(aq)}+\ce{H2O}(l) &⇌ \ce{H3O+}(aq)+\cancel{\ce{A-}(aq)}+\ce{OH-}(aq)+\cancel{\ce{HA}(aq)} \\[4pt] \ce{2H2O}(l) &⇌\ce{H3O+}(aq)+\ce{OH-}(aq) \end{align*} \nonumber \]
Kama inavyoonekana katika sura iliyotangulia juu ya usawa,\(K\) usemi kwa equation ya kemikali inayotokana na kuongeza milinganyo mengine mawili au zaidi ni bidhaa ya hisabati ya\(K\) maneno mengine ya milinganyo. Kuzidisha maneno ya hatua ya wingi pamoja na kufuta maneno ya kawaida, tunaona kwamba:
\[K_\ce{a}×K_\ce{b}=\ce{\dfrac{[H3O+][A- ]}{[HA]}×\dfrac{[HA][OH- ]}{[A- ]}}=\ce{[H3O+][OH- ]}=K_\ce{w} \nonumber \]
Kwa mfano, asidi ionization mara kwa mara ya asidi asetiki (CH 3 COOH) ni 1.8 × 10 -5, na msingi ionization mara kwa mara ya msingi wake conjugate, acetate ion (\(\ce{CH3COO-}\)), ni 5.6 × 10 -10. Bidhaa ya vipindi hivi viwili ni sawa na\(K_w\):
\[K_\ce{a}×K_\ce{b}=(1.8×10^{−5})×(5.6×10^{−10})=1.0×10^{−14}=K_\ce{w} \nonumber \]
Kiwango ambacho asidi\(\ce{HA}\), hutoa protoni kwa molekuli za maji inategemea nguvu ya msingi wa conjugate\(\ce{A^{−}}\),, ya asidi. Ikiwa\(\ce{A^{−}}\) ni msingi wenye nguvu, protoni zozote zinazotolewa kwa molekuli za maji zinarudiwa tena na\(\ce{A^{−}}\). Hivyo kuna kidogo\(\ce{A^{−}}\) na\(\ce{H3O+}\) katika suluhisho, na asidi,\(\ce{HA}\), ni dhaifu. Ikiwa\(\ce{A^{−}}\) ni msingi dhaifu, maji hufunga protoni kwa nguvu zaidi, na suluhisho lina kimsingi\(\ce{A^{−}}\)\(\ce{H3O^{+}}\) na-asidi ni imara. Asidi kali huunda misingi ya conjugate dhaifu sana, na asidi dhaifu huunda misingi yenye nguvu ya conjugate (Kielelezo\(\PageIndex{2}\)).
 "style="upana: 784px; urefu: 271px;” width="784px” height="271px” src=”/@api /deki/files/65684/CNX_Chem_14_03_strengths.jpg “>
"style="upana: 784px; urefu: 271px;” width="784px” height="271px” src=”/@api /deki/files/65684/CNX_Chem_14_03_strengths.jpg “>
Kielelezo\(\PageIndex{3}\) kinaorodhesha mfululizo wa asidi na besi kwa utaratibu wa nguvu za kupungua kwa asidi na nguvu zinazofanana za besi. Asidi na msingi katika mstari uliopewa ni conjugate kwa kila mmoja.
Asidi sita za kwanza katika Kielelezo\(\PageIndex{3}\) ni asidi ya kawaida kali. Asidi hizi zinatenganishwa kabisa katika suluhisho la maji. Msingi wa conjugate wa asidi hizi ni besi dhaifu kuliko maji. Wakati moja ya asidi hizi hupasuka ndani ya maji, protoni zao zinahamishiwa kabisa kwa maji, msingi wenye nguvu.
Wale asidi kwamba uongo kati ya ion hydronium na maji katika Kielelezo\(\PageIndex{3}\) fomu conjugate besi ambayo inaweza kushindana na maji kwa milki ya proton. Ions zote za hidronium na molekuli za asidi zisizo na nonionized zipo katika usawa katika suluhisho la mojawapo ya asidi hizi. Misombo ambayo ni asidi dhaifu kuliko maji (wale kupatikana chini ya maji katika safu ya asidi) katika Kielelezo\(\PageIndex{3}\) maonyesho hakuna tabia inayoonekana tindikali wakati kufutwa katika maji. Msingi wao wa conjugate ni nguvu zaidi kuliko ioni ya hidroksidi, na kama msingi wowote wa conjugate uliundwa, ingeweza kuguswa na maji ili kuunda tena asidi.
 “style="upana: 798px; urefu: 715px;” width="798px” height="715px” src=”/@api /deki/files/65685/CNX_Chem_14_03_Corresp.jpg “>
“style="upana: 798px; urefu: 715px;” width="798px” height="715px” src=”/@api /deki/files/65685/CNX_Chem_14_03_Corresp.jpg “>
Kiwango ambacho msingi huunda ioni ya hidroksidi katika suluhisho la maji hutegemea nguvu ya jamaa ya msingi na ile ya ioni ya hidroksidi, kama inavyoonekana kwenye safu ya mwisho katika Kielelezo\(\PageIndex{3}\). Msingi wenye nguvu, kama moja ya wale walio chini ya ioni ya hidroksidi, hukubali protoni kutoka kwa maji ili kuzalisha 100% ya asidi ya conjugate na ion ya hidroksidi. Msingi huo ulio kati ya maji na ioni ya hidroksidi hukubali protoni kutoka kwa maji, lakini mchanganyiko wa ioni ya hidroksidi na matokeo ya msingi. Misingi ambayo ni dhaifu kuliko maji (yale yaliyo juu ya maji katika safu ya besi) huonyesha tabia ya msingi inayoonekana katika suluhisho la maji.
Tumia\(K_b\) kwa ion ya nitriti,\(\ce{NO2-}\), kuhesabu\(K_a\) kwa asidi yake ya conjugate.
Suluhisho
K b kwa\(\ce{NO2-}\) imetolewa katika sehemu hii kama 2.17 × 10 -11. Asidi ya conjugate ya\(\ce{NO2-}\) ni HNO 2; K a kwa HNO 2 inaweza kuhesabiwa kwa kutumia uhusiano:
\[K_\ce{a}×K_\ce{b}=1.0×10^{−14}=K_\ce{w} \nonumber \]
Kutatua kwa K a, tunapata:
\[\begin{align*} K_\ce{a} &=\dfrac{K_\ce{w}}{K_\ce{b}} \\[4pt] &=\dfrac{1.0×10^{−14}}{2.17×10^{−11}} \\[4pt] &=4.6×10^{−4} \end{align*} \nonumber \]
Jibu hili linaweza kuthibitishwa kwa kutafuta K a kwa HNO 2 katika Jedwali E1
Tunaweza kuamua nguvu za asidi za jamaa\(\ce{NH4+}\) na\(\ce{HCN}\) kwa kulinganisha vipindi vyao vya ionization. Mara kwa mara ya ionization\(\ce{HCN}\) hutolewa katika Jedwali E1 kama 4.9 × 10 -10. Mara kwa mara ya ionization\(\ce{NH4+}\) haijaorodheshwa, lakini mara kwa mara ya ionization ya msingi wake wa conjugate\(\ce{NH3}\), imeorodheshwa kama 1.8 × 10 -5. Kuamua ionization mara kwa mara ya\(\ce{NH4+}\), na kuamua ambayo ni asidi nguvu,\(\ce{HCN}\) au\(\ce{NH4+}\).
- Jibu
-
\(\ce{NH4+}\)ni asidi yenye nguvu kidogo (K a kwa\(\ce{NH4+}\) = 5.6 × 10 -10).
Ionization ya asidi dhaifu na Msingi Dhaifu
Asidi nyingi na besi ni dhaifu; yaani, hawana ionize kikamilifu katika suluhisho la maji. Suluhisho la asidi dhaifu katika maji ni mchanganyiko wa asidi isiyo na nonionized, ioni ya hidronium, na msingi wa conjugate wa asidi, na asidi ya nonionized iliyopo katika mkusanyiko mkubwa. Hivyo, asidi dhaifu huongeza mkusanyiko wa ioni ya hidronium katika suluhisho la maji (lakini si kama kiasi sawa cha asidi kali).
Asidi ya Acetic (\(\ce{CH3CO2H}\)) ni asidi dhaifu. Tunapoongeza asidi ya asidi kwa maji, ionizes kwa kiwango kidogo kulingana na equation:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
kutoa mchanganyiko wa usawa na asidi nyingi zilizopo katika fomu isiyo ya kawaida (Masi). Msawazo huu, kama ulinganifu mwingine, ni wa nguvu; molekuli za asidi asetiki huchangia ioni za hidrojeni kwa molekuli za maji na huunda ioni za hidronium na ioni za acetate kwa kiwango sawa ambacho ioni za hidroniamu zinachangia ioni za hidrojeni kwa ioni za acetate ili kurekebisha molekuli Tunaweza kusema kwa kupima pH ya suluhisho la maji ya mkusanyiko unaojulikana kwamba sehemu tu ya asidi dhaifu ni ionized wakati wowote (Kielelezo\(\PageIndex{4}\)). Asidi dhaifu iliyobaki iko katika fomu isiyo na nonionized.
Kwa asidi ya asidi, kwa usawa:
\[K_\ce{a}=\ce{\dfrac{[H3O+][CH3CO2- ]}{[CH3CO2H]}}=1.8 \times 10^{−5} \nonumber \]

| Mmenyuko wa ionization | K a saa 25 °C |
|---|---|
| \(\ce{HSO4- + H2O ⇌ H3O+ + SO4^2-}\) | 1.2 × 10 -2 |
| \(\ce{HF + H2O ⇌ H3O+ + F-}\) | 3.5 × 10 -4 |
| \(\ce{HNO2 + H2O ⇌ H3O+ + NO2-}\) | 4.6 × 10 -4 |
| \(\ce{HNCO + H2O ⇌ H3O+ + NCO-}\) | 2 × 10 -4 |
| \(\ce{HCO2H + H2O ⇌ H3O+ + HCO2-}\) | 1.8 × 10 -4 |
| \(\ce{CH3CO2H + H2O ⇌ H3O+ + CH3CO2-}\) | 1.8 × 10 -5 |
| \(\ce{HCIO + H2O ⇌ H3O+ + CIO-}\) | 2.9 × 10 —8 |
| \(\ce{HBrO + H2O ⇌ H3O+ + BrO-}\) | 2.8 × 10 —9 |
| \(\ce{HCN + H2O ⇌ H3O+ + CN-}\) | 4.9 × 10 -10 |
Jedwali\(\PageIndex{1}\) hutoa constants ionization kwa asidi kadhaa dhaifu; constants ziada ionization inaweza kupatikana katika Jedwali E1.
Katika usawa, ufumbuzi wa msingi dhaifu katika maji ni mchanganyiko wa msingi wa nonionized, asidi conjugate ya msingi dhaifu, na ion hidroksidi na msingi nonionized sasa katika mkusanyiko mkubwa. Hivyo, msingi dhaifu huongeza mkusanyiko wa ioni ya hidroksidi katika suluhisho la maji (lakini si kama kiasi sawa cha msingi wa nguvu).
Kwa mfano, suluhisho la trimethylamine dhaifu ya msingi, (CH 3) 3 N, katika maji humenyuka kulingana na equation:
\[\ce{(CH3)3N}(aq)+\ce{H2O}(l)⇌\ce{(CH3)3NH+}(aq)+\ce{OH-}(aq) \nonumber \]
Hii inatoa mchanganyiko wa usawa na zaidi ya sasa ya msingi kama amine nonionized. Msawazo huu ni sawa na ule ulioelezwa kwa asidi dhaifu.
Tunaweza kuthibitisha kwa kupima pH ya suluhisho la maji ya msingi dhaifu wa mkusanyiko unaojulikana kwamba sehemu tu ya msingi humenyuka na maji (Mchoro 14.4.5). Msingi dhaifu uliobaki umepo kama fomu isiyofanywa. Mara kwa mara ya usawa kwa ionization ya msingi dhaifu\(K_b\), inaitwa mara kwa mara ionization ya msingi dhaifu, na ni sawa na quotient ya majibu wakati mmenyuko uko katika usawa. Kwa trimethylamine, kwa usawa:
\[K_\ce{b}=\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}} \nonumber \]
Vipindi vya ionization vya besi kadhaa dhaifu hutolewa katika Jedwali\(\PageIndex{2}\) na Jedwali E2.
| Mmenyuko wa ionization | K b saa 25 °C |
|---|---|
| \(\ce{(CH3)2NH + H2O ⇌ (CH3)2NH2+ + OH-}\) | 5.9 × 10 -4 |
| \(\ce{CH3NH2 + H2O ⇌ CH3NH3+ + OH-}\) | 4.4 × 10 -4 |
| \(\ce{(CH3)3N + H2O ⇌ (CH3)3NH+ + OH-}\) | 6.3 × 10 -5 |
| \(\ce{NH3 + H2O ⇌ NH4+ + OH-}\) | 1.8 × 10 -5 |
| \(\ce{C6H5NH2 + H2O ⇌ C6N5NH3+ + OH-}\) | 4.3 × 10 -10 |
Asidi ya Acetic ni kiungo kikuu katika siki; ndiyo sababu inapenda ladha. Katika usawa, suluhisho lina [CH 3 CO 2 H] = 0.0787 M na\(\ce{[H3O+]}=\ce{[CH3CO2- ]}=0.00118\:M\). Je! Ni thamani gani\(K_a\) ya asidi ya asidi?

Suluhisho
Tunaulizwa kuhesabu mara kwa mara ya usawa kutoka kwa viwango vya usawa. Katika usawa, thamani ya mara kwa mara ya usawa ni sawa na quotient ya majibu kwa mmenyuko:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
\[\begin{align*} K_\ce{a} &=\ce{\dfrac{[H3O+][CH3CO2- ]}{[CH3CO2H]}} \\[4pt] &=\dfrac{(0.00118)(0.00118)}{0.0787} \\[4pt] &=1.77×10^{−5} \end{align*} \nonumber \]
Je, ni mara kwa mara ya usawa kwa ionization ya\(\ce{HSO4-}\) ion, asidi dhaifu inayotumiwa katika baadhi ya watakaso wa kaya:
\[\ce{HSO4-}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) \nonumber \]
Katika mchanganyiko mmoja wa NaHSO 4 na Na 2 SO 4 katika usawa,\(\ce{[H3O+]}\) = 0.027 M;\(\ce{[HSO4- ]}=0.29\:M\); na\(\ce{[SO4^2- ]}=0.13\:M\).
- Jibu
-
\(K_a\)kwa\(\ce{HSO_4^-}= 1.2 ×\times 10^{−2}\)
Caffeine, C 8 H 10 N 4 O 2 ni msingi dhaifu. Thamani ya K b kwa caffeine ni nini ikiwa suluhisho la usawa lina [C 8 H 10 N 4 O 2] = 0.050 M,\(\ce{[C8H10N4O2H+]}\) = 5.0 × 10 -3 M, na [OH ∙] = 2.5 × 10 ̈3 M?
Suluhisho
Katika usawa, thamani ya mara kwa mara ya usawa ni sawa na quotient ya majibu kwa mmenyuko:
\[\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq) \nonumber \]
kwa hivyo
\[K_\ce{b}=\ce{\dfrac{[C8H10N4O2H+][OH- ]}{[C8H10N4O2]}}=\dfrac{(5.0×10^{−3})(2.5×10^{−3})}{0.050}=2.5×10^{−4} \nonumber \]
Je, ni mara kwa mara ya usawa kwa ionization ya\(\ce{HPO4^2-}\) ion, msingi dhaifu:
\[\ce{HPO4^2-}(aq)+\ce{H2O}(l)⇌\ce{H2PO4-}(aq)+\ce{OH-}(aq) \nonumber \]
Katika suluhisho iliyo na mchanganyiko wa\(\ce{NaH2PO4}\) na\(\ce{Na2HPO4}\) kwa usawa na:
- \([\ce{OH^{−}}] = 1.3 × 10^{−6} M\)
- \(\ce{[H2PO4^{-}]=0.042\:M}\)na
- \(\ce{[HPO4^{2-}]=0.341\:M}\).
- Jibu
-
K b kwa ajili ya\(\ce{HPO4^2-}=1.6×10^{−7} \)
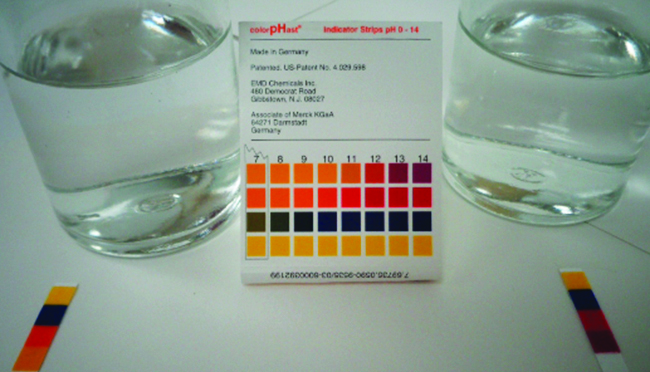
PH ya ufumbuzi wa 0.0516- M wa asidi ya nitrous,\(\ce{HNO2}\), ni 2.34. Ni nini\(K_a\)?
\[\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) \nonumber \]
Suluhisho
Tunaamua mara kwa mara ya usawa kuanzia na viwango vya awali vya HNO 2\(\ce{H3O+}\),, na\(\ce{NO2-}\) pia moja ya viwango vya mwisho, mkusanyiko wa ioni ya hidronium katika usawa. (Kumbuka kwamba pH ni njia nyingine tu ya kueleza mkusanyiko wa ion hidronium.)
Tunaweza kutatua tatizo hili kwa hatua zifuatazo ambazo x ni mabadiliko katika mkusanyiko wa aina katika mmenyuko:
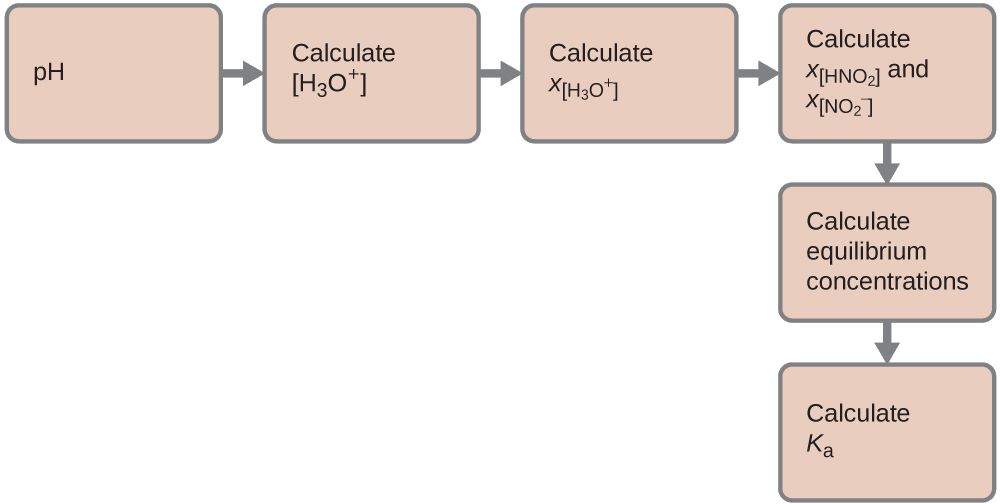
Tunaweza muhtasari viwango mbalimbali na mabadiliko kama inavyoonekana hapa. Kwa sababu maji ni kutengenezea, ina shughuli fasta sawa na 1. Kiasi chochote kidogo cha maji zinazozalishwa au kutumika wakati wa mmenyuko haitabadili jukumu la maji kama kutengenezea, hivyo thamani ya shughuli zake inabakia sawa na 1 katika mmenyuko.
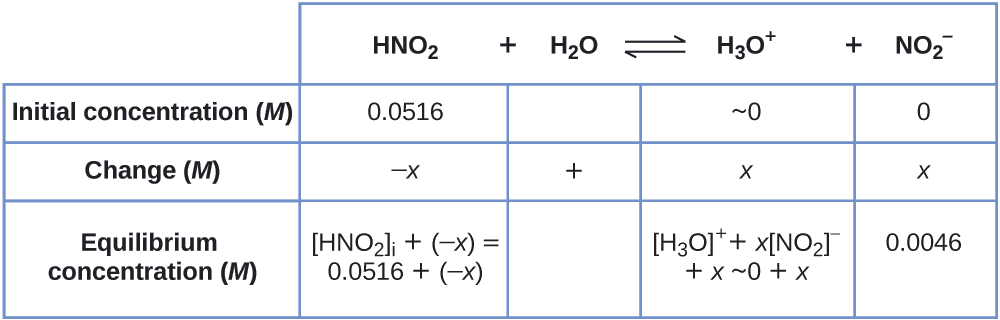
Ili kupata maadili mbalimbali katika meza ya ICE (Awali, Mabadiliko, Msawazo), sisi kwanza kuhesabu\(\ce{[H3O+]}\), mkusanyiko wa usawa\(\ce{H3O+}\), kutoka pH:
\[\ce{[H3O+]}=10^{−2.34}=0.0046\:M \nonumber \]
Mabadiliko katika mkusanyiko wa\(\ce{H3O+}\),\(x_{\ce{[H3O+]}}\), ni tofauti kati ya mkusanyiko wa usawa wa H 3 O +, ambayo tuliamua kutoka pH, na ukolezi wa awali,\(\mathrm{[H_3O^+]_i}\). Mkusanyiko wa awali wa\(\ce{H3O+}\) ni mkusanyiko wake katika maji safi, ambayo ni kidogo sana kuliko mkusanyiko wa mwisho kwamba sisi takriban kama sifuri (~0).
Mabadiliko katika mkusanyiko wa\(\ce{NO2-}\) ni sawa na mabadiliko katika mkusanyiko wa\(\ce{[H3O+]}\). Kwa kila 1 mol ya aina\(\ce{H3O+}\) hiyo, 1 mol ya\(\ce{NO2-}\) fomu. Mkusanyiko wa usawa wa HNO 2 ni sawa na mkusanyiko wake wa awali pamoja na mabadiliko katika ukolezi wake.
Sasa tunaweza kujaza meza ya ICE na viwango vya usawa, kama inavyoonekana hapa:
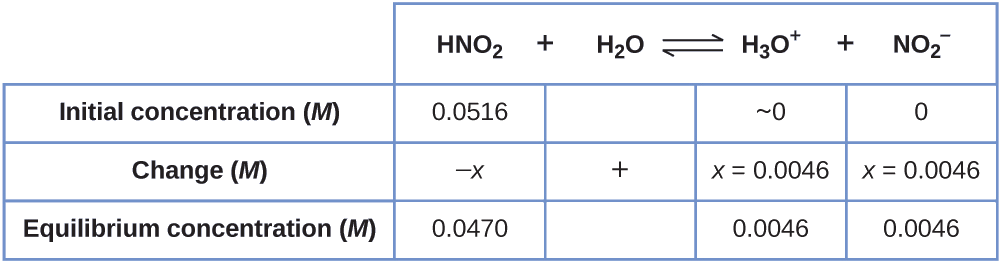
Hatimaye, tunahesabu thamani ya mara kwa mara ya usawa kwa kutumia data katika meza:
\[K_\ce{a}=\ce{\dfrac{[H3O+][NO2- ]}{[HNO2]}}=\dfrac{(0.0046)(0.0046)}{(0.0470)}=4.5×10^{−4} \nonumber \]
PH ya suluhisho la amonia ya kaya, ufumbuzi wa 0.950- M wa NH 3, ni 11.612. K b kwa NH 3 ni nini.
- Jibu
-
\(K_b = 1.8 × 10^{−5}\)
Asidi ya fomu, HCO 2 H, ni hasira ambayo husababisha mmenyuko wa mwili kwa miiba ya ant.

Je, ni mkusanyiko wa ioni ya hidroniamu na pH katika ufumbuzi wa 0.534- M wa asidi ya fomu?
\[\ce{HCO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{HCO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−4} \nonumber \]
Soluti juu
1. Kuamua viwango vya x na usawa. Maneno ya usawa ni:
\[\ce{HCO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{HCO2-}(aq) \nonumber \]
Kwa sababu maji ni kutengenezea, ina shughuli fasta sawa na 1. Kiasi chochote kidogo cha maji kilichozalishwa au kutumika wakati wa mmenyuko hakitabadilisha jukumu la maji kama kutengenezea, hivyo thamani ya shughuli zake inabaki sawa na 1 katika mmenyuko kwa hivyo hatuhitaji kuzingatia wakati wa kuanzisha meza ya ICE.
Jedwali linaonyesha viwango vya awali (viwango kabla ya ionizes asidi), mabadiliko katika mkusanyiko, na viwango vya usawa ifuatavyo (data iliyotolewa katika tatizo inaonekana kwa rangi):
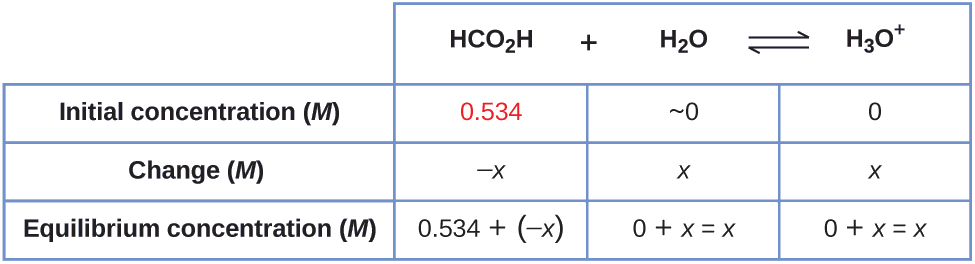
2. Kutatua kwa\(x\) na viwango vya usawa. Katika usawa:
\[\begin{align*} K_\ce{a} &=1.8×10^{−4}=\ce{\dfrac{[H3O+][HCO2- ]}{[HCO2H]}} \\[4pt] &=\dfrac{(x)(x)}{0.534−x}=1.8×10^{−4} \end{align*} \nonumber \]
Sasa tatua kwa\(x\). Kwa sababu mkusanyiko wa awali wa asidi ni sababu kubwa na\(K_a\) ni ndogo sana, sisi kudhani kwamba\(x << 0.534\), ambayo inaruhusu sisi kurahisisha denominator mrefu kama\((0.534 − x) = 0.534\). Hii inatoa:
\[K_\ce{a}=1.8×10^{−4}=\dfrac{x^{2}}{0.534} \nonumber \]
Tatua kwa\(x\) ifuatavyo:
\[\begin{align*} x^2 &=0.534×(1.8×10^{−4}) \\[4pt] &=9.6×10^{−5} \\[4pt] x &=\sqrt{9.6×10^{−5}} \\[4pt] &=9.8×10^{−3} \end{align*} \nonumber \]
Kuangalia dhana ambayo\(x\) ni ndogo ikilinganishwa na 0.534, tunahesabu:
\[\begin{align*} \dfrac{x}{0.534} &=\dfrac{9.8×10^{−3}}{0.534} \\[4pt] &=1.8×10^{−2} \, \textrm{(1.8% of 0.534)} \end{align*} \nonumber \]
\(x\)ni chini ya 5% ya mkusanyiko wa awali; dhana ni halali.
Tunaona mkusanyiko wa usawa wa ioni ya hidronium katika ufumbuzi huu wa asidi ya fomu kutoka kwa ukolezi wake wa awali na mabadiliko katika mkusanyiko huo kama ilivyoonyeshwa kwenye mstari wa mwisho wa meza:
\[\begin{align*} \ce{[H3O+]} &=~0+x=0+9.8×10^{−3}\:M. \\[4pt] &=9.8×10^{−3}\:M \end{align*} \nonumber \]
PH ya suluhisho inaweza kupatikana kwa kuchukua logi hasi ya\(\ce{[H3O+]}\), hivyo:
\[pH = −\log(9.8×10^{−3})=2.01 \nonumber \]
Sehemu ndogo tu ya asidi dhaifu ionizes katika suluhisho la maji. Je! Asilimia ionization ya asidi ya asidi katika ufumbuzi wa 0.100- M ya asidi ya asidi, CH 3 CO 2 H?
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−5} \nonumber \]
- Kidokezo
-
Kuamua\(\ce{[CH3CO2- ]}\) katika usawa.) Kumbuka kwamba ionization ya asilimia ni sehemu ya asidi ya asidi ambayo ni ionized × 100, au\(\ce{\dfrac{[CH3CO2- ]}{[CH3CO2H]_{initial}}}×100\).
- Jibu
-
asilimia ionization = 1.3%
Mfano unaofuata unaonyesha kwamba mkusanyiko wa bidhaa zinazozalishwa na ionization ya msingi dhaifu inaweza kuamua na mfululizo huo wa hatua zinazotumiwa na asidi dhaifu.
Pata mkusanyiko wa ioni ya hidroksidi katika ufumbuzi wa 0.25- M wa trimethylamine, msingi dhaifu:
\[\ce{(CH3)3N}(aq)+\ce{H2O}(l)⇌\ce{(CH3)3NH+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=6.3×10^{−5} \nonumber \]
Suluhisho Tatizo hili linahitaji tuhesabu mkusanyiko wa usawa kwa kuamua mabadiliko ya mkusanyiko kama ionization ya msingi inakwenda kwa usawa. Suluhisho linakaribia kwa njia sawa na ile ya ionization ya asidi ya fomu katika Mfano\(\PageIndex{6}\). Wafanyabiashara na bidhaa zitakuwa tofauti na namba zitakuwa tofauti, lakini mantiki itakuwa sawa:

1. Kuamua viwango vya x na usawa. Jedwali linaonyesha mabadiliko na viwango:
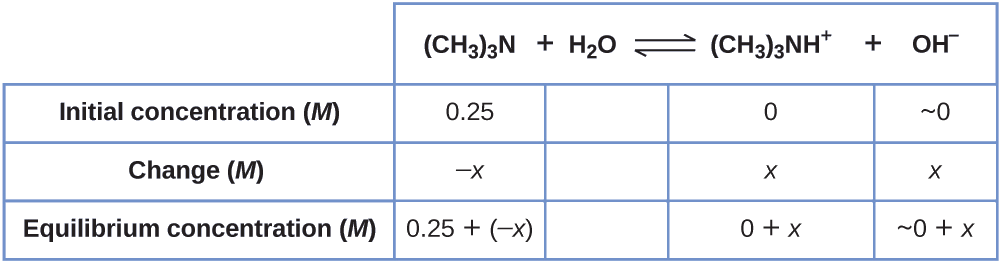
2. Kutatua kwa\(x\) na viwango vya usawa. Katika usawa:
\[K_\ce{b}=\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}}=\dfrac{(x)(x)}{0.25−x=}6.3×10^{−5} \nonumber \]
Ikiwa tunadhani kwamba x ni ndogo jamaa na 0.25, basi tunaweza kuchukua nafasi (0.25 - x) katika equation iliyotangulia na 0.25. Kutatua equation kilichorahisishwa hutoa:
\[x=4.0×10^{−3} \nonumber \]
Mabadiliko haya ni chini ya 5% ya mkusanyiko wa awali (0.25), hivyo dhana ni haki.
Kumbuka kwamba, kwa hesabu hii,\(x\) ni sawa na mkusanyiko wa usawa wa ion hidroksidi katika suluhisho (tazama tabulation mapema):
\[\begin{align*} (\ce{[OH- ]}=~0+x=x=4.0×10^{−3}\:M \\[4pt] &=4.0×10^{−3}\:M \end{align*} \nonumber \]
Kisha uhesabu PoH kama ifuatavyo:
\[\ce{pOH}=−\log(4.3×10^{−3})=2.40 \nonumber \]
Kutumia uhusiano ulioanzishwa katika sehemu ya awali ya sura hii:
\[\mathrm{pH + pOH=p\mathit{K}_w=14.00}\nonumber \]
inaruhusu hesabu ya pH:
\[\mathrm{pH=14.00−pOH=14.00−2.37=11.60} \nonumber \]
Angalia kazi. Cheti cha hesabu yetu inaonyesha kwamba\(K_b = 6.3 \times 10^{−5}\).
- Onyesha kwamba hesabu katika Hatua ya 2 ya mfano huu inatoa x ya 4.3 × 10 ̈3 na hesabu katika Hatua ya 3 inaonyesha K b = 6.3 × 10 -5.
- Pata mkusanyiko wa ioni ya hidroksidi katika suluhisho la 0.0325- M la amonia, msingi dhaifu na K b ya 1.76 × 10 -5. Tumia ionization ya asilimia ya amonia, sehemu ionized × 100, au\(\ce{\dfrac{[NH4+]}{[NH3]}}×100 \%\)
- Jibu
-
\(7.56 × 10^{−4}\, M\), 2.33%
- Jibu b
-
2.33%
Baadhi ya asidi dhaifu na besi dhaifu ionize kwa kiasi kwamba kurahisisha dhana kwamba x ni ndogo jamaa na mkusanyiko wa awali wa asidi au msingi ni sahihi. Tunapotatua kwa viwango vya usawa katika matukio kama hayo, tutaona kwamba hatuwezi kupuuza mabadiliko katika mkusanyiko wa awali wa asidi au msingi, na lazima tusuluhishe equations ya usawa kwa kutumia equation quadratic.
Bisulfate ya sodiamu, NaHSO 4, hutumiwa katika watakaso wa kaya kwa sababu ina\(\ce{HSO4-}\) ion, asidi dhaifu. Je, ni pH ya ufumbuzi wa 0.50- M wa\(\ce{HSO4-}\) nini?
\[\ce{HSO4-}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{a}=1.2×10^{−2} \nonumber \]
Soluti juu
Tunahitaji kuamua mkusanyiko wa usawa wa ioni ya hidroniamu inayotokana na ionization ya\(\ce{HSO4-}\) ili tuweze kutumia\(\ce{[H3O+]}\) kuamua pH. Kama ilivyo katika mifano ya awali, tunaweza kukabiliana na suluhisho kwa hatua zifuatazo:

1. Kuamua\(x\) na viwango vya usawa. Jedwali hili linaonyesha mabadiliko na viwango:

2. Kutatua kwa\(x\) na viwango.
Tunapoanza kutatua\(x\), tutapata hii ni ngumu zaidi kuliko katika mifano ya awali. Kama sisi kujadili matatizo haya hatupaswi kupoteza wimbo wa ukweli kwamba bado ni madhumuni ya hatua hii kuamua thamani ya\(x\).
Katika usawa:
\[K_\ce{a}=1.2×10^{−2}=\ce{\dfrac{[H3O+][SO4^2- ]}{[HSO4- ]}}=\dfrac{(x)(x)}{0.50−x} \nonumber \]
Ikiwa tunadhani kuwa x ni ndogo na takriban (0.50 - x) kama 0.50, tunaona:
\[x=7.7×10^{−2} \nonumber \]
Tunapoangalia dhana, tunathibitisha:
\[\dfrac{x}{\mathrm{[HSO_4^- ]_i}} \overset{?}{\le} 0.05 \nonumber \]
ambayo kwa mfumo huu ni
\[\dfrac{x}{0.50}=\dfrac{7.7×10^{−2}}{0.50}=0.15(15\%) \nonumber \]
Thamani ya\(x\) si chini ya 5% ya 0.50, hivyo dhana si halali. Tunahitaji formula ya quadratic kupata\(x\).
Ulinganisho:
\[K_\ce{a}=1.2×10^{−2}=\dfrac{(x)(x)}{0.50−x}\nonumber \]
anatoa
\[6.0×10^{−3}−1.2×10^{−2}x=x^{2+} \nonumber \]
au
\[x^{2+}+1.2×10^{−2}x−6.0×10^{−3}=0 \nonumber \]
Equation hii inaweza kutatuliwa kwa kutumia formula quadratic. Kwa equation ya fomu
\[ax^{2+} + bx + c=0, \nonumber \]
\(x\)hutolewa na equation quadratic:
\[x=\dfrac{−b±\sqrt{b^{2+}−4ac}}{2a} \nonumber \]
Katika tatizo hili,\(a = 1\),\(b = 1.2 × 10^{−3}\), na\(c = −6.0 × 10^{−3}\).
Kutatua kwa x kunatoa mizizi hasi (ambayo haiwezi kuwa sahihi kwani mkusanyiko hauwezi kuwa hasi) na mzizi mzuri:
\[x=7.2×10^{−2} \nonumber \]
Sasa tambua mkusanyiko wa ioni ya hydronium na pH:
\[\begin{align*} \ce{[H3O+]} &=~0+x=0+7.2×10^{−2}\:M \\[4pt] &=7.2×10^{−2}\:M \end{align*} \nonumber \]
PH ya suluhisho hili ni:
\[\mathrm{pH=−log[H_3O^+]=−log7.2×10^{−2}=1.14} \nonumber \]
- Onyesha kwamba formula ya quadratic inatoa\(x = 7.2 × 10^{−2}\).
- Tumia pH katika ufumbuzi wa 0.010- M wa caffeine, msingi dhaifu:
\[\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=2.5×10^{−4} \nonumber \]
- Kidokezo
-
Itakuwa muhimu kubadili [OH -] kwa\(\ce{[H3O+]}\) au PoH kwa pH kuelekea mwisho wa hesabu.
- Jibu
-
pH 11.16
Nguvu za Jamaa za Asidi Nguvu na Msingi
Asidi kali, kama vile\(\ce{HCl}\)\(\ce{HBr}\),, na\(\ce{HI}\), wote huonyesha nguvu sawa katika maji. Molekuli ya maji ni msingi mkubwa sana ikilinganishwa na misingi ya conjugate Cl -, Br-, na mimi - kwamba ionization ya asidi hizi kali kimsingi ni kamili katika ufumbuzi wa maji. Katika vimumunyisho chini ya msingi kuliko maji\(\ce{HCl}\)\(\ce{HBr}\), tunapata, na\(\ce{HI}\) hutofautiana sana katika tabia yao ya kuacha proton kwa kutengenezea. Kwa mfano, wakati kufutwa katika ethanol (msingi dhaifu kuliko maji), kiwango cha ionization kinaongezeka kwa utaratibu\(\ce{HCl < HBr < HI}\), na hivyo\(\ce{HI}\) kinaonyeshwa kuwa nguvu zaidi ya asidi hizi. Kutokuwa na uwezo wa kutambua tofauti katika nguvu kati ya asidi kali kufutwa katika maji inajulikana kama athari ya kiwango cha maji.
Maji pia huwa na athari ya kiwango cha juu ya nguvu za besi kali. Kwa mfano, ioni ya oksidi, O 2-, na ioni ya amide\(\ce{NH2-}\), ni misingi yenye nguvu ambayo huguswa kabisa na maji:
\[\ce{O^2-}(aq)+\ce{H2O}(l)⟶\ce{OH-}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{NH2-}(aq)+\ce{H2O}(l)⟶\ce{NH3}(aq)+\ce{OH-}(aq) \nonumber \]
Hivyo, O 2- na\(\ce{NH2-}\) kuonekana kuwa na nguvu sawa ya msingi katika maji; wote wawili kutoa mavuno 100% ya ioni hidroksidi.
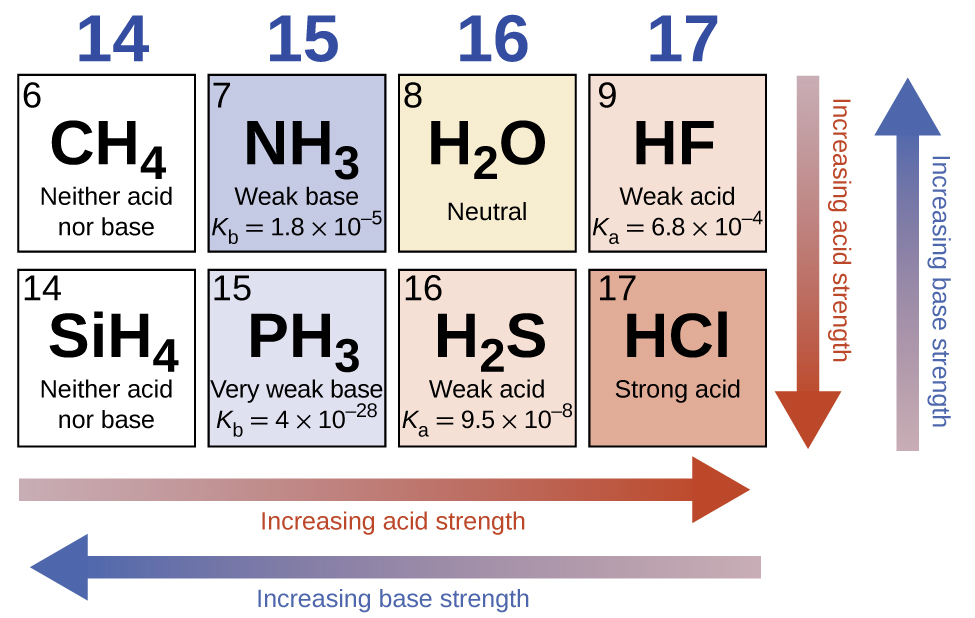
Kutokuwepo kwa athari yoyote ya kupima kiwango, nguvu ya asidi ya misombo ya binary ya hidrojeni na nonmetals (A) huongezeka kama nguvu ya dhamana ya H-A inapungua chini ya kundi katika meza ya mara kwa mara. Kwa kikundi 17, utaratibu wa kuongezeka kwa asidi ni\(\ce{HF < HCl < HBr < HI}\). Vivyo hivyo, kwa kundi la 16, utaratibu wa kuongeza nguvu za asidi ni H 2 O <H 2 S <H 2 Se <H 2 Te. Katika mstari katika meza ya mara kwa mara, nguvu ya asidi ya misombo ya hidrojeni ya binary huongezeka kwa kuongezeka kwa electronegativity ya atomi isiyo ya kawaida kwa sababu polarity ya dhamana ya H-A huongezeka. Hivyo, utaratibu wa kuongezeka kwa asidi (kwa ajili ya kuondolewa kwa proton moja) katika mstari wa pili ni\(\ce{CH4 < NH3 < H2O < HF}\); katika mstari wa tatu, ni\(\ce{SiH4 < PH3 < H2S < HCl}\) (angalia Mchoro\(\PageIndex{6}\)).
Misombo zenye oksijeni na moja au zaidi ya makundi ya hidroksili (OH) yanaweza kuwa tindikali, msingi, au amphoteric, kulingana na nafasi katika meza ya mara kwa mara ya atomi ya kati E, atomi iliyounganishwa na kundi la hidroxyl. Misombo hiyo ina formula ya jumla O n E (OH) m, na ni pamoja na asidi sulfuriki, asidi\(\ce{O2S(OH)2}\) sulfurasi, asidi nitriki\(\ce{OS(OH)2}\), asidi perkloriki\(\ce{O2NOH}\), hidroksidi alumini\(\ce{O3ClOH}\), hidroksidi kalsiamu\(\ce{Al(OH)3}\)\(\ce{Ca(OH)2}\), na hidroksidi ya potasiamu,\(\ce{KOH}\):
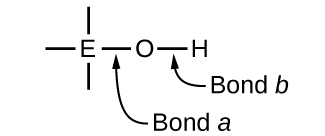
Ikiwa atomi kuu, E, ina electronegativity ya chini, kivutio chake kwa elektroni ni cha chini. Tabia ndogo ipo kwa atomi kuu kuunda dhamana yenye nguvu ya covalent na atomi ya oksijeni, na dhamana kati ya kipengele na oksijeni ni rahisi zaidi kuvunjwa kuliko dhamana b kati ya oksijeni na hidrojeni. Hivyo dhamana a ni ionic, ions hidroksidi hutolewa kwa suluhisho, na nyenzo hufanya kama msingi-hii ni kesi na Ca (OH) 2 na KOH. Chini ya electronegativity ni tabia ya mambo zaidi ya metali; kwa hiyo, vipengele vya metali huunda hidroksidi ya ionic ambayo ni kwa ufafanuzi misombo ya msingi.
Ikiwa, kwa upande mwingine, atomi E ina electronegativity ya juu, inavutia sana elektroni inayoshiriki na atomi ya oksijeni, na kufanya dhamana kuwa kiasi kikubwa cha covalent. dhamana oksijeni-hidrojeni, dhamana b, hivyo dhaifu kwa sababu elektroni ni makazi yao kuelekea E. Bond b ni polar na urahisi releases ions hidrojeni kwa ufumbuzi, hivyo nyenzo tabia kama asidi. Shughuli za juu za electronegativity ni tabia ya mambo yasiyo ya kawaida zaidi. Kwa hiyo, vipengele visivyo na metali huunda misombo ya covalent iliyo na makundi ya tindikali -OH ambayo huitwa oxyacids.
Kuongezeka kwa idadi ya oksidi ya atomi ya kati E pia huongeza asidi ya oksijeni kwa sababu hii huongeza mvuto wa E kwa elektroni unazoshiriki na oksijeni na hivyo kudhoofisha dhamana ya O-H. Asidi ya sulfuriki, H 2 SO 4, au O 2 S (OH) 2 (na idadi ya oxidation ya sulfuri +6), ni tindikali zaidi kuliko asidi sulfurous, H 2 SO 3, au OS (OH) 2 (na idadi ya oxidation ya sulfuri +4). Vivyo hivyo asidi nitriki, HNO 3, au O 2 NOH (N oxidation idadi = +5), ni tindikali zaidi kuliko asidi nitrous, HNO 2, au ONOH (N oxidation idadi = +3). Katika kila jozi hizi, idadi ya oxidation ya atomi kuu ni kubwa kwa asidi kali (Kielelezo\(\PageIndex{7}\)).
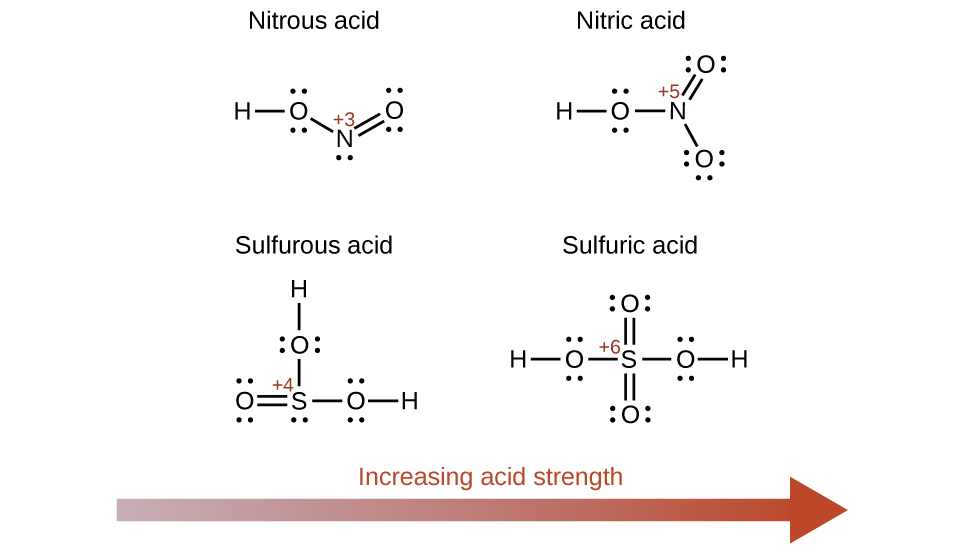
Hydroxy misombo ya vipengele na electronegativities kati na idadi ya juu kiasi oxidation (kwa mfano, mambo karibu na mstari diagonal kutenganisha metali kutoka nonmetals katika meza ya mara kwa mara) ni kawaida amphoteric. Hii ina maana kwamba misombo ya hidrojeni hufanya kama asidi wakati wanaitikia na besi kali na kama besi wakati wanapoitikia na asidi kali. Amphoterism ya hidroksidi ya alumini, ambayo kwa kawaida ipo kama hydrate\(\ce{Al(H2O)3(OH)3}\), inaonekana katika umumunyifu wake katika asidi zote mbili kali na besi kali. Katika misingi yenye nguvu, hidroksidi ya alumini isiyo na hidroksidi ya hidroksidi\(\ce{Al(H2O)3(OH)3}\), inabadilishwa kuwa ion ya mumunyifu\(\ce{[Al(H2O)2(OH)4]-}\), kwa mmenyuko na ioni ya
\[[\ce{Al(H2O)3(OH)3}](aq)+\ce{OH-}(aq)⇌\ce{H2O}(l)+\ce{[Al(H2O)2(OH)4]-}(aq) \nonumber \]
Katika mmenyuko huu, protoni huhamishwa kutoka kwenye mojawapo ya molekuli ya H 2 O iliyofungwa na alumini kwa ioni ya hidroksidi katika suluhisho. Hivyo\(\ce{Al(H2O)3(OH)3}\) kiwanja hufanya kama asidi chini ya hali hizi. Kwa upande mwingine, wakati kufutwa katika asidi kali, inabadilishwa kuwa ion mumunyifu kwa mmenyuko\(\ce{[Al(H2O)6]^3+}\) na ioni ya hidronium:
\[\ce{3H3O+}(aq)+\ce{Al(H2O)3(OH)3}(aq)⇌\ce{Al(H2O)6^3+}(aq)+\ce{3H2O}(l) \nonumber \]
Katika kesi hiyo, protoni huhamishwa kutoka ioni za hidronium katika suluhisho la\(\ce{Al(H2O)3(OH)3}\), na kazi ya kiwanja kama msingi.
Muhtasari
Nguvu za asidi za Brønsted-Lowry na besi katika ufumbuzi wa maji yanaweza kuamua na asidi zao au msingi wa ionization. Asidi kali huunda misingi ya conjugate dhaifu, na asidi dhaifu huunda misingi ya conjugate yenye nguvu. Hivyo asidi kali ni ionized kabisa katika suluhisho la maji kwa sababu misingi yao ya conjugate ni besi dhaifu kuliko maji. Asidi dhaifu ni sehemu tu ionized kwa sababu misingi yao ya conjugate ni nguvu ya kutosha kushindana kwa mafanikio na maji kwa milki ya protoni. Msingi wenye nguvu huguswa na maji kwa kiasi kikubwa kuunda ions hidroksidi. Msingi dhaifu hutoa kiasi kidogo tu cha ioni ya hidroksidi. Nguvu za asidi za binary huongezeka kutoka kushoto kwenda kulia katika kipindi cha meza ya mara kwa mara (CH 4 <NH 3 <H 2 O <HF), na huongeza chini ya kundi (HF <HCl <HBR <HI). Nguvu za oxyacids zilizo na kipengele cha kati huongezeka kama idadi ya oxidation ya elementi inavyoongezeka (H 2 SO 3 <H 2 SO 4). Nguvu za oksiacids pia huongezeka kadiri electronegativity ya elementi ya kati inavyoongezeka [H 2 SEO 4 <H 2 SO 4].
Mlinganyo muhimu
- \(K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}}\)
- \(K_\ce{b}=\ce{\dfrac{[HB+][OH- ]}{[B]}}\)
- \(K_a \times K_b = 1.0 \times 10^{−14} = K_w \,(\text{at room temperature})\)
- \(\textrm{Percent ionization}=\ce{\dfrac{[H3O+]_{eq}}{[HA]_0}}×100\)
faharasa
- asidi ionization mara kwa mara (K a)
- mara kwa mara ya usawa kwa ionization ya asidi dhaifu
- msingi wa ionization mara kwa mara (K b)
- mara kwa mara ya usawa kwa ionization ya msingi dhaifu
- athari ya kiwango cha maji
- asidi yoyote yenye nguvu kuliko\(\ce{H3O+}\), au msingi wowote wenye nguvu zaidi kuliko OH - itaitikia na maji kuunda\(\ce{H3O+}\), au OH -, kwa mtiririko huo; maji hufanya kama msingi wa kufanya asidi zote zenye nguvu zionekane sawa, na hufanya kama asidi kufanya besi zote zenye nguvu zionekane sawa
- oxyacid
- kiwanja zenye nonmetal na moja au zaidi ya makundi hydroxyl
- asilimia ionization
- uwiano wa mkusanyiko wa asidi ionized kwa mkusanyiko wa asidi ya awali, mara 100


