14.4: Hidrolisisi ya Solutions ya Chumvi
- Page ID
- 176943
- Kutabiri kama ufumbuzi wa chumvi itakuwa tindikali, msingi, au neutral
- Tumia viwango vya aina mbalimbali katika suluhisho la chumvi
- Eleza mchakato unaosababisha ufumbuzi wa ions fulani za chuma kuwa tindikali
Kama tulivyoona katika sehemu ya athari za kemikali, wakati asidi na msingi vinachanganywa, hupata mmenyuko wa neutralization. Neno “neutralization” linaonekana kuashiria kwamba suluhisho la stoichiometrically sawa la asidi na msingi haitakuwa neutral. Hii wakati mwingine ni kweli, lakini chumvi ambazo hutengenezwa katika athari hizi zinaweza kuwa na mali ya tindikali au ya msingi ya wao wenyewe, kama tutakavyoona sasa.
Acid-Msingi Neutralization
Suluhisho ni neutral wakati ina viwango sawa vya ioni za hidroniamu na hidroksidi. Tunapochanganya ufumbuzi wa asidi na msingi, mmenyuko wa asidi-msingi wa neutralization hutokea. Hata hivyo, hata kama sisi kuchanganya kiasi stoichiometrically sawa, tunaweza kupata kwamba ufumbuzi kusababisha si upande wowote. Inaweza kuwa na ziada ya ions hidroniamu au ziada ya ioni hidroksidi kwa sababu asili ya chumvi sumu huamua kama suluhisho ni tindikali, neutral, au msingi. Hali nne zifuatazo zinaonyesha jinsi ufumbuzi na maadili mbalimbali ya pH yanaweza kutokea kufuatia mmenyuko wa neutralization kwa kutumia kiasi sawa cha stoichiometrically:
- Asidi kali na msingi wenye nguvu, kama vile HCl (aq) na NaOH (aq) itaitikia ili kuunda suluhisho la neutral tangu washirika wa conjugate zinazozalishwa ni wa nguvu kidogo:\[\ce{HCl}(aq)+\ce{NaOH}(aq)⇌\ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
- Asidi kali na msingi dhaifu hutoa ufumbuzi dhaifu wa tindikali, si kwa sababu ya asidi kali inayohusika, lakini kwa sababu ya asidi ya conjugate ya msingi dhaifu.
- Asidi dhaifu na msingi wenye nguvu hutoa ufumbuzi dhaifu wa msingi. Suluhisho la asidi dhaifu humenyuka na suluhisho la msingi wenye nguvu ili kuunda msingi wa conjugate wa asidi dhaifu na asidi ya conjugate ya msingi wa nguvu. Asidi ya conjugate ya msingi imara ni asidi dhaifu kuliko maji na haina athari juu ya asidi ya suluhisho linalosababisha. Hata hivyo, msingi wa conjugate wa asidi dhaifu ni msingi dhaifu na ionizes kidogo katika maji. Hii huongeza kiasi cha ioni ya hidroksidi katika suluhisho zinazozalishwa katika mmenyuko na hufanya kuwa msingi kidogo.
- Asidi dhaifu pamoja na msingi dhaifu inaweza kutoa suluhisho la tindikali, la msingi, au la neutral. Hii ni ngumu zaidi ya aina nne za athari. Wakati asidi ya conjugate na msingi wa conjugate ni ya nguvu zisizo sawa, suluhisho linaweza kuwa tindikali au msingi, kulingana na uwezo wa jamaa wa conjugates mbili. Mara kwa mara asidi dhaifu na msingi dhaifu utakuwa na nguvu sawa, hivyo msingi wao wa conjugate na asidi watakuwa na nguvu sawa, na suluhisho litakuwa neutral. Ili kutabiri kama mchanganyiko fulani utakuwa tindikali, msingi au neutral, maadili ya K yaliyoandikwa ya conjugates yanapaswa kulinganishwa.
Antacids ya tumbo
Matumbo yetu yana suluhisho la takribani 0.03 M HCl, ambayo inatusaidia kuchimba chakula tunachokula. Hisia inayowaka inayohusishwa na kupungua kwa moyo ni matokeo ya asidi ya tumbo inayovuja kupitia valve ya misuli juu ya tumbo ndani ya kufikia chini ya mkojo. Uchimbaji wa mkojo haukuhifadhiwa kutokana na athari za babuzi za asidi ya tumbo jinsi kitambaa cha tumbo ni, na matokeo yanaweza kuwa chungu sana. Tunapokuwa na kupungua kwa moyo, inahisi vizuri ikiwa tunapunguza asidi ya ziada katika mkojo kwa kuchukua antacid. Kama unaweza kuwa umebadilisha, antacids ni besi. Moja ya antacids ya kawaida ni calcium carbonate, CaCO 3. Mitikio,
\[CaCO_3(s)+2HCl(aq)⇌CaCl_2(aq)+H_2O(l)+CO_2(g) \nonumber \]
sio neutralizes tu asidi ya tumbo, pia hutoa CO 2 (g), ambayo inaweza kusababisha ukanda wa kuridhisha.
Maziwa ya Magnesia ni kusimamishwa kwa hidroksidi ya chini ya mumunyifu ya magnesiamu, Mg (OH) 2. Inafanya kazi kulingana na majibu:
\[Mg(OH)_2(s)⇌Mg^{2+}(aq)+2OH^-(aq) \nonumber \]
Ions hidroksidi zinazozalishwa katika usawa huu kisha kuendelea kuguswa na ions hydronium kutoka asidi ya tumbo, ili:
\[H_3O^+ + OH^- ⇌ 2H_2O(l) \nonumber \]
Tabia hii haina kuzalisha dioksidi kaboni, lakini antacids zenye magnesiamu zinaweza kuwa na athari ya laxative. Antacids kadhaa zina hidroksidi ya alumini, Al (OH) 3, kama kiungo cha kazi. Hidroksidi ya alumini huelekea kusababisha kuvimbiwa, na baadhi ya antacids hutumia hidroksidi ya alumini katika tamasha na hidroksidi ya magnesiamu ili kusawazisha madhara ya
Mambo ya Upishi wa Kemia
Kupika kimsingi ni kemia ya synthetic ambayo hutokea kuwa salama kula. Kuna mifano kadhaa ya kemia ya asidi-msingi katika ulimwengu wa upishi. Mfano mmoja ni matumizi ya soda ya kuoka, au bicarbonate ya sodiamu katika kuoka. NaHCo 3 ni msingi. Wakati humenyuka na asidi kama vile maji ya limao, siagi, au sour cream katika kugonga, Bubbles ya gesi ya dioksidi kaboni hutengenezwa kutokana na kuharibika kwa asidi ya kaboni, na kugonga “kuongezeka.” Poda ya kuoka ni mchanganyiko wa bicarbonate ya sodiamu, na chumvi moja au zaidi ya asidi ambayo huguswa wakati kemikali hizo mbili zinawasiliana na maji katika kugonga.
Watu wengi hupenda kuweka maji ya limao au siki, ambayo yote ni asidi, kwenye samaki kupikwa (Kielelezo\(\PageIndex{1}\)). Inageuka kuwa samaki wana amini tete (besi) katika mifumo yao, ambayo hupunguzwa na asidi ili kutoa chumvi za amonia zinazohusika. Hii inapunguza harufu ya samaki, na pia inaongeza ladha ya “sour” ambayo tunaonekana kufurahia.
Pickling ni njia inayotumiwa kuhifadhi mboga kwa kutumia mazingira ya tindikali ya asili. Mboga, kama vile tango, huwekwa kwenye jar iliyotiwa muhuri iliyojaa suluhisho la brine. Suluhisho la brine hupendeza ukuaji wa bakteria yenye manufaa na huzuia ukuaji wa bakteria hatari. Bakteria yenye manufaa hulisha wanga katika tango na kuzalisha asidi lactic kama bidhaa taka katika mchakato unaoitwa fermentation. Asidi ya lactic hatimaye huongeza asidi ya brine kwa kiwango kinachoua bakteria yoyote hatari, ambayo inahitaji mazingira ya msingi. Bila bakteria yenye madhara yanayotumia matango, wanaweza kudumu kwa muda mrefu zaidi kuliko ikiwa hawakuwa salama. Mchanganyiko wa mchakato wa pickling hubadilisha ladha ya mboga mboga na asidi, na kuwafanya ladha ladha.
Salts ya Msingi Dhaifu na Asidi Nguvu
Tunapopunguza msingi dhaifu na asidi kali, bidhaa hiyo ni chumvi iliyo na asidi ya conjugate ya msingi dhaifu. Asidi hii ya conjugate ni asidi dhaifu. Kwa mfano, kloridi ya amonia, NH 4 Cl, ni chumvi inayotengenezwa na mmenyuko wa amonia dhaifu ya msingi na asidi kali ya HCl:
\[\ce{NH3}(aq)+\ce{HCl}(aq)⟶\ce{NH4Cl}(aq) \nonumber \]
Suluhisho la chumvi hii ina ions za amonia na ions za kloridi. Ioni ya kloridi haina athari juu ya asidi ya suluhisho tangu HCl ni asidi kali. Kloridi ni msingi dhaifu sana na haitakubali protoni kwa kiwango cha kupimika. Hata hivyo, ion ya amonia, asidi conjugate ya amonia, humenyuka na maji na huongeza mkusanyiko wa ioni ya hidronium:
\[\ce{NH4+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NH3}(aq) \nonumber \]
Equation ya usawa kwa mmenyuko huu ni mara kwa mara ya ionization tu. K a, kwa asidi\(\ce{NH4+}\):
\[\ce{\dfrac{[H3O+][NH3]}{[NH4+]}}=K_\ce{a} \nonumber \]
Hatutapata thamani ya K a kwa ioni ya amonia katika Jedwali E1. Hata hivyo, si vigumu kuamua K a kwa\(\ce{NH4+}\) kutoka kwa thamani ya mara kwa mara ya ionization ya maji, K w, na K b, mara kwa mara ya ionization ya msingi wake wa conjugate, NH 3, kwa kutumia uhusiano wafuatayo:
\[K_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Uhusiano huu unashikilia msingi wowote na asidi yake ya conjugate au kwa asidi yoyote na msingi wake wa conjugate.
Aniline ni amine ambayo hutumiwa kutengeneza dyes. Ni pekee kama aniline hydrochloride\(\ce{[C6H5NH3+]Cl}\), chumvi iliyoandaliwa na mmenyuko wa aniline dhaifu ya msingi na asidi hidrokloric. Je, ni pH ya ufumbuzi wa 0.233 M wa hydrochloride ya aniline?
\[\ce{C6H5NH3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H5NH2}(aq) \nonumber \]
Suluhisho
Hatua mpya katika mfano huu ni kuamua K a kwa\(\ce{C6H5NH3+}\) ion. \(\ce{C6H5NH3+}\)Ioni ni asidi ya conjugate ya msingi dhaifu. Thamani ya K a kwa asidi hii haijaorodheshwa katika Jedwali E1, lakini tunaweza kuamua kutoka kwa thamani ya K b kwa aniline, C 6 H 5 NH 2, ambayo hutolewa kama 4.6 × 10 -10:
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)×\mathit{K}_b(for\:C_6H_5NH_2)=\mathit{K}_w=1.0×10^{−14}} \nonumber \]
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)=\dfrac{\mathit{K}_w}{\mathit{K}_b(for\:C_6H_5NH_2)}=\dfrac{1.0×10^{−14}}{4.6×10^{−10}}=2.3×10^{−5}} \nonumber \]
Sasa tuna mara kwa mara ionization na mkusanyiko wa awali wa asidi dhaifu, habari muhimu kuamua mkusanyiko wa usawa wa H 3 O +, na pH:
Kwa hatua hizi tunapata [H 3 O +] = 2.3 × 10 -3 M na pH = 2.64
- Je, mahesabu na kuonyesha kwamba mkusanyiko wa ioni ya hidroniamu kwa ufumbuzi wa 0.233- M\(\ce{C6H5NH3+}\) ni 2.3 × 10 -3 na pH ni 2.64.
- Je, ni mkusanyiko wa ioni ya hydronium katika ufumbuzi wa 0.100- M ya nitrati ya amonia, NH 4 NO 3, chumvi linajumuisha ions\(\ce{NH4+}\) na\(\ce{NO3-}\). Tumia data katika Jedwali E1 kuamua K b kwa ioni ya amonia. Ambayo ni asidi yenye nguvu\(\ce{C6H5NH3+}\) au\(\ce{NH4+}\)?
- Jibu
-
\(K_a\ce{(for\:NH4+)}=5.6×10^{−10}\), [H 3 O +] = 7.5 × 10—6 M
- Jibu b
-
\(\ce{C6H5NH3+}\)ni asidi yenye nguvu (a) (b).
Salts ya Acids Dhaifu na Msingi Nguvu
Tunapopunguza asidi dhaifu na msingi wenye nguvu, tunapata chumvi iliyo na msingi wa conjugate wa asidi dhaifu. Msingi huu wa conjugate kawaida ni msingi dhaifu. Kwa mfano, acetate ya sodiamu, NaCh 3 CO 2, ni chumvi inayotengenezwa na mmenyuko wa asidi dhaifu asidi asidi na msingi wa hidroksidi ya sodiamu:
\[\ce{CH3CO2H}(aq)+\ce{NaOH}(aq)⟶\ce{NaCH3CO2}(aq)+\ce{H2O}(aq) \nonumber \]
Suluhisho la chumvi hii ina ions za sodiamu na ions za acetate. Ioni ya sodiamu haina athari juu ya asidi ya suluhisho. Hata hivyo, ioni ya acetate, msingi wa conjugate wa asidi ya asidi, humenyuka na maji na huongeza mkusanyiko wa ioni ya hidroksidi:
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
Equation ya usawa kwa mmenyuko huu ni mara kwa mara ionization, K b, kwa msingi\(\ce{CH3CO2-}\). Thamani ya K b inaweza kuhesabiwa kutoka kwa thamani ya mara kwa mara ya ionization ya maji, K w, na K a, mara kwa mara ya ionization ya asidi conjugate ya anion kwa kutumia equation:
\[_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Kwa ioni ya acetate na asidi yake ya conjugate tuna:
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Baadhi ya vitabu si ripoti maadili ya K b. Wao tu ripoti constants ionization kwa asidi. Kama tunataka kuamua K b thamani kwa kutumia moja ya vitabu hivi, ni lazima kuangalia juu ya thamani ya K kwa asidi conjugate na kubadilisha kwa thamani K b.
Kuamua mkusanyiko wa asidi ya asidi katika suluhisho\(\ce{[CH3CO2- ]}=0.050\:M\) na [OH -] = 2.5 × 10 -6 M katika usawa. Majibu ni:
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
Suluhisho
Tunapewa mbili ya viwango vya usawa tatu na kuulizwa kupata mkusanyiko kukosa. Ikiwa tunaweza kupata mara kwa mara ya usawa kwa majibu, mchakato huo ni wa moja kwa moja.
Ioni ya acetate hufanya kama msingi katika mmenyuko huu; ions hidroksidi ni bidhaa. Tunaamua K b kama ifuatavyo:
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Sasa tafuta ukolezi usiopotea:
\[K_\ce{b}=\ce{\dfrac{[CH3CO2H][OH- ]}{[CH3CO2- ]}}=5.6×10^{−10} \nonumber \]
\[=\dfrac{[\ce{CH3CO2H}](2.5×10^{−6})}{(0.050)}=5.6×10^{−10} \nonumber \]
Kutatua equation hii tunapata [CH 3 CO 2 H] = 1.1 × 10 -5 M.
Je, ni pH ya ufumbuzi wa 0.083- M wa CN -? Matumizi 4.9 × 10 -10 kama K a kwa HCN. Kidokezo: Pengine tutahitaji kubadilisha PoH kwa pH au kupata [H 3 O +] kwa kutumia [OH -] katika hatua za mwisho za tatizo hili.
- Jibu
-
11.16
Msawazo katika Suluhisho la Chumvi la Asidi Dhaifu na Msingi Dhaifu
Katika suluhisho la chumvi linaloundwa na mmenyuko wa asidi dhaifu na msingi dhaifu, kutabiri pH, lazima tujue K a ya asidi dhaifu na K b ya msingi dhaifu. Ikiwa K a> K b, suluhisho ni tindikali, na kama K b> K a, suluhisho ni la msingi.
Kuamua kama ufumbuzi wa maji ya chumvi zifuatazo ni tindikali, msingi, au neutral:
- KBr
- NaHCO 3
- NH 4 Cl
- Na 2 HPO 4
- NH 4 F
Suluhisho
Fikiria kila ions tofauti kulingana na athari zake kwenye pH ya suluhisho, kama inavyoonekana hapa:
- K + cation na Br - anion ni watazamaji wote, kwa kuwa wao ni cation ya msingi imara (KOH) na anion ya asidi kali (HbR), kwa mtiririko huo. Suluhisho ni neutral.
- Mawasiliano ya Na + ni mtazamaji, na haitaathiri pH ya suluhisho;\(\ce{HCO3-}\) anion ni amphiprotic.K a ya\(\ce{HCO3-}\) ni 4.7 × 10 -11, hivyo K b ya msingi wake wa conjugate ni\(\dfrac{1.0×10^{−14}}{4.7×10^{−11}}=2.1×10^{−4}\). Tangu K b >> K a, suluhisho ni la msingi.
- \(\ce{NH4+}\)Ioni ni tindikali na Cl - ion ni mtazamaji. Suluhisho litakuwa tindikali.
- Ioni Na + ni mtazamaji na haitaathiri pH ya suluhisho, wakati\(\ce{HPO4^{2-}}\) ion ni amphiprotic. K a ya\(\ce{HPO_4^{2-}}\) ni 4.2 × 10 -13 na K b yake ni\(\dfrac{1.0×10^{−14}}{4.2×10^{−13}}=2.4×10^{−2}\). Kwa sababu K b >> K a, suluhisho ni la msingi.
- \(\ce{NH4+}\)Ioni imeorodheshwa kuwa tindikali, na ioni F - imeorodheshwa kama msingi, kwa hiyo tunapaswa kulinganisha moja kwa moja K a na K b ya ions mbili. K a ya\(\ce{NH4+}\) ni 5.6 × 10 -10, ambayo inaonekana ndogo sana, lakini K b ya F - ni 1.4 × 10 -11, hivyo suluhisho ni tindikali, tangu K a> K b.
Kuamua kama ufumbuzi wa maji ya chumvi zifuatazo ni tindikali, msingi, au neutral:
- K 2 CO 3
- CaCl 2
- KH 2 PO 4
- (NH 4) 2 CO 3
- Albr 3
- Jibu
-
msingi
- Jibu b
-
upande wowote
- Jibu c
-
tindikali
- Jibu d
-
msingi
- Jibu e
-
tindikali
Ionization ya Ions Hydrated Metal
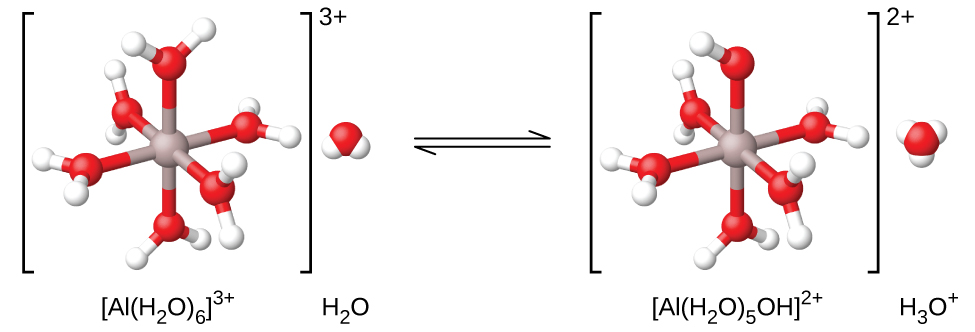
Ikiwa tunapima pH ya ufumbuzi wa ions mbalimbali za chuma, tutapata kwamba ions hizi hufanya kama asidi dhaifu wakati wa suluhisho. Ioni ya alumini ni mfano. Wakati nitrati ya alumini inapasuka ndani ya maji, ion ya alumini humenyuka na maji ili kutoa ioni ya alumini ya hidrati\(\ce{Al(H2O)6^3+}\), kufutwa kwa maji mengi. Hii inamaanisha kwamba ioni ya alumini ina mwingiliano mkubwa zaidi na molekuli sita za karibu zaidi za maji (kinachojulikana kama shell ya kwanza ya solvation), ingawa inaingiliana na molekuli nyingine za maji zinazozunguka\(\ce{Al(H2O)6^3+}\) nguzo hii pia:
\[\ce{Al(NO3)3}(s)+\ce{6H2O}(l)⟶\ce{Al(H2O)6^3+}(aq)+\ce{3NO3-}(aq) \nonumber \]
Mara nyingi tunaona formula ya ion hii tu kama “Al 3 + (aq)”, bila kubainisha wazi molekuli sita za maji ambazo ni za karibu zaidi na ioni ya alumini na kuelezea tu ioni kama imetengenezwa katika maji (hidrati). Hii ni sawa na kurahisisha formula ya ion hydronium, H 3 O + hadi H +. Hata hivyo, katika kesi hii, ioni ya alumini ya hidrati ni asidi dhaifu (Kielelezo\(\PageIndex{2}\)) na hutoa proton kwa molekuli ya maji. Hivyo, taratibu inakuwa muhimu na tunaweza kutumia formula zinazoonyesha kiwango cha taratibu:
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5} \nonumber \]
Kama ilivyo na asidi nyingine za polyprotic, ioni ya alumini ya hidrati ionizes katika hatua, kama inavyoonekana na:
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \nonumber \]
\[\ce{Al(H2O)5(OH)^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)4(OH)2+}(aq) \nonumber \]
\[\ce{Al(H2O)4(OH)2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)3(OH)3}(aq) \nonumber \]
Kumbuka kuwa baadhi ya aina hizi za alumini zinaonyesha tabia ya amphiprotic, kwani zinafanya kama asidi wakati zinaonekana upande wa kushoto wa maneno ya usawa na kama besi wakati zinaonekana upande wa kulia.
Hata hivyo, ionization ya cation kubeba malipo zaidi ya moja ni kawaida si pana zaidi ya hatua ya kwanza. Mifano ya ziada ya hatua ya kwanza katika ionization ya ions hydrated chuma ni:
\[\ce{Fe(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Fe(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=2.74 \nonumber \]
\[\ce{Cu(H2O)6^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Cu(H2O)5(OH)+}(aq) \hspace{20px} K_\ce{a}=~6.3 \nonumber \]
\[\ce{Zn(H2O)4^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Zn(H2O)3(OH)+}(aq) \hspace{20px} K_\ce{a}=9.6 \nonumber \]
Tumia pH ya ufumbuzi wa 0.10- M ya kloridi ya alumini, ambayo hupasuka kabisa kutoa ioni ya alumini hidrati\(\ce{[Al(H2O)6]^3+}\) katika suluhisho.
Suluhisho
Licha ya kuonekana isiyo ya kawaida ya asidi, hii ni tatizo la kawaida la ionization ya asidi.
- Kuamua mwelekeo wa mabadiliko. Equation kwa mmenyuko na K a ni:
\(\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5}\)
Majibu hubadilika kwa haki ya kufikia usawa. - Kuamua viwango vya x na usawa. Tumia meza
:

Kutatua kwa x na viwango vya usawa. Kubadilisha maneno kwa viwango vya usawa katika equation kwa mazao ya mara kwa mara ya ionization:
- \[K_\ce{a}=\ce{\dfrac{[H3O+][Al(H2O)5(OH)^2+]}{[Al(H2O)6^3+]}} \nonumber \]
\(=\dfrac{(x)(x)}{0.10−x}=1.4 \times 10^{−5}\)
Solving this equation gives:
\[x=1.2×10^{−3}\:M \nonumber \]
From this we find:
\[\ce{[H3O+]}=0+x=1.2×10^{−3}\:M \nonumber \]
\[\mathrm{pH=−log[H_3O^+]=2.92(an\: acidic\: solution)} \nonumber \]
Check the work. The arithmetic checks; when 1.2 × 10−3 M is substituted for x, the result = Ka.
What is \(\ce{[Al(H2O)5(OH)^2+]}\) in a 0.15-M solution of Al(NO3)3 that contains enough of the strong acid HNO3 to bring [H3O+] to 0.10 M?
- Answer
-
2.1 × 10−5 M
The constants for the different stages of ionization are not known for many metal ions, so we cannot calculate the extent of their ionization. However, practically all hydrated metal ions other than those of the alkali metals ionize to give acidic solutions. Ionization increases as the charge of the metal ion increases or as the size of the metal ion decreases.
Summary
The characteristic properties of aqueous solutions of Brønsted-Lowry acids are due to the presence of hydronium ions; those of aqueous solutions of Brønsted-Lowry bases are due to the presence of hydroxide ions. The neutralization that occurs when aqueous solutions of acids and bases are combined results from the reaction of the hydronium and hydroxide ions to form water. Some salts formed in neutralization reactions may make the product solutions slightly acidic or slightly basic. Solutions that contain salts or hydrated metal ions have a pH that is determined by the extent of the hydrolysis of the ions in the solution. The pH of the solutions may be calculated using familiar equilibrium techniques, or it may be qualitatively determined to be acidic, basic, or neutral depending on the relative Ka and Kb of the ions involved.


