12.5: Nadharia ya mgongano
- Page ID
- 176433
- Tumia postulates ya nadharia ya mgongano kuelezea madhara ya hali ya kimwili, joto, na ukolezi juu ya viwango vya majibu
- Eleza dhana za nishati ya uanzishaji na hali ya mpito
- Tumia equation ya Arrhenius katika mahesabu yanayohusiana na kiwango cha constants na joto
Hatupaswi kushangaa kwamba atomi, molekuli, au ions lazima zigongane kabla ya kuitikia. Atomi lazima iwe karibu pamoja ili kuunda vifungo vya kemikali. Nguzo hii rahisi ni msingi wa nadharia yenye nguvu sana inayoelezea uchunguzi wengi kuhusu kinetiki za kemikali, ikiwa ni pamoja na sababu zinazoathiri viwango vya mmenyuko. Nadharia ya mgongano inategemea postulates zifuatazo:
- Kiwango cha mmenyuko ni sawa na kiwango cha migongano ya reactant:\[\mathrm{reaction\: rate ∝ \dfrac{\#\,collisions}{time}} \nonumber \]
- Spishi zinazoitikia zinapaswa kugongana katika mwelekeo unaoruhusu kuwasiliana kati ya atomi ambazo zitaunganishwa pamoja katika bidhaa.
- Mgongano lazima kutokea kwa nishati ya kutosha ili kuruhusu kupenya kwa pamoja ya maganda ya valence ya aina ya majibu ili elektroni ziweze kupanga upya na kuunda vifungo vipya (na aina mpya za kemikali).
Tunaweza kuona umuhimu wa mambo mawili ya kimwili yaliyotajwa katika postulates 2 na 3, mwelekeo na nishati ya migongano, wakati tunazingatia mmenyuko wa monoxide kaboni na oksijeni:
\[\ce{2CO}(g)+\ce{O2}(g)⟶\ce{2CO2}(g) \nonumber \]
Monoxide ya kaboni ni uchafuzi unaozalishwa na mwako wa nishati ya hydrocarbon. Ili kupunguza uchafuzi huu, magari yana waongofu wa kichocheo wanaotumia kichocheo kutekeleza majibu haya. Pia ni mmenyuko wa upande wa mwako wa baruti unaosababisha muzzle flash kwa silaha nyingi. Ikiwa monoxide ya kaboni na oksijeni zipo kwa kiasi cha kutosha, mmenyuko huo ni wa kawaida kwa joto la juu na shinikizo.
Hatua ya kwanza katika mmenyuko wa awamu ya gesi kati ya monoxide kaboni na oksijeni ni mgongano kati ya molekuli mbili:
\[\ce{CO}(g)+\ce{O2}(g)⟶\ce{CO2}(g)+\ce{O}(g) \nonumber \]
Ingawa kuna mwelekeo tofauti iwezekanavyo molekuli mbili zinaweza kuwa na jamaa na kila mmoja, fikiria mbili zilizowasilishwa kwenye Kielelezo\(\PageIndex{1}\). Katika kesi ya kwanza, upande wa oksijeni wa molekuli ya monoxide ya kaboni hugongana na molekuli ya oksijeni. Katika kesi ya pili, upande wa kaboni wa molekuli ya monoxide ya kaboni hugongana na molekuli ya oksijeni. Kesi ya pili ni wazi zaidi uwezekano wa kusababisha malezi ya dioksidi kaboni, ambayo ina atomi kuu ya kaboni iliyounganishwa na atomi mbili za oksijeni\(\ce{(O=C=O)}\). Hii ni mfano rahisi sana wa umuhimu wa mwelekeo wa mgongano ni katika suala la kuunda bidhaa inayotaka ya majibu.
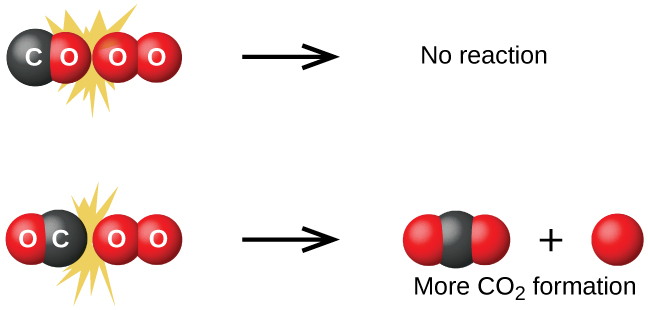
Ikiwa mgongano unafanyika kwa mwelekeo sahihi, bado hakuna uhakika kwamba mmenyuko utaendelea kuunda dioksidi kaboni. Kila mmenyuko inahitaji kiasi fulani cha nishati ya uanzishaji ili iendelee katika mwelekeo wa mbele, ikitoa tata inayofaa iliyoamilishwa njiani. Kama Kielelezo\(\PageIndex{2}\) kinaonyesha, hata mgongano na mwelekeo sahihi unaweza kushindwa kuunda bidhaa ya majibu. Katika utafiti wa taratibu za mmenyuko, kila moja ya mipangilio hii mitatu ya atomi inaitwa hali iliyopendekezwa iliyoanzishwa au ya mpito.
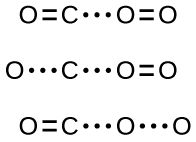
Katika hali nyingi, haiwezekani kutenganisha au kutambua hali ya mpito au tata iliyoamilishwa. Katika mmenyuko kati ya monoxide kaboni na oksijeni kuunda dioksidi kaboni, complexes ulioamilishwa zimeonekana tu spectroscopically katika mifumo ambayo hutumia kichocheo cha kutofautiana. Mmenyuko wa awamu ya gesi hutokea haraka sana ili kutenganisha kiwanja chochote cha kemikali.
Nadharia ya mgongano inaeleza kwa nini viwango vingi vya mmenyuko huongezeka kadiri viwango Kwa ongezeko la mkusanyiko wa dutu lolote la kuitikia, nafasi za migongano kati ya molekuli zinaongezeka kwa sababu kuna molekuli zaidi kwa kila kitengo cha kiasi. Migongano zaidi inamaanisha kiwango cha majibu ya haraka, kuchukua nishati ya migongano ni ya kutosha.
Utekelezaji Nishati na Equation Arrhenius
Nishati ya chini muhimu kuunda bidhaa wakati wa mgongano kati ya reactants inaitwa nishati ya uanzishaji y (\(E_a\)). Nishati ya kinetic ya molekuli ya reactant ina jukumu muhimu katika mmenyuko kwa sababu nishati muhimu kuunda bidhaa hutolewa na mgongano wa molekuli ya reactant na molekuli nyingine ya reactant. (Katika athari moja ya reactant, nishati ya uanzishaji inaweza kutolewa na mgongano wa molekuli ya mmenyuko na ukuta wa chombo cha mmenyuko au kwa molekuli ya uchafu wa ajizi.) Ikiwa nishati ya uanzishaji ni kubwa zaidi kuliko nishati ya wastani ya kinetic ya molekuli, majibu yatatokea polepole: Molekuli chache tu zinazohamia haraka zitakuwa na nishati ya kutosha ya kuguswa. Ikiwa nishati ya uanzishaji ni ndogo sana kuliko nishati ya kawaida ya kinetic ya molekuli, sehemu ya molekuli iliyo na nishati muhimu ya kinetic itakuwa kubwa; migongano mingi kati ya molekuli itasababisha majibu, na majibu yatatokea haraka.
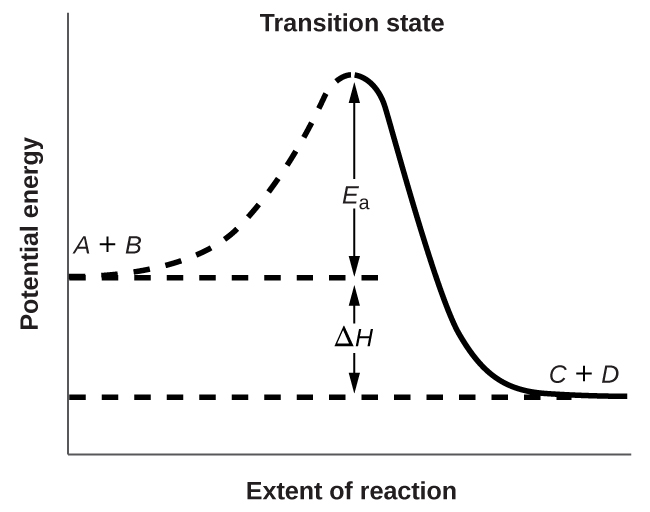
Kielelezo\(\PageIndex{3}\) inaonyesha uhusiano wa nishati kwa majibu ya jumla ya molekuli ya\(A\) na molekuli ya\(B\) kuunda molekuli ya\(C\) na\(D\):
\[A+B⟶C+D \nonumber \]
Takwimu inaonyesha kwamba nishati ya hali ya mpito ni ya juu kuliko ile ya majibu\(A\) na\(B\) kwa kiasi sawa na\(E_a\), nishati ya uanzishaji. Hivyo, jumla ya nguvu za kinetic\(A\) na\(B\) lazima iwe sawa au kubwa kuliko E kufikia hali ya mpito. Baada ya hali ya mpito imefikiwa,\(C\) na kama na\(D\) kuanza kuunda, mfumo hupoteza nishati mpaka nishati yake yote iko chini kuliko ile ya mchanganyiko wa awali. Nishati hii iliyopotea imehamishiwa kwenye molekuli nyingine, kuwapa nishati ya kutosha kufikia hali ya mpito. Mmenyuko wa mbele (yaani kati ya molekuli\(A\) na\(B\)) kwa hiyo huelekea kutokea kwa urahisi mara mmenyuko umeanza. Katika Kielelezo\(\PageIndex{3}\),\(ΔH\) inawakilisha tofauti katika enthalpy kati ya reactants (\(A\)na\(B\)) na bidhaa (\(C\)na\(D\)). Jumla ya\(E_a\) na\(ΔH\) inawakilisha nishati ya uanzishaji kwa mmenyuko wa reverse:
\[C+D⟶A+B \nonumber \]
Tunaweza kutumia equation ya Arrhenius kuhusisha nishati ya uanzishaji na kiwango cha mara kwa mara, k, ya mmenyuko uliotolewa:
\[k=Ae^{−E_a/RT} \label{Arrhenius} \]
Katika equation hii,
- \(R\)ni bora gesi mara kwa mara, ambayo ina thamani 8.314 J/mol/K,
- \(T\)ni joto kwenye kiwango cha Kelvin,
- \(E_a\)ni nishati ya uanzishaji katika joules kwa mole,
- \(e\)ni mara kwa mara 2.7183, na
- \(A\)ni mara kwa mara inayoitwa sababu ya mzunguko, ambayo inahusiana na mzunguko wa migongano na mwelekeo wa molekuli zinazoitikia.
Wote postulates ya nadharia mgongano wa viwango vya majibu ni kushughulikiwa katika equation Arrhenius. Sababu ya mzunguko A inahusiana na kiwango ambacho migongano yenye mwelekeo sahihi hutokea. Neno la ufafanuzi\(e^{−E_a/RT}\), linahusiana na sehemu ya migongano kutoa nishati ya kutosha ili kuondokana na kizuizi cha uanzishaji wa majibu.
Kwa ukali mmoja, mfumo hauna nishati ya kutosha kwa migongano ili kuondokana na kizuizi cha uanzishaji. Katika hali hiyo, hakuna majibu hutokea. Kwa upande mwingine uliokithiri, mfumo una nishati nyingi kwamba kila mgongano na mwelekeo sahihi unaweza kushinda kizuizi cha uanzishaji, na kusababisha athari kuendelea. Katika hali hiyo, mmenyuko ni karibu mara moja.
Equation Arrhenius (Equation\ ref {Arrhenius}) inaelezea kiasi kikubwa cha yale tuliyojadiliwa tayari kuhusu viwango vya majibu. Kwa athari mbili kwa joto sawa, majibu na nishati ya juu ya uanzishaji ina kiwango cha chini cha mara kwa mara na kiwango cha polepole. Thamani kubwa ya\(E_a\) matokeo kwa thamani ndogo kwa\(e^{−E_a/RT}\), kuonyesha sehemu ndogo ya molekuli na nishati ya kutosha kuguswa. Vinginevyo, majibu na ndogo\(E_a\) ina sehemu kubwa ya molekuli yenye nishati ya kutosha kuitikia. Hii itakuwa yalijitokeza kama thamani kubwa ya\(e^{−E_a/RT}\), kiwango kikubwa mara kwa mara, na kiwango cha kasi kwa majibu.
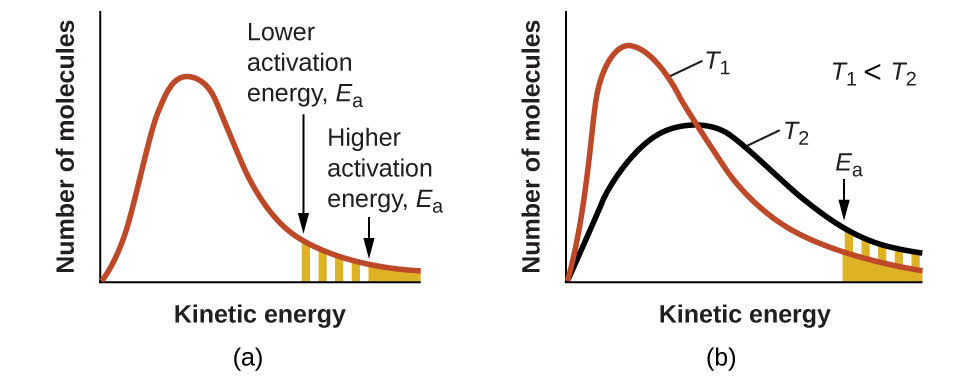
Kielelezo\(\PageIndex{4}\): (a) Kama nishati ya uanzishaji wa mmenyuko inapungua, idadi ya molekuli yenye angalau nishati hii huongezeka, kama inavyoonekana na maeneo ya kivuli. (b) Katika joto la juu, T2, molekuli zaidi zina nguvu za kinetic zaidi kuliko Ea, kama inavyoonekana na eneo la kivuli cha njano.
Kuongezeka kwa joto kuna athari sawa na kupungua kwa nishati ya uanzishaji. Sehemu kubwa ya molekuli ina nishati muhimu ya kuguswa (Kielelezo\(\PageIndex{4}\)), kama ilivyoonyeshwa na ongezeko la thamani ya\(e^{−E_a/RT}\). Kiwango cha mara kwa mara pia ni sawa sawa na sababu ya mzunguko,\(A\). Kwa hiyo mabadiliko katika hali au majibu ambayo huongeza idadi ya migongano na mwelekeo mzuri wa matokeo ya majibu katika ongezeko la\(A\) na, kwa hiyo, ongezeko la\(k\).
Njia rahisi ya kuamua\(E_a\) kwa mmenyuko inahusisha kipimo cha\(k\) joto tofauti na matumizi ya toleo mbadala la equation ya Arrhenius ambayo inachukua fomu ya equation linear:
\ [kuanza {align*}
\ ln k&=\ kushoto (\ dfrac {-e_a} {R}\ kulia)\ kushoto (\ dfrac {1} {T}\ haki) +\ ln A\\
y&=mx+b
\ mwisho {align*}\ nonumber\]
Hivyo, njama ya\(\ln k\) dhidi\(\dfrac{1}{T}\) inatoa mstari wa moja kwa moja na mteremko\(\dfrac{-E_\ce{a}}{R}\), ambayo E a inaweza kuamua. Intercept inatoa thamani ya\(\ln A\). Hii ni wakati mwingine wito Arrhenius Plot.
Uamuzi wa E a Tofauti ya kiwango cha mara kwa mara na joto kwa kuharibika kwa HI (g) hadi H 2 (g) na mimi 2 (g) hutolewa hapa. Nishati ya uanzishaji kwa majibu ni nini?
\[\ce{2HI}(g)⟶\ce{H2}(g)+\ce{I2}(g) \nonumber \]
| T (K) | k (L/mol/s) |
|---|---|
| 555 | 3.52 × 10 -7 |
| 575 | 1.22 × 10 -6 |
| 645 | 8.59 × 10 -5 |
| 700 | 1.16 × 10 -3 |
| 781 | 3.95 × 10 -2 |
Suluhisho
Maadili ya\(\dfrac{1}{T}\) na ln k ni:
| \(\mathrm{\dfrac{1}{T}\:(K^{−1})}\) | ln m |
|---|---|
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {-1})}\)” style="Nakala-align:katikati; "> 1.80 × 10 ˚ 3 | -14.860 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {-1})}\)” style="Nakala-align:katikati; "> 1.74 × 10 ˚ 3 | -13.617 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {-1})}\)” style="Nakala-align:katikati; "> 1.55 × 10 ˚ 3 | -9.362 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {-1})}\)” style="Nakala-align:katikati; "> 1.43 × 10 ˚ 3 | -6.759 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {-1})}\)” style="Nakala-align:katikati; "> 1.28 × 10 ˚ 3 | -3.231 |
Kielelezo\(\PageIndex{5}\) ni grafu ya ln n dhidi\(\dfrac{1}{T}\). Kuamua mteremko wa mstari, tunahitaji maadili mawili ya ln k, ambayo yanatokana na mstari kwenye maadili mawili ya\(\dfrac{1}{T}\) (moja karibu na kila mwisho wa mstari ni bora). Kwa mfano, thamani ya ln k imedhamiriwa kutoka mstari wakati\(\dfrac{1}{T}=1.25×10^{−3}\) ni -2.593; thamani wakati\(\dfrac{1}{T}=1.78×10^{−3}\) ni -14.447.
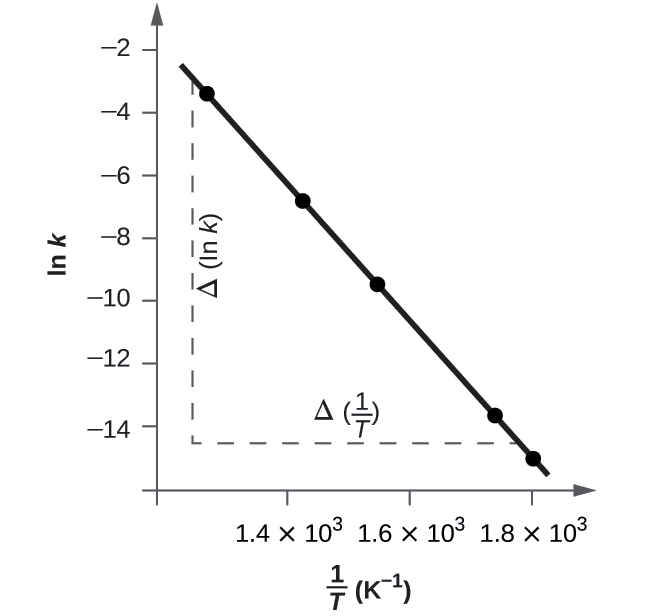
Mteremko wa mstari huu unatolewa na maneno yafuatayo:
\ [kuanza {mlangano*}\ ce {Teremko} &=\ dfrac {Δ (\ ln k)} {Δ\ kushoto (\ dfrac {1} {T}\ haki)}\\
&=\ hesabu {\ dfrac {(14.447) - (-2.593)} {(1.78×10^ {˚}\ :K ^ {,1-1}) - (1.25×10 ^ {˚ 3}\ :K^ {-1})}}\\
&=\ hesabu {\ dfrac {-11.854} {0.53×10^ {˚ 3}\ K^ {—1}}} =2.2×10^4\
:K}\\ dfrac {E_\ ce {a}} {R}
\ mwisho {align*}\ nonumber\]
Hivyo:
\[ \begin{align*} E_\ce{a} &=\mathrm{−slope×\mathit R=−(−2.2×10^4\:K×8.314\: J\: mol^{−1}\:K^{−1})} \\[4pt] &=\mathrm{1.8×10^5\:J\: mol^{−1}} \end{align*} \nonumber \]
Katika hali nyingi, inawezekana kupata makadirio ya busara ya nishati ya uanzishaji bila kupitia mchakato mzima wa kujenga njama ya Arrhenius. Ulinganisho wa Arrhenius:
\[\ln k=\left(\dfrac{−E_\ce{a}}{R}\right)\left(\dfrac{1}{T}\right)+\ln A \nonumber \]
inaweza kupangwa upya kama inavyoonekana kutoa:
\[\dfrac{Δ(\ln k)}{Δ\left(\dfrac{1}{T}\right)}=−\dfrac{E_\ce{a}}{R} \nonumber \]
au
\[\ln\dfrac{k_1}{k_2}=\dfrac{E_\ce{a}}{R}\left(\dfrac{1}{T_2}−\dfrac{1}{T_1}\right) \nonumber \]
Equation hii inaweza kupangwa upya ili kutoa hesabu ya hatua moja ili kupata makadirio ya nishati ya uanzishaji:
\[E_\ce{a}=−R\left( \dfrac{\ln k_2−\ln k_1}{\left(\dfrac{1}{T_2}\right)−\left(\dfrac{1}{T_1}\right)}\right ) \nonumber \]
Kutumia data ya majaribio iliyotolewa hapa, tunaweza kuchagua tu entries data mbili. Kwa mfano huu, tunachagua kuingia kwanza na kuingia mwisho:
| T (K) | k (L/mol/s) | \(\dfrac{1}{T}\:(K^{-1})\) | ln m |
|---|---|---|---|
| 555 | 3.52 × 10 -7 | \ (\ dfrac {1} {T}\: (K^ {-1})\)” style="Nakala-align:katikati; "> 1.80 × 10 ˚ 3 | -14.860 |
| 781 | 3.95 × 10 —2 | \ (\ dfrac {1} {T}\: (K^ {-1})\)” style="Nakala-align:katikati; "> 1.28 × 10 ˚ 3 | -3.231 |
Baada ya kuhesabu\(\dfrac{1}{T}\) na ln k, tunaweza kubadilisha katika equation:
\[E_\ce{a}=\mathrm{−8.314\:J\:mol^{−1}\:K^{−1}\left(\dfrac{−3.231−(−14.860)}{1.28×10^{−3}\:K^{−1}−1.80×10^{−3}\:K^{−1}}\right)} \nonumber \]
na matokeo ni E = 185,900 J/mol.
Njia hii ni ya ufanisi sana, hasa wakati idadi ndogo ya kiwango cha tegemezi ya joto hupatikana kwa majibu ya riba.
Kiwango cha mara kwa mara kwa kiwango cha kuharibika kwa N 2 O 5 hadi NO na O 2 katika awamu ya gesi ni 1.66 L/mol/s saa 650 K na 7.39 L/mol/s saa 700 K:
\[\ce{2N2O5}(g)⟶\ce{4NO}(g)+\ce{3O2}(g) \nonumber \]
Kutokana na kinetics ya mmenyuko huu ni sawa na equation Arrhenius, mahesabu ya nishati ya uanzishaji kwa uharibifu huu.
- Jibu
-
113,000 J/mol
Muhtasari
Athari za kemikali zinahitaji migongano kati ya aina za reactant. Hizi migongano reactant lazima ya mwelekeo sahihi na nishati ya kutosha ili kusababisha malezi ya bidhaa. Nadharia ya mgongano hutoa maelezo rahisi lakini yenye ufanisi kwa athari za vigezo vingi vya majaribio kwenye viwango vya majibu. Ulinganisho wa Arrhenius unaelezea uhusiano kati ya kiwango cha majibu ya mara kwa mara na nishati yake ya uanzishaji, joto, na utegemezi wa mwelekeo wa mgongano.
Mlinganyo muhimu
- \(k=Ae^{−E_a/RT}\)
- \(\ln k=\left(\dfrac{−E_\ce{a}}{R}\right)\left(\dfrac{1}{T}\right)+\ln A\)
- \(\ln\dfrac{k_1}{k_2}=\dfrac{E_\ce{a}}{R}\left(\dfrac{1}{T_2}−\dfrac{1}{T_1}\right)\)
faharasa
- ulioamilishwa tata
- (pia, hali ya mpito) mchanganyiko usio na uhakika wa aina za reactant zinazowakilisha hali ya juu ya nishati ya mfumo wa majibu
- nishati ya uanzishaji (E a)
- nishati muhimu ili mmenyuko ufanyike
- Arrhenius equation
- hisabati uhusiano kati ya kiwango cha mara kwa mara na nishati Activation ya mmenyuko
- nadharia mgongano
- mfano kwamba inasisitiza nishati na mwelekeo wa migongano Masi kueleza na kutabiri kinetics mmenyuko
- sababu ya mzunguko (A)
- uwiano wa mara kwa mara katika equation ya Arrhenius, kuhusiana na idadi ya jamaa ya migongano yenye mwelekeo unaoweza kuongoza kwenye malezi ya bidhaa


