12.6: Mfumo wa Majibu
- Page ID
- 176452
- Tofautisha athari za wavu kutoka kwa athari za msingi (hatua)
- Kutambua molekuli ya athari za msingi
- Andika uwiano kemikali equation kwa ajili ya mchakato kutokana na majibu yake utaratibu
- Hupata sheria ya kiwango sambamba na utaratibu kupewa majibu
Equation uwiano kwa mmenyuko wa kemikali inaonyesha nini kinachojibu na kile kinachozalishwa, lakini inaonyesha chochote kuhusu jinsi majibu yanavyofanyika. Utaratibu wa majibu (au njia ya majibu) ni mchakato, au njia, ambayo majibu hutokea. Mara nyingi mmenyuko wa kemikali hutokea kwa hatua, ingawa haiwezi kuwa dhahiri kwa mwangalizi. Uharibifu wa ozoni, kwa mfano, unaonekana kufuata utaratibu na hatua mbili:
\ [ce {O3} (g)\ ce {O2} (g) +\ ce {O}\\ ce {O}
\\ ce {O} +\ ce {O3} (g)\ ce {2O2} (g)\ studio {12.7.1}\]
Tunaita kila hatua katika utaratibu wa majibu majibu ya msingi. Athari za msingi hutokea hasa kama zilivyoandikwa na haziwezi kuvunjwa kuwa hatua rahisi. Athari ya msingi huongeza hadi majibu ya jumla, ambayo, kwa kuharibika, ni:
\[\ce{2O3}(g)⟶\ce{3O2}(g) \label{12.7.2} \]
Angalia kwamba atomi ya oksijeni inayozalishwa katika hatua ya kwanza ya utaratibu huu inatumiwa katika hatua ya pili na kwa hiyo haionekani kama bidhaa katika mmenyuko wa jumla. Aina zinazozalishwa kwa hatua moja na zinazotumiwa katika hatua inayofuata zinaitwa intermediates.
Wakati equation ya jumla ya mmenyuko kwa utengano wa ozoni inaonyesha kuwa molekuli mbili za ozoni huguswa kutoa molekuli tatu za oksijeni, utaratibu wa mmenyuko hauhusishi mgongano na mmenyuko wa molekuli mbili za ozoni. Badala yake, inahusisha molekuli ya ozoni inayoharibika kwa molekuli ya oksijeni na atomi ya kati ya oksijeni; atomi ya oksijeni kisha humenyuka na molekuli ya pili ya ozoni kutoa molekuli mbili za oksijeni Athari hizi mbili za msingi hutokea hasa kama zinavyoonyeshwa katika utaratibu wa majibu.
Mitikio ya msingi ya Unimolecular
Masi ya mmenyuko wa msingi ni idadi ya aina za reactant (atomi, molekuli, au ions). Kwa mfano, mmenyuko unimolecular unahusisha rearrangement ya aina moja reactant kuzalisha molekuli moja au zaidi ya bidhaa:
\[A⟶\ce{products} \label{12.7.2b} \]
Equation ya kiwango cha mmenyuko unimolecular ni:
\[\ce{rate}=k[A] \label{12.7.3} \]
Menyu ya unimolecular inaweza kuwa moja ya athari kadhaa za msingi katika utaratibu tata. Kwa mfano, majibu:
\[\ce{O3 ⟶ O2 + O} \label{12.7.4} \]
inaonyesha mmenyuko wa msingi wa unimolecular ambayo hutokea kama sehemu moja ya utaratibu wa majibu ya hatua mbili. Hata hivyo, baadhi ya athari unimolecular inaweza kuwa na majibu moja tu katika utaratibu wa majibu. (Kwa maneno mengine, mmenyuko wa msingi pia unaweza kuwa majibu ya jumla katika baadhi ya matukio.) Kwa mfano, kuharibika kwa awamu ya gesi ya cyclobutane, C 4 H 8, kwa ethylene, C 2 H 4, hutokea kupitia utaratibu wa unimolecular, moja-hatua:
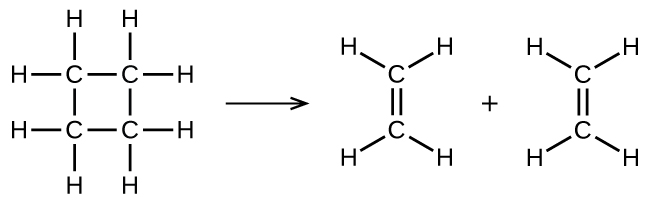
Kwa athari hizi za unimolecular kutokea, yote yanayotakiwa ni kutenganishwa kwa sehemu za molekuli moja ya reactant katika bidhaa.
Vifungo vya kemikali havianguka tu wakati wa athari za kemikali. Nishati inahitajika kuvunja vifungo vya kemikali. Nishati ya uanzishaji kwa kuharibika kwa C 4 H 8, kwa mfano, ni 261 kJ kwa mole. Hii ina maana kwamba inahitaji 261 kilojoules kupotosha mole moja ya molekuli hizi katika complexes ulioamilishwa ambayo hutengana katika bidhaa:
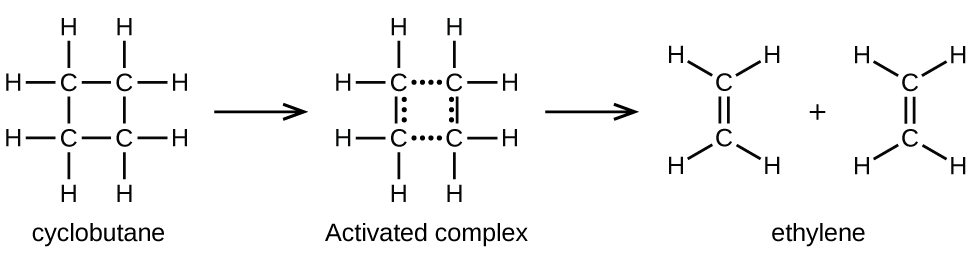
Katika sampuli ya C 4 H 8, wachache wa molekuli zinazohamia kwa kasi za C 4 H 8 zinapigana na molekuli nyingine zinazohamia haraka na kuchukua nishati ya ziada. Wakati molekuli za C 4 H 8 zinapata nishati ya kutosha, zinaweza kubadilisha kuwa ngumu iliyoamilishwa, na malezi ya molekuli ya ethylene yanaweza kutokea. Kwa kweli, mgongano hasa wa juhudi hugonga molekuli ya C 4 H 8 ndani ya jiometri ya tata iliyoamilishwa. Hata hivyo, sehemu ndogo tu ya molekuli za gesi husafiri kwa kasi ya kutosha na nguvu kubwa za kutosha za kinetic ili kukamilisha hili. Kwa hiyo, wakati wowote, molekuli chache tu huchukua nishati ya kutosha kutoka kwa migongano ili kuitikia.
Kiwango cha kuharibika kwa C 4 H 8 ni sawa sawa na ukolezi wake. Mara mbili mkusanyiko wa C 4 H 8 katika sampuli hutoa molekuli mara mbili kwa lita. Ingawa sehemu ya molekuli yenye nishati ya kutosha kuitikia inabakia sawa, jumla ya idadi ya molekuli hizo ni mara mbili kubwa. Kwa hiyo, kuna mara mbili ya C 4 H 8 kwa lita, na kiwango cha majibu ni mara mbili kwa haraka:
\[\ce{rate}=−\dfrac{Δ[\ce{C4H8}]}{Δt}=k[\ce{C4H8}] \label{12.7.5} \]
Uhusiano sawa unatumika kwa mmenyuko wowote wa msingi wa unimolecular; kiwango cha mmenyuko ni moja kwa moja sawia na mkusanyiko wa mmenyuko, na majibu yanaonyesha tabia ya kwanza. Mara kwa mara uwiano ni kiwango cha mara kwa mara kwa mmenyuko fulani wa unimolecular.
Mitikio ya msingi ya Bimolecular
Mgongano na mchanganyiko wa molekuli mbili au atomi kuunda tata iliyoamilishwa katika mmenyuko wa msingi huitwa mmenyuko wa bimolecular. Kuna aina mbili za athari za msingi za bimolecular:
\[A+B⟶\ce{products} \label{12.7.6} \]
na
\[2A⟶\ce{products} \label{12.7.7} \]
Kwa aina ya kwanza, ambayo molekuli mbili za reactant ni tofauti, sheria ya kiwango ni ya kwanza katika A na utaratibu wa kwanza katika B:
\[\ce{rate}=k[A][B] \label{12.7.8} \]
Kwa aina ya pili, ambayo molekuli mbili zinazofanana zinapigana na kuguswa, sheria ya kiwango ni amri ya pili katika A:
\[\ce{rate}=k[A][A]=k[A]^2 \label{12.7.9} \]
Baadhi ya athari za kemikali zina taratibu ambazo zinajumuisha mmenyuko mmoja wa msingi wa bimolecular. Mfano mmoja ni mmenyuko wa dioksidi ya nitrojeni na monoxide kaboni:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{NO}(g)+\ce{CO2}(g) \label{12.7.10} \]
(angalia Kielelezo\(\PageIndex{1}\))

Athari za msingi za bimolecular zinaweza pia kuhusishwa kama hatua katika utaratibu wa mmenyuko wa multistep. Mmenyuko wa oksijeni ya atomiki na ozoni ni mfano mmoja:
\[\ce{O}(g)+\ce{O3}(g)⟶\ce{2O2}(g) \label{12.7.12} \]
Thermolecular ya msingi athari
Mmenyuko wa msingi wa termolecular unahusisha mgongano wa wakati mmoja wa atomi tatu, molekuli, au ions. Athari za msingi za termolecular ni kawaida kwa sababu uwezekano wa chembe tatu zinazogongana wakati huo huo ni chini ya elfu moja ya uwezekano wa chembe mbili zinazogongana. Kuna, hata hivyo, wachache imara termolecular athari ya msingi. Mmenyuko wa oksidi ya nitriki na oksijeni inaonekana kuhusisha hatua za termolecular:
\ [\ ce {2NO + O2 2NO2}\
\ ce {kiwango} =k [\ ce {NO}] ^2 [\ ce {O2}]\ studio {12.7.13}\]
Vivyo hivyo, mmenyuko wa oksidi ya nitriki na klorini inaonekana kuhusisha hatua za termolecular:
\ [\ ce {2NO + Cl2 2noCl}\
\ ce {kiwango} =k [\ ce {NO}] ^2 [\ ce {Cl2}]\ studio {12.7.14}\]
Kuhusiana na utaratibu wa majibu ya Kiwango cha Sheria
Mara nyingi ni kesi kwamba hatua moja katika utaratibu wa mmenyuko wa multistep ni polepole sana kuliko wengine. Kwa sababu mmenyuko hauwezi kuendelea kwa kasi zaidi kuliko hatua yake ya polepole zaidi, hatua hii itapunguza kiwango ambacho majibu ya jumla hutokea. Hatua ya polepole zaidi inaitwa hatua ya upeo wa kiwango (au hatua ya kuamua kiwango) ya Kielelezo cha majibu\(\PageIndex{2}\).

Kama ilivyoelezwa hapo awali, sheria ya kiwango inaweza kuwa inayotokana moja kwa moja kutoka equations kemikali kwa ajili ya athari ya msingi. Hii sio kesi, hata hivyo, kwa athari za kawaida za kemikali. Equations ya usawa mara nyingi hukutana inawakilisha mabadiliko ya jumla kwa mfumo fulani wa kemikali, na mara nyingi hii ni matokeo ya utaratibu wa mmenyuko wa multistep. Katika kila kesi, ni lazima kuamua sheria ya kiwango cha jumla kutoka data ya majaribio na kuthibitisha utaratibu kutoka sheria ya kiwango (na wakati mwingine kutoka data nyingine). Majibu ya NO 2 na CO hutoa mfano wa mfano:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{CO2}(g)+\ce{NO}(g) \nonumber \]
Kwa joto la juu ya 225 °C, sheria ya kiwango imepatikana kuwa:
\[\ce{rate}=k[\ce{NO2}][\ce{CO}] \nonumber \]
Majibu ni amri ya kwanza kwa heshima na NO 2 na utaratibu wa kwanza kwa heshima na CO. Hii ni sawa na utaratibu wa bimolecular moja na inawezekana kwamba hii ndiyo utaratibu wa mmenyuko huu kwa joto la juu.
Katika joto chini ya 225 °C, mmenyuko unaelezewa na sheria ya kiwango ambacho ni utaratibu wa pili kwa heshima ya NO 2:
\[\ce{rate}=k[\ce{NO2}]^2 \nonumber \]
Hii ni sawa na utaratibu unaohusisha athari mbili za msingi, ambazo kwanza ni polepole na kwa hiyo ni hatua ya kuamua kiwango:
\ [ce {NO2} (g) +\ ce {NO2} (g)\ ce {NO3} (g) +\ ce {NO} (g)\\ ce {NO} (g)\
\ ce {NO3} (g) +\ ce {CO} (g)\ ce {NO2} (g) +\ ce {CO2} (g)\\ ce {haraka)}\ nonumber\]
Hatua ya kuamua kiwango hutoa sheria ya kiwango cha kuonyesha utegemezi wa pili kwenye mkusanyiko wa NO 2, na jumla ya milinganyo miwili inatoa majibu ya jumla ya wavu.
Kwa ujumla, wakati kiwango cha kuamua (polepole) hatua ni hatua ya kwanza katika utaratibu, sheria ya kiwango cha majibu ya jumla ni sawa na sheria ya kiwango cha hatua hii. Hata hivyo, wakati hatua ya kuamua kiwango inatanguliwa na hatua inayohusisha mmenyuko wa usawa, sheria ya kiwango cha majibu ya jumla inaweza kuwa vigumu zaidi kupata.
Mmenyuko wa msingi ni katika usawa wakati unapoendelea katika maelekezo yote ya mbele na ya nyuma kwa viwango sawa. Fikiria dimerization ya NO kwa N 2 O 2, na k 1 kutumika kuwakilisha kiwango cha mara kwa mara ya majibu ya mbele na k -1 kutumika kuwakilisha kiwango cha mara kwa mara ya mmenyuko reverse:
\[\ce{NO + NO ⇌ N2O2} \nonumber \]
\[\ce{rate_{forward}=rate_{reverse}} \nonumber \]
\[k_1[\ce{NO}]^2=k_{−1}[\ce{N2O2}] \nonumber \]
Ikiwa N 2 O 2 ilikuwa ya kati katika utaratibu, maneno haya yanaweza kupangwa upya ili kuwakilisha mkusanyiko wa N 2 O 2 katika kujieleza kwa kiwango cha jumla cha sheria kwa kutumia udanganyifu wa algebraic:
\[\mathrm{\left(\dfrac{k_1[NO]^2}{k_{−1}}\right)=[N_2O_2]} \nonumber \]
Hata hivyo, mara nyingine tena, intermediates hawezi kuwa waliotajwa kama sehemu ya jumla kiwango kujieleza sheria, ingawa wanaweza kuwa ni pamoja na katika mtu binafsi majibu ya msingi ya utaratibu. Mfano\(\PageIndex{1}\) utaonyesha jinsi ya kupata sheria za kiwango cha jumla kutoka kwa taratibu zinazohusisha hatua za usawa kabla ya hatua ya kuamua kiwango.
Mfumo wa Nitryl kloridi (NO 2 Cl) hutengana na dioksidi ya nitrojeni (NO 2) na gesi ya klorini (Cl 2) kulingana na utaratibu wafuatayo:
- \(\ce{2NO2Cl}(g)⇌\ce{ClO2}(g)+\ce{N2O}(g)+\ce{ClO}(g)\)(haraka, k 1 inawakilisha kiwango cha mara kwa mara kwa majibu ya mbele na k -1 kiwango cha mara kwa mara kwa mmenyuko wa reverse)
- \(\ce{N2O}(g)+\ce{ClO2}(g)⇌\ce{NO2}(g)+\ce{NOCl}(g)\)(haraka, k 2 kwa majibu ya mbele, k -1 kwa mmenyuko wa reverse)
- \(\ce{NOCl + ClO ⟶ NO2 + Cl2}\)(polepole, k 3 kiwango cha mara kwa mara kwa majibu ya mbele)
Kuamua majibu ya jumla, kuandika kiwango cha sheria kujieleza kwa kila mmenyuko wa msingi, kutambua intermediates yoyote, na kuamua kiwango cha jumla kujieleza sheria.
Suluhisho
Kwa majibu ya jumla, tu jumla ya hatua tatu, kufuta intermediates, na kuchanganya kama formula:
\[\ce{2NO2Cl}(g)⟶\ce{2NO2}(g)+\ce{Cl2}(g) \nonumber \]
Kisha, weka kiwango cha sheria ya kujieleza kwa kila mmenyuko wa msingi. Kumbuka kwamba kwa athari ya msingi ambayo ni sehemu ya utaratibu, kiwango cha sheria kujieleza inaweza kuwa inayotokana moja kwa moja kutoka stoichiometry:
\ [kuanza {align*}
k_1\ ce {[No2Cl] 2} &=k_ {-1}\ ce {[ClO2] [N2O] [ClO]}\\
k_2\ ce {[N2O] [ClO2]} & =k_ {\2}\ ce {[NO2] [NoCl]}\\ ce {[N2O] [Kiwango} &=k_ {\2}\\ ce {[NOCl]]
\\ ce {[N2O]] _3\ ce {[NoCl] [ClO]}
\ mwisho {align*}\ nonumber\]
Hatua ya tatu, ambayo ni hatua ya polepole, ni hatua ya kuamua kiwango. Kwa hiyo, kiwango cha jumla cha sheria kujieleza inaweza kuandikwa kama Kiwango = k 3 [NoCl] [ClO]. Hata hivyo, wote NoCl na ClO ni intermediates. Maneno ya algebraic yanapaswa kutumika kuwakilisha [NoCl] na [ClO] kama kwamba hakuna intermediates kubaki katika kiwango cha jumla kujieleza sheria.
- Kutumia mmenyuko wa msingi 1,\(\ce{[ClO]}=\dfrac{k_1\ce{[NO2Cl]^2}}{k_{−1}\ce{[ClO2][N2O]}}\).
- Kutumia mmenyuko wa msingi 2,\(\ce{[NOCl]}=\dfrac{k_2\ce{[N2O][ClO2]}}{k_{−2}\ce{[NO2]}}\).
Sasa badala maneno haya algebraic katika jumla kiwango cha sheria kujieleza na kurahisisha:
\ [kuanza {align*}
\ ce {kiwango} &=k_3\ kushoto (\ dfrac {k_2\ ce {[N2O] [ClO2]}} {k_ {\2}\ ce {[NO2]}}\ kulia)\ kushoto (\ dfrac {k_1\ ce {[No2Cl] ^2}} {k_ {-1}\ ce {[No2Cl]] {[ClO2] [N2O]}}\ haki)
\\ ce {kiwango} &=\ dfrac {k_3k_2k_1\ ce {[No2Cl] ^2}} {k_ {Δ 2} k_ {-1}\ ce {[NO2]}}
\ mwisho {align*}\ nonumber\]
Kumbuka kwamba sheria hii ya kiwango inaonyesha utegemezi kinyume juu ya mkusanyiko wa aina moja ya bidhaa, sambamba na kuwepo kwa hatua ya usawa katika utaratibu wa majibu.
Klorini ya atomiki katika anga humenyuka na ozoni katika jozi zifuatazo za athari za msingi:
\(\ce{Cl}+\ce{O3}(g)⟶\ce{ClO}(g)+\ce{O2}(g)\hspace{20px}(\textrm{rate constant }k_1)\)
Kuamua majibu ya jumla, kuandika kiwango cha sheria kujieleza kwa kila mmenyuko wa msingi, kutambua intermediates yoyote, na kuamua kiwango cha jumla kujieleza sheria.
- Jibu
-
- majibu ya jumla:\(\ce{O3}(g)+\ce{O}⟶\ce{2O2}(g)\)
- kiwango cha 1 = k 1 [The 3] [Cl]; kiwango cha 2 = k 2 [ClO] [The]
- kati: ClO (g)
- kiwango cha jumla = k 2 k 1 [the 3] [Cl] [The]
Muhtasari
Mlolongo wa hatua za kibinafsi, au athari za msingi, ambazo majibu hubadilishwa kuwa bidhaa wakati wa majibu huitwa utaratibu wa majibu. Kiwango cha jumla cha mmenyuko kinatambuliwa na kiwango cha hatua ya polepole, inayoitwa hatua ya kuamua kiwango. Athari za msingi zisizo na kawaida zina sheria za kiwango cha kwanza, wakati athari za msingi za bimolecular zina sheria za kiwango cha pili. Kwa kulinganisha sheria kiwango inayotokana na utaratibu mmenyuko na kwamba kuamua majaribio, utaratibu inaweza kuwa aliona ama sahihi au plausible.
maelezo ya chini
- Swali hili linachukuliwa kutoka kwa Uchunguzi wa Uwekaji wa Kemia ya Juu na hutumiwa kwa idhini ya Huduma ya Upimaji wa Elimu.
faharasa
- mmenyuko wa bimolecular
- msingi mmenyuko kuwashirikisha mgongano na mchanganyiko wa aina mbili reactant
- mmenyuko wa msingi
- mmenyuko unaofanyika just kama depicted katika equation yake kemikali
- kati
- molekuli au ion zinazozalishwa katika hatua moja ya utaratibu mmenyuko na zinazotumiwa katika mwingine
- molekuli
- idadi ya aina reactant (atomi, molekuli au ions) kushiriki katika mmenyuko wa msingi
- hatua ya kuamua kiwango
- (pia, hatua ya kupunguza kiwango) majibu ya msingi ya polepole katika utaratibu wa majibu; huamua kiwango cha majibu ya jumla
- utaratibu wa majibu
- hatua kwa hatua mlolongo wa athari ya msingi ambayo mabadiliko ya kemikali unafanyika
- mmenyuko wa termolekuli
- mmenyuko wa msingi unaohusisha mgongano wa wakati mmoja na mchanganyiko wa aina tatu za reactant
- mmenyuko wa unimolecular
- mmenyuko wa msingi unaohusisha rearrangement ya aina moja ya reactant kuzalisha molekuli moja au zaidi ya bidhaa


