11.3: umumunyifu
- Page ID
- 176210
- Eleza madhara ya joto na shinikizo juu ya umumunyifu
- Hali ya sheria Henry na matumizi yake katika mahesabu kuwashirikisha umumunyifu wa gesi katika kioevu
- Eleza digrii za umumunyifu iwezekanavyo kwa ufumbuzi wa kioevu-kioevu
Fikiria kuongeza kiasi kidogo cha chumvi kwenye kioo cha maji, kuchochea mpaka chumvi zote zimeharibika, na kisha kuongeza kidogo zaidi. Unaweza kurudia mchakato huu mpaka chumvi mkusanyiko wa ufumbuzi kufikia kikomo yake ya asili, kikomo imedhamiriwa hasa na uwezo jamaa wa solute-solute, soluti-kutengenezea, na kutengenezea vikosi vya kuvutia vilivyojadiliwa katika modules mbili zilizopita za sura hii. Unaweza kuwa na uhakika kwamba umefikia kikomo hiki kwa sababu, bila kujali muda gani unasumbua suluhisho, chumvi isiyofunguliwa bado. Mkusanyiko wa chumvi katika suluhisho kwa hatua hii inajulikana kama umumunyifu wake.
Umumunyifu wa solute katika kutengenezea fulani ni mkusanyiko wa kiwango cha juu ambacho kinaweza kupatikana chini ya hali iliyotolewa wakati mchakato wa kufutwa ni katika usawa. Akizungumzia mfano wa chumvi katika maji:
\[\ce{NaCl}(s)⇌\ce{Na+}(aq)+\ce{Cl-}(aq) \label{11.4.1} \]
Wakati mkusanyiko wa solute ni sawa na umumunyifu wake, suluhisho inasemekana kuwa imejaa na solute hiyo. Ikiwa mkusanyiko wa solute ni chini ya umumunyifu wake, suluhisho inasemekana kuwa haijatumiwa. Suluhisho ambalo lina mkusanyiko mdogo wa solute huitwa kuondokana, na moja yenye ukolezi wa juu huitwa kujilimbikizia.
Ikiwa tunaongeza chumvi zaidi kwenye suluhisho la chumvi iliyojaa, tunaona inaanguka chini na hakuna tena inaonekana kufuta. Kwa kweli, chumvi iliyoongezwa haina kufuta, kama inawakilishwa na mwelekeo wa mbele wa equation ya kuvunjwa. Kufuatana na mchakato huu, chumvi iliyovunjika itapungua, kama inavyoonyeshwa na mwelekeo wa nyuma wa equation. Mfumo huo unasemekana kuwa katika usawa wakati taratibu hizi mbili za kurudia zinatokea kwa viwango sawa, na hivyo kiasi cha chumvi ambacho haijafutwa na kufutwa kinabaki mara kwa mara. Msaada kwa ajili ya tukio la wakati huo huo wa mchakato wa kuvunjwa na mvua hutolewa kwa kutambua kwamba idadi na ukubwa wa fuwele za chumvi zisizoharibika zitabadilika kwa muda, ingawa molekuli yao ya pamoja itabaki sawa.
Ufumbuzi unaweza kuwa tayari ambapo mkusanyiko wa solute huzidi umumunyifu wake. Ufumbuzi huo unasemekana kuwa supersaturated, na ni mifano ya kuvutia ya majimbo yasiyo ya usawa. Kwa mfano, kinywaji cha kaboni katika chombo kilicho wazi ambacho bado hakijawahi “gorofa” kina supersaturated na gesi ya dioksidi kaboni; wakati uliopewa, mkusanyiko wa CO 2 utapungua hadi kufikia thamani yake ya usawa.
Ufumbuzi wa Gesi katika Liquids
Katika moduli ya awali ya sura hii, athari za majeshi ya kuvutia ya intermolecular juu ya malezi ya suluhisho ilijadiliwa. Miundo ya kemikali ya solute na kutengenezea inaamuru aina ya nguvu iwezekanavyo na, kwa hiyo, ni mambo muhimu katika kuamua umumunyifu. Kwa mfano, chini ya hali kama hiyo, umumunyifu wa maji wa oksijeni ni takriban mara tatu zaidi kuliko ile ya heliamu, lakini mara 100 chini ya umumunyifu wa kloromethane, ChCl 3. Kuzingatia jukumu la muundo wa kemikali ya kutengenezea, kumbuka kuwa umumunyifu wa oksijeni katika hydrocarbon hexane kioevu, C 6 H 14, ni takriban mara 20 zaidi kuliko ilivyo katika maji.
Sababu nyingine pia huathiri umumunyifu wa dutu iliyotolewa katika kutengenezea kupewa. Joto ni moja ya sababu hiyo, na umumunyifu wa gesi kawaida kupungua kama ongezeko la joto (Kielelezo\(\PageIndex{1}\)). Hii ni moja ya athari kubwa kutokana na uchafuzi wa joto wa miili ya asili ya maji.
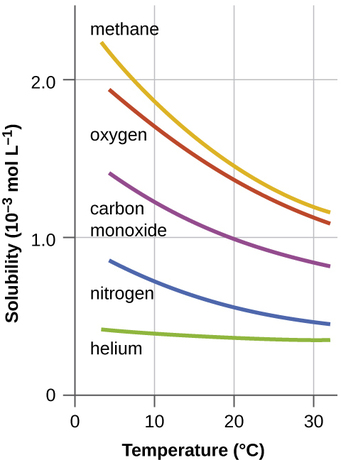
Wakati joto la mto, ziwa, au mkondo hufufuliwa kwa kawaida juu, kwa kawaida kutokana na kutokwa kwa maji ya moto kutokana na mchakato fulani wa viwanda, umumunyifu wa oksijeni ndani ya maji unapungua. Kupungua kwa viwango vya oksijeni kufutwa inaweza kuwa na madhara makubwa kwa afya ya mazingira ya maji na, katika hali mbaya, inaweza kusababisha kuua samaki kwa kiasi kikubwa (Kielelezo\(\PageIndex{2}\)).

Umumunyifu wa solute ya gesi pia huathiriwa na shinikizo la sehemu ya solute katika gesi ambayo suluhisho linafunuliwa. Umumunyifu wa gesi huongezeka kadiri shinikizo la gesi linavyoongezeka. Vinywaji vya kaboni hutoa mfano mzuri wa uhusiano huu. Mchakato wa kaboni unahusisha kufichua kinywaji kwa shinikizo la juu kiasi cha gesi ya dioksidi kaboni na kisha kuziba chombo cha kinywaji, hivyo kueneza kinywaji na CO 2 kwa shinikizo hili. Wakati chombo kinywaji ni kufunguliwa, Hiss ukoo ni habari kama carbon dioxide gesi shinikizo ni huru, na baadhi ya dioksidi kaboni kufutwa ni kawaida kuonekana kuacha ufumbuzi katika mfumo wa Bubbles ndogo (Kielelezo\(\PageIndex{3}\)). Katika hatua hii, kinywaji ni supersaturated na dioksidi kaboni na, baada ya muda, kufutwa kaboni dioksidi mkusanyiko itapungua kwa thamani yake ya usawa na kinywaji itakuwa “gorofa.”

Kwa solutes nyingi za gesi, uhusiano kati ya umumunyifu\(C_g\),, na shinikizo la sehemu\(P_g\), ni sawa sawa:
\[C_\ce{g}=kP_\ce{g} \nonumber \]
ambapo\(k\) ni mara kwa mara uwiano ambayo inategemea utambulisho wa solute ya gesi na kutengenezea, na juu ya joto la suluhisho. Hii ni taarifa ya hisabati ya sheria ya Henry: Kiasi cha gesi bora ambayo hupasuka kwa kiasi kikubwa cha kioevu ni sawa sawa na shinikizo la gesi.
Katika 20 °C, mkusanyiko wa oksijeni iliyoyeyushwa katika maji iliyo wazi kwa oksijeni ya gesi kwenye shinikizo la sehemu ya 101.3 kPa (760 torr) ni 1.38 × 10 -3 mol L -1. Tumia sheria ya Henry kuamua umumunyifu wa oksijeni wakati shinikizo lake la sehemu ni 20.7 kPa (155 torr), shinikizo la takriban la oksijeni katika anga ya dunia.
Suluhisho
Kwa mujibu wa sheria ya Henry, kwa suluhisho bora umumunyifu, C g, wa gesi (1.38 × 10 -3 mol L -1, katika kesi hii) ni sawia moja kwa moja na shinikizo, P g, ya gesi isiyofutwa juu ya suluhisho (101.3 kPa, au 760 torr, katika kesi hii). Kwa sababu tunajua wote C g na P g, tunaweza upya maneno haya kutatua kwa k.
\ [kuanza {align*}
C_\ ce {g} &=KP_\ ce {g}\\ [4pt]
k&=\ dfrac {C_\ ce {g}} {P_\ ce {g}}\\ [4pt]
&=\ hesabu {\ dfrac {1.38×10^ {˚ 3}\ :mol\ :L^ {-1}} {101.3\ :kPa}}\\ [4pt]
&=\ mathrm {1.36×10^ {-5}\: mol\ :L ^ {-1}\: KPA ^ {—1}}\\ [4pt]
&\ hnafasi {15px}\ mathrm {(1.82×10^ {-6}\: mol\ :L ^ {-1}\: torr^ {-1})}
\ mwisho {align*}\ hakuna nambari\]
Sasa tunaweza kutumia k kupata umumunyifu kwenye shinikizo la chini.
\[C_\ce{g}=kP_\ce{g} \nonumber \]
\ [hesabu {1.36×10^ {-5}\: mol\: L ^ {-1}\: kPa ^ {-1} × 20.7\: kPa\\ [4pt]
(au\ :1.82×10^ {18-6}\: mol\ :L ^ {-1}\: torr^ {-1} × 155\: torr)\\ [4pt]
=2.82×10 ^ {-4}\: mol\: L ^ {-1}}\ hakuna idadi\]
Kumbuka kwamba vitengo mbalimbali inaweza kutumika kueleza kiasi kushiriki katika aina hizi za hesabu. Mchanganyiko wowote wa vitengo vinavyotokana na vikwazo vya uchambuzi wa mwelekeo ni kukubalika.
Kufichua sampuli ya 100.0 mL ya maji kwenye 0 °C kwa angahewa iliyo na solute ya gesi kwenye 20.26 kPa (152 torr) ilisababisha kuvunjwa kwa 1.45 × 10 —3 g ya solute. Tumia sheria ya Henry kuamua umumunyifu wa solute hii ya gesi wakati shinikizo lake ni 101.3 kPa (760 torr).
- Jibu
-
7.25 × 10 -3 g katika 100.0 ml au 0.0725 g/L
Ugonjwa wa decompression (DCS), au “bends,” ni athari ya shinikizo la kuongezeka kwa hewa iliyovutwa na scuba mbalimbali wakati wa kuogelea chini ya maji kwa kina kirefu. Mbali na shinikizo linalofanywa na anga, aina mbalimbali zinakabiliwa na shinikizo la ziada kutokana na maji juu yao, na kuongezeka kwa takriban 1 atm kwa kila m 10 ya kina. Kwa hiyo, hewa inhaled na diver wakati iliyokuwa ina gesi katika sambamba shinikizo la juu iliyoko, na viwango vya gesi kufutwa katika damu ya diver ni proportionally juu kwa sheria ya Henry.
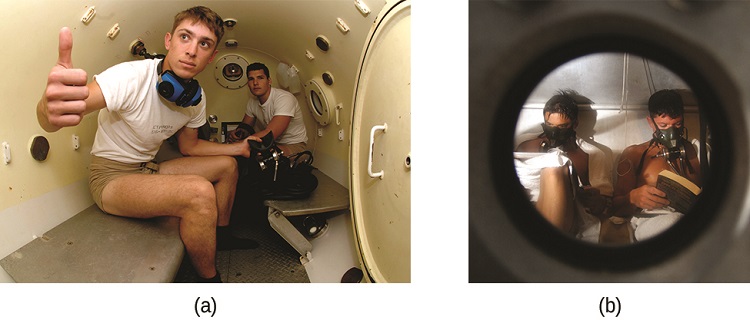
Kama diver inapanda juu ya uso wa maji, shinikizo la kawaida hupungua na gesi zilizovunjika huwa chini ya mumunyifu. Ikiwa kupanda ni haraka mno, gesi zinazokimbia kutoka damu ya diver zinaweza kutengeneza Bubbles ambazo zinaweza kusababisha dalili mbalimbali kuanzia vipele na maumivu ya pamoja hadi kupooza na kifo. Ili kuepuka DCS, aina mbalimbali zinapaswa kupaa kutoka kwa kina kwa kasi ya polepole (10 au 20 m/min) au vinginevyo kufanya vituo kadhaa vya decompression, kuacha kwa dakika kadhaa kwa kina kilichopewa wakati wa kupanda. Wakati hatua hizi za kuzuia hazifanikiwa, mara nyingi mbalimbali na DCS hutolewa tiba ya oksijeni ya hyperbaric katika vyombo vya shinikizo vinavyoitwa decompression (au recompression) vyumba (Kielelezo\(\PageIndex{4}\)).
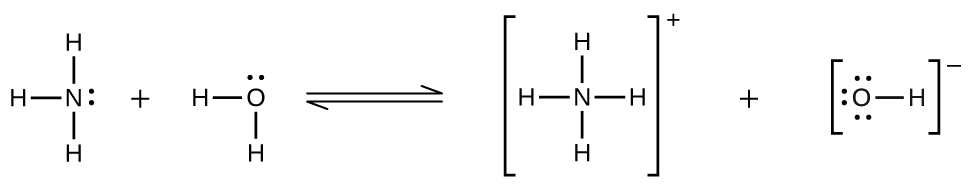
Mapungufu kutoka kwa sheria ya Henry huzingatiwa wakati mmenyuko wa kemikali unafanyika kati ya solute ya gesi na kutengenezea. Hivyo, kwa mfano umumunyifu wa amonia katika maji hauzidi kwa kasi na shinikizo la kuongezeka kama ilivyotabiriwa na sheria kwa sababu amonia, kuwa msingi, humenyuka kwa kiasi fulani na maji kuunda ioni za amonia na ioni hidroksidi.
Gesi zinaweza kuunda ufumbuzi wa supersaturated. Ikiwa suluhisho la gesi katika kioevu linatayarishwa ama kwa joto la chini au chini ya shinikizo (au vyote viwili), basi kama suluhisho linapungua au kama shinikizo la gesi limepunguzwa, suluhisho linaweza kuwa supersaturated. Mwaka 1986, watu zaidi ya 1700 nchini Cameroon waliuawa wakati wingu la gesi, karibu na kaboni dioksidi, lilipigwa kutoka Ziwa Nyos (Kielelezo\(\PageIndex{5}\)), ziwa la kina katika volkeno la volkeno. Maji yaliyo chini ya Ziwa Nyos yanajaa dioksidi kaboni kwa shughuli za volkeno chini ya ziwa. Inaaminika kuwa ziwa lilipata mauzo kutokana na joto la polepole kutoka chini ya ziwa, na maji ya joto, chini ya mnene yaliyojaa dioksidi kaboni yalifikia uso. Kwa hiyo, kiasi kikubwa cha CO 2 kilichopasuka kilitolewa, na gesi isiyo na rangi, ambayo ni denser kuliko hewa, ikatiririka chini ya bonde chini ya ziwa na kuvumilia wanadamu na wanyama wanaoishi bonde.

Ufumbuzi wa Liquids katika Liquids
Tunajua kwamba baadhi ya vinywaji huchanganya kwa kila mmoja; kwa maneno mengine, wana umumunyifu usio na kipimo na wanasemekana kuwa miscible. Ethanol, asidi sulfuriki, na ethylene glycol (maarufu kwa matumizi kama antifreeze, picha katika Kielelezo\(\PageIndex{6}\)) ni mifano ya vinywaji ambazo hazipatikani kabisa na maji. Mafuta mawili ya mzunguko wa mzunguko ni miscible na petroli.

Vinywaji vinavyochanganya na maji kwa uwiano wote ni kawaida vitu vya polar au vitu vinavyounda vifungo vya hidrojeni. Kwa vinywaji vile, vivutio vya dipole-dipole (au bonding hidrojeni) ya molekuli za solute na molekuli za kutengenezea ni angalau kama nguvu kama zile kati ya molekuli katika solute safi au katika kutengenezea safi. Hivyo, aina mbili za molekuli huchanganya kwa urahisi. Vivyo hivyo, majimaji yasiyo ya polar ni miscible na kila mmoja kwa sababu hakuna tofauti appreciable katika nguvu ya solute-solute, kutengenezea kutengenezea, na solvent-solvent vivutio intermolecular. Umumunyifu wa molekuli za polar katika vimumunyisho vya polar na molekuli zisizo za polar katika vimumunyisho vya nonpolar ni, tena, mfano wa axiom ya kemikali “kama hupasuka kama.”
Maji mawili ambayo hayachanganyiki kwa kiwango cha thamani huitwa immiscible. Vipande vinaundwa wakati tunamwaga maji yasiyotumiwa kwenye chombo kimoja. Petroli, mafuta (Kielelezo\(\PageIndex{7}\)), benzini, tetrakloridi ya kaboni, rangi fulani, na vinywaji vingine vingi vya nonpolar havikubaliki na maji. Mvuto kati ya molekuli ya vinywaji vile vya nonpolar na molekuli za maji ya polar ni dhaifu sana. Vivutio tu vya nguvu katika mchanganyiko huo ni kati ya molekuli za maji, hivyo hupunguza kwa ufanisi molekuli za kioevu kisicho na nonpolar. Tofauti kati ya immiscibility na miscibility ni kweli moja ya digrii, ili majimaji miscible ni ya umumunyifu usio kuheshimiana, wakati majimaji alisema kuwa immiscible ni ya chini sana (ingawa si sifuri) umumunyifu kuheshimiana.

Vioevu viwili, kama vile bromini na maji, ambavyo ni vya umumunyifu wa wastani wa pamoja vinasemekana kuwa sehemu ya miscible. Vipande viwili vya miscible kwa kawaida huunda tabaka mbili wakati vikichanganywa. Katika kesi ya mchanganyiko wa bromini na maji, safu ya juu ni maji, imejaa bromini, na safu ya chini ni bromini iliyojaa maji. Kwa kuwa bromini ni nonpolar, na hivyo, si mumunyifu sana katika maji, safu ya maji ni kidogo tu kupasuka na bromini mkali machungwa kufutwa ndani yake. Kwa kuwa umumunyifu wa maji katika bromini ni mdogo sana, hakuna athari inayoonekana kwenye rangi ya giza ya safu ya bromini (Kielelezo\(\PageIndex{8}\)).

Ufumbuzi wa Solids katika Liquids
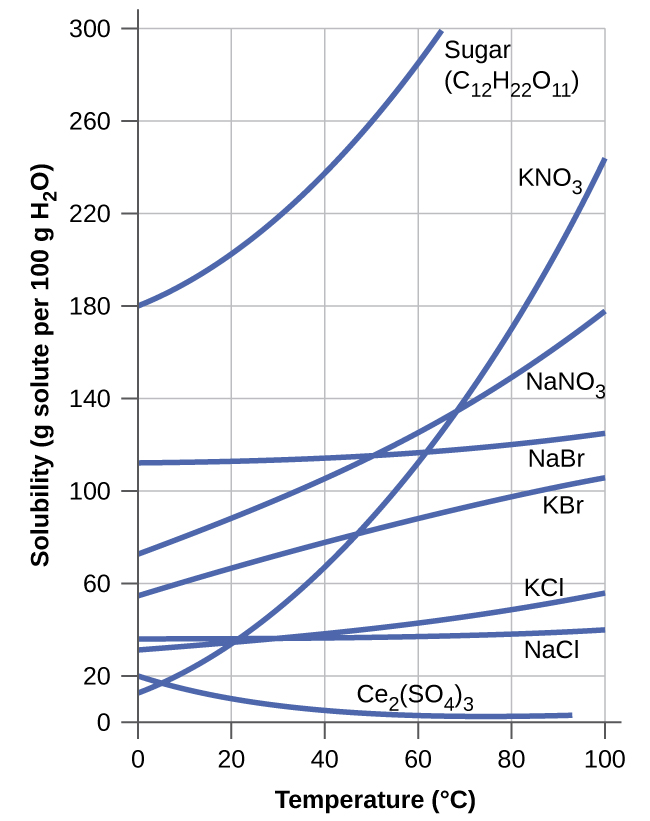
utegemezi wa umumunyifu juu ya joto kwa idadi ya yabisi isokaboni katika maji ni inavyoonekana na curves umumunyifu katika Kielelezo\(\PageIndex{9}\). Kupitia data hizi zinaonyesha mwenendo wa jumla wa kuongezeka kwa umumunyifu na joto, ingawa kuna tofauti, kama inavyoonyeshwa na kiwanja cha ionic cha cerium sulfate.
Utegemezi wa joto wa umumunyifu unaweza kutumiwa ili kuandaa ufumbuzi wa supersaturated wa misombo fulani. Suluhisho linaweza kujazwa na kiwanja kwenye joto la juu (ambapo solute ni mumunyifu zaidi) na hatimaye kilichopozwa kwenye joto la chini bila kuimarisha solute. Suluhisho la matokeo lina solute katika mkusanyiko mkubwa kuliko umumunyifu wake wa usawa kwenye joto la chini (yaani, ni supersaturated) na ni imara. Upepo wa solute ya ziada unaweza kuanzishwa kwa kuongeza kioo cha mbegu (angalia video katika Kiungo cha Kujifunza mapema katika moduli hii) au kwa njia ya kuchochea suluhisho. Baadhi ya joto la mkono, kama vile moja iliyoonyeshwa kwenye Kielelezo\(\PageIndex{10}\), tumia faida ya tabia hii.

Video\(\PageIndex{2}\): Video hii inaonyesha mchakato wa crystallization unatokea kwa joto la mkono.
Muhtasari
Kiwango ambacho dutu moja itapasuka katika mwingine imedhamiriwa na sababu kadhaa, ikiwa ni pamoja na aina na nguvu za jamaa za vikosi vya kuvutia ambavyo vinaweza kuwepo kati ya atomi za vitu, ions, au molekuli. Tabia hii ya kufuta inahesabiwa kama umumunyifu wa dutu, ukolezi wake wa juu katika suluhisho katika usawa chini ya hali maalum. Suluhisho lililojaa lina solute katika mkusanyiko sawa na umumunyifu wake. Suluhisho la supersaturated ni moja ambayo mkusanyiko wa solute huzidi umumunyifu wake-hali isiyo ya usawa (imara) ambayo itasababisha mvua ya solute wakati suluhisho linapotoshwa vizuri. Maji ya miscible ni mumunyifu kwa idadi zote, na vinywaji visivyoweza kutolewa huonyesha umumunyifu mdogo sana. Uharibifu wa solutes ya gesi hupungua kwa joto la kuongezeka, wakati wale kwa wengi, lakini sio wote, solutes imara huongezeka kwa joto. Mkusanyiko wa solute ya gesi katika suluhisho ni sawa na shinikizo la sehemu ya gesi ambayo suluhisho hufunuliwa, uhusiano unaojulikana kama sheria ya Henry.
Mlinganyo muhimu
- \(C_\ce{g}=kP_\ce{g}\)
faharasa
- Sheria ya Henry
- sheria inayoelezea uhusiano wa uwiano kati ya mkusanyiko wa gesi iliyovunjwa katika suluhisho na shinikizo la sehemu ya gesi katika kuwasiliana na suluhisho
- isiyoweza kufananishwa
- ya umumunyifu kidogo kuheshimiana; kawaida inahusu dutu kioevu
- kuweza miscible
- pande mumunyifu katika idadi yote; kawaida inahusu dutu kioevu
- sehemu miscible
- ya umumunyifu wastani kuheshimiana; kawaida inahusu dutu kioevu
- imejaa
- ya mkusanyiko sawa na umumunyifu; zenye mkusanyiko wa kiwango cha juu cha solute iwezekanavyo kwa joto na shinikizo lililopewa
- umumunyifu
- kiwango ambacho solute inaweza kuwa kufutwa katika maji, au kutengenezea yoyote
- supersaturated
- ya mkusanyiko unaozidi umumunyifu; hali isiyo ya usawa
- isiyo kifu
- ya mkusanyiko chini ya umumunyifu


