11.4: Mali ya Colligative
- Page ID
- 176187
- Express viwango vya vipengele vya ufumbuzi kwa kutumia sehemu ya mole na molality
- Eleza athari za mkusanyiko wa solute kwenye mali mbalimbali za ufumbuzi (shinikizo la mvuke, kiwango cha kuchemsha, kiwango cha kufungia, na shinikizo la osmotic)
- Kufanya mahesabu kwa kutumia equations hisabati kwamba kuelezea hizi madhara mbalimbali colligative
- Eleza mchakato wa kunereka na matumizi yake ya vitendo
- Eleza mchakato wa osmosis na kuelezea jinsi unatumiwa viwanda na kwa asili
Mali ya suluhisho ni tofauti na yale ya solute safi (s) au kutengenezea. Mali nyingi za ufumbuzi zinategemea utambulisho wa kemikali wa solute. Ikilinganishwa na maji safi, suluhisho la kloridi hidrojeni ni tindikali zaidi, suluhisho la amonia ni la msingi zaidi, suluhisho la kloridi ya sodiamu ni mnene zaidi, na suluhisho la sucrose ni mbaya zaidi. Kuna wachache ufumbuzi mali, hata hivyo, kwamba hutegemea tu juu ya mkusanyiko jumla ya aina solute, bila kujali utambulisho wao. Mali hizi za colligative ni pamoja na kupungua kwa shinikizo la mvuke, kiwango cha kuchemsha, unyogovu wa kiwango cha kufungia, na shinikizo la osmotic. Seti hii ndogo ya mali ni ya umuhimu mkubwa kwa matukio mengi ya asili na matumizi ya teknolojia, kama itaelezwa katika moduli hii.
Sehemu ya Mole na Molality
Vitengo kadhaa vinavyotumika kwa kawaida kueleza viwango vya vipengele vya ufumbuzi vilianzishwa katika sura ya awali ya maandishi haya, kila kutoa faida fulani kwa matumizi katika programu tofauti. Kwa mfano, molarity (M) ni kitengo rahisi cha matumizi katika mahesabu ya stoichiometric, kwani inafafanuliwa kwa suala la kiasi cha molar cha aina za solute:
\[M=\dfrac{\text{mol solute}}{\text{L solution}} \label{11.5.1} \]
Kwa sababu kiasi cha ufumbuzi hutofautiana na joto, viwango vya molar vivyo hivyo vinatofautiana. Ikiwa imeelezwa kama molarity, mkusanyiko wa suluhisho na idadi sawa ya aina ya solute na kutengenezea itakuwa tofauti kwa joto tofauti, kutokana na contraction/upanuzi wa suluhisho. Inafaa zaidi kwa mahesabu yanayohusisha mali nyingi za colligative ni vitengo vya mole-msingi ambavyo maadili hayategemei joto. Vitengo viwili vile ni sehemu ya mole (iliyoletwa katika sura ya awali juu ya gesi) na molality.
Sehemu ya mole\(\chi\),, ya sehemu ni uwiano wa kiasi chake cha molar kwa jumla ya moles ya vipengele vyote vya ufumbuzi:
\[\chi_\ce{A}=\dfrac{\text{mol A}}{\text{total mol of all components}} \label{11.5.2} \]
Molality ni kitengo cha ukolezi kinachofafanuliwa kama uwiano wa idadi ya moles ya solute kwa wingi wa kutengenezea kwa kilo:
\[m=\dfrac{\text{mol solute}}{\text{kg solvent}} \label{11.5.3} \]
Kwa kuwa vitengo hivi vinahesabiwa kwa kutumia raia tu na kiasi cha molar, hazipatikani na joto na, kwa hiyo, vinafaa zaidi kwa programu zinazohitaji viwango vya joto-kujitegemea, ikiwa ni pamoja na mali kadhaa za colligative, kama itaelezwa katika moduli hii ya sura.
Antifreeze katika radiators nyingi za magari ni mchanganyiko wa kiasi sawa cha ethylene glycol na maji, na kiasi kidogo cha vidonge vingine vinavyozuia kutu. Je, ni (a) sehemu ya mole na (b) molality ya ethylene glikoli, C 2 H 4 (OH) 2, katika suluhisho iliyoandaliwa kutoka\(\mathrm{2.22 \times 10^3 \;g}\) kwa ethylene glikoli na\(\mathrm{2.00 \times 10^3\; g}\) maji (takriban 2 L ya glycol na 2 L ya maji)?
Suluhisho
(a) Sehemu ya mole ya ethylene glikoli inaweza kuhesabiwa kwa kiasi cha kwanza cha molar cha vipengele vyote vya ufumbuzi na kisha kubadilisha kiasi hiki katika ufafanuzi wa kitengo.
\(\mathrm{mol\:H_2O=2000\:g×\dfrac{1\:mol\:H_2O}{18.02\:g\:H_2O}=111\:mol\:H_2O}\)
\(\chi_\mathrm{ethylene\:glycol}=\mathrm{\dfrac{35.8\:mol\:C_2H_4(OH)_2}{(35.8+111)\:mol\: total}=0.245}\)
Angalia kwamba sehemu ya mole ni mali isiyo na kipimo, kuwa uwiano wa mali na vitengo vinavyofanana (moles).
(b) Ili kupata molality, tunahitaji kujua moles ya solute na wingi wa kutengenezea (kwa kilo).
Kwanza, tumia molekuli iliyotolewa ya ethylene glycol na molekuli yake ya molar ili kupata moles ya solute:
\[\mathrm{2220\:g\:C_2H_4(OH)_2\left(\dfrac{mol\:C_2H_2(OH)_2}{62.07\:g}\right)=35.8\:mol\:C_2H_4(OH)_2} \nonumber \]
Kisha, kubadilisha wingi wa maji kutoka gramu hadi kilo:
\[\mathrm{2000\: g\:H_2O\left(\dfrac{1\:kg}{1000\:g}\right)=2\: kg\:H_2O} \nonumber \]
Hatimaye, mahesabu ya molarity kwa ufafanuzi wake:
\ [\ kuanza {align*}
\ ce {molality} &=\ hesabu {\ dfrac {mol\: solute} {kg\: kutengenezea}}\
\ ce {molality} &=\\ hesabu {\ dfrac {35.8\: mol\ :C_2H_4 (OH) _2} {2\ :kg\ :H_2O}}\
\ ce {molality} &=17.9\: m
\ mwisho {align*}\ nonumber\]
Je, ni sehemu gani ya mole na molality ya suluhisho ambayo ina 0.850 g ya amonia, NH 3, kufutwa katika 125 g ya maji?
- Jibu
-
7.14 × 10 -3; 0.399 m
Tumia sehemu ya mole ya solute na kutengenezea katika suluhisho la 3.0 m ya kloridi ya sodiamu.
Solution
Kubadilisha kutoka kitengo kimoja cha ukolezi hadi mwingine kunakamilika kwa kulinganisha kwanza ufafanuzi wa kitengo mbili. Katika kesi hiyo, vitengo vyote vina namba sawa (moles ya solute) lakini denominators tofauti. Mkusanyiko wa molal unaotolewa unaweza kuandikwa kama:
\[\mathrm{\dfrac{3.0\;mol\; NaCl}{1.0\; kg\; H_2O}} \nonumber \]
Nambari ya sehemu ya mole ya ufumbuzi huu ni, kwa hiyo, 3.0 mol NaCl. Denominator inaweza kuhesabiwa kwa kupata kiasi cha maji cha molar kinachofanana na kilo 1.0
\[\mathrm{1.0\:kg\:H_2O\left(\dfrac{1000\:g}{1\:kg}\right)\left(\dfrac{mol\:H_2O}{18.02\:g}\right)=55\:mol\:H_2O} \nonumber \]
na kisha kubadilisha hizi kiasi molar katika ufafanuzi kwa sehemu mole.
\ [kuanza {align*}
X_\ hesabu {H_2O} &=\ hesabu {\ drac {mol\ :H_2O} {mol\: NaCl + mol\ :H_2O}}\\
X_\ hisabati {H_2O} &=\ hisabati {\ drac {55\ :mol\ :H_H_2O} {3.0\: mol\: NaCl+55\: mol\ :H_2O}}\\
X_\ hesabu {H_2O} &= 0.95\\
X_\ hesabu {NaCl} &=\ hesabu {\ drac {mol\: NaCl} { mol\: NaCl+mol\ :H_2O}}\\
X_\ hesabu {NaCl} &=\ hisabati {\ drac {3.0\: mol\: NaCl} {3.0\: mol\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\: NaCl\
: NaCl\: NaCl\: NaCl\: NaCl\: NaCl
\: NaCl\ align*}\ nonumber\]
Sehemu ya mole ya iodini\(\ce{I_2}\), kufutwa katika dichloromethane\(\ce{CH_2Cl_2}\), ni 0.115. Mkusanyiko wa molal, m, wa iodini katika suluhisho hili ni nini?
- Jibu
-
1.50 m
Kupunguza shinikizo la mvuke
Kama ilivyoelezwa katika sura ya vinywaji na yabisi, shinikizo la mvuke la usawa wa kioevu ni shinikizo linalojitokeza na awamu yake ya gesi wakati uvukizi na condensation vinatokea kwa viwango sawa:
\[ \text{liquid} \rightleftharpoons \text{gas} \label{11.5.4} \]
Kufuta dutu isiyo na volatile katika matokeo ya kioevu tete katika kupungua kwa shinikizo la mvuke la kioevu. Jambo hili linaweza kupunguzwa kwa kuzingatia athari za molekuli zilizoongezwa za solute kwenye mchakato wa mvuke wa kioevu na condensation. Ili kuvuja, molekuli za kutengenezea lazima ziwepo kwenye uso wa suluhisho. Uwepo wa solute hupungua eneo la uso linalopatikana kwa molekuli za kutengenezea na hivyo hupunguza kiwango cha uvukizi wa kutengenezea. Kwa kuwa kiwango cha condensation haipatikani na kuwepo kwa solute, matokeo halisi ni kwamba usawa wa vaporization-condensation unapatikana kwa molekuli chache za kutengenezea katika awamu ya mvuke (yaani, kwa shinikizo la chini la mvuke) (Kielelezo\(\PageIndex{1}\)). Wakati tafsiri hii ya kinetic ni muhimu, haina akaunti kwa mambo kadhaa muhimu ya asili ya colligative ya shinikizo la mvuke kupungua. Maelezo ya ukali zaidi inahusisha mali ya entropy, mada ya majadiliano katika sura ya maandishi ya baadaye juu ya thermodynamics. Kwa madhumuni ya kuelewa kupungua kwa shinikizo la mvuke wa kioevu, ni kutosha kutambua kwamba entropy kubwa ya suluhisho ikilinganishwa na kutengenezea yake tofauti na solute hutumikia kwa ufanisi utulivu wa molekuli za kutengenezea na kuzuia uvukizi wao. Matokeo ya shinikizo la mvuke ya chini, na kiwango cha juu cha kuchemsha kama ilivyoelezwa katika sehemu inayofuata ya moduli hii.
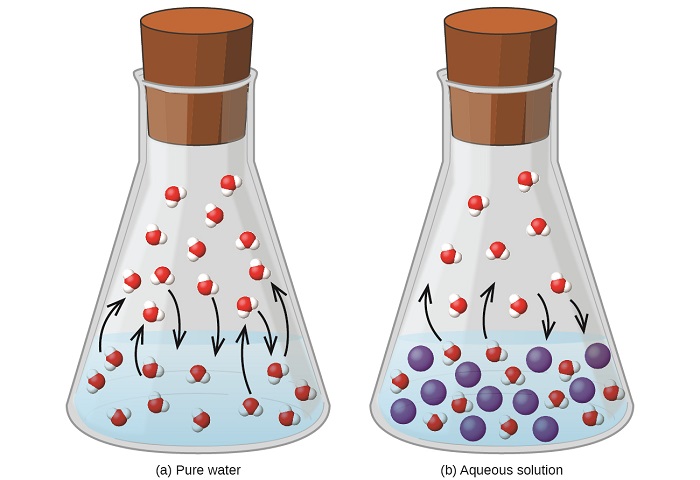
Uhusiano kati ya shinikizo la mvuke wa vipengele vya ufumbuzi na viwango vya vipengele hivi huelezwa na sheria ya Raoult: Shinikizo la sehemu inayotumiwa na sehemu yoyote ya suluhisho bora ni sawa na shinikizo la mvuke la sehemu safi inayoongezeka kwa mole yake sehemu katika suluhisho.
\[P_\ce{A}=X_\ce{A}P^\circ_\ce{A} \label{11.5.5} \]
ambapo P A ni shinikizo la sehemu inayotumiwa na sehemu A katika suluhisho,\(P^\circ_\ce{A}\) ni shinikizo la mvuke la A safi, na X A ni sehemu ya mole ya A katika suluhisho. (Sehemu ya Mole ni kitengo cha ukolezi kilicholetwa katika sura ya gesi.)
Akikumbuka kuwa shinikizo la jumla la mchanganyiko wa gesi ni sawa na jumla ya shinikizo la sehemu kwa vipengele vyake vyote (sheria ya Dalton ya shinikizo la sehemu), shinikizo la jumla la mvuke linalojitokeza na suluhisho iliyo na vipengele ni
\[P_\ce{solution}=\sum_{i}P_i=\sum_{i}X_iP^\circ_i \label{11.5.6} \]
Dutu isiyo na volatile ni moja ambayo shinikizo la mvuke ni duni (P° ≈ 0), na hivyo shinikizo la mvuke juu ya suluhisho iliyo na solutes zisizo na tete tu ni kutokana na kutengenezea:
\[P_\ce{solution}=X_\ce{solvent}P^\circ_\ce{solvent} \label{11.5.7} \]
Punguza shinikizo la mvuke la suluhisho bora iliyo na 92.1 g ya glycerini, C 3 H 5 (OH) 3, na 184.4 g ya ethanol, C 2 H 5 OH, saa 40 °C. joto.
Suluhisho
Kwa kuwa kutengenezea ni sehemu pekee ya tete ya suluhisho hili, shinikizo lake la mvuke linaweza kuhesabiwa kwa sheria ya Raoult kama:
\(P_\ce{solution}=X_\ce{solvent}P^\circ_\ce{solvent}\)
Kwanza, hesabu kiasi cha molar cha kila sehemu ya suluhisho kwa kutumia data ya molekuli iliyotolewa.
\(\mathrm{92.1\cancel{g\:C_3H_5(OH)_3}×\dfrac{1\:mol\:C_3H_5(OH)_3}{92.094\cancel{g\:C_3H_5(OH)_3}}=1.00\:mol\:C_3H_5(OH)_3}\)
Kisha, hesabu sehemu ya mole ya kutengenezea (ethanol) na utumie sheria ya Raoult kuhesabu shinikizo la mvuke la suluhisho.
\(X_\mathrm{C_2H_5OH}=\mathrm{\dfrac{4.000\:mol}{(1.00\:mol+4.000\:mol)}=0.800}\)
\(P_\ce{solv}=X_\ce{solv}P^\circ_\ce{solv}=\mathrm{0.800×0.178\:atm=0.142\:atm}\)
Suluhisho lina 5.00 g ya urea, CO (NH 2) 2 (solute isiyo ya kawaida) na kilo 0.100 cha maji. Ikiwa shinikizo la mvuke la maji safi kwenye 25 °C ni 23.7 torr, shinikizo la mvuke la suluhisho ni nini?
- Jibu
-
23.4 torr
Mwinuko wa Kiwango cha kuchemsha cha Kutengenezea
Kama ilivyoelezwa katika sura juu ya vinywaji na yabisi, kiwango cha kuchemsha cha kioevu ni joto ambalo shinikizo lake la mvuke ni sawa na shinikizo la anga la anga. Kwa kuwa shinikizo la mvuke la suluhisho linapungua kutokana na kuwepo kwa solutes zisizo na tete, inasimama kwa sababu kwamba hatua ya kuchemsha ya suluhisho itaongezeka. Ikilinganishwa na kutengenezea safi, suluhisho, kwa hiyo, itahitaji joto la juu ili kufikia shinikizo lolote la mvuke, ikiwa ni pamoja na moja sawa na ile ya anga inayozunguka. Kuongezeka kwa kiwango cha kuchemsha aliona wakati solute isiyo na volatile inapasuka katika kutengenezea\(ΔT_b\), inaitwa kiwango cha kuchemsha na ni moja kwa moja sawia na mkusanyiko wa molal wa aina za solute:
\[ΔT_b=K_bm \label{11.5.8} \]
wapi
- \(K_\ce{b}\)ni kiwango cha kuchemsha mwinuko mara kwa mara, au mara kwa mara ebullioscopic na
- \(m\)ni mkusanyiko wa molal (molality) wa aina zote za solute.
Vipindi vya kuinua kiwango cha kuchemsha ni mali ya tabia ambayo hutegemea utambulisho wa kutengenezea. Maadili ya K b kwa vimumunyisho kadhaa yameorodheshwa kwenye Jedwali\(\PageIndex{1}\).
| Kutengenezea | Kiwango cha kuchemsha (°C saa 1 atm) | KK b (Sm -1) | Kiwango cha kufungia (°C saa 1 atm) | Kilo f (Cm -1) |
|---|---|---|---|---|
| maji | 100.0 | 0.512 | 0.0 | 1.86 |
| acetate ya hid | 118.1 | 3.07 | 16.6 | 3.9 |
| benzini | 80.1 | 2.53 | 5.5 | 5.12 |
| chloroform | 61.26 | 3.63 | -63.5 | 4.68 |
| nitrobenzini | 210.9 | 5.24 | 5.67 | 8.1 |
Kiwango ambacho shinikizo la mvuke la kutengenezea hupungua na kiwango cha kuchemsha kinainua inategemea idadi ya chembe za solute zilizopo kwa kiasi fulani cha kutengenezea, si kwa wingi au ukubwa au utambulisho wa kemikali wa chembe. 1 m mmumunyo wa maji ya sucrose (342 g/mol) na 1 m mmumunyo wa maji ya ethilini glikoli (62 g/mol) itakuwa kuonyesha kiwango sawa kuchemsha kwa sababu kila suluhisho ina mole moja ya chembe solute (molekuli) kwa kilo ya kutengenezea.
Je! Ni kiwango gani cha kuchemsha cha suluhisho la 0.33 m ya solute isiyo ya kawaida katika benzini?
Suluhisho
Matumizi equation zinazohusiana mchemko uhakika mwinuko solute molality kutatua tatizo hili katika hatua mbili.

- Tumia mabadiliko katika kiwango cha kuchemsha.
\(ΔT_\ce{b}=K_\ce{b}m=2.53\:°\ce C\:m^{−1}×0.33\:m=0.83\:°\ce C\)
- Ongeza kiwango cha kuchemsha kwenye kiwango cha kuchemsha cha kutengenezea safi.
\(\mathrm{Boiling\: temperature=80.1\:°C+0.83\:°C=80.9\:°C}\)
Je! Ni kiwango gani cha kuchemsha cha antifreeze kilichoelezwa katika Mfano\(\PageIndex{4}\)?
- Jibu
-
109.2 °C
Pata kiwango cha kuchemsha cha suluhisho la 92.1 g ya iodini\(\ce{I2}\), katika 800.0 g ya kloroform\(\ce{CHCl3}\), kwa kuzingatia kwamba iodini haipatikani na kwamba suluhisho ni bora.
Suluhisho
Tunaweza kutatua tatizo hili kwa kutumia hatua nne.
- Badilisha kutoka gramu hadi moles ya\(\ce{I2}\) kutumia molekuli ya molar ya\(\ce{I2}\) katika kipengele cha uongofu wa kitengo.
Matokeo: 0.363 mol
Kuamua molality ya suluhisho kutoka kwa idadi ya moles ya solute na wingi wa kutengenezea, kwa kilo.
Matokeo: 0.454 m
Tumia uwiano wa moja kwa moja kati ya mabadiliko katika kiwango cha kuchemsha na mkusanyiko wa molal ili kuamua ni kiasi gani cha kuchemsha kinabadilika.
Matokeo: 1.65 °C
Kuamua hatua mpya ya kuchemsha kutoka kwa kiwango cha kuchemsha cha kutengenezea safi na mabadiliko.
Matokeo: 62.91 °C
Angalia kila matokeo kama tathmini binafsi.
Je! Ni kiwango gani cha kuchemsha cha suluhisho la 1.0 g ya glycerini\(\ce{C3H5(OH)3}\), katika 47.8 g ya maji? Fikiria suluhisho bora.
- Jibu
-
100.12 °C
Uharibifu wa Solutions
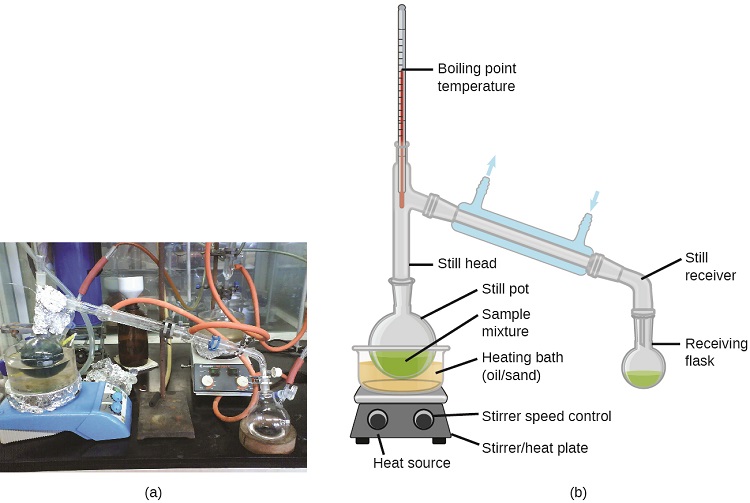
Kutengenezea ni mbinu ya kutenganisha vipengele vya mchanganyiko ambao hutumiwa sana katika maabara na katika mazingira ya viwanda. Inatumika kusafisha mafuta ya petroli, kutenganisha bidhaa za fermentation, na kusafisha maji. Mbinu hii ya kujitenga inahusisha inapokanzwa kudhibitiwa ya mchanganyiko wa sampuli ili kuchagua vaporize, condense, na kukusanya sehemu moja au zaidi ya riba. Vifaa vya kawaida vya distillations ya maabara vinaonyeshwa kwenye Mchoro\(\PageIndex{2}\).
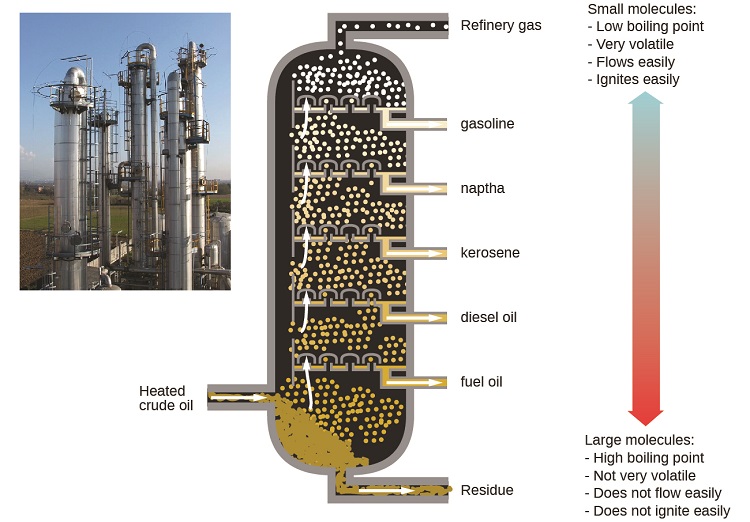
Refineries ya mafuta hutumia kunereka kwa kiasi kikubwa ili kutenganisha vipengele vya mafuta yasiyosafishwa. Mafuta yasiyosafishwa yanawaka kwa joto la juu chini ya safu ndefu ya kugawanya, ikitengeneza vipengele vingi vinavyoongezeka ndani ya safu. Kama vipengele vaporized kufikia maeneo ya kutosha baridi wakati wa kupanda kwao, wao condense na kukusanywa. vinywaji zilizokusanywa ni mchanganyiko rahisi wa hidrokaboni na misombo mingine ya petroli ambayo ni ya muundo sahihi kwa ajili ya maombi mbalimbali (kwa mfano, mafuta ya dizeli, mafuta ya taa, petroli), kama inavyoonyeshwa katika Kielelezo\(\PageIndex{3}\).
Unyogovu wa Point ya kufungia ya kutengenezea
Ufumbuzi kufungia kwa joto la chini kuliko vinywaji safi. Jambo hili hutumiwa katika mipango ya “de-icing” ambayo hutumia chumvi (Kielelezo\(\PageIndex{4}\)), kloridi kalsiamu, au urea kuyeyuka barafu kwenye barabara na barabara za barabara, na katika matumizi ya ethylene glikoli kama “antifreeze” katika radiators za magari. Maji ya bahari huganda kwenye joto la chini kuliko maji safi, na hivyo bahari ya Aktiki na Antaktiki hubakia bila kufungia hata kwenye joto chini ya 0 °C (kama vile maji ya mwili ya samaki na wanyama wengine wa bahari wenye damu baridi wanaoishi katika bahari hizi).

Kupungua kwa hatua ya kufungia ya suluhisho la kuondokana ikilinganishwa na ile ya kutengenezea safi, Δ T f, inaitwa unyogovu wa uhakika wa kufungia na ni sawa sawa na mkusanyiko wa molal wa solute
\[ΔT_\ce{f}=K_\ce{f}m \label{11.5.9} \]
wapi
- \(m\)ni mkusanyiko wa molal wa solute katika kutengenezea na
- \(K_f\)inaitwa hatua ya kufungia unyogovu mara kwa mara (au mara kwa mara cryoscopic)
Kama vile kwa kiwango cha kuchemsha kiwango cha kuinua, hizi ni tabia za tabia ambazo maadili hutegemea utambulisho wa kemikali wa kutengenezea. Maadili ya K f kwa vimumunyisho kadhaa yameorodheshwa kwenye Jedwali\(\PageIndex{1}\).
Je, ni hatua ya kufungia ya suluhisho la 0.33 m ya solute isiyo ya kawaida ya electrolyte katika benzini iliyoelezwa katika Mfano\(\PageIndex{4}\)?
Suluhisho
Matumizi equation zinazohusiana kufungia uhakika unyogovu solute molality kutatua tatizo hili katika hatua mbili.

- Tumia mabadiliko katika hatua ya kufungia. \[ΔT_\ce{f}=K_\ce{f}m=5.12\:°\ce C\:m^{−1}×0.33\:m=1.7\:°\ce C \nonumber \]
- Ondoa mabadiliko ya hatua ya kufungia yaliyozingatiwa kutoka kwenye hatua ya kufungia safi ya kutengenezea. \[\mathrm{Freezing\: Temperature=5.5\:°C−1.7\:°C=3.8\:°C} \nonumber \]
Je, ni hatua ya kufungia ya suluhisho la 1.85 m ya solute isiyo ya kawaida ya electrolyte katika nitrobenzene?
- Jibu
-
-9.3 °C
Kloridi ya sodiamu na kikundi chake cha 2 analogi kalsiamu na kloridi ya magnesiamu mara nyingi hutumiwa kwa barabara za barafu na barabara za barabara, kutokana na ukweli kwamba suluhisho la mojawapo ya chumvi hizi zitakuwa na kiwango cha kufungia chini ya 0 °C, hatua ya kufungia ya maji safi. Chumvi cha chuma cha kundi 2 mara nyingi huchanganywa na kloridi ya sodiamu ya bei nafuu na kwa urahisi zaidi (“chumvi ya mwamba”) kwa matumizi ya barabara, kwani huwa na kuwa chini ya babuzi kuliko NaCl, na hutoa unyogovu mkubwa wa hatua ya kufungia, kwani hutenganisha kutoa chembe tatu kwa kila formula kitengo, badala ya chembe mbili kama kloridi sodiamu.
Kwa sababu hizi misombo ionic huwa na kuharakisha kutu ya chuma, bila kuwa chaguo busara kutumia katika antifreeze kwa radiator katika gari yako au de-barafu ndege kabla ya takeoff. Kwa maombi haya, misombo ya covalent, kama vile ethylene au propylene glycol, hutumiwa mara nyingi. Glycols kutumika katika maji ya radiator si tu kupunguza kiwango cha kufungia ya kioevu, lakini wao kuinua kiwango cha kuchemsha, na kufanya maji muhimu katika majira ya baridi na majira ya joto. Joto glycols mara nyingi sprayed juu ya uso wa ndege kabla ya takeoff katika hali ya hewa mbaya katika majira ya baridi kuondoa barafu ambayo tayari sumu na kuzuia malezi ya barafu zaidi, ambayo itakuwa hasa hatari kama sumu juu ya nyuso udhibiti wa ndege (Video\(\PageIndex{1}\)).
Video\(\PageIndex{1}\): Unyogovu wa kiwango cha kufungia hutumiwa ili kuondoa barafu kutoka kwenye nyuso za udhibiti wa ndege.
Mchoro wa Awamu kwa Suluhisho la Maji ya Nonelectr
Madhara ya colligative juu ya shinikizo la mvuke, kiwango cha kuchemsha, na hatua ya kufungia ilivyoelezwa katika sehemu ya awali ni rahisi muhtasari kwa kulinganisha michoro ya awamu kwa kioevu safi na suluhisho inayotokana na kioevu hicho. Mipango ya awamu ya maji na suluhisho la maji yanaonyeshwa kwenye Mchoro\(\PageIndex{5}\).
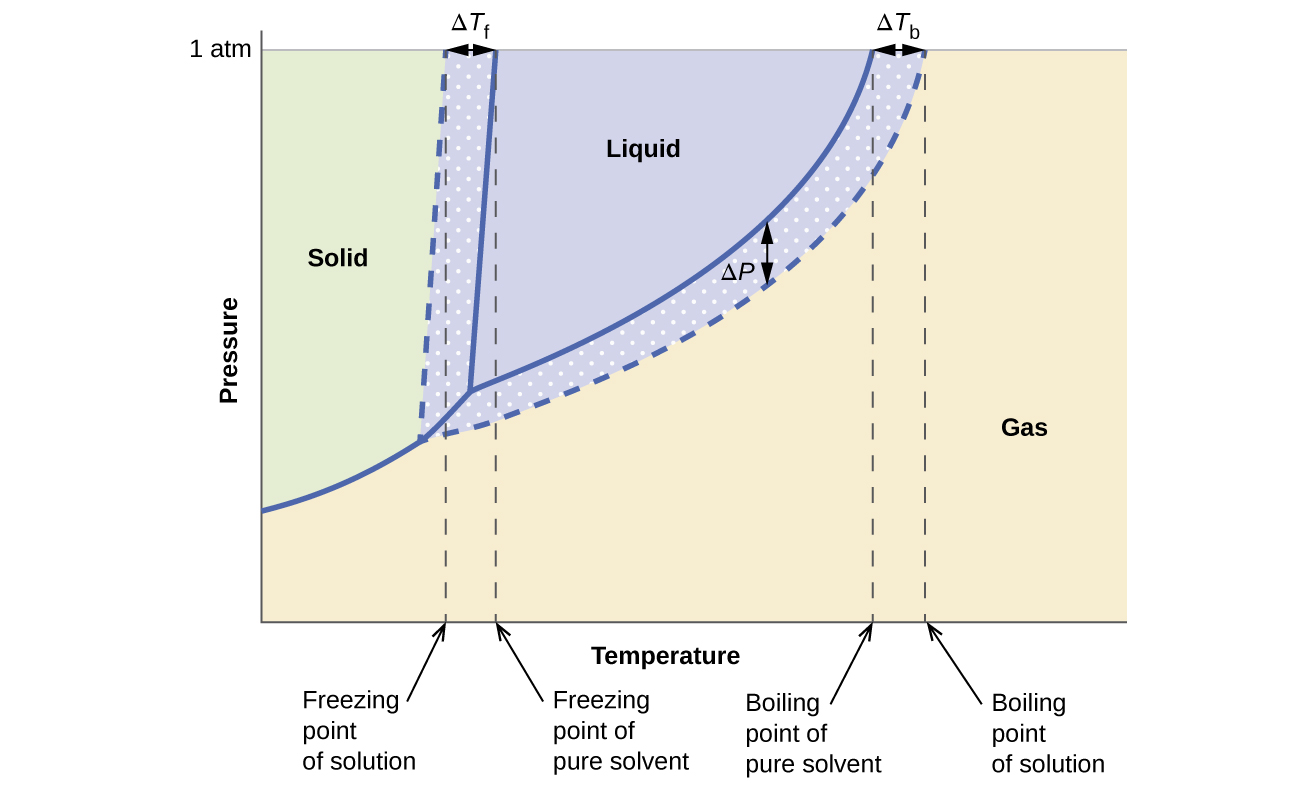
Curve ya kioevu-mvuke kwa suluhisho iko chini ya safu inayofanana kwa kutengenezea, inayoonyesha kupungua kwa shinikizo la mvuke, Δ P, ambalo linatokana na kuvunjwa kwa solute isiyo ya kawaida. Kwa hiyo, kwa shinikizo lolote, kiwango cha kuchemsha cha suluhisho kinazingatiwa kwa joto la juu kuliko ile ya kutengenezea safi, inayoonyesha kiwango cha kuchemsha, Δ T b, inayohusishwa na kuwepo kwa solute isiyo ya kawaida. Curve imara-kioevu kwa ajili ya ufumbuzi ni makazi yao kushoto ya kwamba kwa ajili ya kutengenezea safi, anayewakilisha hatua ya kufungia unyogovu, Δ Tf, ambayo inaambatana ufumbuzi malezi. Hatimaye, angalia kwamba curves imara-gesi kwa ajili ya kutengenezea na ufumbuzi wake ni sawa. Hii ni kesi kwa ufumbuzi wengi inahusu vimumunyisho kioevu na solutes nonvolatile. Kama vile kwa uvukizi, wakati suluhisho la aina hii limehifadhiwa, ni kweli tu molekuli za kutengenezea ambazo hupitia mpito wa kioevu-kwa-imara, na kutengeneza kutengenezea safi imara ambayo haihusishi aina za solute. Awamu imara na gesi, kwa hiyo, zinajumuisha kutengenezea tu, na hivyo mabadiliko kati ya awamu hizi sio chini ya madhara ya colligative.
Osmosis na Osmotic Shinikizo la Solutions
Idadi ya vifaa vya asili na synthetic huonyesha upenyezaji wa kuchagua, maana yake ni kwamba molekuli tu au ions ya ukubwa fulani, sura, polarity, malipo, na kadhalika, zinaweza kupitisha (kupenyeza) nyenzo. Kibaiolojia kiini utando kutoa mifano kifahari ya upenyezaji kuchagua katika asili, wakati dialysis neli kutumika kuondoa taka metabolic kutoka damu ni zaidi simplistic teknolojia mfano. Bila kujali jinsi zinaweza kuzalishwa, vifaa hivi kwa ujumla hujulikana kama utando wa semipermit.
Fikiria vifaa vilivyoonyeshwa kwenye Kielelezo\(\PageIndex{6}\), ambapo sampuli za kutengenezea safi na suluhisho zinatenganishwa na utando ambao molekuli tu za kutengenezea zinaweza kuenea. Molekuli za kutengenezea zitaenea kwenye membrane kwa njia zote mbili. Kwa kuwa mkusanyiko wa kutengenezea ni mkubwa zaidi katika kutengenezea safi kuliko suluhisho, molekuli hizi zitaenea kutoka upande wa kutengenezea wa utando hadi upande wa suluhisho kwa kiwango cha kasi zaidi kuliko yatakuwa katika mwelekeo wa nyuma. Matokeo yake ni uhamisho wa wavu wa molekuli za kutengenezea kutoka kwa kutengenezea safi kwa suluhisho. Uhamisho unaotokana na usambazaji wa molekuli za kutengenezea kwa njia ya utando wa semipermit ni mchakato unaojulikana kama osmosis.
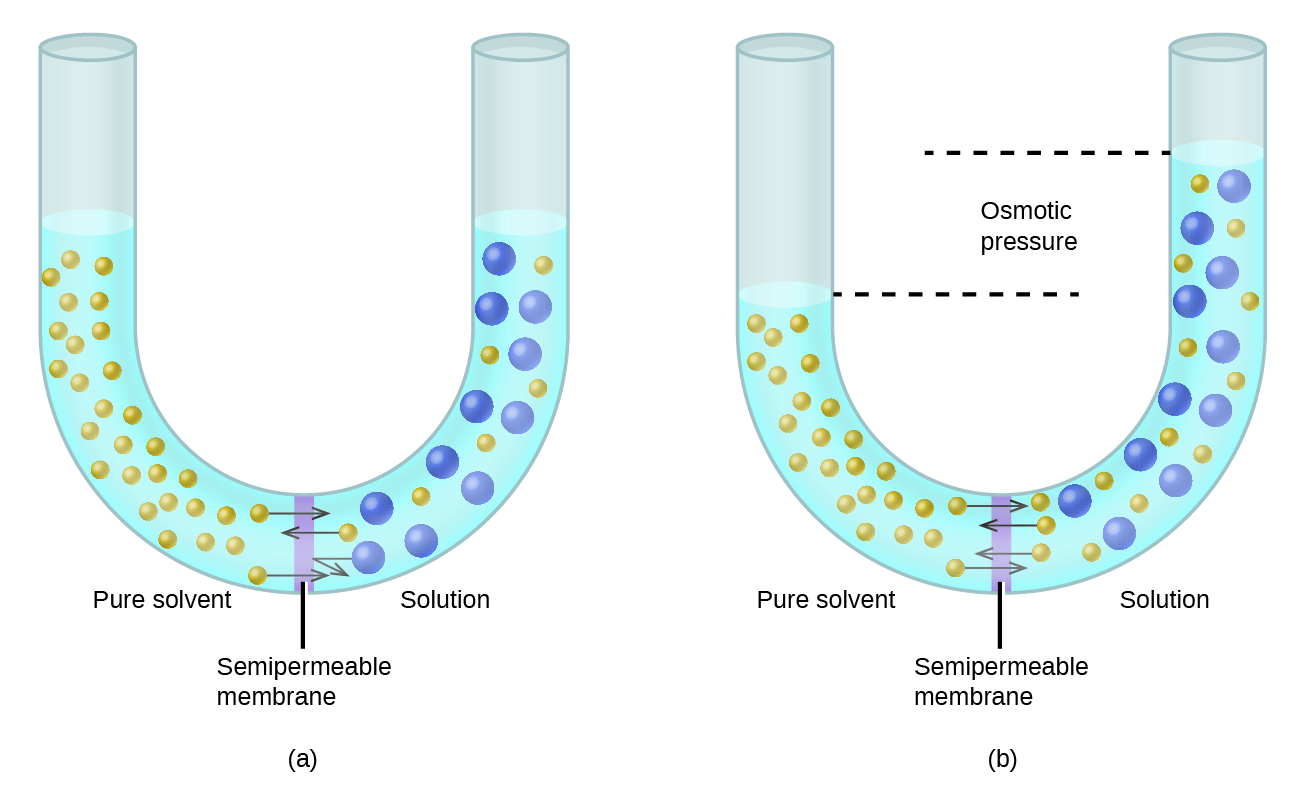
Wakati osmosis inafanywa katika vifaa kama vile ilivyoonyeshwa kwenye Kielelezo\(\PageIndex{6}\), kiasi cha suluhisho kinaongezeka kama inakuwa diluted na mkusanyiko wa kutengenezea. Hii inasababisha kiwango cha suluhisho kuongezeka, kuongeza shinikizo lake la hydrostatic (kutokana na uzito wa safu ya suluhisho katika tube) na kusababisha uhamisho wa kasi wa molekuli za kutengenezea nyuma upande wa kutengenezea safi. Wakati shinikizo linafikia thamani ambayo huzalisha kiwango cha uhamisho wa kutengenezea sawa na kiwango cha osmosis, uhamisho wa wingi wa kutengenezea hukoma. Shinikizo hili linaitwa shinikizo la osmotic (e\(\Pi\)) la suluhisho. Shinikizo la osmotic la suluhisho la kuondokana linahusiana na molarity yake ya solute, M, na joto kamili, T, kulingana na equation
\[Π=MRT \label{11.5.10} \]
ambapo\(R\) ni gesi zima mara kwa mara.
Shinikizo la kiosmotiki (atm) la suluhisho la 0.30 M la glucose katika maji ambalo hutumiwa kwa infusion ya ndani ya mishipa kwenye joto la mwili, 37 °C?
Suluhisho
Tunaweza kupata shinikizo la kiosmotiki\(Π\), kwa kutumia Equation\ ref {11.5.10}, ambapo T iko kwenye kiwango cha Kelvin (310 K) na thamani ya R inaelezwa katika vitengo vinavyofaa (0.08206 L atm/mol K).
\ [kuanza {align*}
π&= MRT\\
&=\\ mathrm {0.03\ :Mol/l × 0.08206\: L\: atm/mol\: K × 310\: K}\\
&=\ hesabu {7.6\: atm}
\ mwisho {align*}\ nonnumber\]
Shinikizo la kiosmotiki (atm) ni suluhisho lenye kiasi cha 0.750 L ambacho kina 5.0 g ya methanoli, CH 3 OH, katika maji saa 37 °C?
- Jibu
-
5.3 atm
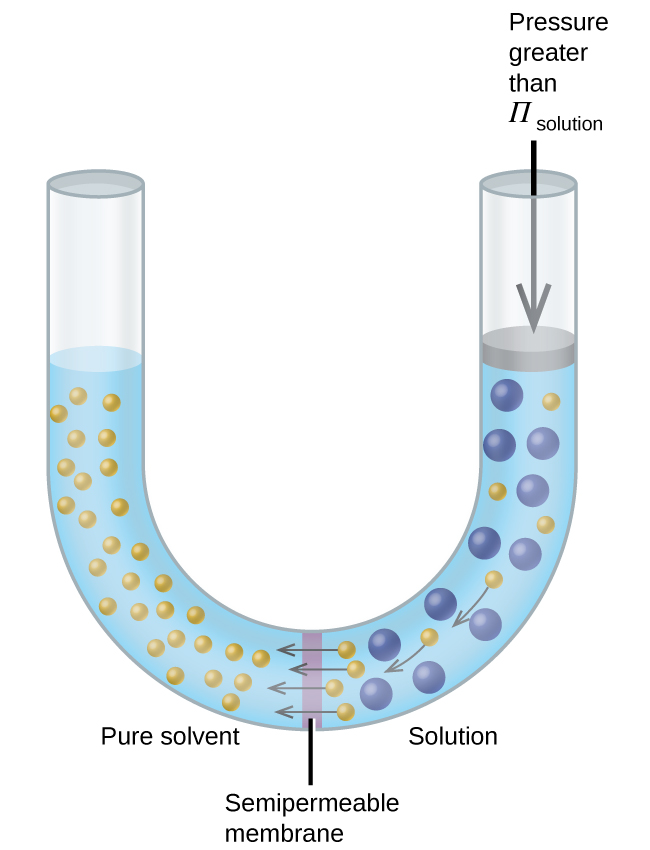
Kama ufumbuzi ni kuwekwa katika vifaa kama moja inavyoonekana katika Kielelezo\(\PageIndex{7}\), kutumia shinikizo kubwa kuliko shinikizo kiosmotiki ya ufumbuzi reverses osmosis na inasubu molekuli kutengenezea kutoka ufumbuzi katika kutengenezea safi. Mbinu hii ya osmosis ya reverse hutumiwa kwa ajili ya kufuta maji ya bahari kwa kiasi kikubwa na kwa mizani ndogo ili kuzalisha maji ya bomba ya usafi wa juu kwa kunywa.
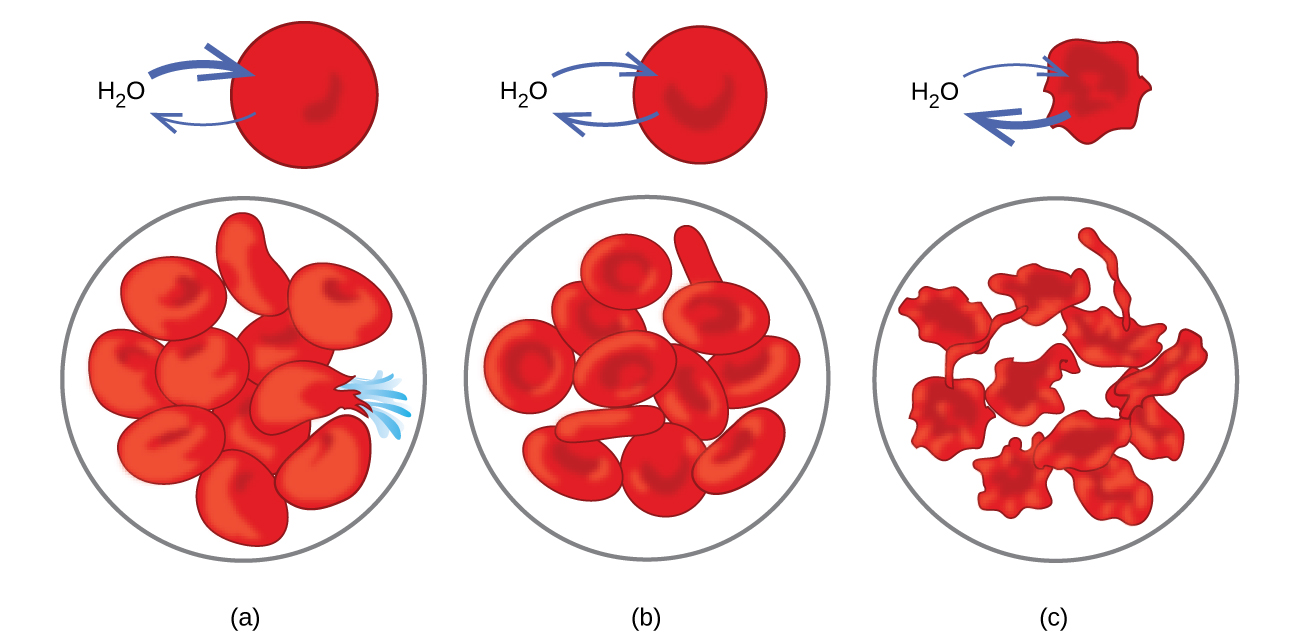
Mifano ya osmosis inaonekana katika mifumo mingi ya kibaiolojia kwa sababu seli zinazungukwa na utando wa semipermit. Karoti na celery ambazo zimepungua kwa sababu zimepoteza maji zinaweza kufanywa crisp tena kwa kuziweka majini. Maji huingia kwenye seli za karoti au celery na osmosis. Tango iliyowekwa katika suluhisho la chumvi iliyojilimbikizia inapoteza maji kwa osmosis na inachukua chumvi kuwa chumvi. Osmosis inaweza pia kuathiri seli za wanyama. Viwango vya Solute ni muhimu hasa wakati ufumbuzi unaingizwa ndani ya mwili. Solutes katika maji ya seli za mwili na serum ya damu hutoa ufumbuzi huu shinikizo la osmotic la takriban 7.7 atm. Ufumbuzi unaoingizwa ndani ya mwili lazima uwe na shinikizo sawa la osmotic kama seramu ya damu; yaani, wanapaswa kuwa isotonic na seramu ya damu. Ikiwa suluhisho la chini la kujilimbikizia, suluhisho la hypotonic, linajitenga kwa kiasi cha kutosha ili kuondokana na seramu ya damu, maji kutoka serum iliyosafishwa hupita kwenye seli za damu kwa osmosis, na kusababisha seli kupanua na kupasuka. Utaratibu huu unaitwa hemolysis. Wakati suluhisho la kujilimbikizia zaidi, suluhisho la hypertonic, linajitokeza, seli hupoteza maji kwa suluhisho la kujilimbikizia zaidi, hupungua, na huenda kufa katika mchakato unaoitwa crenation (Mchoro 11.5.8).
Uamuzi wa Misa ya Molar
Shinikizo la Osmotic na mabadiliko katika hatua ya kufungia, kiwango cha kuchemsha, na shinikizo la mvuke ni moja kwa moja sawa na mkusanyiko wa sasa ya solute. Kwa hiyo, tunaweza kutumia kipimo cha mojawapo ya mali hizi ili kuamua molekuli ya molar ya solute kutoka kwa vipimo.
Suluhisho la 4.00 g ya nonelectrolyte kufutwa katika 55.0 g ya benzini hupatikana kufungia saa 2.32 °C.
Suluhisho
Tunaweza kutatua tatizo hili kwa kutumia hatua zifuatazo.
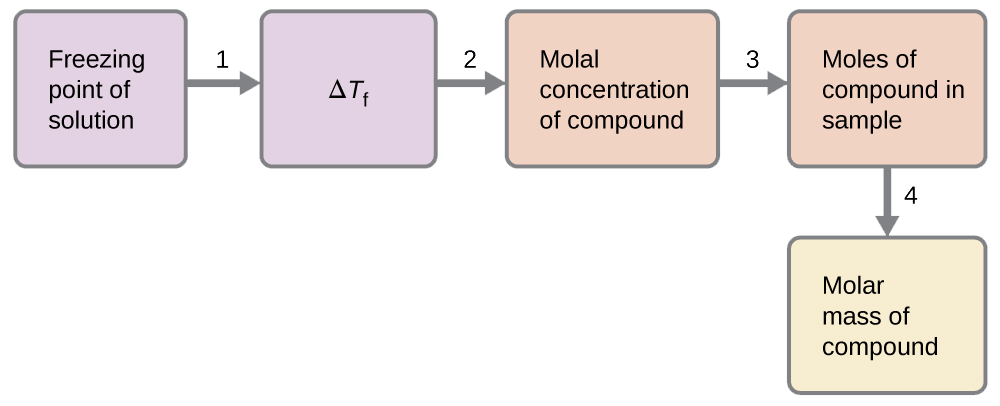
- Kuamua mabadiliko katika hatua ya kufungia kutoka kwa kiwango cha kufungia kilichozingatiwa na kiwango cha kufungia cha benzini safi (Jedwali 11.5.1).
- Kuamua mkusanyiko wa molal kutoka K f, kiwango cha kufungia unyogovu mara kwa mara kwa benzini (Jedwali 11.5.1), na Δ T f.
\(ΔT_\ce{f}=K_\ce{f}m\)
\(m=\dfrac{ΔT_\ce{f}}{K_\ce{f}}=\dfrac{3.2\:°\ce C}{5.12\:°\ce C m^{−1}}=0.63\:m\)
- Kuamua idadi ya moles ya kiwanja katika suluhisho kutoka kwa mkusanyiko wa molal na wingi wa kutengenezea kutumika kufanya suluhisho.
\(\mathrm{Moles\: of\: solute=\dfrac{0.62\:mol\: solute}{1.00\cancel{kg\: solvent}}×0.0550\cancel{kg\: solvent}=0.035\:mol}\)
- Kuamua molekuli ya molar kutoka kwa wingi wa solute na idadi ya moles katika molekuli hiyo.
\(\mathrm{Molar\: mass=\dfrac{4.00\:g}{0.034\:mol}=1.2×10^2\:g/mol}\)
Suluhisho la 35.7 g ya nonelectrolyte katika 220.0 g ya kloroform ina kiwango cha kuchemsha cha 64.5 °C.
- Jibu
-
1.8 × 10 2 g/mol
Sampuli ya 0.500 L ya suluhisho la maji yenye 10.0 g ya hemoglobin ina shinikizo la osmotiki la 5.9 torr saa 22 °C Ni nini molekuli ya molar ya hemoglobin?
Suluhisho
Hapa kuna seti moja ya hatua ambazo zinaweza kutumika kutatua tatizo:
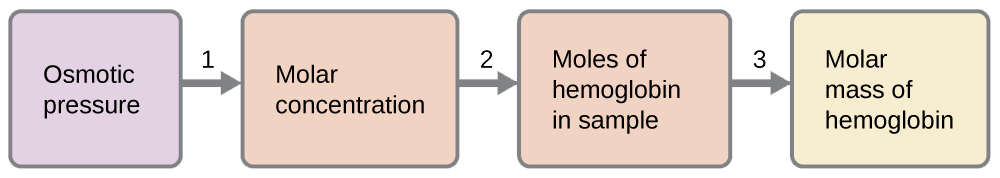
- \[\Pi=\mathrm{\dfrac{5.9\:torr×1\:atm}{760\:torr}=7.8×10^{−3}\:atm} \nonumber \]
\[\Pi=MRT \nonumber \]
\(M=\dfrac{Π}{RT}=\mathrm{\dfrac{7.8×10^{−3}\:atm}{(0.08206\:L\: atm/mol\: K)(295\:K)}=3.2×10^{−4}\:M}\)
- \(\mathrm{moles\: of\: hemoglobin=\dfrac{3.2×10^{−4}\:mol}{1\cancel{L\: solution}}×0.500\cancel{L\: solution}=1.6×10^{−4}\:mol}\)
- Kuamua molekuli ya molar kutoka kwa wingi wa hemoglobin na idadi ya moles katika molekuli hiyo.
\(\mathrm{molar\: mass=\dfrac{10.0\:g}{1.6×10^{−4}\:mol}=6.2×10^4\:g/mol}\)
Masi ya molar ya protini ni nini ikiwa suluhisho la 0.02 g ya protini katika 25.0 ml ya suluhisho lina shinikizo la osmotiki la 0.56 torr saa 25 °C?
- Jibu
-
2.7 × 10 4 g/mol
Mali ya Colligative ya Electrolytes
Kama ilivyoelezwa hapo awali katika moduli hii, mali ya colligative ya suluhisho hutegemea tu idadi, si kwa aina, ya aina ya solute kufutwa. Kwa mfano, 1 mole ya nonelectrolyte yoyote kufutwa katika kilo 1 ya kutengenezea hutoa kupungua sawa ya hatua ya kufungia kama ilivyo 1 mole ya nonelectrolyte nyingine yoyote. Hata hivyo, 1 mole ya kloridi ya sodiamu (electrolyte) huunda moles 2 ya ions wakati kufutwa katika suluhisho Kila ion ya mtu hutoa athari sawa kwenye hatua ya kufungia kama molekuli moja inavyofanya.
Mkusanyiko wa ions katika maji ya bahari ni takriban sawa na ile katika suluhisho iliyo na 4.2 g ya NaCl kufutwa katika 125 g ya maji. Kudhani kwamba kila ions katika ufumbuzi NaCl ina athari sawa juu ya hatua ya kufungia ya maji kama molekuli nonelectrolyte, na kuamua kufungia joto ufumbuzi (ambayo ni takriban sawa na joto kufungia ya maji ya bahari).
Suluhisho
Tunaweza kutatua tatizo hili kwa kutumia mfululizo wa hatua zifuatazo.
- Badilisha kutoka gramu hadi moles ya NaCl kwa kutumia molekuli ya molar ya NaCl katika sababu ya uongofu wa kitengo. Matokeo: 0.072 ml NaCl
- Kuamua idadi ya moles ya ions zilizopo katika suluhisho kwa kutumia idadi ya moles ya ions katika mole 1 ya NaCl kama sababu ya uongofu (2 mol/1 mol NaCl). Matokeo: 0.14 mol ions
- Kuamua molality ya ions katika suluhisho kutoka kwa idadi ya moles ya ions na wingi wa kutengenezea, kwa kilo. Matokeo: 1.1 m
- Tumia uwiano wa moja kwa moja kati ya mabadiliko katika hatua ya kufungia na mkusanyiko wa molal ili kuamua ni kiasi gani cha kufungia kinabadilika. Matokeo: 2.0 °C
- Kuamua hatua mpya ya kufungia kutoka hatua ya kufungia ya kutengenezea safi na mabadiliko. Matokeo: -2.0 °C
Angalia kila matokeo kama tathmini binafsi.
Fikiria kwamba kila ions katika kloridi kalsiamu, CaCl 2, ina athari sawa juu ya kiwango cha kufungia cha maji kama molekuli isiyo ya electrolyte. Tumia kiwango cha kufungia cha suluhisho la 0.724 g ya CaCl 2 katika 175 g ya maji.
- Jibu
-
-0.208 °C
Kutokana na dissociation kamili, 1.0 m mmumunyo wa maji ya NaCl ina 2.0 mole ya ions (1.0 mol Na + na 1.0 mol Cl -) kwa kila kilo ya maji, na unyogovu wake wa kufungia unatarajiwa kuwa
\[ΔT_\ce{f}=\mathrm{2.0\:mol\: ions/kg\: water×1.86\:°C\: kg\: water/mol\: ion=3.7\:°C.} \label{11.5.11} \]
Wakati suluhisho hili limeandaliwa na unyogovu wake wa kiwango cha kufungia hupimwa, hata hivyo, thamani ya 3.4 °C inapatikana. Tofauti sawa ni kuzingatiwa kwa misombo mingine ionic, na tofauti kati ya kipimo na inatarajiwa maadili colligative mali kawaida kuwa muhimu zaidi kama viwango solute kuongezeka. Uchunguzi huu unaonyesha kwamba ions ya kloridi ya sodiamu (na electrolytes nyingine kali) hazipatikani kabisa katika suluhisho.
Ili kuhesabu hili na kuepuka makosa yanayoambatana na dhana ya kujitenga kwa jumla, parameter ya kupima majaribio iliyoitwa kwa heshima ya mwanakemia wa Ujerumani aliyeshinda tuzo ya Nobel Jacobus Henricus van't Hoff hutumiwa. Sababu ya van't Hoff (i) inaelezwa kama uwiano wa chembe za solute katika suluhisho la idadi ya vitengo vya formula kufutwa:
\[i=\dfrac{\textrm{moles of particles in solution}}{\textrm{moles of formula units dissolved}} \label{11.5.12} \]
Maadili ya vipimo van't Hoff sababu kwa solutes kadhaa, pamoja na maadili yaliyotabiriwa kuchukua dissociation kamili, ni inavyoonekana katika Jedwali\(\PageIndex{2}\).
| Electrolyte | Chembe katika Solution | i (Alitabiri) | i (Kipimo) |
|---|---|---|---|
| HCl | H +, Cl - | 2 | 1.9 |
| NaCl | Na +, Cl - | 2 | 1.9 |
| MGSO 4 | Mg 2 +,\(\ce{SO4^2-}\) | 2 | 1.3 |
| MgCl 2 | Mg 2 +, 2Cl - | 3 | 2.7 |
| FeCl 3 | Fe 3 +, 3Cl - | 4 | 3.4 |
| glucose (sio electrolyte) | C 12 H 22 O 11 | 1 | 1.0 |
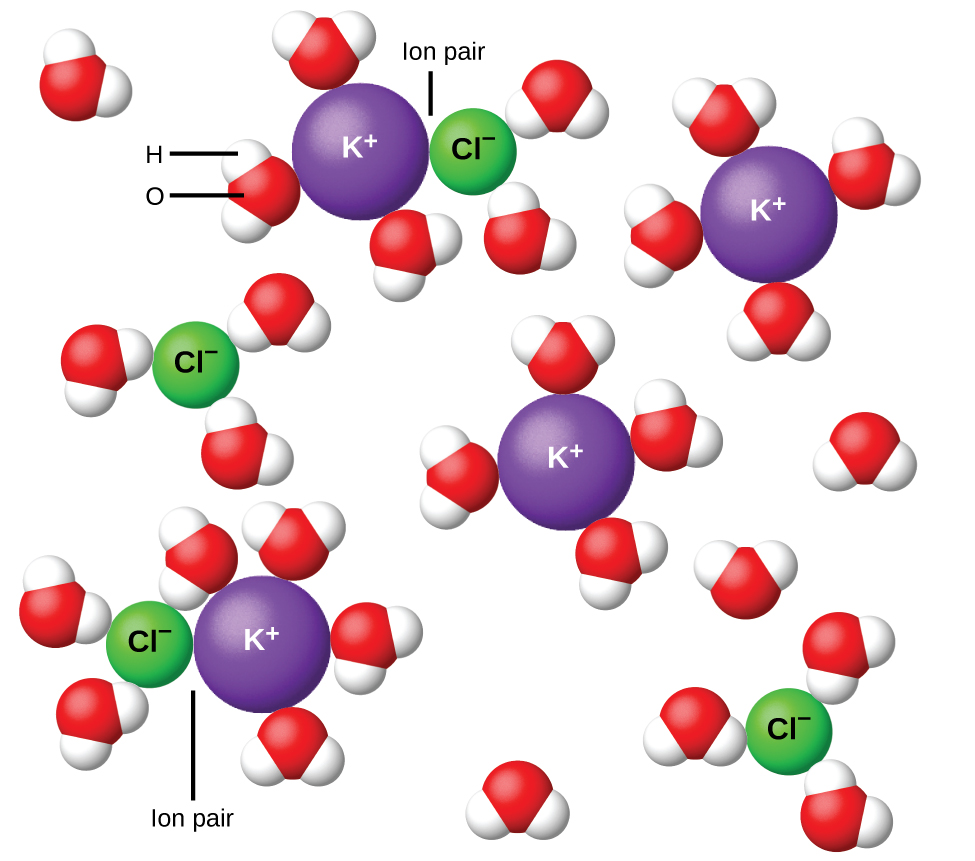
Mwaka wa 1923, wanakemia Peter Debye na Erich Hückel walipendekeza nadharia ya kuelezea ionization isiyo kamili ya electrolytes kali. Walipendekeza kwamba ingawa kivutio cha interionic katika suluhisho la maji hupunguzwa sana na ufumbuzi wa ions na hatua ya kuhami ya kutengenezea polar, haijafanywa kabisa. Vivutio vya mabaki huzuia ions kutoka kwa tabia kama chembe huru kabisa (Kielelezo\(\PageIndex{9}\)). Katika baadhi ya matukio, ioni nzuri na hasi inaweza kweli kugusa, kutoa kitengo cha kutengenezewa kinachoitwa jozi ya ion. Hivyo, shughuli, au mkusanyiko wa ufanisi, wa aina yoyote ya ion ni chini ya ile iliyoonyeshwa na ukolezi halisi. Ions kuwa zaidi na zaidi sana kutengwa, zaidi kuondokana na ufumbuzi, na vivutio mabaki interionic kuwa chini na chini. Hivyo, katika ufumbuzi mkubwa sana, viwango vya ufanisi vya ions (shughuli zao) ni sawa na viwango halisi. Kumbuka kwamba van't Hoff sababu kwa electrolytes katika Jedwali\(\PageIndex{2}\) ni kwa 0.05 m ufumbuzi, ambapo mkusanyiko thamani ya i kwa NaCl ni 1.9, kinyume na thamani bora ya 2.
Muhtasari
Mali ya suluhisho ambayo hutegemea tu mkusanyiko wa chembe za solute huitwa mali ya colligative. Wao ni pamoja na mabadiliko katika shinikizo la mvuke, kiwango cha kuchemsha, na kiwango cha kufungia cha kutengenezea katika suluhisho. Ukubwa wa mali hizi hutegemea tu mkusanyiko wa chembe za solute katika suluhisho, si kwa aina ya chembe. Mkusanyiko wa jumla wa chembe za solute katika suluhisho pia huamua shinikizo lake la osmotic. Hii ni shinikizo ambalo linapaswa kutumiwa kwenye suluhisho la kuzuia utbredningen wa molekuli ya kutengenezea safi kupitia membrane isiyoweza kupunguzwa ndani ya suluhisho. Misombo ya Ionic haiwezi kuondokana kabisa na suluhisho kutokana na madhara ya shughuli, ambapo kesi iliona madhara ya colligative inaweza kuwa chini ya ilivyotabiriwa.
Mlinganyo muhimu
- \(\left(P_\ce{A}=X_\ce{A}P^\circ_\ce{A}\right)\)
- \(P_\ce{solution}=\sum_{i}P_i=\sum_{i}X_iP^\circ_i\)
- \(P_\ce{solution}=X_\ce{solvent}P^\circ_\ce{solvent}\)
- Δ T b = K b m
- Δ T f = K f m
- = MRT
maelezo ya chini
- Nonelectrolyte imeonyeshwa kwa kulinganisha.
faharasa
- kiwango cha kuchemsha mwinuko
- mwinuko wa kiwango cha kuchemsha cha kioevu kwa kuongeza solute
- kiwango cha kuchemsha mwinuko mara kwa mara
- uwiano mara kwa mara katika equation zinazohusiana kiwango cha kuchemsha mwinuko kwa molality solute; pia inajulikana kama mara kwa mara ebullioscopic
- mali ya colligative
- mali ya ufumbuzi ambayo inategemea tu juu ya mkusanyiko wa aina solute
- crenation
- mchakato ambapo seli kibiolojia kuwa shriveled kutokana na hasara ya maji na osmosis
- kufungia uhakika unyogovu
- kupungua kwa hatua ya kufungia ya kioevu kwa kuongeza solute
- uhakika wa kufungia unyogovu
- (pia, cryoscopic mara kwa mara) uwiano mara kwa mara katika equation zinazohusiana kufungia uhakika unyogovu kwa solute molality
- kupasuka kwa damu
- kupasuka kwa seli nyekundu za damu kutokana na mkusanyiko wa maji ya ziada na osmosis
- hypertonic
- ya shinikizo kubwa la osmotic
- hypotonic
- ya shinikizo la chini la osmotic
- jozi ya ioni
- solvated anion/cation jozi uliofanyika pamoja na kivutio wastani umeme
- isotoniki
- ya shinikizo sawa la osmotic
- molality (m)
- kitengo cha ukolezi kinachofafanuliwa kama uwiano wa idadi ya moles ya solute kwa wingi wa kutengenezea kwa kilo
- osmosis
- utbredningen ya molekuli kutengenezea kupitia membrane
- shinikizo la kiosmotiki ()
- shinikizo la kupinga linalohitajika kuzuia uhamisho wa wingi wa molekuli za kutengenezea kwa njia ya utando wa nusu
- Sheria ya Raoult
- shinikizo la sehemu linalofanywa na sehemu ya suluhisho ni sawa na bidhaa ya sehemu ya sehemu ya mole katika suluhisho na shinikizo la mvuke la usawa katika hali safi
- utando wa semipermit
- utando kwamba selectively vibali kifungu ya ions fulani au molekuli
- van 't Hoff sababu (i)
- uwiano wa idadi ya moles ya chembe katika suluhisho kwa idadi ya moles ya vitengo vya formula kufutwa katika suluhisho


