11.2: Electrolytes
- Page ID
- 176186
- Eleza na kutoa mifano ya electrolytes
- Tofautisha kati ya mabadiliko ya kimwili na kemikali ambayo yanaongozana na uharibifu wa electrolytes ionic na covalent
- Kuhusiana electrolyte nguvu kwa Solute-kutengenezea nguvu
Wakati baadhi ya vitu hupasuka ndani ya maji, hupata mabadiliko ya kimwili au kemikali ambayo huzalisha ions katika suluhisho. Dutu hizi hufanya darasa muhimu la misombo inayoitwa electrolytes. Mambo ambayo hayatoi ions wakati kufutwa huitwa nonelectrolytes. Ikiwa mchakato wa kimwili au kemikali unaozalisha ions kimsingi ni ufanisi wa 100% (yote ya kiwanja kilichopasuka huzalisha ions), basi dutu hii inajulikana kama electrolyte yenye nguvu. Ikiwa sehemu ndogo tu ya dutu iliyoharibiwa inakabiliwa na mchakato wa kuzalisha ion, inaitwa electrolyte dhaifu.
Mambo yanaweza kutambuliwa kama nguvu, dhaifu, au nonelectrolytes kwa kupima upitishaji wa umeme wa suluhisho la maji yenye dutu. Kufanya umeme, dutu lazima iwe na aina za simu za mkononi, za kushtakiwa. Wengi wanaojulikana ni uendeshaji wa umeme kupitia waya za metali, ambapo kesi ya simu, vyombo vya kushtakiwa ni elektroni. Ufumbuzi pia unaweza kufanya umeme ikiwa yana ions kufutwa, na conductivity kuongezeka kama mkusanyiko ion kuongezeka. Kutumia voltage kwa electrodes kuzama katika ufumbuzi vibali tathmini ya mkusanyiko jamaa wa ions kufutwa, ama quantitatively, kwa kupima mtiririko wa umeme wa sasa, au kwa ubora, kwa kuchunguza mwangaza wa bulb mwanga pamoja na katika mzunguko (Kielelezo\(\PageIndex{1}\)).
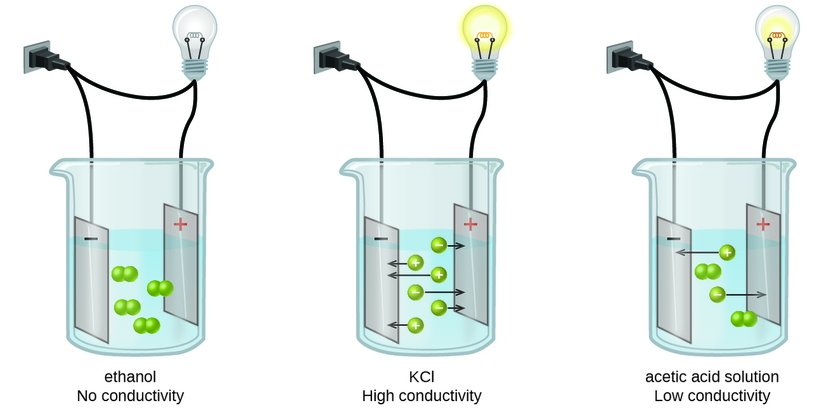
Electrolytes ya ionic
Maji na molekuli nyingine za polar huvutiwa na ions, kama inavyoonekana kwenye Mchoro\(\PageIndex{2}\). Mvuto wa umeme kati ya ioni na molekuli yenye dipole inaitwa kivutio cha ion-dipole. Vivutio hivi vina jukumu muhimu katika kuvunjwa kwa misombo ya ionic katika maji.
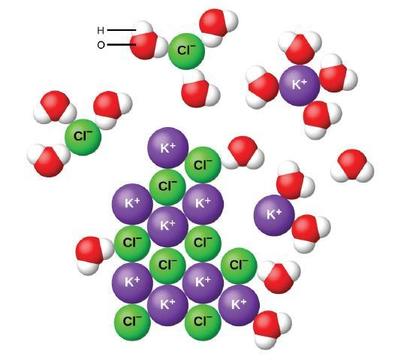
Wakati misombo ionic kufutwa katika maji, ions katika tofauti imara na kueneza enhetligt katika suluhisho kwa sababu molekuli maji surround na solvate ions, kupunguza nguvu nguvu umeme kati yao. Utaratibu huu inawakilisha mabadiliko ya kimwili inayojulikana kama dissociation. Chini ya hali nyingi, misombo ionic itakuwa dissociate karibu kabisa wakati kufutwa, na hivyo wao ni classified kama electrolytes nguvu.
Hebu tuchunguze kinachotokea katika ngazi microscopic tunapoongeza kCl imara kwa maji. Vikosi vya ion-dipole huvutia mwisho wa hidrojeni (hidrojeni) wa molekuli za maji ya polar kwa ions hasi ya kloridi kwenye uso wa imara, na huvutia mwisho wa hasi (oksijeni) kwa ions nzuri za potasiamu. Molekuli maji kupenya kati ya mtu binafsi K + na Cl -ions na kuzunguka yao, kupunguza nguvu nguvu interionic kwamba kumfunga ions pamoja na kuruhusu yao hoja mbali katika ufumbuzi kama ions solvated, kama Kielelezo inaonyesha. Kupunguza kivutio cha umeme inaruhusu mwendo wa kujitegemea wa kila ioni hidrati katika suluhisho la kuondokana, na kusababisha kuongezeka kwa ugonjwa wa mfumo kama ions zinabadilika kutoka nafasi zao za kudumu na zilizoamuru katika kioo kwa majimbo ya simu na mengi zaidi yanayosababishwa katika suluhisho. Ugonjwa huu ulioongezeka unawajibika kwa uharibifu wa misombo mingi ya ionic, ikiwa ni pamoja na kCl, ambayo hupasuka kwa kunyonya joto.
Katika hali nyingine, vivutio vya umeme kati ya ioni katika kioo ni kubwa sana, au vikosi vya kuvutia ion-dipole kati ya ioni na molekuli za maji ni dhaifu sana, kwamba ongezeko la ugonjwa hauwezi kulipa fidia kwa nishati inayotakiwa kutenganisha ioni, na kioo hakina. Hiyo ni kesi kwa misombo kama calcium carbonate (chokaa), kalsiamu phosphate (sehemu isokaboni ya mfupa), na oksidi ya chuma (kutu).
Electrolytes ya covalent
Maji safi ni kondakta duni sana ya umeme kwa sababu ni kidogo tu ionized- tu takriban mbili kati ya kila molekuli bilioni 1 ionize saa 25 °C Maji ionizes pale molekuli moja ya maji ikitoa protoni kwa molekuli nyingine ya maji, ikitoa ioni hidroniamu na hidroksidi.
\[\ce{H_2O (l)+ H_2O (l) \rightleftharpoons H_3O^{+} (aq) + OH^{−} (aq)} \label{11.3.2} \]
Katika baadhi ya matukio, tunaona kwamba ufumbuzi ulioandaliwa kutoka kwa misombo ya covalent hufanya umeme kwa sababu molekuli za solute huguswa kemikali na kutengenezea kuzalisha ions. Kwa mfano, kloridi safi ya hidrojeni ni gesi yenye molekuli ya hCl ya covalent. Gesi hii haina ions. Hata hivyo, wakati sisi kufuta kloridi hidrojeni katika maji, tunaona kwamba suluhisho ni conductor nzuri sana. Molekuli za maji zina sehemu muhimu katika kutengeneza ions: Ufumbuzi wa kloridi hidrojeni katika vimumunyisho vingine vingi, kama vile benzini, haufanyi umeme na hauna ions.
Kloridi hidrojeni ni asidi, na hivyo molekuli zake huguswa na maji, kuhamisha ioni H + kuunda ioni za hidronium (\(H_3O^+\)) na ioni za kloridi (Cl -):
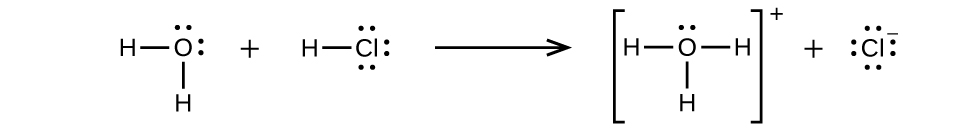
Tabia hii ni kimsingi 100% kamili kwa HCl (yaani, ni asidi kali na, kwa hiyo, electrolyte yenye nguvu). Vivyo hivyo, asidi dhaifu na misingi ambayo huguswa sehemu tu huzalisha viwango vya chini vya ioni wakati kufutwa katika maji na huwekwa kama electrolytes dhaifu. Msomaji anaweza kutaka kupitia majadiliano ya asidi kali na dhaifu zinazotolewa katika sura ya awali ya maandishi haya juu ya madarasa ya majibu na stoichiometry.
Muhtasari
Mambo ambayo hupasuka katika maji ili kuzalisha ions huitwa electrolytes. Electrolytes inaweza kuwa misombo ya covalent ambayo kemikali kuguswa na maji ili kuzalisha ions (kwa mfano, asidi na besi), au wanaweza kuwa misombo ionic ambayo dissociate kutoa cations yao Constituent na anions, wakati kufutwa. Uharibifu wa kiwanja cha ionic huwezeshwa na vivutio vya ion-dipole kati ya ions ya kiwanja na molekuli za maji ya polar. Dutu ionic mumunyifu na asidi kali ionize kabisa na ni electrolytes nguvu, wakati asidi dhaifu na besi ionize kwa kiasi kidogo tu na ni electrolytes dhaifu. Nonelectrolytes ni vitu ambavyo hazizalishi ions wakati kufutwa katika maji.
faharasa
- kujitenga
- mchakato wa kimwili unaoongozana na uharibifu wa kiwanja cha ionic ambacho ions ya kiwanja hutenganishwa na kutawanyika katika suluhisho
- electroliti
- Dutu inayozalisha ions wakati kufutwa katika maji
- kivutio cha ion-dipole
- mvuto wa umeme kati ya ion na molekuli ya polar
- isiyo electrolyt
- Dutu ambayo haina kuzalisha ions wakati kufutwa katika maji
- electrolyte
- Dutu kwamba dissociates au ionizes kabisa wakati kufutwa katika maji
- elektroliti dhaifu
- Dutu kwamba ionizes sehemu tu wakati kufutwa katika maji


