9.5: Nadharia ya Kinetic-Masi
- Page ID
- 176886
- Hali ya postulates ya nadharia ya kinetic-Masi
- Matumizi ya nadharia hii postulates kueleza sheria gesi
Sheria za gesi ambazo tumeona kwa hatua hii, pamoja na usawa bora wa gesi, ni za kimapenzi, yaani, zimetokana na uchunguzi wa majaribio. Aina za hisabati za sheria hizi zinaelezea kwa karibu tabia ya macroscopic ya gesi nyingi kwa shinikizo chini ya 1 au 2 atm. Ingawa sheria za gesi zinaelezea mahusiano ambayo yamehakikishiwa na majaribio mengi, hayatuambii kwa nini gesi hufuata mahusiano haya.
Nadharia ya Masi ya kinetic (KMT) ni mfano rahisi wa microscopic unaoelezea kwa ufanisi sheria za gesi zilizoelezwa katika modules zilizopita za sura hii. Nadharia hii inategemea postulates tano zifuatazo zilizoelezwa hapa. (Kumbuka: Neno “molekuli” litatumika kutaja aina ya kemikali ya mtu binafsi ambayo kutunga gesi, ingawa baadhi ya gesi ni linajumuisha aina atomiki, kwa mfano, gesi vyeo.)
- Gesi zinajumuisha molekuli ambazo ziko katika mwendo unaoendelea, zinasafiri katika mistari nyooka na kubadilisha mwelekeo tu wakati zinapogongana na molekuli nyingine au kwa kuta za chombo.
- Molekuli zinazojumuisha gesi ni ndogo sana ikilinganishwa na umbali kati yao.
- Shinikizo linalotumiwa na gesi katika chombo linatokana na migongano kati ya molekuli za gesi na kuta za chombo.
- Molekuli za gesi hazitumii nguvu za kuvutia au za kukataa kwa kila mmoja au kuta za chombo; kwa hiyo, migongano yao ni elastic (usihusishe kupoteza nishati).
- Nishati ya kinetic ya wastani ya molekuli ya gesi ni sawa na joto la kelvin la gesi.
Mtihani wa KMT na postulates yake ni uwezo wake wa kueleza na kuelezea tabia ya gesi. Sheria mbalimbali za gesi zinaweza kutokana na mawazo ya KMT, ambayo yamesababisha wanakemia kuamini kwamba mawazo ya nadharia yanawakilisha kwa usahihi mali za molekuli za gesi. Tutaangalia kwanza sheria za gesi za mtu binafsi (sheria za Boyle, Charles, Amontons, Avogadro, na Dalton) kwa dhana ili kuona jinsi KMT inavyoelezea. Kisha, tutazingatia kwa makini uhusiano kati ya raia wa Masi, kasi, na nguvu za kinetic na joto, na kuelezea sheria ya Graham.
Nadharia ya Kinetic-Masi Inaelezea Tabia ya Gesi, Sehemu ya I
Akikumbuka kwamba shinikizo la gesi linajitokeza na molekuli za gesi zinazohamia haraka na inategemea moja kwa moja idadi ya molekuli inayopiga eneo la kitengo cha ukuta kwa kitengo cha wakati, tunaona kwamba KMT conceptually inaelezea tabia ya gesi kama ifuatavyo:
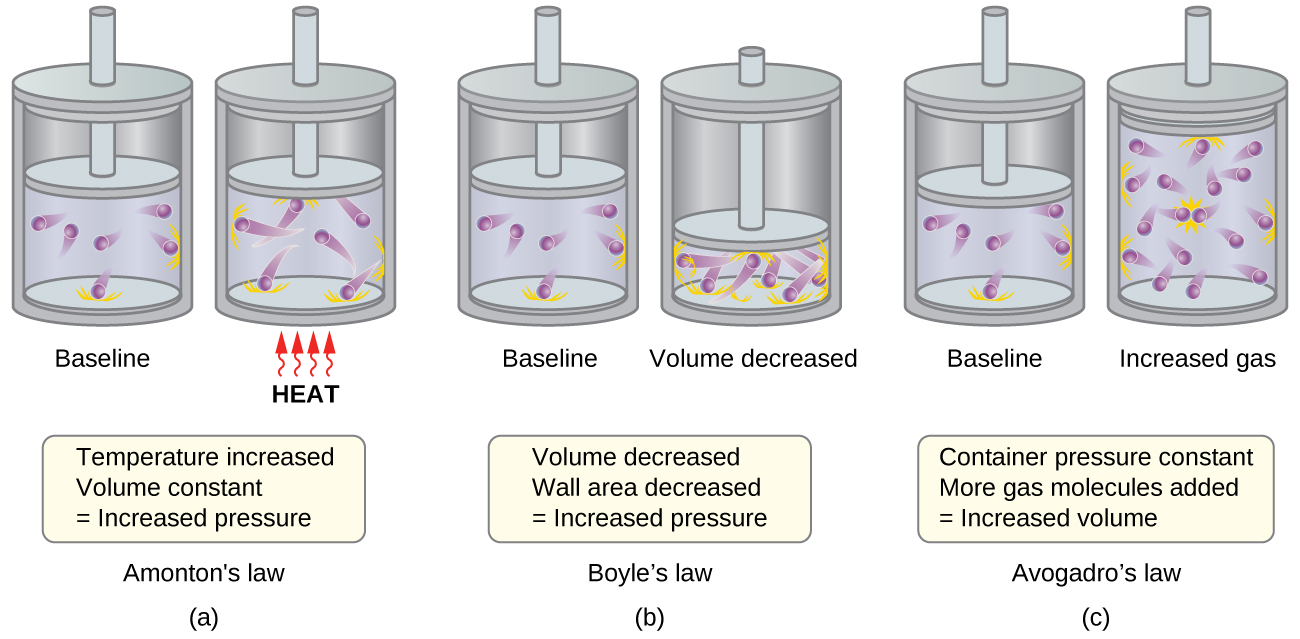
- Sheria ya Amontons. Ikiwa joto linaongezeka, kasi ya wastani na nishati ya kinetic ya molekuli za gesi huongezeka. Ikiwa kiasi kinafanyika mara kwa mara, kasi ya kuongezeka kwa molekuli ya gesi husababisha migongano ya mara kwa mara na yenye nguvu zaidi na kuta za chombo, kwa hiyo kuongeza shinikizo (Kielelezo\(\PageIndex{1a}\)).
- Sheria ya Charles. Ikiwa joto la gesi linaongezeka, shinikizo la mara kwa mara linaweza kudumishwa tu ikiwa kiasi kinachotumiwa na gesi kinaongezeka. Hii itasababisha umbali mkubwa wa wastani uliosafiri na molekuli kufikia kuta za chombo, pamoja na eneo la uso wa ukuta ulioongezeka. Hali hizi zitapungua mzunguko wa migongano ya ukuta wa molekuli na idadi ya migongano kwa eneo la kitengo, athari za pamoja ambazo zina usawa wa athari za kuongezeka kwa nguvu za mgongano kutokana na nishati kubwa ya kinetic kwenye joto la juu.
- Sheria ya Boyle. Ikiwa kiasi cha gesi kinapungua, eneo la ukuta wa chombo hupungua na mzunguko wa mgongano wa ukuta wa molekuli huongezeka, wote ambao huongeza shinikizo linalofanywa na gesi (Kielelezo\(\PageIndex{1b}\)).
- Sheria ya Avogadro. Kwa shinikizo la mara kwa mara na joto, mzunguko na nguvu ya migongano ya ukuta wa molekuli ni mara kwa mara. Chini ya hali hiyo, kuongeza idadi ya molekuli za gesi itahitaji ongezeko la kawaida katika kiasi cha chombo ili kupunguza idadi ya migongano kwa eneo la kitengo ili kulipa fidia kwa mzunguko ulioongezeka wa migongano (Kielelezo\(\PageIndex{1c}\)).
- Sheria ya Dalton. Kwa sababu ya umbali mkubwa kati yao, molekuli ya gesi moja katika mchanganyiko hupiga kuta za chombo na mzunguko sawa ikiwa gesi nyingine zipo au la, na shinikizo la jumla la mchanganyiko wa gesi ni sawa na jumla ya shinikizo (sehemu) ya gesi ya mtu binafsi.
Velocities ya molekuli na Nishati ya
Majadiliano ya awali yalionyesha kuwa KMT inaeleza kimaelezo tabia zilizoelezwa na sheria mbalimbali za gesi. Postulates ya nadharia hii inaweza kutumika kwa mtindo wa kiasi zaidi ili kupata sheria hizi za kibinafsi. Ili kufanya hivyo, lazima kwanza tuangalie kasi na nguvu za kinetic za molekuli za gesi, na joto la sampuli ya gesi.
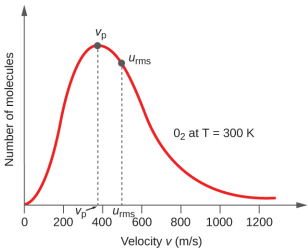
Katika sampuli ya gesi, molekuli ya mtu binafsi ina kasi tofauti sana; hata hivyo, kwa sababu ya idadi kubwa ya molekuli na migongano inayohusika, usambazaji wa kasi ya Masi na kasi ya wastani ni mara kwa mara. Hii usambazaji kasi Masi inajulikana kama usambazaji Maxwell-Boltzmann, na inaonyesha idadi jamaa ya molekuli katika sampuli wingi wa gesi ambayo ana kasi fulani (Kielelezo\(\PageIndex{2}\)).
Nishati ya kinetic (KE) ya chembe ya wingi (m) na kasi (u) hutolewa na:
\[\ce{KE}=\dfrac{1}{2}mu^2 \nonumber \]
Kuonyesha wingi kwa kilo na kasi kwa mita kwa pili itazalisha maadili ya nishati katika vitengo vya joules (J = kg m 2 s -2). Ili kukabiliana na idadi kubwa ya molekuli za gesi, tunatumia wastani kwa kasi na nishati ya kinetic. Katika KMT, mizizi ina maana kasi ya mraba ya chembe, u rms, hufafanuliwa kama mizizi ya mraba ya wastani wa mraba wa kasi na n = idadi ya chembe:
\[u_\ce{rms}=\sqrt{\overline{u^2}}=\sqrt{\dfrac{u^2_1+u^2_2+u^2_3+u^2_4+…}{n}} \nonumber \]
Nishati ya kinetic wastani, KE avg, ni sawa na:
\[\mathrm{KE_{avg}}=\dfrac{1}{2}mu^2_\ce{rms} \nonumber \]
Kiwango cha KE cha mkusanyiko wa molekuli za gesi pia ni sawia moja kwa moja na joto la gesi na inaweza kuelezewa na equation:
\[\mathrm{KE_{avg}}=\dfrac{3}{2}RT \nonumber \]
ambapo R ni mara kwa mara ya gesi na T ni joto la kelvin. Wakati unatumiwa katika equation hii, fomu sahihi ya mara kwa mara ya gesi ni 8.314 J mol -1 K -1 (8.314 kg m 2 s — 2 mol -1 K -1). Hizi milinganyo miwili tofauti kwa KE avg inaweza kuunganishwa na kupangwa upya ili kutoa uhusiano kati ya kasi ya Masi na joto:
\[\dfrac{1}{2}mu^2_\ce{rms}=\dfrac{3}{2}RT \nonumber \]
\[u_\ce{rms}=\sqrt{\dfrac{3RT}{m}} \label{RMS} \]
Tumia kasi ya mzizi-maana-mraba kwa molekuli ya nitrojeni saa 30 °C.
Suluhisho
Badilisha joto ndani ya Kelvin:
\[30°C+273=303\: K \nonumber \]
Kuamua wingi wa molekuli ya nitrojeni kwa kilo:
\[\mathrm{\dfrac{28.0\cancel{g}}{1\: mol}×\dfrac{1\: kg}{1000\cancel{g}}=0.028\:kg/mol} \nonumber \]
Badilisha nafasi ya vigezo na vipindi katika formula ya kasi ya mizizi-maana-mraba (Equation\ ref {RMS}), ukibadilisha Joules na kilo sawa m 2 s —2:
\[ \begin{align*} u_\ce{rms} &= \sqrt{\dfrac{3RT}{m}} \\ u_\ce{rms} &=\sqrt{\dfrac{3(8.314\:J/mol\: K)(303\: K)}{(0.028\:kg/mol)}} \\ &=\sqrt{2.70 \times 10^5\:m^2s^{−2}} \\ &= 519\:m/s \end{align*} \nonumber \]
Tumia kasi ya mzizi-maana-mraba kwa molekuli ya oksijeni kwenye -23 °C.
- Jibu
-
441 m/s
Ikiwa joto la gesi linaongezeka, KE avg yake huongezeka, molekuli zaidi zina kasi ya juu na molekuli chache zina kasi ya chini, na usambazaji hubadilika kuelekea kasi ya juu kwa ujumla, yaani, kulia. Kama joto itapungua, KE avg itapungua, molekuli zaidi zina kasi ya chini na molekuli chache zina kasi ya juu, na usambazaji hubadilika kuelekea kasi ya chini kwa ujumla, yaani upande wa kushoto. Tabia hii ni mfano kwa gesi ya nitrojeni katika Kielelezo\(\PageIndex{3}\).
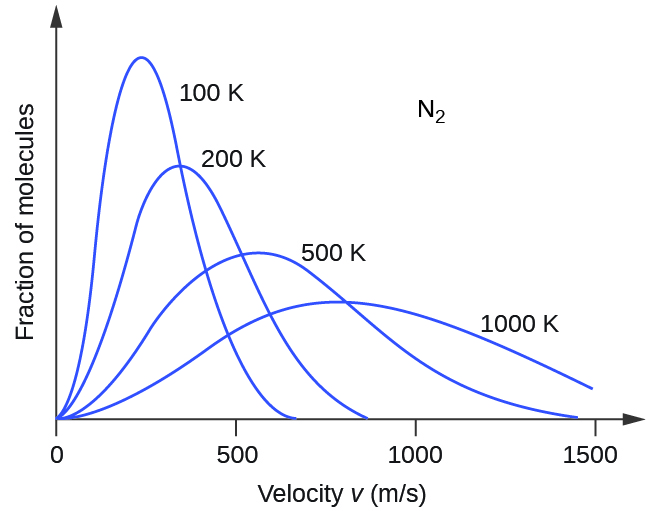
Katika joto lililopewa, gesi zote zina wastani wa KE sawa kwa molekuli zao. Gesi linajumuisha molekuli nyepesi na chembe zaidi high-speed na juu u RMS, na usambazaji kasi kwamba peaks katika velocities juu kiasi. Gesi yenye molekuli nzito zina chembe za kasi za chini zaidi, rms ya chini, na usambazaji wa kasi unaozunguka kwa kasi ya chini. Hali hii imeonyeshwa na data kwa mfululizo wa gesi nzuri zilizoonyeshwa kwenye Kielelezo\(\PageIndex{4}\).

Simulator ya gesi inaweza kutumika kuchunguza athari za joto kwenye kasi ya Masi. Kuchunguza simulator “histograms nishati” (Masi kasi mgawanyo) na “spishi habari” (ambayo inatoa wastani kasi maadili) kwa molekuli ya raia mbalimbali katika joto mbalimbali.
Nadharia ya Kinetic-Masi Inaelezea Tabia ya Gesi, Sehemu ya II
Kwa mujibu wa sheria ya Graham, molekuli za gesi ziko katika mwendo wa haraka na molekuli wenyewe ni ndogo. Umbali wa wastani kati ya molekuli za gesi ni kubwa ikilinganishwa na ukubwa wa molekuli. Matokeo yake, molekuli za gesi zinaweza kusongana kwa urahisi na kuenea kwa viwango vya haraka.
Kiwango cha uharibifu wa gesi inategemea moja kwa moja juu ya kasi (wastani) ya molekuli zake:
\[\textrm{effusion rate} ∝ u_\ce{rms} \nonumber \]
Kwa kutumia uhusiano huu, na equation zinazohusiana kasi Masi kwa wingi, sheria Graham inaweza kuwa rahisi inayotokana kama inavyoonekana hapa:
\[u_\ce{rms}=\sqrt{\dfrac{3RT}{m}} \nonumber \]
\[m=\dfrac{3RT}{u^2_\ce{rms}}=\dfrac{3RT}{\overline{u}^2} \nonumber \]
\[\mathrm{\dfrac{effusion\: rate\: A}{effusion\: rate\: B}}=\dfrac{u_\mathrm{rms\:A}}{u_\mathrm{rms\:B}}=\dfrac{\sqrt{\dfrac{3RT}{m_\ce{A}}}}{\sqrt{\dfrac{3RT}{m_\ce{B}}}}=\sqrt{\dfrac{m_\ce{B}}{m_\ce{A}}} \nonumber \]
Uwiano wa viwango vya uharibifu hutolewa kuwa inversely sawia na uwiano wa mizizi ya mraba ya raia wao. Hii ni uhusiano huo aliona experimentally na walionyesha kama sheria Graham ya.
Muhtasari
Nadharia ya molekuli ya kinetic ni mfano rahisi lakini ufanisi sana unaoelezea kwa ufanisi tabia bora ya gesi. Nadharia inadhani kwamba gesi zinajumuisha molekuli zilizojitenga sana za kiasi kidogo ambazo ziko katika mwendo wa mara kwa mara, zikigongana elastically na kila mmoja na kuta za chombo chao na kasi ya wastani inayoamua na joto lao kamili. Molekuli ya mtu binafsi ya gesi huonyesha kasi nyingi, usambazaji wa kasi hizi unategemea joto la gesi na wingi wa molekuli zake.
Mlinganyo muhimu
- \(u_\ce{rms}=\sqrt{\overline{u^2}}=\sqrt{\dfrac{u^2_1+u^2_2+u^2_3+u^2_4+…}{n}}\)
- \(\mathrm{KE_{avg}}=\dfrac{3}{2}RT\)
- \(u_\ce{rms}=\sqrt{\dfrac{3RT}{m}}\)
Muhtasari
- kinetic Masi nadharia
- nadharia kulingana na kanuni rahisi na mawazo ambayo kwa ufanisi anaelezea tabia bora gesi
- mizizi maana kasi ya mraba (u rms)
- kipimo cha kasi ya wastani kwa kundi la chembe zilizohesabiwa kama mizizi ya mraba ya kasi ya wastani wa mraba


