9.6: Tabia isiyo ya Bora ya Gesi
- Page ID
- 176898
- Eleza mambo ya kimwili ambayo husababisha upungufu kutoka kwa tabia bora ya gesi
- Eleza jinsi mambo haya yanawakilishwa katika equation ya van der Waals
- Eleza ufanisi (Z) na ueleze jinsi tofauti yake na shinikizo huonyesha tabia isiyo bora
- Quantify tabia zisizo bora kwa kulinganisha hesabu ya mali gesi kwa kutumia sheria bora gesi na van der Waals equation
Hadi sasa, sheria bora ya gesi, PV = NRT, imetumika kwa aina mbalimbali za matatizo, kuanzia stoichiometry mmenyuko na matatizo empirical na molekuli formula kuamua wiani na molekuli molekuli ya gesi. Kama ilivyoelezwa katika modules zilizopita za sura hii, hata hivyo, tabia ya gesi mara nyingi haifai, maana yake ni kwamba uhusiano uliozingatiwa kati ya shinikizo lake, kiasi, na joto hazielezewi kwa usahihi na sheria za gesi. Katika sehemu hii, sababu za upungufu huu kutoka kwa tabia bora ya gesi zinachukuliwa.
Njia moja ambayo usahihi wa PV = NRT unaweza kuhukumiwa ni kwa kulinganisha kiasi halisi cha mole 1 ya gesi (kiasi chake cha molar, Vm) kwa kiasi cha molar cha gesi bora kwa joto sawa na shinikizo. Uwiano huu unaitwa sababu ya ufanisi (Z) na:
\[\mathrm{Z=\dfrac{molar\: volume\: of\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}{molar\: volume\: of\: ideal\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}}=\left(\dfrac{PV_m}{RT}\right)_\ce{measured} \nonumber \]
Kwa hiyo tabia nzuri ya gesi huonyeshwa wakati uwiano huu ni sawa na 1, na kupotoka yoyote kutoka 1 ni dalili ya tabia isiyo bora. Kielelezo\(\PageIndex{1}\) kinaonyesha viwanja vya Z juu ya aina kubwa ya shinikizo kwa gesi kadhaa za kawaida.
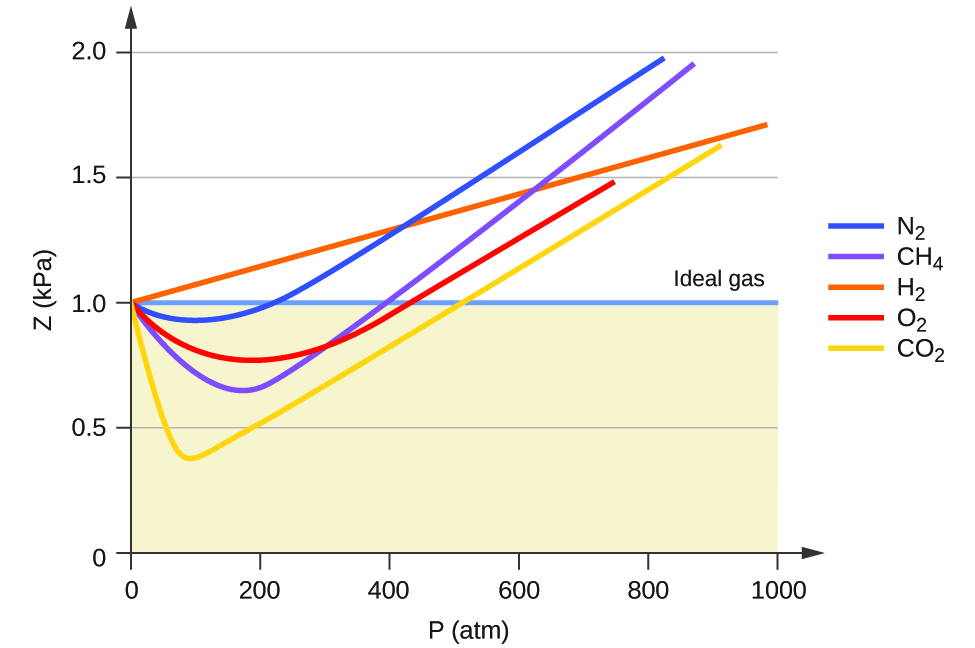
Kama ni dhahiri kutoka Kielelezo\(\PageIndex{1}\), bora gesi sheria haina kuelezea gesi tabia vizuri katika shinikizo kiasi juu. Kuamua kwa nini hii ni, fikiria tofauti kati ya mali halisi ya gesi na kile kinachotarajiwa cha gesi bora ya nadharia.
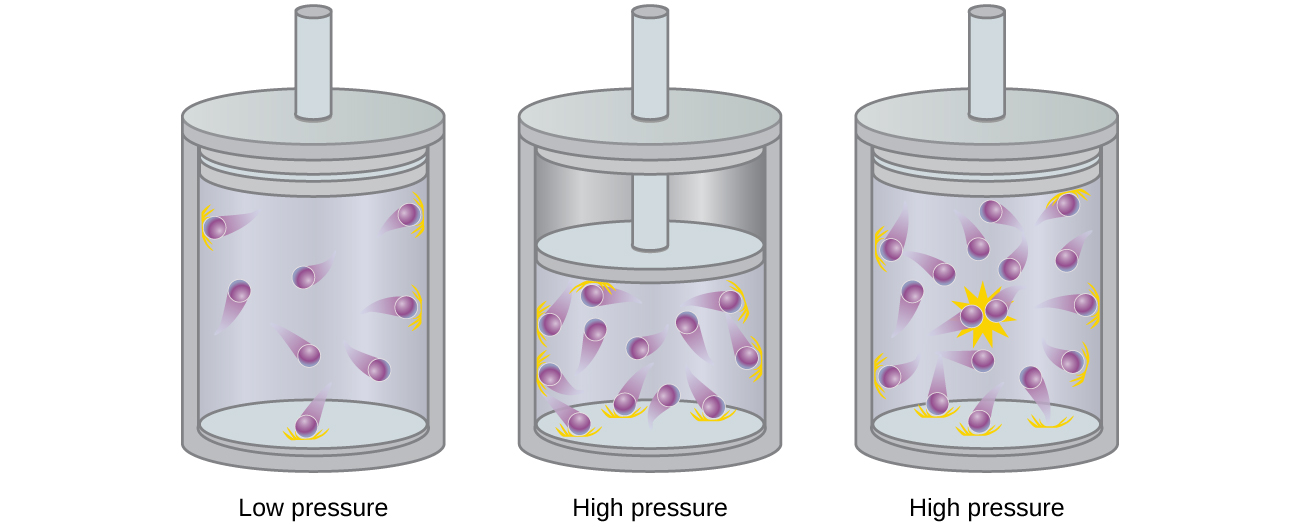
Vipande vya gesi bora ya nadharia hazina kiasi kikubwa na hazivutii au kurudiana. Kwa ujumla, gesi halisi inakaribia tabia hii kwa shinikizo la chini na joto la juu. Hata hivyo, kwa shinikizo kubwa, molekuli za gesi zimejaa karibu pamoja, na kiasi cha nafasi tupu kati ya molekuli hupunguzwa. Katika shinikizo hizi za juu, kiasi cha molekuli za gesi wenyewe huwa na thamani ya jamaa na kiasi cha jumla kinachotumiwa na gesi (Kielelezo\(\PageIndex{2}\)). Kwa hiyo gesi inakuwa chini ya compressible katika shinikizo hizi kubwa, na ingawa kiasi chake kinaendelea kupungua kwa shinikizo kuongezeka, kupungua hii si sawia kama ilivyotabiriwa na sheria ya Boyle.
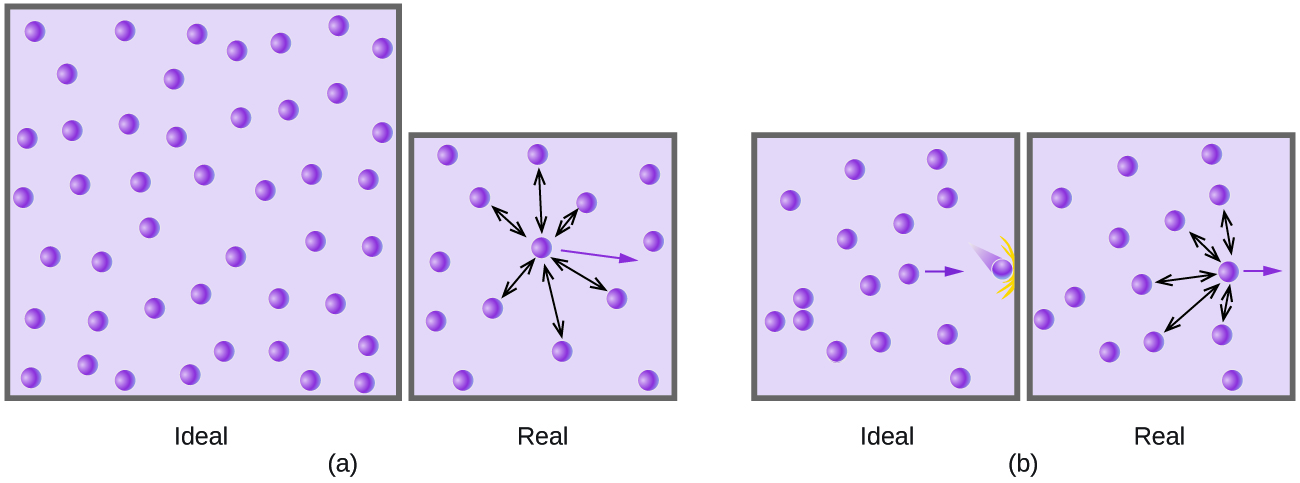
Kwa shinikizo la chini, molekuli za gesi hazina kivutio kwa kila mmoja kwa sababu ni (kwa wastani) mbali sana, na zinaishi karibu kama chembe za gesi bora. Kwa shinikizo la juu, hata hivyo, nguvu ya kivutio pia haifai tena. Nguvu hii huchota molekuli karibu kidogo pamoja, kupunguza kidogo shinikizo (ikiwa kiasi ni mara kwa mara) au kupunguza kiasi (kwa shinikizo la mara kwa mara) (Kielelezo\(\PageIndex{3}\)). Mabadiliko haya yanatamkwa zaidi kwenye joto la chini kwa sababu molekuli zina KE ya chini ikilinganishwa na vikosi vya kuvutia, na hivyo hazina ufanisi zaidi katika kushinda vivutio hivi baada ya kugongana.
Kuna milinganyo kadhaa tofauti ambayo bora takriban gesi tabia kuliko gani bora gesi sheria. Ya kwanza, na rahisi, ya haya ilianzishwa na mwanasayansi wa Uholanzi Johannes van der Waals mwaka 1879. Equation ya van der Waals inaboresha juu ya sheria bora ya gesi kwa kuongeza maneno mawili: moja kuhesabu kiasi cha molekuli ya gesi na nyingine kwa nguvu za kuvutia kati yao.
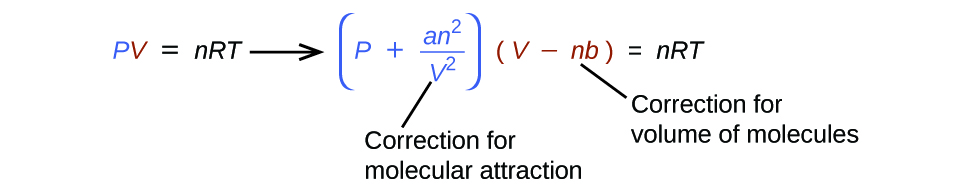
A mara kwa mara inalingana na nguvu ya mvuto kati ya molekuli ya gesi fulani, na b mara kwa mara inalingana na ukubwa wa molekuli ya gesi fulani. “Marekebisho” kwa neno la shinikizo katika sheria bora ya gesi ni\(\dfrac{n^2a}{V^2}\), na “marekebisho” kwa kiasi ni nb. Kumbuka kwamba wakati V ni kubwa na n ni ndogo, wote wa masharti haya marekebisho kuwa kidogo, na van der Waals equation inapunguza sheria bora gesi, PV = NRT. Hali hiyo inalingana na gesi ambayo idadi ndogo ya molekuli inachukua kiasi kikubwa, yaani, gesi kwa shinikizo la chini. Maadili ya majaribio kwa constants van der Waals ya baadhi ya gesi ya kawaida hutolewa katika Jedwali\(\PageIndex{1}\).
| Gesi | (L 2 atm/mol 2) | b (L/mol) |
|---|---|---|
| N 2 | 1.39 | 0.0391 |
| O 2 | 1.36 | 0.0318 |
| CO 2 | 3.59 | 0.0427 |
| H 2 O | 5.46 | 0.0305 |
| Yeye | 0.0342 | 0.0237 |
| cCl 4 | 20.4 | 0.1383 |
Kwa shinikizo la chini, marekebisho ya kivutio cha intermolecular, ni muhimu zaidi kuliko moja kwa kiasi cha Masi, b. Kwa shinikizo la juu na kiasi kidogo, marekebisho ya kiasi cha molekuli inakuwa muhimu kwa sababu molekuli wenyewe hazipatikani na hufanya sehemu inayojulikana ya kiasi cha jumla. Katika shinikizo fulani la kati, marekebisho hayo mawili yana mvuto wa kupinga na gesi inaonekana kufuata uhusiano uliotolewa na PV = NRT juu ya shinikizo mbalimbali ndogo. Tabia hii ni yalijitokeza na “majosho” katika kadhaa ya curves compressibility inavyoonekana katika Kielelezo\(\PageIndex{1}\). Nguvu ya kuvutia kati ya molekuli awali hufanya gesi iwe rahisi zaidi kuliko gesi bora, kama shinikizo linafufuliwa (Z hupungua kwa kuongezeka kwa P). Kwa shinikizo la juu sana, gesi inakuwa chini ya kuchanganya (Z huongezeka na P), kama molekuli za gesi zinaanza kuchukua sehemu kubwa zaidi ya kiasi cha gesi.
Kwa kusema, usawa wa gesi bora hufanya kazi vizuri wakati vivutio vya intermolecular kati ya molekuli za gesi ni duni na molekuli za gesi wenyewe hazitachukua sehemu inayojulikana ya kiasi kikubwa. Vigezo hivi vinaridhika chini ya hali ya shinikizo la chini na joto la juu. Chini ya hali hiyo, gesi inasemekana kuwa na tabia nzuri, na ukiukaji kutoka kwa sheria za gesi ni ndogo ya kutosha ili waweze kupuuzwa-hii ni, hata hivyo, mara nyingi sana si kesi.
Flaski 4.25-L ina 3.46 mol CO 2 saa 229 °C Kuhesabu shinikizo la sampuli hii ya CO 2:
- kutoka sheria bora ya gesi
- kutoka kwa equation ya van der Waals
- Eleza sababu (s) kwa tofauti.
Suluhisho
(a) Kutokana na sheria bora ya gesi:
(b) Kutoka van der Waals equation:
\(\left(P+\dfrac{n^2a}{V^2}\right)×(V−nb)=nRT⟶P=\dfrac{nRT}{(V−nb)}−\dfrac{n^2a}{V^2}\)
\(P=\mathrm{\dfrac{3.46\:mol×0.08206\:L\:atm\:mol^{−1}\:K^{−1}×502\: K}{(4.25\:L−3.46\:mol×0.0427\:L\:mol^{−1})}−\dfrac{(3.46\:mol)^2×3.59\:L^2\:atm\:mol^2}{(4.25\:L)^2}}\)
Hii hatimaye huzaa P = 32.4 atm.
(c) Hii si tofauti sana na thamani kutoka sheria bora ya gesi kwa sababu shinikizo si kubwa sana na joto si chini sana. Thamani ni tofauti kwa sababu molekuli za CO 2 zina kiasi na vivutio kati ya molekuli, na sheria bora ya gesi inadhani hawana kiasi au vivutio.
Flask 560-ml ina 21.3 g N 2 saa 145 °C Kuhesabu shinikizo la N 2:
- kutoka sheria bora ya gesi
- kutoka kwa equation ya van der Waals
- Eleza sababu (s) kwa tofauti.
- Jibu
-
46.562 atm
- Jibu b
-
46.594 atm
- Jibu c
-
Ulinganisho wa van der Waals unazingatia kiasi cha molekuli za gesi wenyewe pamoja na vivutio vya intermolecular.
Muhtasari
Molekuli za gesi zina kiasi cha mwisho na vikosi vya uzoefu wa kivutio kwa kila mmoja. Kwa hiyo, tabia ya gesi haielezewi vizuri na sheria bora ya gesi. Chini ya hali ya shinikizo la chini na joto la juu, mambo haya ni duni, usawa wa gesi bora ni maelezo sahihi ya tabia ya gesi, na gesi inasemekana kuonyesha tabia bora. Hata hivyo, katika joto la chini na shinikizo la juu, marekebisho ya kiasi cha Masi na vivutio vya Masi yanahitajika kuhesabu ukubwa wa Masi ya mwisho na majeshi ya kuvutia. Ulinganisho wa van der Waals ni toleo la kurekebishwa la sheria bora ya gesi ambayo inaweza kutumika kwa akaunti kwa tabia zisizo bora za gesi chini ya hali hizi.
Mlinganyo muhimu
- \(\mathrm{Z=\dfrac{molar\:volume\: of\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}{molar\: volume\: of\: ideal\: gas\: at\: same\:\mathit{T}\:and\:\mathit{P}}}=\left(\dfrac{P×V_m}{R×T}\right)_\ce{measured}\)
- \(\left(P+\dfrac{n^2a}{V^2}\right)×(V−nb)=nRT\)
faharasa
- sababu ya kutosha (Z)
- uwiano wa kiasi cha majaribio ya kupima kwa gesi kwa kiasi chake cha molar kama kilichohesabiwa kutoka kwa usawa bora wa gesi
- van der Waals equation
- iliyopita toleo la bora gesi equation zenye masharti ya ziada kwa akaunti kwa ajili ya tabia zisizo bora gesi


