8.4: Nadharia ya Orbital ya Masi
- Page ID
- 175953
- Eleza mbinu ya msingi ya quantum-mitambo ya kupata orbitals Masi kutoka orbitals atomiki
- Eleza sifa za bonding na antibonding orbitals Masi
- Tumia maagizo ya dhamana kulingana na usanidi wa elektroni
- Andika usanidi wa elektroni wa Masi kwa molekuli ya diatomiki ya kwanza na ya
- Kuhusiana na mazungumzo haya elektroni na stabilities molekuli 'na mali magnetic
Kwa karibu kila molekuli covalent iliyopo, sasa tunaweza kuteka muundo wa Lewis, kutabiri jiometri ya jozi ya elektroni, kutabiri jiometri ya Masi, na kuja karibu na kutabiri pembe za dhamana. Hata hivyo, moja ya molekuli muhimu zaidi tunayojua, molekuli ya oksijeni O 2, inatoa tatizo kuhusiana na muundo wake wa Lewis. Tutakuwa kuandika zifuatazo Lewis muundo kwa O 2:
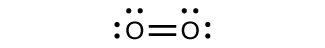
Muundo huu wa elektroniki unafuata sheria zote zinazosimamia nadharia ya Lewis. Kuna dhamana ya O=O mara mbili, na kila atomu ya oksijeni ina elektroni nane karibu nayo. Hata hivyo, picha hii inakabiliwa na tabia ya magnetic ya oksijeni. Kwa yenyewe, O 2 sio magnetic, lakini inavutiwa na mashamba ya magnetic. Kwa hiyo, tunapomwaga oksijeni ya kioevu kupita sumaku yenye nguvu, inakusanya kati ya miti ya sumaku na inakanusha mvuto. Mvuto huo kwenye uwanja wa magnetic huitwa paramagnetism, na hutokea katika molekuli ambazo zina elektroni zisizo na uharibifu. Na hata hivyo, muundo wa Lewis wa O 2 unaonyesha kwamba elektroni zote zimeunganishwa. Je, sisi akaunti kwa tofauti hii?
Uwezekano wa magnetic hupima nguvu inayotokana na dutu katika uwanja wa magnetic. Tunapolinganisha uzito wa sampuli kwa uzito uliopimwa katika uwanja wa magnetic (Kielelezo\(\PageIndex{1}\)), sampuli za paramagnetic ambazo zinavutiwa na sumaku zitaonekana nzito kwa sababu ya nguvu inayotumiwa na shamba la magnetic. Tunaweza kuhesabu idadi ya elektroni zisizoharibika kulingana na ongezeko la uzito.
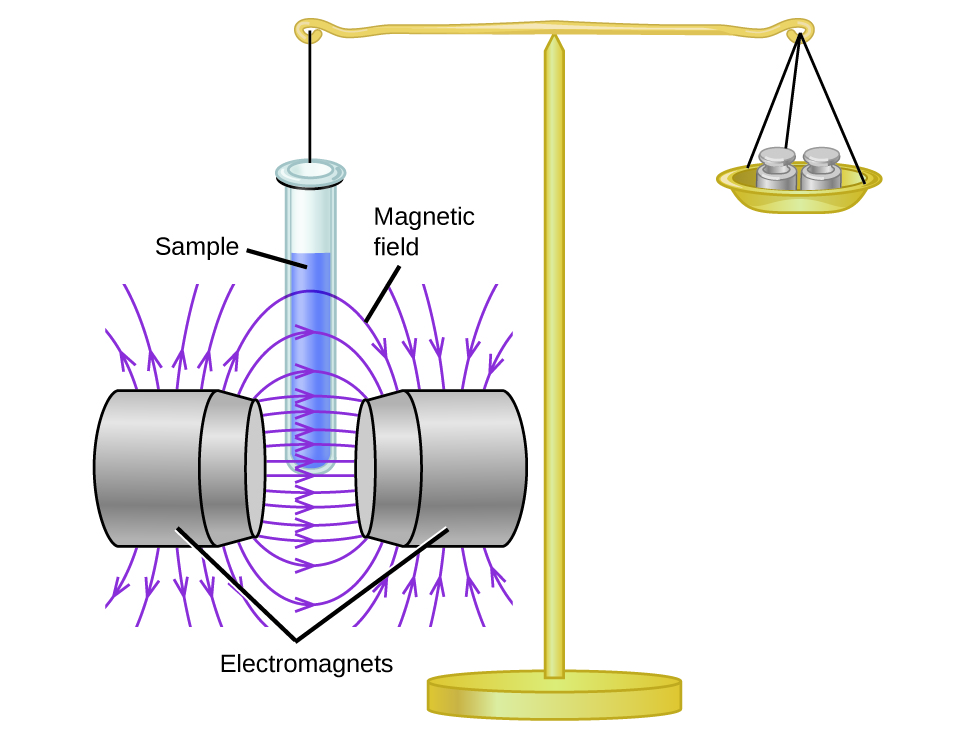
Majaribio yanaonyesha kwamba kila molekuli O 2 ina elektroni mbili zisizo na nguvu. Mfano wa muundo wa Lewis hautabiri uwepo wa elektroni hizi mbili zisizo na nguvu. Tofauti na oksijeni, uzito wa dhahiri wa molekuli nyingi hupungua kidogo mbele ya shamba lisilo la kawaida la magnetic. Vifaa ambavyo elektroni zote zimeunganishwa ni diamagnetic na hupunguza shamba la magnetic. Vifaa vya paramagnetic na diamagnetic hazifanyi kazi kama sumaku za kudumu. Tu mbele ya shamba la magnetic linalotumiwa huonyesha kivutio au kukataa.
Nadharia ya orbital ya molekuli (nadharia ya MO) hutoa maelezo ya kuunganisha kemikali ambayo huhesabu paramagnetism ya molekuli ya oksijeni. Pia inaeleza bonding katika idadi ya molekuli nyingine, kama vile ukiukaji wa utawala octet na molekuli zaidi na bonding ngumu zaidi (zaidi ya upeo wa maandishi haya) ambayo ni vigumu kuelezea na miundo Lewis. Zaidi ya hayo, hutoa mfano wa kuelezea nguvu za elektroni katika molekuli na eneo linalowezekana la elektroni hizi. Tofauti na nadharia ya dhamana ya valence, ambayo inatumia orbitals ya mseto ambayo hupewa atomi moja maalum, nadharia ya MO inatumia mchanganyiko wa orbitals atomiki ili kuzalisha orbitali za molekuli ambazo zimetengwa juu ya molekuli nzima badala ya kuwa zinakaa kwenye atomi zake za majimbo. Nadharia ya MO pia inatusaidia kuelewa kwa nini baadhi ya vitu ni conductors umeme, wengine ni semiconductors, na wengine bado ni insulators. \(\PageIndex{1}\)Jedwali linafupisha pointi kuu za nadharia mbili za ziada za kuunganisha. Nadharia zote mbili hutoa njia tofauti, muhimu za kuelezea muundo wa Masi.
| Valence dhamana nadharia | Masi Orbital nadharia |
|---|---|
| anaona vifungo kama localized kati ya jozi moja ya atomi | inazingatia elektroni zilizowekwa ndani ya molekuli nzima |
| hujenga vifungo kutoka kwa kuingiliana kwa orbitals ya atomiki (s, p, d...) na orbitals ya mseto (sp, sp 2, sp 3...) | inachanganya orbitals atomiki kuunda orbitals Masi (σ, σ*, π, π*) |
| fomu σ au π vifungo | inajenga bonding na antibonding mwingiliano kulingana na ambayo orbitals ni kujazwa |
| anatabiri sura Masi kulingana na idadi ya mikoa ya wiani elektroni | anatabiri utaratibu wa elektroni katika molekuli |
| inahitaji miundo mingi kuelezea resonance |
Nadharia ya orbital ya molekuli inaelezea usambazaji wa elektroni katika molekuli kwa kiasi sawa na kwamba usambazaji wa elektroni katika atomi unaelezewa kwa kutumia orbitali atomia. Kutumia mechanics ya quantum, tabia ya elektroni katika molekuli bado inaelezewa na kazi ya wimbi,, sawa na tabia katika atomi. Kama vile elektroni karibu na atomi pekee, elektroni karibu na atomi katika molekuli ni mdogo kwa nguvu za kipekee (quantized). Eneo la nafasi ambalo elektroni ya valence katika molekuli inawezekana kupatikana inaitwa orbital ya Masi (2). Kama orbital atomiki, orbital ya Masi imejaa wakati ina elektroni mbili zilizo na spin kinyume.
Tutachunguza orbitals Masi katika molekuli linajumuisha atomi mbili zinazofanana (H 2 au Cl 2, kwa mfano). Molekuli hizo huitwa molekuli ya diatomiki ya homonuclear. Katika molekuli hizi za diatomiki, aina kadhaa za orbitals za Masi hutokea.
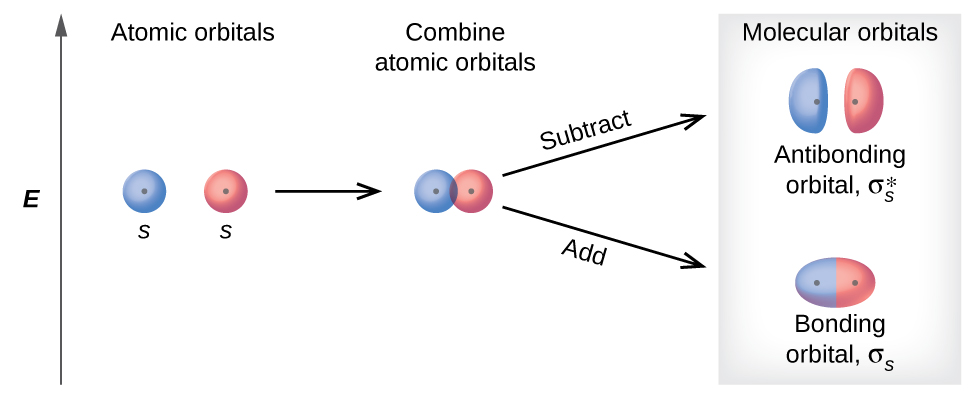
Mchakato wa hisabati wa kuchanganya orbitals atomiki kuzalisha orbitals Masi inaitwa mchanganyiko linear ya orbitals atomiki (LCAO). Kazi ya wimbi inaelezea mali ya wimbi ya elektroni. Orbitals ya molekuli ni mchanganyiko wa kazi za wimbi la orbital la atomiki. Kuchanganya mawimbi kunaweza kusababisha kuingiliwa kwa kujenga, ambapo kilele kinalingana na kilele, au kuingiliwa kwa uharibifu, ambapo kilele kinaendelea na mabwawa (Kielelezo\(\PageIndex{2}\)). Katika orbitals, mawimbi ni mwelekeo wa tatu, na huchanganya na mawimbi ya awamu inayozalisha mikoa yenye uwezekano mkubwa wa wiani wa elektroni na mawimbi ya nje ya awamu ya kuzalisha nodes, au mikoa isiyo na wiani wa elektroni.

Kuna aina mbili za orbitals Masi ambayo inaweza kuunda kutoka mwingiliano wa orbitals mbili atomiki s juu ya atomi karibu. aina mbili ni mfano katika Kielelezo\(\PageIndex{3}\). Mchanganyiko wa awamu hutoa nishati ya chini σ s molekuli orbital (kusoma kama “sigma-s”) ambapo wengi wa wiani wa elektroni ni moja kwa moja kati ya viini. Mbali ya awamu ya nje (ambayo inaweza pia kufikiriwa kama kutoa kazi ya wimbi) hutoa nishati ya juu\(σ^∗_s\) m olecular orbital (kusoma kama “sigma-s-star”) orbital Masi ambayo kuna nodi kati ya viini. Asterisk inaashiria kwamba orbital ni antibonding orbital. Electroni katika orbital σ s huvutiwa na viini vyote kwa wakati mmoja na ni imara zaidi (ya nishati ya chini) kuliko yangekuwa katika atomi zilizotengwa. Kuongeza elektroni kwa orbitals hizi inajenga nguvu kwamba ana viini mbili pamoja, hivyo sisi kuwaita orbitals hizi bonding orbitals. Electroni katika\(σ^∗_s\) orbitals ziko vizuri mbali na kanda kati ya viini viwili. Nguvu ya kuvutia kati ya nuclei na elektroni hizi huvuta viini viwili mbali. Kwa hiyo, orbitals hizi huitwa orbitals antibonding. Electroni kujaza chini ya nishati bonding orbital kabla ya juu-nishati antibonding orbital, kama wao kujaza chini ya nishati orbitals atomiki kabla ya kujaza juu-nishati orbitals atomiki.
Katika p orbitals, kazi ya wimbi inatoa kupanda kwa lobes mbili na awamu kinyume, sawa na jinsi wimbi mbili-dimensional ina sehemu zote mbili juu na chini ya wastani. Tunaonyesha awamu kwa shading lobes orbital rangi tofauti. Wakati lobes orbital ya awamu hiyo inaingiliana, kuingiliwa kwa wimbi la kujenga huongeza wiani wa elektroni. Wakati mikoa ya awamu kinyume inaingiliana, kuingiliwa kwa wimbi la uharibifu hupungua wiani wa elektroni na hujenga nodes. Wakati p orbitals huingilia mwisho hadi mwisho, huunda σ na σ* orbitals (Kielelezo\(\PageIndex{4}\)). Ikiwa atomi mbili ziko kando ya mhimili x katika mfumo wa kuratibu wa Cartesian, mbili p x orbitals huingiliana mwisho hadi mwisho na kuunda σ px (bonding) na\(σ^∗_{px}\) (antibonding) (soma kama “sigma-p-x” na “nyota sigma-p-x,” kwa mtiririko huo). Kama ilivyo na kuingiliana kwa s -orbital, asterisk inaonyesha orbital na node kati ya nuclei, ambayo ni ya juu-nishati, antibonding orbital.
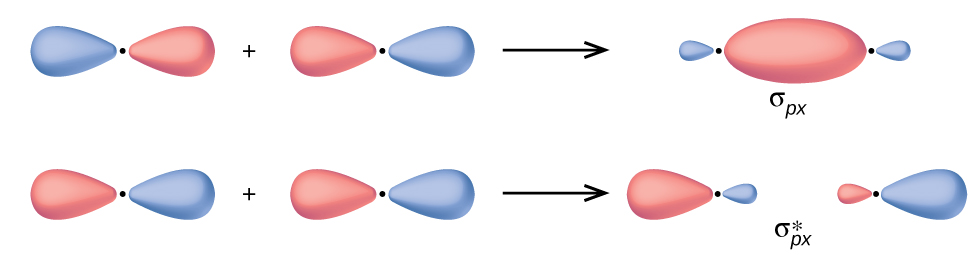
The side-by-side overlap of two p orbitals gives rise to a pi (\(π\)) bonding molecular orbital and a \(π^*\) antibonding molecular orbital, as shown in Figure \(\PageIndex{5}\). In valence bond theory, we describe π bonds as containing a nodal plane containing the internuclear axis and perpendicular to the lobes of the p orbitals, with electron density on either side of the node. In molecular orbital theory, we describe the π orbital by this same shape, and a π bond exists when this orbital contains electrons. Electrons in this orbital interact with both nuclei and help hold the two atoms together, making it a bonding orbital. For the out-of-phase combination, there are two nodal planes created, one along the internuclear axis and a perpendicular one between the nuclei.
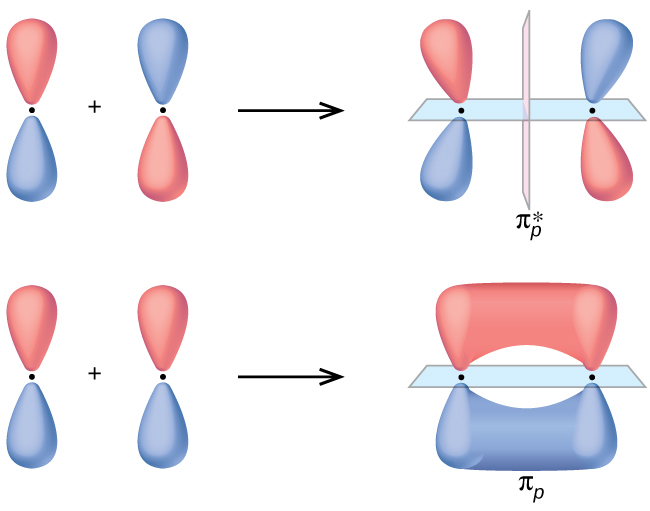
In the molecular orbitals of diatomic molecules, each atom also has two sets of p orbitals oriented side by side (py and pz), so these four atomic orbitals combine pairwise to create two π orbitals and two \(π^*\) orbitals. The \(π_{py}\) and \(π^∗_{py}\) orbitals are oriented at right angles to the \(π_{pz}\) and \(π^∗_{pz}\) orbitals. Except for their orientation, the πpy and πpz orbitals are identical and have the same energy; they are degenerate orbitals. The \(π^∗_{py}\) and \(π^∗_{pz}\) antibonding orbitals are also degenerate and identical except for their orientation. A total of six molecular orbitals results from the combination of the six atomic p orbitals in two atoms: \(σ_{px}\) and \(σ^∗_{px}\), \(π_{py}\) and \(π^∗_{py}\), \(π_{pz}\) and \(π^∗_{pz}\).
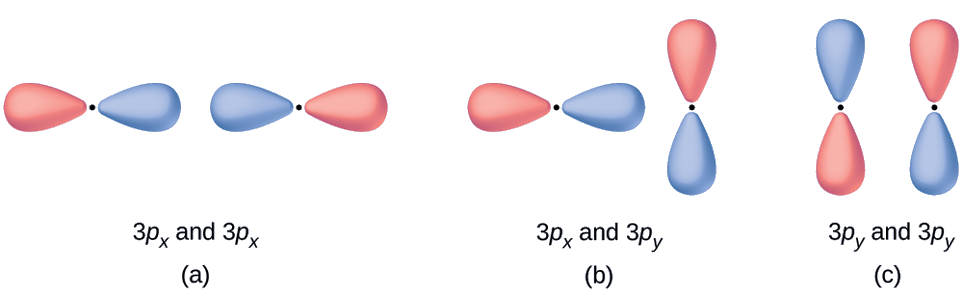
Predict what type (if any) of molecular orbital would result from adding the wave functions so each pair of orbitals shown overlap. The orbitals are all similar in energy.
Suluhisho
- Hii ni mchanganyiko wa awamu, na kusababisha σ 3 p orbital
- Hii haiwezi kusababisha orbital mpya kwa sababu sehemu ya awamu (chini) na sehemu ya nje ya awamu (juu) kufuta. Orbitals tu na alignment sahihi inaweza kuchanganya.
- Hii ni mchanganyiko wa nje ya awamu, na kusababisha\(π^∗_{3p}\) orbital.
Lebo orbital Masi inavyoonekana kama\(σ\) au\(π\), bonding au antibonding na kuonyesha ambapo nodi hutokea.

- Jibu
-
Orbital iko kando ya mhimili wa internuclear, hivyo ni\(σ\) orbital. Kuna node bisecting mhimili internuclear, hivyo ni antibonding orbital.
Orbitals mbili zinaonyeshwa uongo mwisho hadi mwisho. Kila mmoja ana upande mmoja ulioenea na mmoja mdogo. Pande ndogo zinakabiliwa na kila mmoja na zinatenganishwa na mstari wa wima.
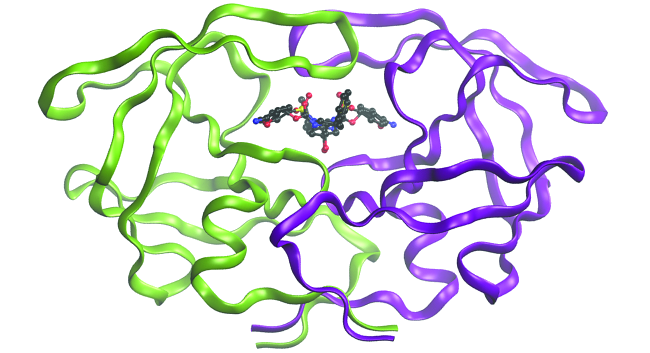
Wakati maelezo ya bonding ilivyoelezwa katika sura hii yanahusisha dhana nyingi za kinadharia, pia wana maombi mengi ya vitendo, halisi ya ulimwengu. Kwa mfano, kubuni madawa ya kulevya ni uwanja muhimu ambao hutumia uelewa wetu wa kemikali bonding kuendeleza madawa. Eneo hili la masomo mbalimbali hutumia biolojia (kuelewa magonjwa na jinsi wanavyofanya kazi) kutambua malengo maalum, kama vile tovuti ya kisheria inayohusika katika njia ya ugonjwa. Kwa kuimarisha miundo ya tovuti ya kumfunga na madawa ya kulevya, wanakemia wa kompyuta wanaweza kutabiri ni miundo gani inayoweza kuunganisha pamoja na jinsi watakavyofunga (Kielelezo\(\PageIndex{6}\)). Maelfu ya wagombea uwezo inaweza kupunguzwa chini ya wachache wa wagombea wengi kuahidi. Hizi molekuli mgombea ni kisha makini majaribio ya kuamua madhara, jinsi ufanisi wanaweza kusafirishwa kwa njia ya mwili, na mambo mengine. Kadhaa ya madawa mapya muhimu yamegunduliwa kwa msaada wa kemia ya computational, na miradi mpya ya utafiti inaendelea.
Masi Orbital Nishati michoro
Viwango vya nishati ya jamaa ya orbitals atomiki na Masi ni kawaida inavyoonekana katika Masi orbital mchoro (Kielelezo\(\PageIndex{7}\)). Kwa molekuli ya diatomiki, orbitals ya atomiki ya atomi moja huonyeshwa upande wa kushoto, na wale wa atomi nyingine huonyeshwa upande wa kulia. Kila mstari wa usawa unawakilisha orbital moja ambayo inaweza kushikilia elektroni mbili. Orbitals ya Masi iliyoundwa na mchanganyiko wa orbitals ya atomiki huonyeshwa katikati. Mistari iliyopigwa inaonyesha ni ipi ya orbitals ya atomiki inayochanganya ili kuunda orbitals ya Masi. Kwa kila jozi ya orbitals atomiki kwamba kuchanganya, moja ya chini ya nishati (bonding) Masi orbital na moja juu-nishati (antibonding) orbital matokeo. Hivyo tunaweza kuona kwamba kuchanganya sita 2 p atomiki orbitals matokeo katika orbitals tatu bonding (moja σ na mbili π) na tatu antibonding orbitals (moja* σ* na mbili π*).
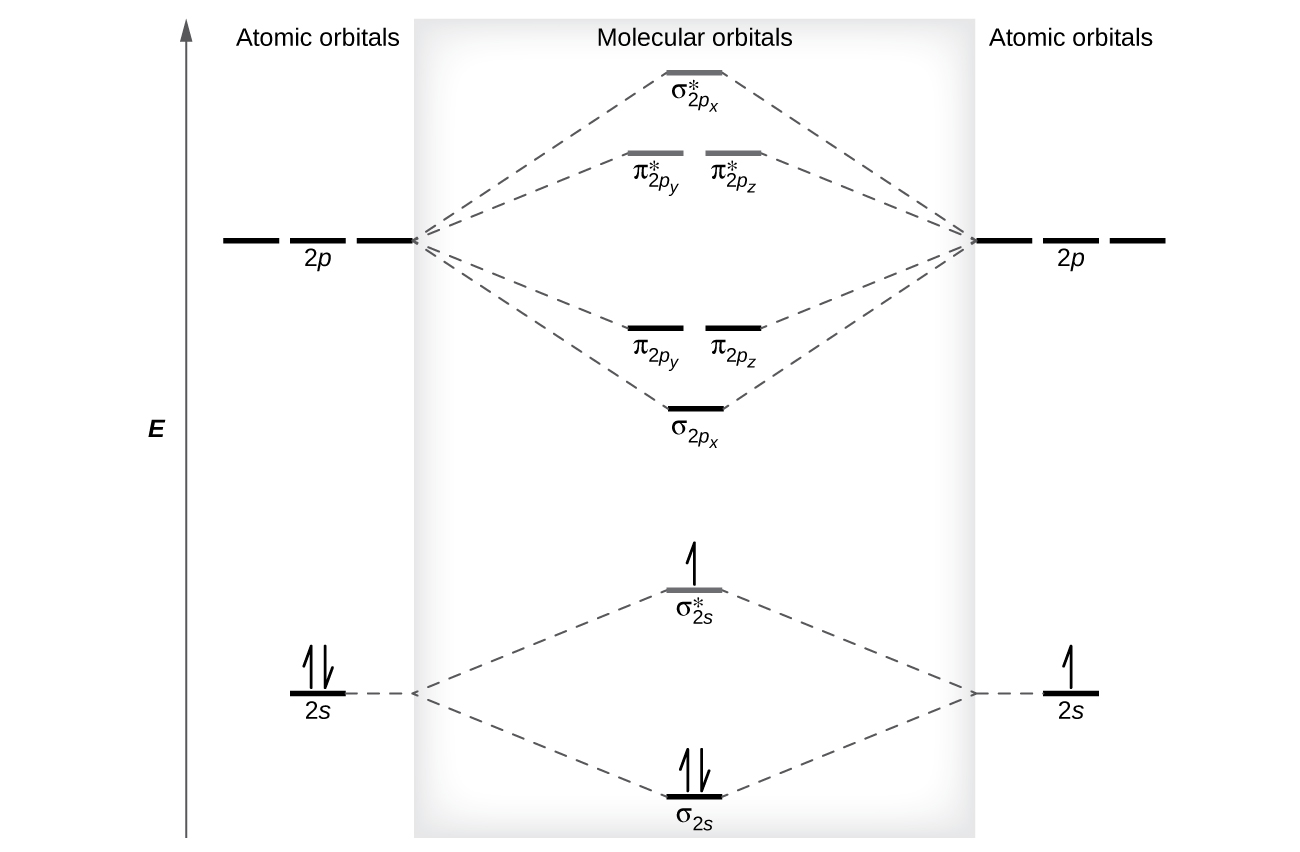
Tunatabiri usambazaji wa elektroni katika orbitals hizi za Masi kwa kujaza orbitals kwa njia ile ile tunayojaza orbitals atomiki, kwa kanuni ya Aufbau. Orbitals ya chini ya nishati kujaza kwanza, elektroni kuenea kati ya orbitals degenerate kabla pairing, na kila orbital inaweza kushikilia upeo wa elektroni mbili na spins kinyume (Kielelezo\(\PageIndex{7}\)). Kama vile sisi kuandika usanidi elektroni kwa atomi, tunaweza kuandika Configuration Masi elektroniki kwa orodha orbitals na superscripts kuonyesha idadi ya elektroni sasa. Kwa usahihi, tunaweka mabano karibu na orbitals za Masi na nishati sawa. Katika kesi hii, kila orbital ina nishati tofauti, hivyo mabano hutenganisha kila orbital. Hivyo tungependa kutarajia molekuli diatomiki au ion zenye elektroni saba (kama vile\(\ce{Be2+}\)) ingekuwa na usanidi wa elektroni Masi\((σ_{1s})^2(σ^∗_{1s})^2(σ_{2s})^2(σ^∗_{2s})^1\). Ni kawaida kuacha elektroni za msingi kutoka michoro za orbital za molekuli na usanidi na ni pamoja na elektroni za valence tu.
Amri ya dhamana
Mchoro uliojaa molekuli orbital unaonyesha idadi ya elektroni katika obiti zote mbili za kuunganisha na antibonding za Masi. Mchango halisi wa elektroni kwa nguvu ya dhamana ya molekuli hutambuliwa kwa kuamua utaratibu wa dhamana unaotokana na kujazwa kwa orbitals za Masi na elektroni.
Tunapotumia miundo ya Lewis kuelezea usambazaji wa elektroni katika molekuli, tunafafanua utaratibu wa dhamana kama idadi ya jozi za kuunganisha elektroni kati ya atomi mbili. Hivyo dhamana moja ina utaratibu wa dhamana ya 1, dhamana mara mbili ina utaratibu wa dhamana ya 2, na dhamana ya mara tatu ina utaratibu wa dhamana ya 3. Sisi kufafanua dhamana ili tofauti wakati sisi kutumia Masi orbital maelezo ya usambazaji wa elektroni, lakini kusababisha dhamana ili ni kawaida sawa. Mbinu ya MO ni sahihi zaidi na inaweza kushughulikia kesi wakati mbinu ya muundo wa Lewis inashindwa, lakini njia zote mbili zinaelezea jambo lile lile.
Katika mfano wa orbital ya Masi, elektroni inachangia mwingiliano wa kuunganisha ikiwa inachukua obital ya kuunganisha na inachangia mwingiliano wa antibonding ikiwa inachukua orbital ya antibonding. Amri ya dhamana imehesabiwa kwa kuondoa elektroni za kuharibika (antibonding) kutoka kwa elektroni za kuimarisha (kuunganisha). Kwa kuwa dhamana ina elektroni mbili, tunagawanya na mbili ili kupata utaratibu wa dhamana. Tunaweza kuamua utaratibu wa dhamana na equation zifuatazo:
\[\textrm{bond order}=\dfrac{(\textrm{number of bonding electrons})−(\textrm{number of antibonding electrons})}{2} \nonumber \]
Utaratibu wa dhamana ya covalent ni mwongozo wa nguvu zake; dhamana kati ya atomi mbili zilizopewa inakuwa imara kadiri utaratibu wa dhamana unavyoongezeka. Kama usambazaji wa elektroni katika orbitals Masi kati ya atomi mbili ni kama kwamba dhamana kusababisha itakuwa na dhamana ili ya sifuri, dhamana imara haina fomu. Sisi ijayo kuangalia baadhi ya mifano maalum ya MO michoro na amri dhamana.
Kuunganisha katika Molekuli za Diatomic
Molekuli ya dihidrojeni (H 2) hutokana na atomi mbili za hidrojeni. Wakati orbitals atomiki ya atomi mbili kuchanganya, elektroni huchukua orbital Masi ya nishati ya chini kabisa, σ 1 s bonding orbital. Molekuli ya dihidrojeni, H 2, inaunda kwa urahisi kwa sababu nishati ya molekuli ya H 2 ni ya chini kuliko ile ya atomi mbili H. Orbital σ 1 s ambayo ina elektroni zote mbili ni ya chini katika nishati kuliko mojawapo ya orbitals atomiki 1 s.
Orbital Masi inaweza kushikilia elektroni mbili, hivyo elektroni zote mbili katika H 2 molekuli ni katika σ 1 s bonding orbital; Configuration elektroni ni\((σ_{1s})^2\). Tunawakilisha usanidi huu kwa mchoro wa nishati ya orbital ya Masi (Kielelezo\(\PageIndex{8}\)) ambapo mshale mmoja wa juu unaonyesha elektroni moja katika orbital, na mishale miwili (juu na chini) inaonyesha elektroni mbili za spin kinyume.
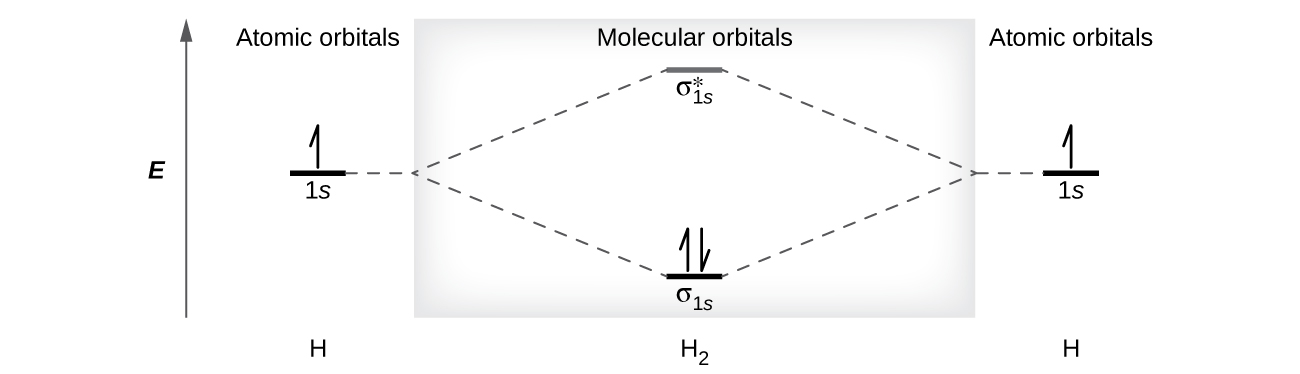
Molekuli ya dihydrogen ina elektroni mbili za kuunganisha na hakuna elektroni za antibonding hivyo tuna
\[\ce{bond\: order\: in\: H2}=\dfrac{(2−0)}{2}=1 \nonumber \]
Kwa sababu utaratibu wa dhamana kwa dhamana ya H—H ni sawa na 1, dhamana ni dhamana moja.
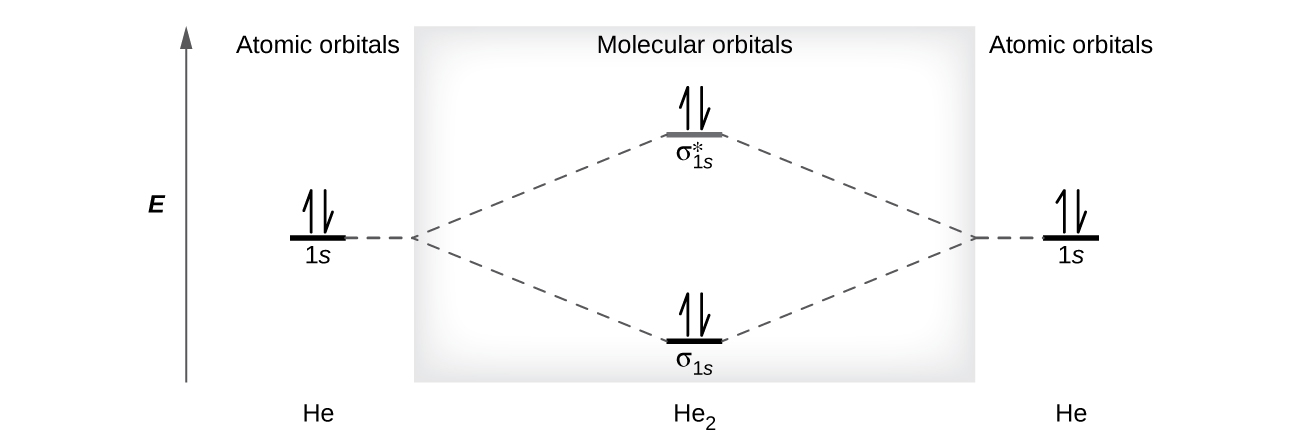
Atomu ya heliamu ina elektroni mbili, zote mbili ziko katika orbital yake ya 1 s. Mbili atomi heliamu wala kuchanganya na kuunda molekuli dihelium, yeye 2, na elektroni nne, kwa sababu athari kuleta utulivu wa elektroni mbili katika chini ya nishati bonding orbital itakuwa kukabiliana na athari destabilizing ya elektroni mbili katika juu-nishati antibonding Masi orbital. Tutakuwa kuandika nadharia elektroni Configuration ya Yeye 2\((σ_{1s})^2(σ^∗_{1s})^2\) kama katika Kielelezo\(\PageIndex{9}\). Mabadiliko ya nishati ya wavu yatakuwa sifuri, kwa hiyo hakuna nguvu ya kuendesha gari kwa atomi za heliamu kuunda molekuli ya diatomiki. Kwa kweli heliamu ipo kama atomi za kipekee badala ya kama molekuli diatomiki. Mpangilio wa dhamana katika molekuli ya dhana ya diheliamu itakuwa sifuri.
\[\ce{bond\: order\: in\: He2}=\dfrac{(2−2)}{2}=0 \nonumber \]
Amri ya dhamana ya sifuri inaonyesha kuwa hakuna dhamana inayoundwa kati ya atomi mbili.
Molekuli ya Diatomic ya Kipindi cha Pili
Nane inawezekana homonuclear diatomic molekuli inaweza kuwa sumu na atomi ya kipindi cha pili cha meza ya mara kwa mara: Li 2, Kuwa 2, B 2, C 2, N 2, O 2, F 2, na Ne 2. Hata hivyo, tunaweza kutabiri kuwa molekuli ya Be 2 na molekuli ya Ne 2 haiwezi kuwa imara. Tunaweza kuona hili kwa kuzingatia usanidi wa elektroni Masi (Jedwali\(\PageIndex{1}\)).
| Molekuli | Usanidi wa Electron | Amri ya dhamana |
|---|---|---|
| Li 2 | \((σ_{2s})^2\) | 1 |
| Kuwa 2 (imara) | \((σ_{2s})^2(σ^∗_{2s})^2\) | 0 |
| B 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^2\) | 1 |
| C 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4\) | 2 |
| N 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4(σ_{2px})^2\) | 3 |
| O 2 | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},π^∗_{2pz})^2\) | 2 |
| F 2 | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},\:π^∗_{2pz})^4\) | 1 |
| Ne 2 (imara) | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},π^∗_{2pz})^4(σ^∗_{2px})^2\) | 0 |
Sisi kutabiri Valence Masi orbital elektroni usanidi kama sisi kutabiri usanidi elektroni ya atomi. Electroni za valence zinatolewa kwa orbitals za Masi ya valence na nguvu za chini kabisa. Sambamba na utawala wa Hund, wakati wowote kuna orbitals mbili au zaidi degenerate Masi, elektroni kujaza kila orbital ya aina hiyo single kabla pairing yoyote ya elektroni hufanyika.
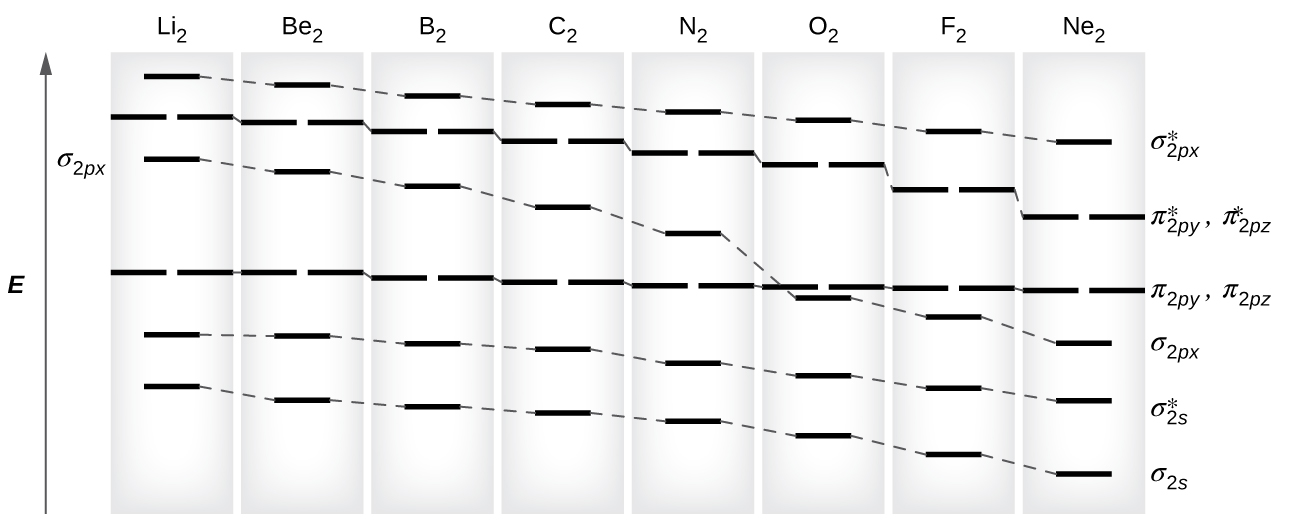
Kama tulivyoona katika nadharia ya dhamana ya valence, vifungo σ kwa ujumla ni imara zaidi kuliko vifungo vya π vinavyotengenezwa kutoka kwa orbitali za atomiki zinazoharibika. Vilevile, katika nadharia ya orbital ya molekuli, σ orbitali huwa imara zaidi kuliko π orbitals. Hata hivyo, hii sio wakati wote. MOs kwa orbitals valence ya kipindi cha pili ni inavyoonekana katika Kielelezo\(\PageIndex{10}\). Kuangalia Ne 2 orbitals Masi, tunaona kwamba ili ni sambamba na mchoro generic inavyoonekana katika sehemu ya awali. Hata hivyo, kwa atomi zilizo na elektroni tatu au chache katika orbitals p (Li kupitia N) tunaona muundo tofauti, ambapo orbital σ p ni ya juu katika nishati kuliko kuweka π p. Pata mchoro wa orbital wa Masi kwa ioni ya diatomiki ya homonuclear kwa kuongeza au kuondoa elektroni kutoka kwenye mchoro kwa molekuli ya neutral.
Kubadili hii katika kuagiza orbital hutokea kwa sababu ya jambo linaloitwa s-p kuchanganya. s-p kuchanganya haina kujenga orbitals mpya; inaathiri tu nguvu za orbitals zilizopo Masi. Kazi ya mawimbi ya σ s inachanganya kwa hesabu ya σ p wavefunction, na matokeo kwamba orbital σ s inakuwa imara zaidi, na orbital σ p inakuwa imara (Kielelezo\(\PageIndex{11}\)). Vile vile, orbitals antibonding pia hupata s-p kuchanganya, na σ s * kuwa imara zaidi na σ p * kuwa imara.
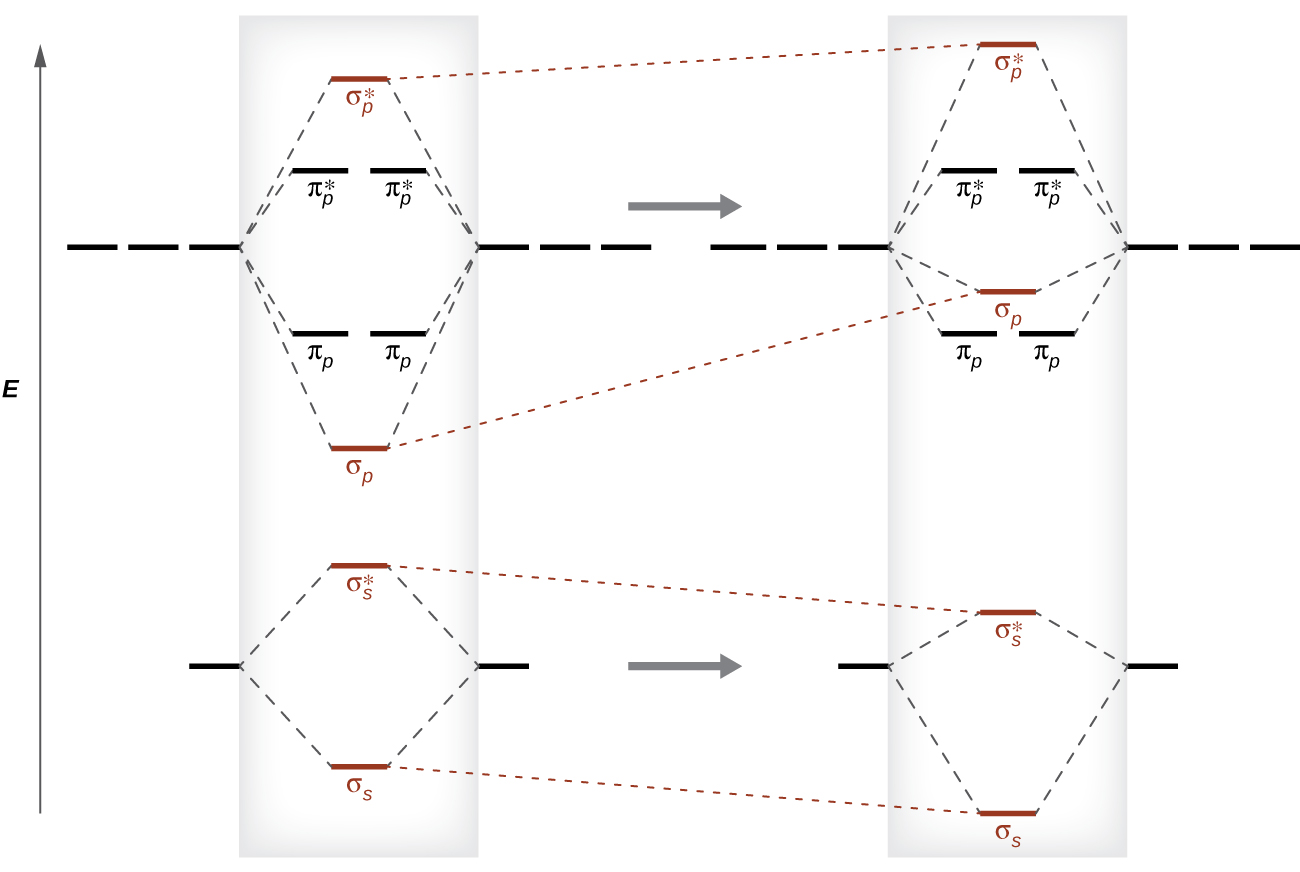
s-p kuchanganya hutokea wakati s na p orbitals wana nguvu sawa. Tofauti ya nishati kati ya 2 s na 2 p orbitals katika O, F, na Ne ni kubwa zaidi kuliko ile katika Li, Kuwa, B, C, na N. Kwa sababu hii, O 2, F 2, na Ne kuonyesha kidogo s-p kuchanganya (haitoshi kubadili kuagiza nishati), na michoro zao za MO zinafuata muundo wa kawaida, kama inavyoonekana katika Kielelezo\(\PageIndex{7}\). Molekuli zote za kipindi kingine 2 za diatomiki zina s-p kuchanganya, ambayo inaongoza kwa muundo ambapo orbital σ p inafufuliwa juu ya seti π p.
Kwa kutumia michoro MO inavyoonekana katika Kielelezo\(\PageIndex{11}\), tunaweza kuongeza katika elektroni na kuamua Configuration Masi elektroni na dhamana ili kwa kila moja ya molekuli diatomic. Kama inavyoonekana katika Jedwali\(\PageIndex{1}\), Kuwa 2 na Ne 2 molekuli ingekuwa ili dhamana ya 0, na molekuli hizi hazipo.
Mchanganyiko wa atomi mbili za lithiamu kuunda molekuli ya lithiamu, Li 2, ni sawa na malezi ya H 2, lakini orbitals ya atomiki inayohusika ni orbitals valence 2 s. Kila moja ya atomi mbili za lithiamu ina elektroni moja ya valence. Hivyo, tuna mbili valence elektroni inapatikana kwa σ 2 s bonding Masi orbital. Kwa sababu wote valence elektroni itakuwa katika bonding orbital, tutakuwa kutabiri Li 2 molekuli kuwa imara. Molekuli ni, kwa kweli, iko katika mkusanyiko unaofaa katika mvuke ya lithiamu kwenye joto karibu na kiwango cha kuchemsha cha kipengele. Yote ya molekuli nyingine katika Jedwali\(\PageIndex{1}\) na utaratibu dhamana kubwa kuliko sifuri pia inajulikana.
Molekuli O 2 ina elektroni za kutosha kwa nusu kujaza\((π^∗_{2py},\:π^∗_{2pz})\) kiwango. Tunatarajia elektroni mbili kwamba kuchukua hizi mbili orbitals degenerate kuwa unpaired, na hii Configuration Masi elektroniki kwa O 2 ni kwa mujibu wa ukweli kwamba molekuli oksijeni ina elektroni mbili unpaired (Kielelezo\(\PageIndex{10}\)). Uwepo wa elektroni mbili zisizoharibika umeonekana kuwa vigumu kueleza kwa kutumia miundo ya Lewis, lakini nadharia ya orbital ya Masi inaelezea vizuri kabisa. Kwa kweli, elektroni zisizo na uharibifu wa molekuli ya oksijeni hutoa kipande kikubwa cha msaada kwa nadharia ya orbital ya Masi.
Wakati mbili orbitals atomiki kufanana juu ya atomi tofauti kuchanganya, mbili orbitals Masi matokeo (kwa mfano,\(H_2\) katika Kielelezo\(\PageIndex{8}\)). Orbital bonding ni ya chini katika nishati kuliko orbitals awali atomiki kwa sababu orbitals atomiki ni katika awamu katika orbital Masi. Orbital ya antibonding ni ya juu katika nishati kuliko orbitals ya awali ya atomiki kwa sababu orbitals atomiki ni nje ya awamu.
Katika imara, mambo kama hayo yanatokea, lakini kwa kiwango kikubwa zaidi. Kumbuka kwamba hata katika sampuli ndogo kuna idadi kubwa ya atomi (kawaida> 10 23 atomi), na kwa hiyo idadi kubwa ya orbitals atomiki ambayo inaweza kuwa pamoja katika orbitals Masi. Wakati N valence atomiki orbitals, wote wa nishati sawa na kila zenye moja (1) elektroni, ni pamoja, N /2 (kujazwa) obitals bonding na N /2 (tupu) antibonding orbitals matokeo. Kila orbital bonding itaonyesha nishati kupungua kama orbitals atomiki ni zaidi katika awamu, lakini kila moja ya orbitals bonding itakuwa tofauti kidogo na kuwa na nguvu tofauti kidogo. Orbitals antibonding itaonyesha ongezeko la nishati kama orbitals atomiki ni zaidi ya nje ya awamu, lakini kila moja ya orbitals antibonding pia kuwa tofauti kidogo na kuwa na nguvu tofauti kidogo. Viwango vya nishati vinavyoruhusiwa kwa orbitals zote za kuunganisha ni karibu sana kwamba huunda bendi, inayoitwa bendi ya valence. Vivyo hivyo, orbitals wote antibonding ni karibu sana pamoja na kuunda bendi, aitwaye bendi upitishaji. Kielelezo\(\PageIndex{12}\)) inaonyesha bendi kwa madarasa matatu muhimu ya vifaa: washughulikiaji, semiconductors, na conductors.
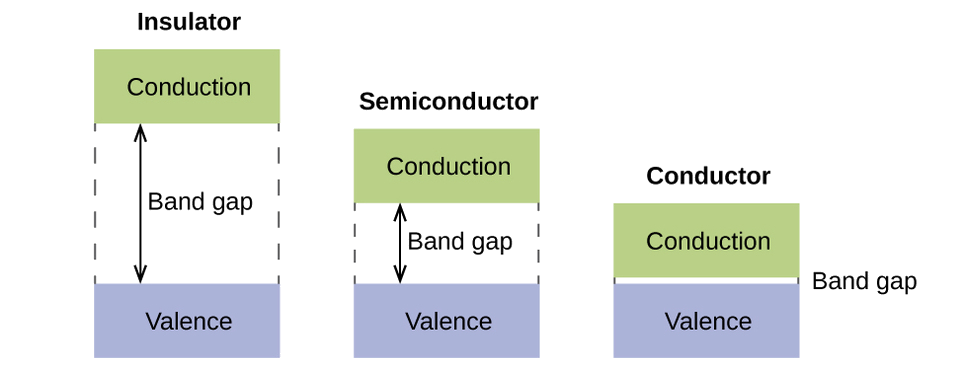
Ili kuendesha umeme, elektroni lazima ziondoke kwenye bendi ya valence iliyojaa kujazwa hadi kwenye bendi ya upitishaji tupu ambapo wanaweza kuhamia katika imara. Ukubwa wa pengo la bendi, au tofauti ya nishati kati ya juu ya bendi ya valence na chini ya bendi ya upitishaji, huamua jinsi ilivyo rahisi kusonga elektroni kati ya bendi. Kiasi kidogo tu cha nishati kinahitajika katika kondakta kwa sababu pengo la bendi ni ndogo sana. Tofauti hii ndogo ya nishati ni “rahisi” kushinda, hivyo ni watendaji mzuri wa umeme. Katika kizio, pengo la bendi ni “kubwa” kiasi kwamba elektroni chache sana huingia kwenye bendi ya upitishaji; matokeo yake, vihami ni makondakta maskini wa umeme. Semiconductors hufanya umeme wakati kiasi cha “wastani” cha nishati hutolewa kuhamisha elektroni nje ya bendi ya valence na kwenye bendi ya uendeshaji. Semiconductors, kama vile silicon, hupatikana katika umeme wengi.
Semiconductors hutumiwa katika vifaa kama vile kompyuta, simu za mkononi, na seli za jua. Seli za jua huzalisha umeme wakati mwanga unatoa nishati ya kuhamisha elektroni nje ya bendi ya valence. Umeme unaozalishwa unaweza kisha kutumika kwa nguvu mwanga au chombo, au inaweza kuhifadhiwa kwa matumizi ya baadaye kwa malipo ya betri. Kufikia Desemba 2014, hadi asilimia 46 ya nishati ya jua inaweza kubadilishwa kuwa umeme kwa kutumia seli za jua.
Chora mchoro wa orbital ya Masi kwa molekuli ya oksijeni, O 2. Kutoka kwenye mchoro huu, uhesabu utaratibu wa dhamana kwa O 2. Je! Mchoro huu unashughulikaje kwa paramagnetism ya O 2?
Suluhisho
Sisi kuteka Masi orbital nishati mchoro sawa na ile inavyoonekana katika Kielelezo\(\PageIndex{7}\). Kila atomu ya oksijeni inachangia elektroni sita, hivyo mchoro unaonekana kama inavyoonekana kwenye Kielelezo\(\PageIndex{7}\).
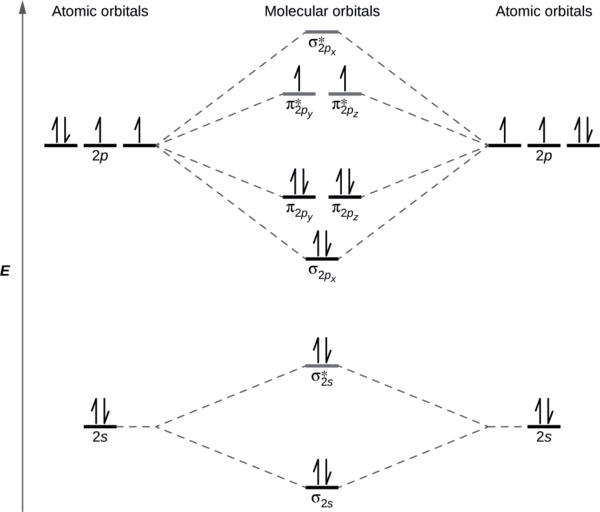
Sisi mahesabu ili dhamana kama
\[\ce{O2}=\dfrac{(8−4)}{2}=2 \nonumber \]
Paramagnetism ya oksijeni inaelezewa na kuwepo kwa elektroni mbili zisizoharibika katika (π 2 py, π 2 pz) * orbitali za molekuli.
Sehemu kuu ya hewa ni N 2. Kutoka mchoro wa orbital ya Masi ya N 2, kutabiri utaratibu wake wa dhamana na ikiwa ni diamagnetic au paramagnetic.
- Jibu
-
N 2 ina utaratibu wa dhamana ya 3 na ni diamagnetic.
Kutoa Configuration Masi orbital kwa elektroni valence katika\(\ce{C2^2-}\). Je! Ion hii itakuwa imara?
Suluhisho
Kuangalia mchoro sahihi wa MO, tunaona kwamba orbitals π ni chini katika nishati kuliko orbital σ p. Configuration ya elektroni ya valence kwa C 2 ni
\((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4\).
Kuongeza elektroni mbili zaidi kuzalisha\(\ce{C2^2-}\) anion kutoa valence elektroni Configuration ya
\((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4(σ_{2px})^2\)
Kwa kuwa hii ina elektroni sita zaidi ya kuunganisha kuliko antibonding, utaratibu wa dhamana utakuwa 3, na ion inapaswa kuwa imara.
Ni elektroni ngapi zisizo na nguvu zitakuwapo kwenye\(\ce{Be2^2-}\) ion? Je, itakuwa paramagnetic au diamagnetic?
- Jibu
-
mbili, paramagnetic
Dhana muhimu na Muhtasari
Nadharia ya molekuli orbital (MO) inaelezea tabia ya elektroni katika molekuli kwa suala la mchanganyiko wa kazi za wimbi la atomiki. Orbitals Masi kusababisha inaweza kupanua juu ya atomi zote katika molekuli. Kuunganisha orbitals Masi hutengenezwa na mchanganyiko wa awamu ya kazi za wimbi la atomiki, na elektroni katika orbitals hizi huimarisha molekuli. Antibonding orbitals Masi kutokana na mchanganyiko nje ya awamu ya kazi atomiki wimbi na elektroni katika orbitals hizi kufanya molekuli chini imara. Orbitals ya molekuli iko kando ya mhimili wa internuclear huitwa σ MOs. Wanaweza kuundwa kutoka kwa orbitals s au kutoka orbitals p oriented katika mtindo wa mwisho hadi mwisho. Orbitali za molekuli zilizotengenezwa kutoka kwa p orbitali zinazoelekezwa kwa mtindo wa upande kwa upande zina wiani wa elektroni kwenye pande tofauti za mhimili wa internuclear na huitwa π orbitals.
Tunaweza kuelezea muundo wa elektroniki wa molekuli za diatomiki kwa kutumia nadharia ya orbital ya Masi kwa elektroni za valence za atomi. Electroni hujaza orbitali za molekuli zifuatazo sheria zile zinazotumika kwa kujaza orbitali atomiki; utawala wa Hund na kanuni ya Aufbau inatuambia kwamba orbitali za chini za nishati zitajaza kwanza, elektroni zitaenea kabla ya kuunganishwa, na kila orbital inaweza kushikilia upeo wa elektroni mbili na spins kinyume. Vifaa na elektroni zisizo na uharibifu ni paramagnetic na huvutiwa na shamba la magnetic, wakati wale walio na elektroni zote zilizounganishwa ni diamagnetic na huchanganyikiwa na shamba la magnetic. Usahihi utabiri mali magnetic ya molekuli ni katika faida ya molekuli orbital nadharia juu ya miundo Lewis na valence dhamana nadharia.


