8.2: Orbitals ya Atomiki ya Mseto
- Page ID
- 175926
- Eleza dhana ya hybridization ya atomiki orbital
- Kuamua orbitals mseto kuhusishwa na jiometri mbalimbali Masi
Kufikiri katika suala la kuingiliana orbitals atomiki ni njia moja kwa sisi kueleza jinsi vifungo kemikali fomu katika molekuli diatomic. Hata hivyo, kuelewa jinsi molekuli zilizo na atomi zaidi ya mbili zinaunda vifungo imara, tunahitaji mfano wa kina zaidi. Kwa mfano, hebu tuchunguze molekuli ya maji, ambayo tuna atomi moja ya oksijeni inayounganishwa na atomi mbili za hidrojeni. Oksijeni ina usanidi wa elektroni 1 s 2 s 2 s 2 p 4, na elektroni mbili zisizo na nguvu (moja katika kila moja ya mbili 2 p orbitals). Valence dhamana nadharia bila kutabiri kwamba mbili O-H vifungo fomu kutoka mwingiliano wa hizi mbili orbitals 2 p na orbitals 1 s ya atomi hidrojeni. Kama hii ilikuwa kesi, dhamana angle itakuwa 90°, kama inavyoonekana katika Kielelezo\(\PageIndex{1}\), kwa sababu p orbitals ni perpendicular kwa kila mmoja. Ushahidi wa majaribio unaonyesha kwamba pembe ya dhamana ni 104.5°, si 90°. Utabiri wa mfano wa nadharia ya dhamana ya valence haufanani na uchunguzi halisi wa ulimwengu wa molekuli ya maji; mfano tofauti unahitajika.
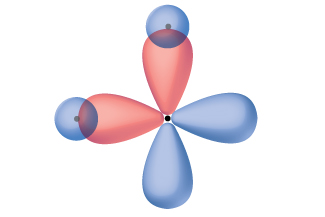
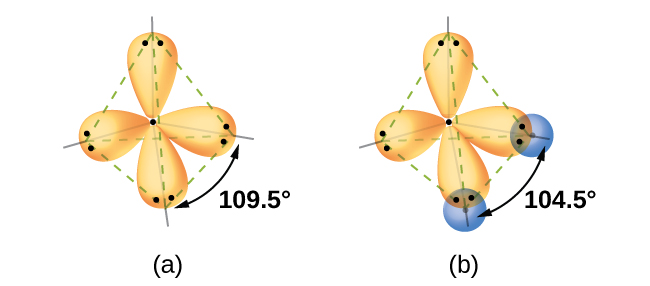
Hesabu za mitambo zinaonyesha kwa nini pembe za dhamana zilizozingatiwa katika H 2 O zinatofautiana na zile zilizotabiriwa na kuingiliana kwa orbital ya 1 ya atomi za hidrojeni na orbitals 2 p ya atomi ya oksijeni. Maneno ya hisabati inayojulikana kama kazi ya wimbi,, ina taarifa kuhusu kila orbital na tabia ya wimbi ya elektroni katika atomu pekee. Wakati atomi zinafungwa pamoja katika molekuli, kazi za wimbi huchanganya ili kuzalisha maelezo mapya ya hisabati ambayo yana maumbo tofauti. Utaratibu huu wa kuchanganya kazi wimbi kwa orbitals atomiki inaitwa hybridization na ni hesabu kukamilika kwa mchanganyiko linear ya orbitals atomiki, LCAO, (mbinu kwamba sisi kukutana tena baadaye). Orbitals mpya ambayo matokeo huitwa orbitals mseto. Orbitals valence katika atomi pekee oksijeni ni 2 s orbital na tatu 2 p orbitals. Njia za valence katika atomi ya oksijeni katika molekuli ya maji hutofautiana; zinajumuisha orbitals nne sawa za mseto ambazo zinaonyesha takriban kuelekea pembe za tetrahedron (Kielelezo\(\PageIndex{2}\)). Kwa hiyo, kuingiliana kwa mizunguko ya O na H inapaswa kusababisha angle ya dhamana ya tetrahedral (109.5°). Angle iliyozingatiwa ya 104.5° ni ushahidi wa majaribio ambayo hesabu za quantum-mitambo hutoa maelezo muhimu: Nadharia ya dhamana ya Valence lazima ijumuishe sehemu ya kuchanganyikiwa ili kutoa utabiri sahihi.
Mawazo yafuatayo ni muhimu katika kuelewa mahuluti:
- Orbitals ya mseto haipo katika atomi pekee. Wao huundwa tu katika atomi zilizounganishwa kwa covalently.
- Orbitali za mseto zina maumbo na mwelekeo ambao ni tofauti sana na yale ya orbitali atomia katika atomi za pekee.
- Seti ya orbitals ya mseto huzalishwa kwa kuchanganya orbitals ya atomiki. Idadi ya orbitals ya mseto katika seti ni sawa na idadi ya orbitals ya atomiki iliyounganishwa ili kuzalisha seti.
- Orbitals zote katika seti ya orbitals mseto ni sawa katika sura na nishati.
- Aina ya orbitali ya mseto inayotengenezwa katika atomu iliyofungwa inategemea jiometri yake ya jozi ya elektroni kama ilivyotabiriwa na nadharia ya VSEPR.
- Orbitals ya mseto huingiliana ili kuunda vifungo σ. Orbitals zisizosababishwa huingiliana ili kuunda vifungo vya π.
Katika sehemu zifuatazo, tutajadili aina ya kawaida ya orbitals ya mseto.
sp Hybridization
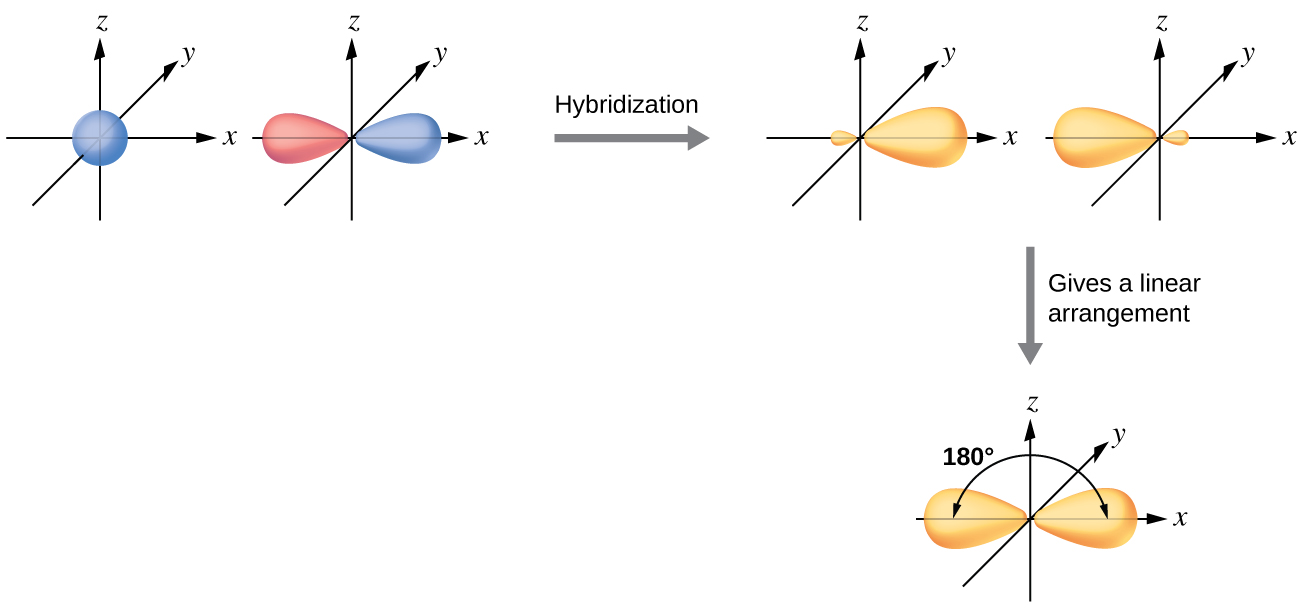
Atomu ya berili katika molekuli ya gesi ya BeCl 2 ni mfano wa atomi ya kati isiyo na jozi pekee ya elektroni katika mpangilio wa mstari wa atomi tatu. Kuna mikoa miwili ya wiani wa elektroni ya valence katika molekuli ya BeCl 2 ambayo yanahusiana na vifungo viwili vya Be-Cl. Ili kumiliki nyanja hizi mbili za elektroni, mbili za mzunguko wa valence nne za atomi zitachanganya ili kuzalisha orbitals mbili za mseto. Mchakato huu hybridization inahusisha kuchanganya ya valence s orbital na moja ya orbitals valence p mavuno mbili sawa sp mseto orbitals kwamba ni oriented katika jiometri linear (Kielelezo\(\PageIndex{3}\)). Katika takwimu hii, seti ya orbitals sp inaonekana sawa na sura ya awali p orbital, lakini kuna tofauti muhimu. Idadi ya orbitals ya atomiki pamoja daima sawa na idadi ya orbitals mseto sumu. Orbital p ni orbital moja ambayo inaweza kushikilia hadi elektroni mbili. Seti ya sp ni orbitals mbili sawa zinazoelekeza 180° kutoka kwa kila mmoja. elektroni mbili kwamba walikuwa awali katika s orbital sasa kusambazwa kwa orbitals mbili sp, ambayo ni nusu kujazwa. Katika BeCl 2 ya gesi, hizi orbitals za mseto zilizojaa nusu zitaingiliana na orbitals kutoka atomi za klorini ili kuunda vifungo viwili vya kufanana.
Sisi kuonyesha tofauti za elektroniki katika pekee Kuwa atomi na katika Bonded Kuwa atomi katika orbital nishati ya ngazi mchoro katika Kielelezo\(\PageIndex{4}\). Michoro hizi zinawakilisha kila orbital kwa mstari usio na usawa (kuonyesha nishati yake) na kila elektroni kwa mshale. Nishati huongezeka kuelekea juu ya mchoro. Tunatumia mshale mmoja wa juu ili kuonyesha elektroni moja katika orbital na mishale miwili (juu na chini) ili kuonyesha elektroni mbili za spin kinyume.
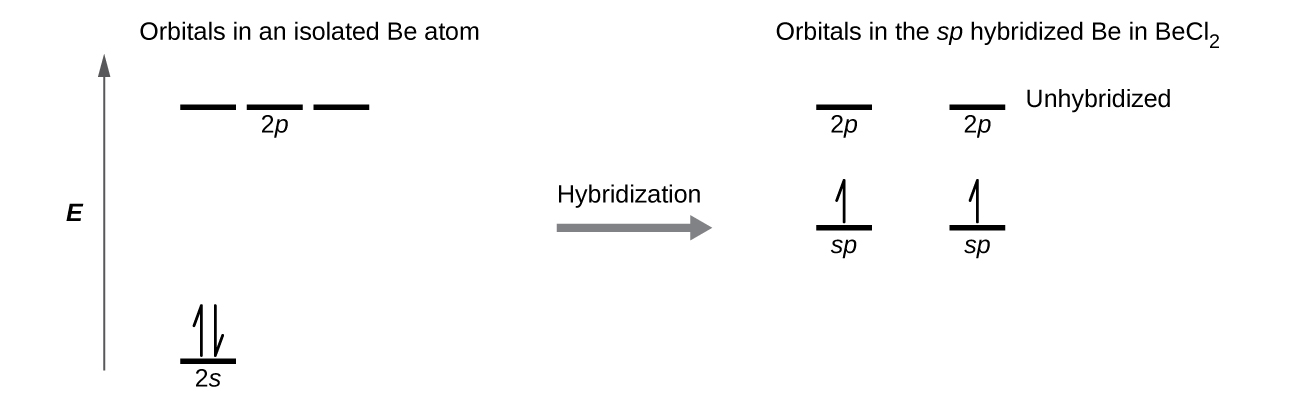
Wakati orbitals ya atomiki huchanganya, elektroni za valence zinachukua orbitals wapya. Atomi ya Be ilikuwa na elektroni mbili za valence, hivyo kila moja ya orbitals sp inapata moja ya elektroni hizi. Kila moja ya elektroni hizi hujiunga na elektroni isiyoharibika kwenye atomi ya klorini wakati orbital ya mseto na orbital ya klorini huingiliana wakati wa malezi ya vifungo vya Be-Cl. Any atomi kati kuzungukwa na mikoa miwili tu ya valence elektroni wiani katika molekuli itaonyesha sp hybridization. Mifano mingine ni pamoja na atomi ya zebaki katika molekuli linear HgCl 2, atomi ya zinki katika Zn (CH 3) 2, ambayo ina mpangilio wa mstari wa C—Zn—C, na atomi za kaboni katika HCCH na CO 2.
sp 2 Hybridization
Orbitals valence ya atomi ya kati iliyozungukwa na mikoa mitatu ya wiani wa elektroni inajumuisha seti ya tatu sp 2 orbitals mseto na moja unhybridized p orbital. Mpangilio huu matokeo kutoka sp 2 hybridization, kuchanganya ya moja s orbital na mbili p orbitals kuzalisha orbitals tatu kufanana mseto oriented katika trigonal planar jiometri (Kielelezo\(\PageIndex{5}\)).
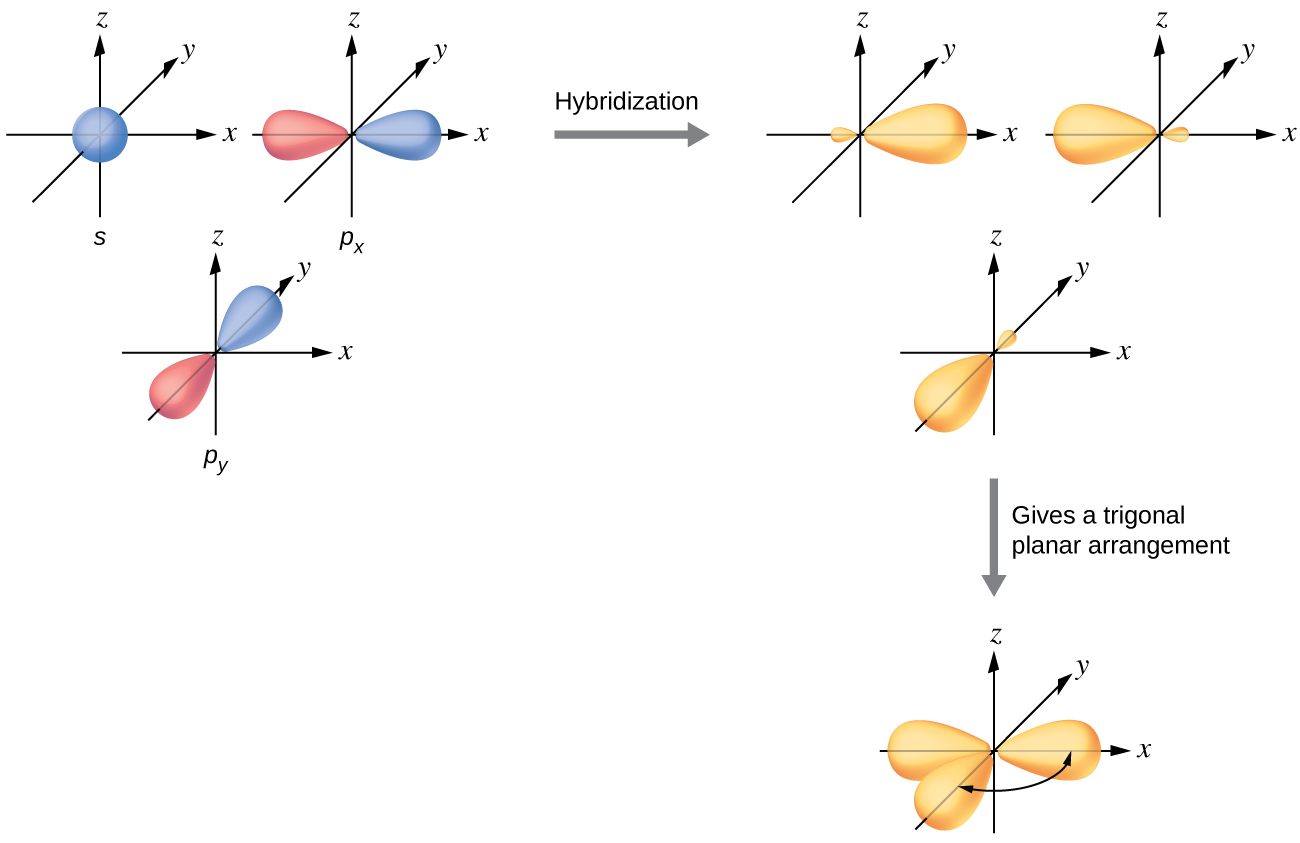
Ingawa quantum mechanics mavuno “nono” orbital lobes kama inavyoonyeshwa katika Kielelezo\(\PageIndex{5}\), wakati mwingine kwa uwazi orbitals hizi ni inayotolewa wakondefu na bila maskio madogo\(\PageIndex{6}\), kama katika Kielelezo, ili kuepuka kuficha sifa nyingine ya mfano huo. Tutatumia uwakilishi huu “mwembamba” wakati wowote mtazamo wa kweli umejaa sana kutazama kwa urahisi.
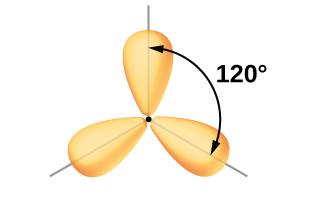
Muundo uliozingatiwa wa molekuli ya borane, BH 3, unaonyesha sp 2 hybridization kwa boron katika kiwanja hiki. Molekuli ni mpango wa trigonal, na atomi ya boroni inashiriki katika vifungo vitatu kwa atomi za hidrojeni (Kielelezo\(\PageIndex{7}\)).
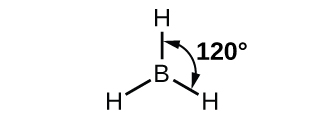
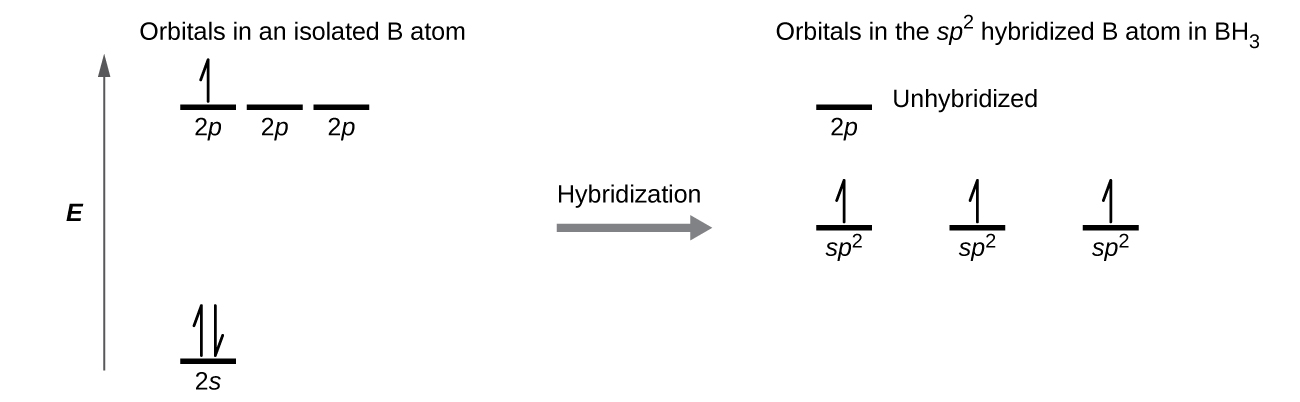
Tunaweza kuonyesha kulinganisha orbitals na usambazaji elektroni katika wametengwa boroni atomi na katika atomi Bonded katika BH 3 kama inavyoonekana katika orbital nishati ngazi mchoro katika Kielelezo\(\PageIndex{8}\). Tunasambaza tena elektroni za valence tatu za atomi ya boroni katika orbitals tatu za mseto wa sp 2, na kila jozi za elektroni za boroni na elektroni ya hidrojeni wakati vifungo vya B - H vinaunda.
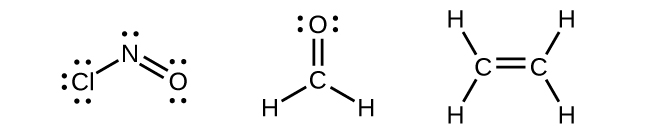
Atomi yoyote ya kati iliyozungukwa na mikoa mitatu ya wiani wa elektroni itaonyesha sp 2 hybridization. Hii inajumuisha molekuli zilizo na jozi pekee kwenye atomi ya kati, kama vile ClNO (Kielelezo\(\PageIndex{9}\)), au molekuli zilizo na vifungo viwili vya moja na dhamana mbili zilizounganishwa na atomi kuu, kama ilivyo katika formaldehyde, CH 2 O, na ethene, H 2 CCH 2.
sp 3 Hybridization
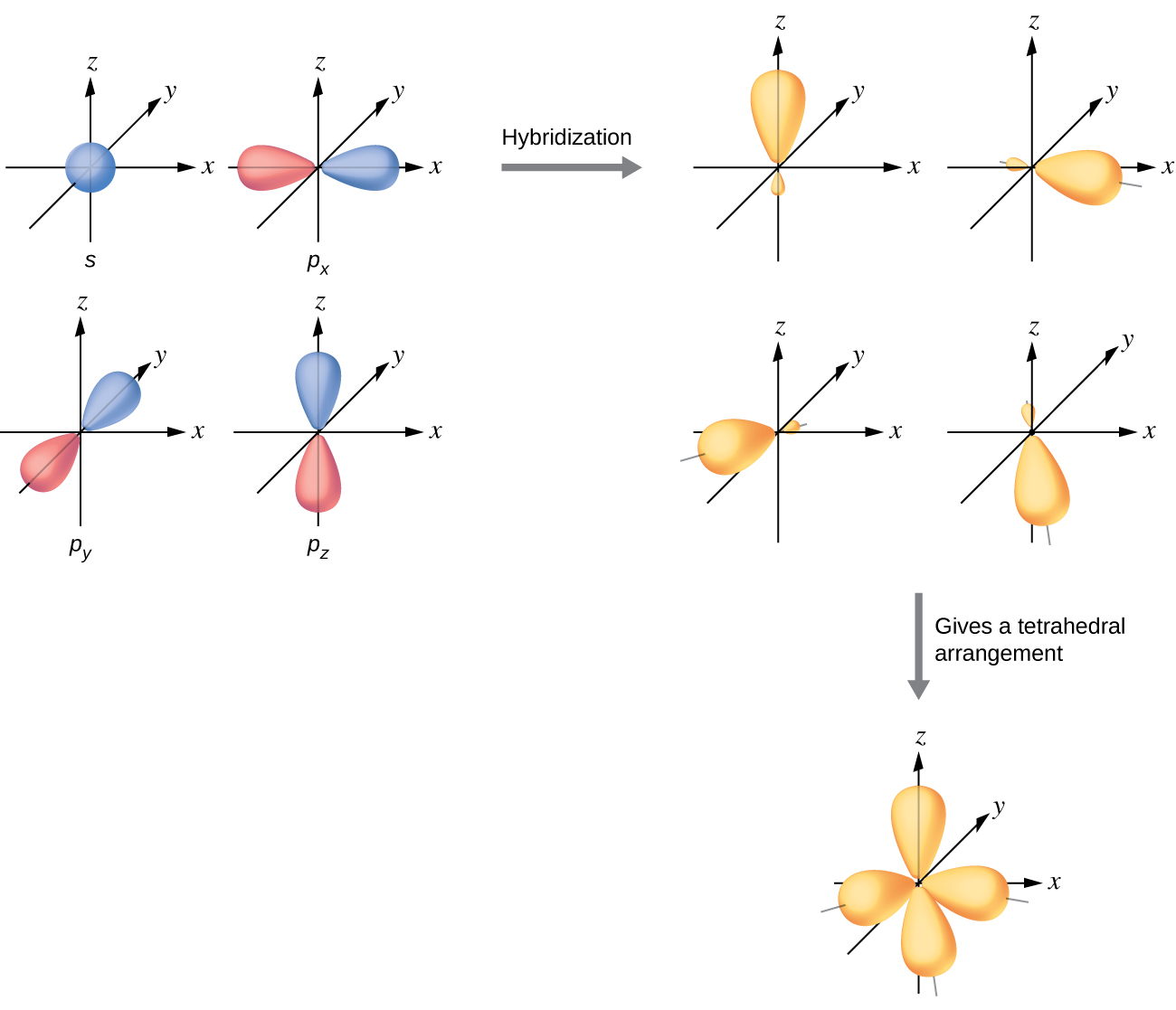
Orbitals valence ya atomi iliyozungukwa na mpangilio wa tetrahedral wa jozi za kuunganisha na jozi pekee zinajumuisha seti ya nne za sp 3 za mseto. Mahuluti hutokana na kuchanganya ya orbital moja na orbitals zote tatu p ambayo inazalisha nne kufanana sp 3 orbitals mseto (Kielelezo\(\PageIndex{10}\)). Kila moja ya orbitals hizi za mseto huelekea kona tofauti ya tetrahedron.
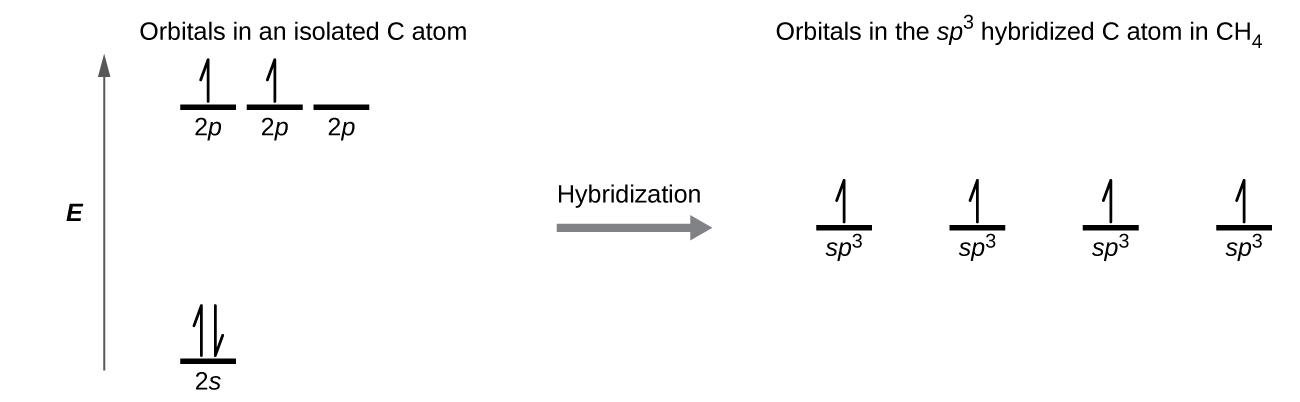
Molekuli ya methane, CH 4, ina atomi ya kaboni iliyozungukwa na atomi nne za hidrojeni kwenye pembe za tetrahedroni. Atomi ya kaboni katika methane inaonyesha sp 3 hybridization. Sisi kuonyesha orbitals na usambazaji elektroni katika pekee kaboni atomi na katika chembe Bonded katika CH 4 katika Kielelezo\(\PageIndex{11}\). Elektroni nne za valence za atomi ya kaboni zinasambazwa sawasawa katika orbitali za mseto, na kila kaboni elektroni jozi na elektroni ya hidrojeni wakati vifungo vya C—H vinaunda.
Katika molekuli ya methane, orbital ya 1 s ya kila moja ya atomi nne za hidrojeni huingiliana na mojawapo ya orbitali nne za sp 3 za atomi ya kaboni ili kuunda dhamana ya sigma (σ). Hii inasababisha kuundwa kwa vifungo vinne vyenye nguvu, sawa sawa kati ya atomi ya kaboni na kila moja ya atomi za hidrojeni ili kuzalisha molekuli ya methane, CH 4.
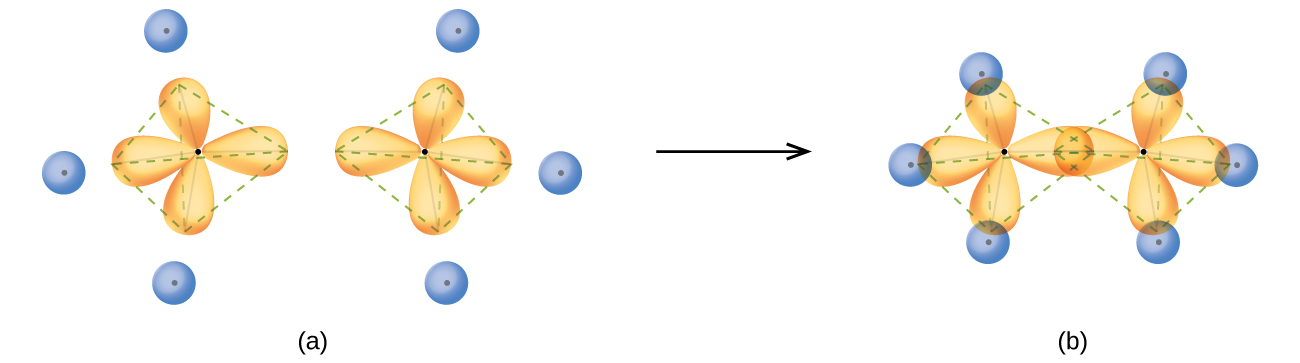
Muundo wa ethane, C 2 H 6, unafanana na ule wa methane kwa kuwa kila kaboni katika ethane ina atomi nne za jirani zilizopangwa kwenye pembe za tetrahedron—atomi tatu za hidrojeni na atomi moja ya kaboni (Kielelezo\(\PageIndex{10}\)). Hata hivyo, katika ethane sp 3 orbital ya atomu moja ya kaboni huingilia mwisho hadi mwisho na sp 3 orbital ya atomi ya pili ya kaboni ili kuunda dhamana σ kati ya atomi mbili za kaboni. Kila moja ya orbitals iliyobaki ya sp 3 ya mseto huingilia na orbital s ya atomi ya hidrojeni ili kuunda vifungo vya kaboni-hidrojeni σ. Muundo na muhtasari wa jumla wa orbitals bonding ya ethane ni inavyoonekana katika Kielelezo\(\PageIndex{12}\). Mwelekeo wa makundi mawili ya CH 3 haujawekwa jamaa kwa kila mmoja. Ushahidi wa majaribio unaonyesha kwamba mzunguko karibu na vifungo σ hutokea kwa urahisi.
Orbital ya mseto wa sp 3 pia inaweza kushikilia jozi moja ya elektroni. Kwa mfano, atomi ya nitrojeni katika amonia imezungukwa na jozi tatu za kuunganisha na jozi moja ya elektroni iliyoelekezwa kwenye pembe nne za tetrahedron. Atomi ya nitrojeni ni sp 3 iliyochanganywa na orbital moja ya mseto inayotumiwa na jozi pekee.
Muundo wa Masi ya maji ni sawa na utaratibu wa tetrahedral wa jozi mbili za pekee na jozi mbili za kuunganisha za elektroni. Hivyo tunasema kwamba atomi oksijeni ni sp 3 hybridized, na mbili ya orbitals mseto ulichukua na jozi moja na mbili kwa bonding jozi. Kwa kuwa jozi pekee huchukua nafasi zaidi kuliko jozi za kuunganisha, miundo iliyo na jozi pekee ina pembe za dhamana zilizopotoka kidogo kutoka kwa bora. Tetrahedra kamilifu huwa na pembe za 109.5°, lakini pembe zilizoonekana katika amonia (107.3°) na maji (104.5°) ni ndogo kidogo. Mifano mingine ya sp 3 hybridization ni pamoja na cCl 4, PCL 3, na nCl 3.
sp 3 d na sp 3 d 2 Hybridization
Kuelezea orbitals tano bonding katika trigonal bipyramidal mpangilio lazima kutumia tano ya valence shell orbitals atomiki (s orbital, tatu p orbitals, na moja ya orbitals d), ambayo inatoa tano sp 3 d orbitals mseto. Kwa utaratibu wa octahedral wa orbitals sita ya mseto, tunapaswa kutumia sita valence shell orbitals atomiki (s orbital, orbitals tatu p, na mbili ya orbitals d katika shell yake valence), ambayo inatoa sita sp 3 d 2 orbitals mseto. Hizi hybridizations inawezekana tu kwa atomi zilizo na d orbitals katika subshells zao za valence (yaani, sio wale walio katika kipindi cha kwanza au cha pili).

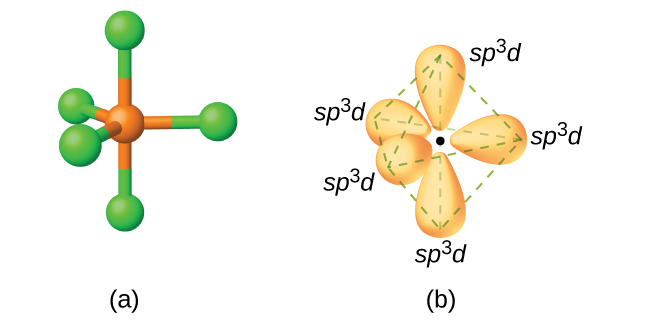
Katika molekuli ya pentachloride ya fosforasi, PCL 5, kuna tano vifungo vya P—Cl (hivyo jozi tano za elektroni za valence karibu na atomi ya fosforasi) iliyoelekezwa kuelekea pembe za bipiramidi ya trigonal. Sisi kutumia 3 s orbital, tatu 3 p orbitals, na moja ya orbitals 3 d kuunda seti ya tano sp 3 d orbitals mseto (Kielelezo\(\PageIndex{13}\)) kwamba ni kushiriki katika vifungo P—Cl. Atomi nyingine zinazoonyesha sp 3 d hybridization ni pamoja na atomi sulfuri katika SF 4 na atomi klorini katika ClF 3 na katika\(\ce{ClF4+}\). (Electroni kwenye atomi za fluorini zimeachwa kwa uwazi.)
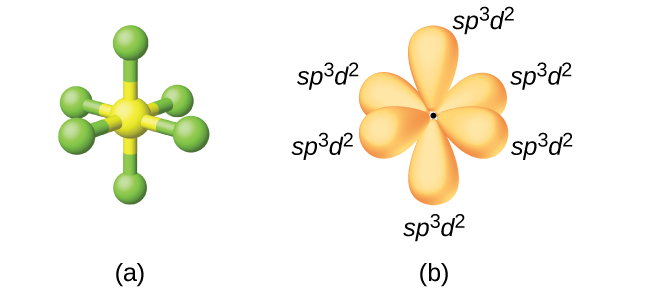
Atomi ya sulfuri katika hexafluoride ya sulfuri, SF 6, inaonyesha sp 3 d 2 hybridization. Molekuli ya hexafluoride ya sulfuri ina jozi sita za elektroni zinazounganisha atomi sita za fluorini kwa atomi moja ya sulfuri. Hakuna jozi pekee za elektroni kwenye atomu ya kati. Kuunganisha atomi sita za fluorini, 3 s orbital, tatu za 3 p, na mbili za orbitals 3 d huunda sita sawa sp 3 d 2 orbitals mseto, kila moja kwa moja kuelekea kona tofauti ya octahedron. Atomi nyingine zinazoonyesha sp 3 d 2 hybridization ni pamoja na atomi ya fosforasi katika\(\ce{PCl6-}\), atomi iodini katika interhalogens\(\ce{IF6+}\), IF 5\(\ce{ICl4-}\),,\(\ce{IF4-}\) na atomi xenon katika xEF 4.
Kazi ya Orbitals ya Mseto kwa Atomi za Kati
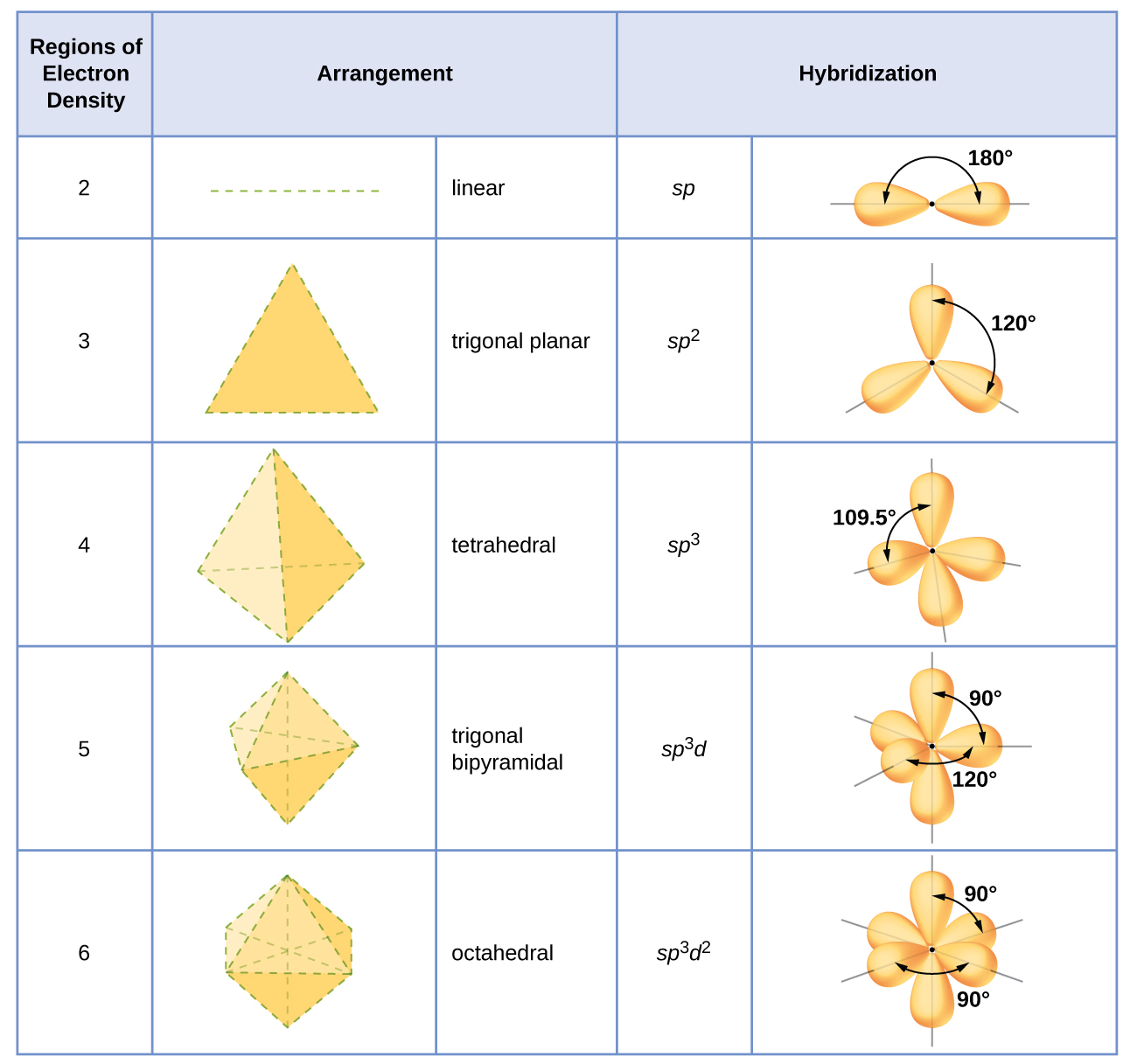
Uchanganyiko wa atomu huamua kulingana na idadi ya mikoa ya wiani wa elektroni inayozunguka. mipango kijiometri tabia ya seti mbalimbali ya orbitals mseto ni inavyoonekana katika Kielelezo\(\PageIndex{16}\). Mipango hii inafanana na yale ya jiometri za jozi za elektroni zilizotabiriwa na nadharia ya VSEPR. Nadharia ya VSEPR inabiri maumbo ya molekuli, na nadharia ya orbital ya mseto hutoa maelezo ya jinsi maumbo hayo yanavyoundwa. Ili kupata mahuluti ya atomu ya kati, tunaweza kutumia miongozo ifuatayo:
- Kuamua muundo wa Lewis wa molekuli.
- Tambua idadi ya mikoa ya wiani wa elektroni karibu na atomu kwa kutumia nadharia ya VSEPR, ambayo vifungo moja, vifungo vingi, radicals, na jozi pekee kila huhesabu kama kanda moja.
- Hawawajui seti ya orbitals hybridized kutoka Kielelezo\(\PageIndex{16}\) kwamba sambamba na jiometri hii.
Ni muhimu kukumbuka kuwa hybridization ilipangwa kwa rationalize majaribio aliona jiometri Masi, si njia nyingine kote.
Mfano huo unafanya kazi vizuri kwa molekuli zilizo na atomi ndogo za kati, ambapo jozi za elektroni za valence ziko karibu pamoja katika nafasi. Hata hivyo, kwa atomi kubwa za kati, jozi za elektroni za valence-shell ziko mbali zaidi na kiini, na kuna repulsions chache. Misombo yao inaonyesha miundo ambayo mara nyingi si sawa na nadharia ya VSEPR, na orbitals zilizochanganywa sio lazima kuelezea data iliyoonekana.
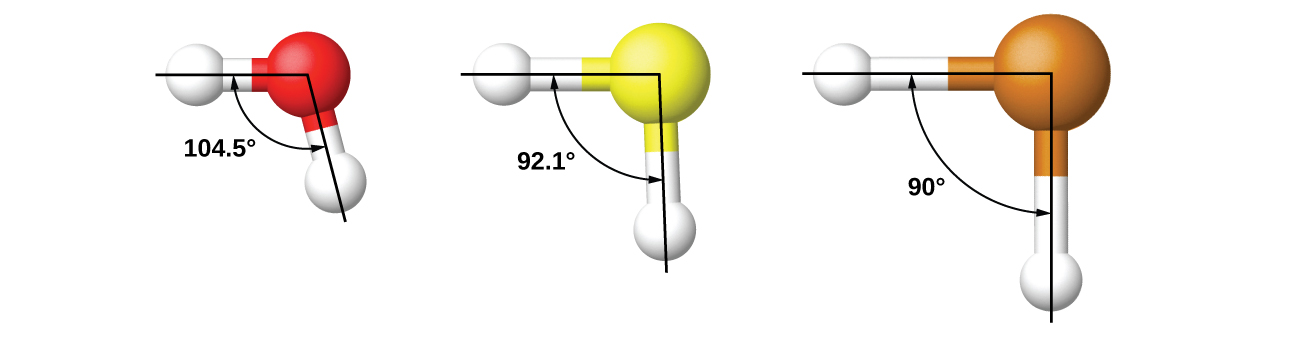
Kwa mfano, tumejadili pembe ya dhamana ya H—O—H katika H 2 O, 104.5°, ambayo inafanana zaidi na orbitali za mseto sp 3 (109.5°) kwenye atomu ya kati kuliko iliyo na orbitali 2 p (90°). Sulfuri iko katika kundi moja kama oksijeni, na H 2 S ina muundo sawa wa Lewis. Hata hivyo, ina angle ndogo sana ya dhamana (92.1°), ambayo inaonyesha mahuluti kidogo juu ya sulfuri kuliko oksijeni. Kuendelea chini ya kikundi, tellurium ni kubwa zaidi kuliko sulfuri, na kwa H 2 Te, angle ya dhamana iliyoonekana (90°) inafanana na mwingiliano wa orbitals 5 p, bila kuomba hybridization. Tunaomba hybridization ambapo ni muhimu kuelezea miundo iliyoonekana.
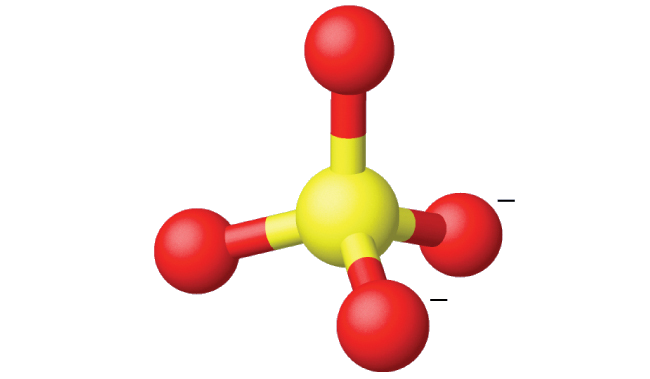
Ammonium sulfate is important as a fertilizer. What is the hybridization of the sulfur atom in the sulfate ion, \(\ce{SO4^2-}\)?
Solution
The Lewis structure of sulfate shows there are four regions of electron density.
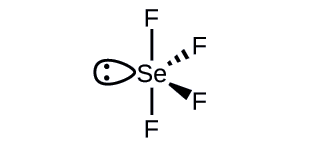
What is the hybridization of the selenium atom in SeF4?
- Answer
-
The selenium atom is sp3d hybridized.
Urea, NH2C(O)NH2, is sometimes used as a source of nitrogen in fertilizers. What is the hybridization of each nitrogen and carbon atom in urea?
Solution
The Lewis structure of urea is
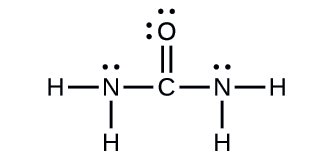
The carbon atom is surrounded by three regions of electron density, positioned in a trigonal planar arrangement. The hybridization in a trigonal planar electron pair geometry is sp2 (Figure \(\PageIndex{16}\)), which is the hybridization of the carbon atom in urea.
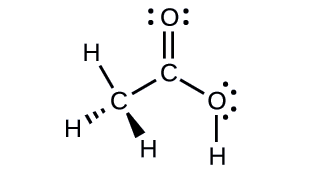
Acetic acid, H3CC(O)OH, is the molecule that gives vinegar its odor and sour taste. What is the hybridization of the two carbon atoms in acetic acid?
- Answer
-
H3C, sp3; C(O)OH, sp2
Summary
We can use hybrid orbitals, which are mathematical combinations of some or all of the valence atomic orbitals, to describe the electron density around covalently bonded atoms. These hybrid orbitals either form sigma (σ) bonds directed toward other atoms of the molecule or contain lone pairs of electrons. We can determine the type of hybridization around a central atom from the geometry of the regions of electron density about it. Two such regions imply sp hybridization; three, sp2 hybridization; four, sp3 hybridization; five, sp3d hybridization; and six, sp3d2 hybridization. Pi (π) bonds are formed from unhybridized atomic orbitals (p or d orbitals).
Footnotes
- Note that orbitals may sometimes be drawn in an elongated “balloon” shape rather than in a more realistic “plump” shape in order to make the geometry easier to visualize.
Glossary
- hybrid orbital
- orbital created by combining atomic orbitals on a central atom
- hybridization
- model that describes the changes in the atomic orbitals of an atom when it forms a covalent compound
- sp hybrid orbital
- one of a set of two orbitals with a linear arrangement that results from combining one s and one p orbital
- sp2 hybrid orbital
- one of a set of three orbitals with a trigonal planar arrangement that results from combining one s and two p orbitals
- sp3 hybrid orbital
- one of a set of four orbitals with a tetrahedral arrangement that results from combining one s and three p orbitals
- sp3d hybrid orbital
- one of a set of five orbitals with a trigonal bipyramidal arrangement that results from combining one s, three p, and one d orbital
- sp3d2 hybrid orbital
- one of a set of six orbitals with an octahedral arrangement that results from combining one s, three p, and two d orbitals


