8.1: Theory ya dhamana ya Valence
- Page ID
- 175902
- Eleza malezi ya vifungo vya covalent kwa suala la kuingiliana kwa atomiki orbital
- Eleza na kutoa mifano ya vifungo vya σ na π
Kama tunavyojua, nadharia ya kisayansi ni maelezo yenye mkono kwa sheria za asili zilizozingatiwa au miili mikubwa ya data ya majaribio. Kwa nadharia kukubaliwa, ni lazima kueleza data ya majaribio na kuwa na uwezo wa kutabiri tabia. Kwa mfano, nadharia ya VSEPR imepata kukubalika kwa kawaida kwa sababu inatabiri maumbo ya molekuli tatu-dimensional ambayo ni sambamba na data za majaribio zilizokusanywa kwa maelfu ya Hata hivyo, nadharia ya VSEPR haitoi maelezo ya kuunganisha kemikali.
Kuna nadharia zilizofanikiwa zinazoelezea muundo wa elektroniki wa atomi. Tunaweza kutumia quantum mechanics kutabiri mikoa maalum karibu atomi ambapo elektroni ni uwezekano wa kuwa iko: sura spherical kwa s orbital, sura dumbbell kwa p orbital, na kadhalika. Hata hivyo, utabiri huu unaelezea tu orbitals karibu na atomi za bure. Wakati atomi zinafunga kuunda molekuli, orbitali atomiki hazitoshi kuelezea mikoa ambako elektroni zitakuwapo katika molekuli. Uelewa kamili zaidi wa mgawanyo wa elektroni unahitaji mfano ambao unaweza kuhesabu muundo wa elektroniki wa molekuli. Nadharia moja maarufu inashikilia kwamba dhamana ya covalent inaunda wakati jozi ya elektroni inashirikiwa na atomi mbili na wakati huo huo huvutiwa na viini vya atomi zote mbili. Katika sehemu zifuatazo, tutajadili jinsi vifungo vile vinaelezewa na nadharia ya dhamana ya valence na mahuluti.
Nadharia ya dhamana ya Valence inaeleza dhamana ya covalent kama mwingiliano wa orbitals atomiki nusu-kujazwa (kila zenye elektroni moja) kwamba mavuno jozi ya elektroni pamoja kati ya atomi mbili Bonded. Tunasema kwamba orbitals juu ya atomi mbili tofauti huingiliana wakati sehemu ya orbital moja na sehemu ya orbital ya pili inachukua eneo moja la nafasi. Kwa mujibu wa nadharia ya dhamana ya valence, matokeo ya dhamana ya covalent wakati hali mbili zinakabiliwa:
- orbital juu ya atomi moja huingilia orbital kwenye atomi ya pili na
- elektroni moja katika kila orbital kuchanganya kuunda jozi elektroni.
Mvuto wa kuheshimiana kati ya jozi hii ya elektroni yenye kushtakiwa vibaya na viini viwili vya atomi vinavyotumiwa vyema hutumikia kuunganisha atomi mbili kwa njia ya nguvu tunayofafanua kama dhamana ya covalent. Nguvu ya dhamana ya covalent inategemea kiwango cha kuingiliana kwa orbitals zinazohusika. Orbitals kwamba mwingiliano sana fomu vifungo kwamba ni nguvu zaidi kuliko wale ambao chini ya mwingiliano.
Nishati ya mfumo inategemea kiasi gani orbitals huingiliana. Kielelezo\(\PageIndex{1}\) unaeleza jinsi jumla ya nguvu za atomi mbili hidrojeni (rangi Curve) mabadiliko kama wao mbinu kila mmoja. Wakati atomi ni mbali mbali hakuna mwingiliano, na kwa mkataba sisi kuweka jumla ya nguvu katika sifuri. Kama atomi zinavyosonga pamoja, orbitali zao zinaanza kuingiliana. Kila elektroni huanza kujisikia kivutio cha kiini katika atomu nyingine. Kwa kuongeza, elektroni huanza kurudiana, kama vile nuclei. Wakati atomi bado zinajitenga sana, vivutio vina nguvu kidogo kuliko repulsions, na nishati ya mfumo hupungua. (dhamana huanza kuunda.) Kama atomi zinakaribia pamoja, mwingiliano huongezeka, hivyo mvuto wa nuclei kwa elektroni unaendelea kuongezeka (kama vile repulsions kati ya elektroni na kati ya nuclei). Kwa umbali fulani maalum kati ya atomi, ambayo inatofautiana kulingana na atomi zinazohusika, nishati hufikia thamani yake ya chini kabisa (imara zaidi). Hii umbali optimum kati ya viini mbili Bonded ni dhamana umbali kati ya atomi mbili. Dhamana ni imara kwa sababu kwa hatua hii, vikosi vya kuvutia na vyema vinachanganya ili kuunda usanidi wa nishati ya chini kabisa. Ikiwa umbali kati ya viini ulipungua zaidi, repulsions kati ya nuclei na repulsions kama elektroni zimefungwa karibu na kila mmoja ingekuwa na nguvu zaidi kuliko vikosi vya kuvutia. Nishati ya mfumo ingekuwa kisha kupanda (kufanya mfumo destabilized), kama inavyoonekana katika mbali kushoto ya Kielelezo\(\PageIndex{1}\).
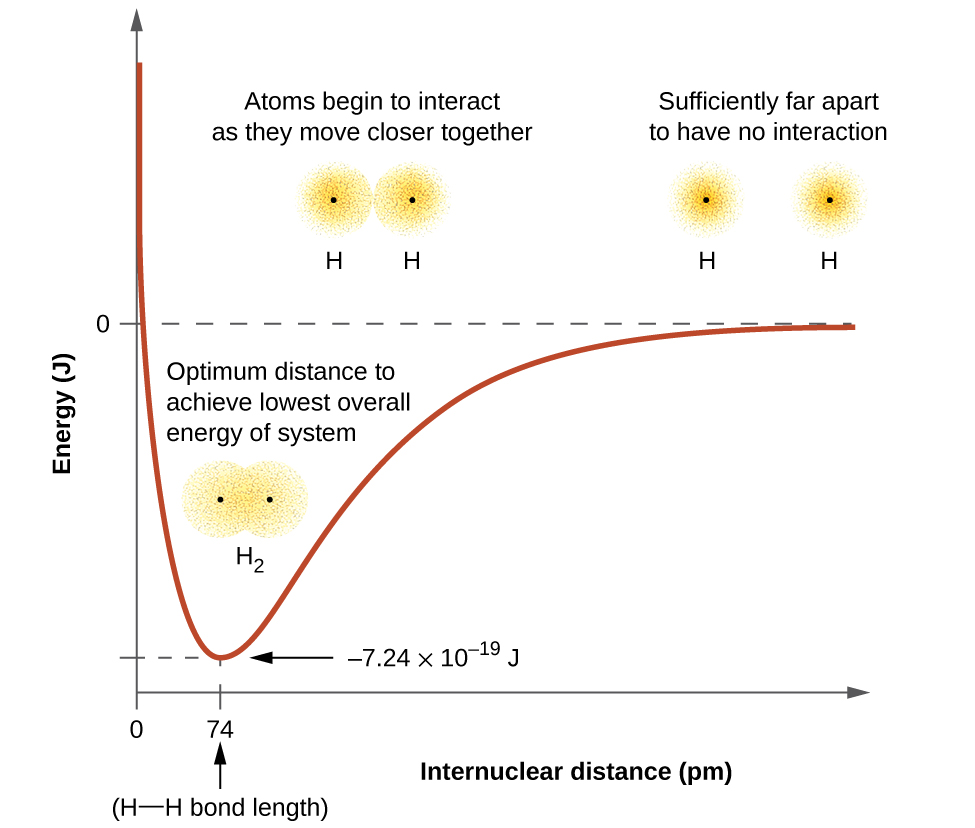
Nishati ya dhamana ni tofauti kati ya kiwango cha chini cha nishati (kinachotokea umbali wa dhamana) na nishati ya atomi mbili zilizotengwa. Hii ni kiasi cha nishati iliyotolewa wakati dhamana inapoundwa. Kinyume chake, kiasi hicho cha nishati kinahitajika kuvunja dhamana. Kwa\(H_2\) molekuli inavyoonekana katika Kielelezo\(\PageIndex{1}\), katika umbali wa dhamana ya 74 pm mfumo ni wa\(7.24 \times 10^{−19}\, J\) chini katika nishati kuliko mbili kutengwa atomi hidrojeni. Hii inaweza kuonekana kama idadi ndogo. Hata hivyo, tunajua kutokana na maelezo yetu ya awali ya thermochemistry kwamba nguvu za dhamana mara nyingi hujadiliwa kwa msingi wa kila mole. Kwa mfano, inahitaji\(7.24 \times 10^{−19}\; J\) kuvunja moja H—H dhamana, lakini inachukua\(4.36 \times 10^5\; J\) kuvunja 1 mole ya H—H vifungo. Ulinganisho wa urefu wa dhamana na nguvu huonyeshwa katika Jedwali\(\PageIndex{1}\). Tunaweza kupata mengi ya vifungo hivi katika aina ya molekuli, na meza hii inatoa maadili ya wastani. Kwa mfano, kuvunja dhamana ya kwanza ya C—H katika CH4 inahitaji 439.3 kJ/mol, huku kuvunja dhamana ya kwanza ya C—H katika\(\ce{H–CH2C6H5}\) (rangi nyembamba ya kawaida) inahitaji 375.5 kJ/mol.
| Bond | Urefu (pm) | Nishati (KJ/mol) | Bond | Urefu (pm) | Nishati (KJ/mol) | |
|---|---|---|---|---|---|---|
| H—H | 74 | 436 | C—O | 140.1 | 358 | |
| H—C | 106.8 | 413 | \(\mathrm{C=O}\) | 119.7 | 745 | |
| H—N | 101.5 | 391 | \(\mathrm{C≡O}\) | 113.7 | 1072 | |
| H—O | 97.5 | 467 | H—Cl | 127.5 | 431 | |
| C—C | 150.6 | 347 | H—Br | 141.4 | 366 | |
| \(\mathrm{C=C}\) | 133.5 | 614 | H—I | 160.9 | 298 | |
| \(\mathrm{C≡C}\) | 120.8 | 839 | O—O | 148 | 146 | |
| C—N | 142.1 | 305 | \(\mathrm{O=O}\) | 120.8 | 498 | |
| \(\mathrm{C=N}\) | 130.0 | 615 | F—F | 141.2 | 159 | |
| \(\mathrm{C≡N}\) | 116.1 | 891 | Cl—Cl | 198.8 | 243 |
Mbali na umbali kati ya orbitals mbili, mwelekeo wa orbitals pia huathiri mwingiliano wao (isipokuwa kwa orbitals mbili, ambazo ni spherically symmetric). Kuingiliana zaidi kunawezekana wakati orbitals ni oriented kama kwamba wao huingiliana kwenye mstari wa moja kwa moja kati ya viini viwili. Kielelezo\(\PageIndex{2}\) unaeleza hii kwa orbitals p mbili kutoka atomi tofauti; mwingiliano ni mkubwa wakati orbitals huingiliana mwisho hadi mwisho badala ya pembe.
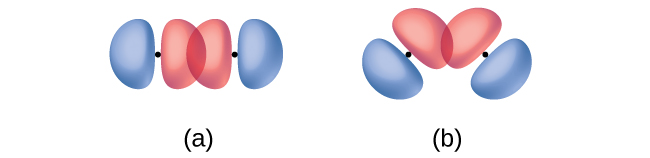
Kuingiliana kwa orbitals mbili s (kama katika H 2), mwingiliano wa s orbital na p orbital (kama katika HCl), na mwisho-kwa-mwisho mwingiliano wa orbitals mbili p (kama katika Cl 2) wote kuzalisha sigma vifungo (σ vifungo), kama inavyoonekana katika Kielelezo \(\PageIndex{3}\). Dhamana ya σ ni dhamana ya covalent ambayo wiani wa elektroni hujilimbikizia katika kanda kando ya mhimili wa internuclear; yaani, mstari kati ya viini ungepita katikati ya mkoa wa kuingiliana. Vifungo vya pekee katika miundo ya Lewis vinaelezewa kama vifungo σ katika nadharia ya dhamana ya valence.
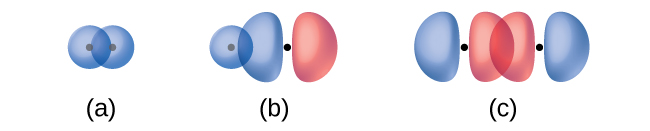
dhamana pi (π dhamana) ni aina ya dhamana covalent kwamba matokeo kutoka upande kwa upande mwingiliano wa orbitals mbili p, kama inavyoonekana katika Kielelezo\(\PageIndex{4}\). Katika dhamana ya π, mikoa ya orbital inaingiliana kwenye pande tofauti za mhimili wa internuclear. Pamoja na mhimili yenyewe, kuna node, yaani, ndege isiyo na uwezekano wa kupata elektroni.
 "style="upana: 325px; urefu: 115px;” width="325px” height="115px” src=”/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg “>
"style="upana: 325px; urefu: 115px;” width="325px” height="115px” src=”/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg “>
Wakati vifungo vyote vya moja ni vifungo σ, vifungo vingi vinajumuisha vifungo vyote vya σ na π. Kama miundo ya Lewis inavyoonyesha, O 2 ina dhamana mara mbili, na N 2 ina dhamana tatu. Dhamana ya mara mbili ina dhamana moja σ na dhamana moja π, na dhamana ya mara tatu ina dhamana moja σ na vifungo viwili π. Kati ya atomi zozote mbili, dhamana ya kwanza iliyoundwa daima itakuwa dhamana ya σ, lakini kunaweza kuwa na dhamana moja tu ya σ katika eneo lolote. Katika dhamana yoyote nyingi, kutakuwa na dhamana moja ya σ, na vifungo moja au mbili vilivyobaki vitakuwa π vifungo. Vifungo hivi vinaelezwa kwa undani zaidi baadaye katika sura hii.
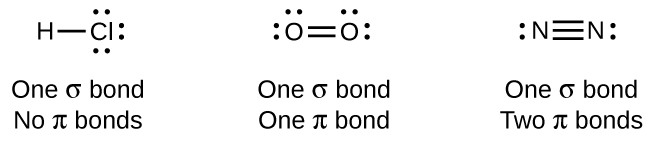
Kama inavyoonekana katika Jedwali\(\PageIndex{1}\), dhamana ya wastani ya kaboni-kaboni moja ni 347 KJ/mol, wakati katika dhamana ya kaboni-kaboni mara mbili, dhamana π huongeza nguvu ya dhamana kwa 267 KJ/mol. Kuongeza ziada π dhamana husababisha ongezeko zaidi la 225 kJ/mol. Tunaweza kuona mfano sawa tunapolinganisha vifungo vingine σ na π. Hivyo, kila mtu π dhamana kwa ujumla ni dhaifu kuliko dhamana ya σ sambamba kati ya atomi hizo mbili. Katika dhamana ya σ, kuna kiwango kikubwa cha kuingiliana kwa orbital kuliko katika dhamana π.
Butadiene, C 4 H 6, hutumiwa kufanya mpira wa synthetic. Tambua idadi ya vifungo σ na π zilizomo katika molekuli hii.
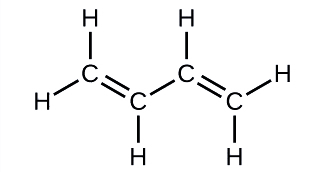
Suluhisho
Kuna sita σ C—H vifungo na moja σ C—C dhamana, kwa jumla ya saba kutoka vifungo moja. Kuna vifungo viwili mara mbili ambavyo kila mmoja ana dhamana π pamoja na dhamana ya σ. Hii inatoa jumla tisa σ na mbili π vifungo kwa ujumla.
Tambua kila mfano kama unaonyesha dhamana ya σ au π:
- kuingiliana kwa upande wa 4 p na 2 p orbital
- mwingiliano wa mwisho hadi mwisho wa 4 p na 4 p orbital
- mwingiliano wa mwisho hadi mwisho wa 4 p na 2 p orbital
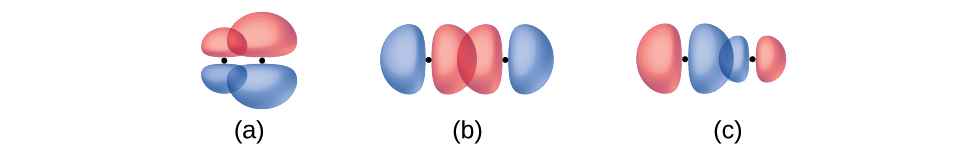
- Jibu
-
(a) ni dhamana π yenye nodi kando ya mhimili inayounganisha nuclei ilhali (b) na (c) ni vifungo σ vinavyoingiliana kando ya mhimili.
Muhtasari
Nadharia ya dhamana ya Valence inaelezea kuunganishwa kama matokeo ya mwingiliano wa orbitali atomia mbili tofauti kwenye atomi tofauti zinazojenga kanda yenye jozi moja ya elektroni zilizoshirikiwa kati ya atomi hizo mbili. Wakati orbitals huingiliana pamoja na mhimili ulio na nuclei, huunda dhamana ya σ. Wakati wanaingiliana kwa mtindo ambao hujenga nodi kando ya mhimili huu, huunda dhamana π.
faharasa
- kuingiliana
- mshikamano wa orbitals kutoka atomi mbili tofauti kugawana eneo moja la nafasi, na kusababisha kuundwa kwa dhamana covalent
- kinundu
- ndege kutenganisha lobes tofauti ya orbitals, ambapo uwezekano wa kupata elektroni ni sifuri
- pi dhamana (π dhamana)
- dhamana ya covalent iliyoundwa na kuingiliana kwa upande mmoja wa orbitals ya atomiki; wiani wa elektroni hupatikana kwenye pande tofauti za mhimili wa internuclear
- Sigma dhamana (σ dhamana)
- dhamana covalent sumu na mwingiliano wa orbitals atomiki pamoja mhimili internuclear
- valence dhamana nadharia
- maelezo ya kuunganisha ambayo inahusisha orbitals ya atomiki inayoingiliana ili kuunda vifungo σ au π, ndani ambayo jozi za elektroni zinashirikiwa


