6.3: Maendeleo ya Theory ya Quantum
- Page ID
- 176181
- Kupanua dhana ya duality wimbi-chembe kwamba alikuwa aliona katika mionzi sumakuumeme kwa jambo pia
- Kuelewa wazo la jumla la maelezo ya mitambo ya quantum ya elektroni katika atomu, na kwamba inatumia dhana ya kazi tatu-dimensional wimbi, au orbitals, kwamba kufafanua usambazaji wa uwezekano wa kupata elektroni katika sehemu fulani ya nafasi
- Orodha na ueleze sifa za namba nne za quantum zinazounda msingi wa kubainisha kabisa hali ya elektroni katika atomu
Mfano wa Bohr ulieleza data ya majaribio kwa atomi ya hidrojeni na ilikubaliwa sana, lakini pia ilileta maswali mengi. Kwa nini elektroni obiti katika umbali tu fasta defined na idadi moja quantum n = 1, 2, 3, na kadhalika, lakini kamwe katika kati? Kwa nini mfano huo ulifanya kazi vizuri kuelezea ioni za hidrojeni na moja ya elektroni, lakini haikuweza kutabiri kwa usahihi wigo wa chafu kwa heliamu au atomi yoyote kubwa? Ili kujibu maswali haya, wanasayansi walihitaji kurekebisha kabisa jinsi walivyofikiri juu ya suala hilo.
Tabia katika Dunia Microscopic
Tunajua jinsi jambo linavyofanya katika ulimwengu wa macroscopic—vitu ambavyo ni kubwa vya kutosha kuonekana kwa jicho la uchi hufuata sheria za fizikia ya kikabila. Mpira billiard kusonga juu ya meza itakuwa kuishi kama chembe: Itaendelea katika mstari wa moja kwa moja isipokuwa inagongana na mpira mwingine au mto meza, au ni alitenda juu na baadhi ya nguvu nyingine (kama vile msuguano). mpira ina nafasi vizuri defined na kasi (au kasi vizuri defined\(p = mv\),, inavyoelezwa\(m\) na wingi na kasi\(v\)) wakati wowote. Kwa maneno mengine, mpira unahamia katika trajectory ya classical. Hii ni tabia ya kawaida ya kitu cha classical.
Wakati mawimbi yanaingiliana, yanaonyesha mifumo ya kuingiliwa ambayo haionyeshwa na chembe za macroscopic kama vile mpira wa billiard. Kwa mfano, mawimbi kuingiliana juu ya uso wa maji inaweza kuzalisha patters kuingiliwa sawa na wale inavyoonekana kwenye Kielelezo\(\PageIndex{1}\). Hii ni kesi ya tabia ya wimbi kwa kiwango kikubwa, na ni wazi kwamba chembe na mawimbi ni tofauti sana matukio katika eneo la macroscopic.

Kama maboresho ya kiteknolojia yaliruhusu wanasayansi kuchunguza ulimwengu wa microscopic kwa undani zaidi, ilizidi kuwa wazi kwa miaka ya 1920 kwamba vipande vidogo sana vya suala vinafuata seti tofauti ya sheria kutoka kwa yale tunayoyaona kwa vitu vikubwa. Kutenganishwa bila shaka ya mawimbi na chembe haikuwa tena kwa ulimwengu wa microscopic.
Mmoja wa watu wa kwanza kuzingatia tabia maalum ya ulimwengu wa microscopic alikuwa Louis de Broglie. Aliuliza swali: Ikiwa mionzi ya umeme inaweza kuwa na tabia ya chembechembe, unaweza elektroni na chembe zingine ndogo ndogo zinaonyesha tabia ya wimbi? Katika yake 1925 udaktari dissertation, de Broglie kupanuliwa wimbi-chembe duality ya mwanga kwamba Einstein kutumika kutatua photoelectric-athari kitendawili kwa chembe nyenzo. Alitabiri kuwa chembe yenye molekuli m na kasi v (yaani, kwa kasi ya mstari p) inapaswa pia kuonyesha tabia ya wimbi yenye thamani ya wavelength λ, iliyotolewa na maneno haya ambayo h ni mara kwa mara ya kawaida ya Planck
\[\lambda=\dfrac{h}{mv}=\dfrac{h}{p} \label{6.4.1} \]
Hii inaitwa de Broglie wavelength. Tofauti na maadili mengine ya λ yaliyojadiliwa katika sura hii, wavelength ya de Broglie ni tabia ya chembe na miili mingine, si mionzi ya umeme (kumbuka kuwa equation hii inahusisha kasi [v, m/s], si mzunguko [ν, Hz]. Ingawa alama hizi mbili zinafanana, zinamaanisha mambo tofauti sana). Ambapo Bohr alikuwa amesema elektroni kama kuwa chembe inayozunguka kiini katika mizunguko ya kupimwa, de Broglie alisema kuwa dhana ya Bohr ya quantization inaweza kuelezewa kama elektroni inachukuliwa si kama chembe, bali kama wimbi la mviringo lililosimama kama kwamba tu idadi integer ya wavelengths inaweza fit hasa ndani ya obiti (Kielelezo\(\PageIndex{2}\)).
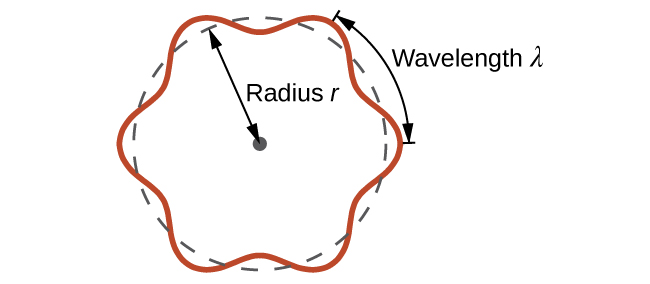
Kwa obiti ya mviringo ya r radius, mduara ni 2πr, na hivyo hali ya de Broglie ni:
\[2πr=nλ \label{6.4.3} \]
na\(n=1,2,3,...\)
Kwa kuwa maneno ya Broglie yanahusiana na wavelength kwa kasi na, kwa hiyo, kasi, hii ina maana:
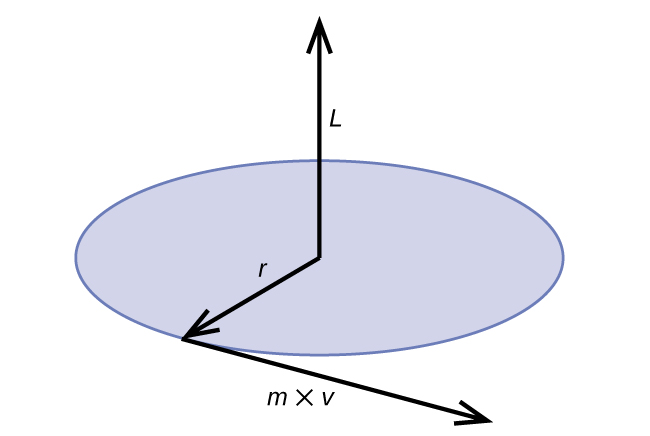
\[2πr=nλ=\dfrac{nh}{p}=\dfrac{nh}{mv}=\dfrac{nhr}{mvr}=\dfrac{nhr}{L} \label{6.4.3b} \]
Maneno haya yanaweza kupangwa upya ili kutoa formula ya Bohr kwa upimaji wa kasi ya angular:
\[L=\dfrac{nh}{2π}=n \hbar \label{6.4.4} \]
Kasi ya kawaida ya angular L kwa mwendo wa mviringo ni sawa na bidhaa ya radius ya mduara na kasi ya chembe inayohamia p.
\[L=rp=rmv \;\;\; \text{(for a circular motion)} \label{6.4.5} \]
Muda mfupi baada ya de Broglie mapendekezo asili ya wimbi la jambo, wanasayansi wawili katika Bell Laboratories, C. J. Davisson na L. H. Germer, alionyesha experimentally kwamba elektroni inaweza kuonyesha tabia wavelike kwa kuonyesha muundo kuingiliwa kwa elektroni kusafiri kwa njia ya mara kwa mara mfano wa atomiki katika kioo. Vipande vya atomiki vilivyowekwa mara kwa mara viliwahi kuwa slits, kama kutumika katika majaribio mengine ya kuingiliwa. Kwa kuwa nafasi kati ya tabaka kutumikia kama slits inahitaji kuwa sawa na ukubwa wa wavelength ya wimbi lililojaribiwa kwa muundo wa kuingiliwa kuunda, Davisson na Germer walitumia lengo la nikeli la fuwele kwa “slits” zao, kwa kuwa nafasi ya atomi ndani ya kimiani ilikuwa takriban sawa na de Broglie wavelengths ya elektroni walizotumia. Kielelezo\(\PageIndex{4}\) kinaonyesha muundo wa kuingiliwa.
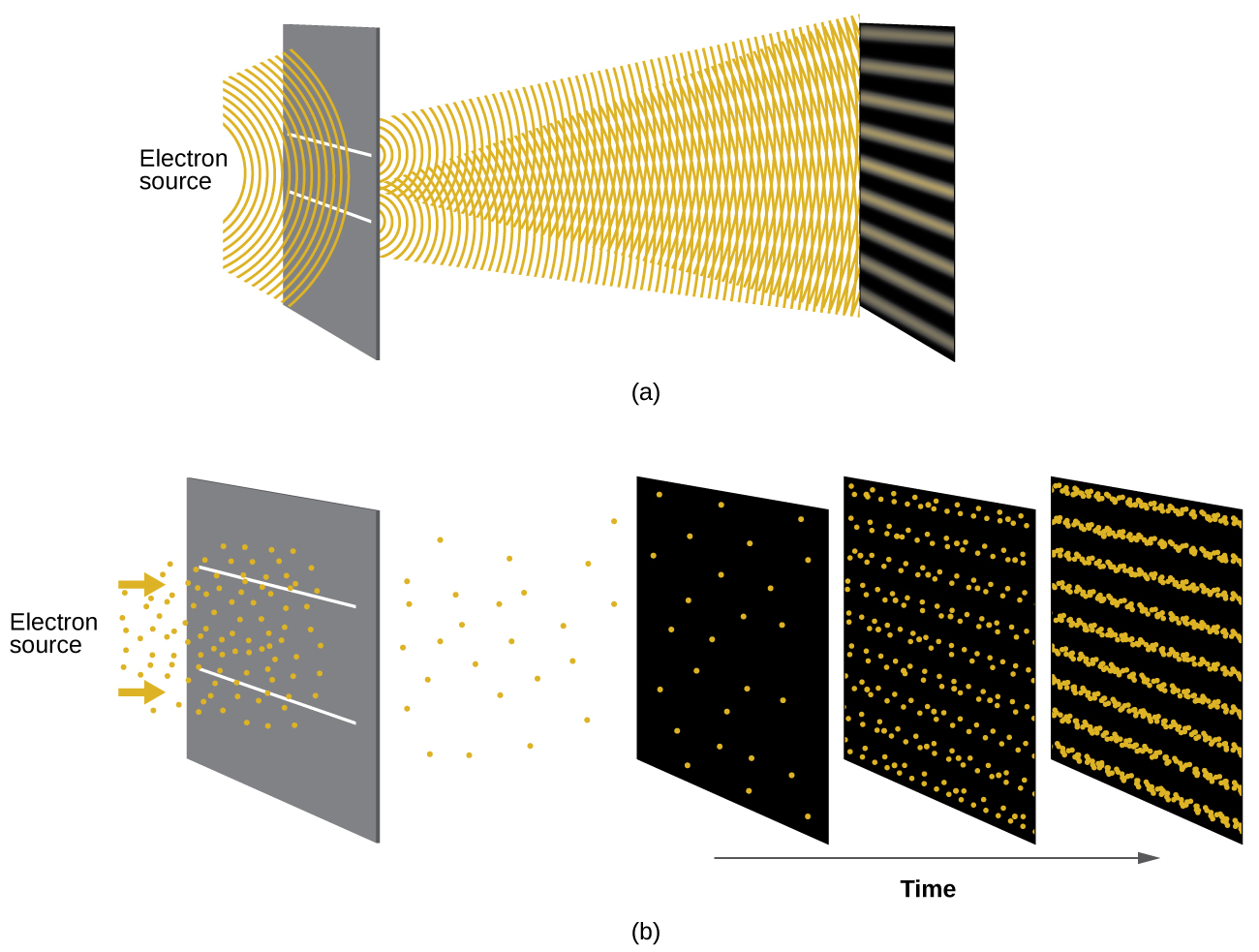
Wimbi-chembe duality ya suala inaweza kuonekana kwa kuchunguza nini kinatokea kama elektroni migongano ni kumbukumbu katika kipindi kirefu cha muda. Awali, wakati elektroni chache tu zimeandikwa, zinaonyesha tabia ya wazi ya chembe, baada ya kufika kwenye pakiti ndogo za ndani ambazo zinaonekana kuwa random. Kama elektroni zaidi na zaidi zilifika na zilirekodiwa, mfano wa kuingiliwa wazi ambao ni alama ya tabia ya wimbi iliibuka. Hivyo, inaonekana kwamba ilhali elektroni ni chembe ndogo za kienyeji, mwendo wao haufuati milinganyo ya mwendo unaotajwa na mitambo ya kikabila, lakini badala yake inasimamiwa na aina fulani ya equation ya wimbi inayoongoza usambazaji uwezekano hata kwa mwendo wa elektroni moja. Hivyo wimbi-chembe duality kwanza aliona na photons ni kweli tabia ya msingi ndani ya chembe zote quantum.
Ikiwa elektroni inasafiri kwa kasi ya 1.000 × 10 7 m s -1 na ina masi ya 9.109 × 10 —28 g, wavelength yake ni nini?
Suluhisho
Tunaweza kutumia equation de Broglie ya kutatua tatizo hili, lakini sisi kwanza lazima kufanya kitengo uongofu wa mara kwa mara Planck ya. Ulijifunza mapema kwamba 1 J = kilo 1 m 2 /s 2. Hivyo, tunaweza kuandika h = 6.626 × 10 —34 J s kama 6.626 × 10 —34 kg m 2 /s.
\[\begin{align*} λ&=\dfrac{h}{mv} \\[4pt] &=\mathrm{\dfrac{6.626×10^{−34}\:kg\: m^2/s}{(9.109×10^{−31}\:kg)(1.000×10^7\:m/s)}}\\[4pt] &= \mathrm{7.274×10^{−11}\:m} \end{align*} \nonumber \]
Hii ni thamani ndogo, lakini ni kubwa zaidi kuliko ukubwa wa elektroni katika mtazamo wa classical (chembe). Ukubwa huu ni utaratibu sawa wa ukubwa kama ukubwa wa atomi. Hii ina maana kwamba elektroni wimbi tabia ni kwenda kuwa liko katika atomu.
Tumia masafa ya wavelength ya softball yenye wingi wa g 100 kusafiri kwa kasi ya 35 m s -1, kudhani kwamba inaweza kuonyeshwa kama chembe moja.
- Jibu
-
1.9 × 10 —34 m.
Sisi kamwe kufikiria Softball kutupwa kuwa wavelength, kama wavelength hii ni ndogo sana, haiwezekani kwa akili zetu au chombo chochote inayojulikana kuchunguza (madhubuti kusema, wavelength ya baseball halisi ingekuwa yanahusiana na wavelengths ya atomi yake Constituent na molekuli, ambayo, wakati kubwa zaidi kuliko thamani hii, bado itakuwa microscopically vidogo). wavelength de Broglie ni appreciable tu kwa jambo ambalo lina molekuli ndogo sana na/au kasi ya juu sana.
Werner Heisenberg alizingatia mipaka ya jinsi ya usahihi tunaweza kupima mali ya elektroni au chembe nyingine za microscopic. Aliamua kuwa kuna kikomo cha msingi kwa jinsi usahihi mtu anaweza kupima msimamo wa chembe na kasi yake wakati huo huo. Kwa usahihi tunapima kasi ya chembe, kwa usahihi tunaweza kuamua msimamo wake wakati huo, na kinyume chake. Hii inaongozwa katika kile tunachokiita kanuni ya kutokuwa na uhakika wa Heisenberg: Ni vigumu kuamua wakati huo huo na hasa kasi na nafasi ya chembe. Kwa chembe ya molekuli m kusonga kwa kasi v x katika mwelekeo x (au sawa na kasi p x), bidhaa ya kutokuwa na uhakika katika nafasi, Δ x, na kutokuwa na uhakika katika kasi, Δ p x, lazima iwe kubwa kuliko au sawa na\(\dfrac{ℏ}{2}\) (kumbuka kwamba\(ℏ=\dfrac{h}{2π}\), thamani ya mara kwa mara ya Planck imegawanywa na 2 π).
\[Δx×Δp_x=(Δx)(mΔv)≥\dfrac{ℏ}{2} \nonumber \]
Equation hii inatuwezesha kuhesabu kikomo cha jinsi tunaweza kujua wote nafasi ya wakati mmoja wa kitu na kasi yake. Kwa mfano, ikiwa tunaboresha kipimo chetu cha msimamo wa elektroni ili kutokuwa na uhakika katika nafasi (Δ x) ina thamani ya, sema, 1 pm (10 —12 m, karibu 1% ya kipenyo cha atomi ya hidrojeni), basi uamuzi wetu wa kasi yake lazima uwe na uhakika na thamani ya angalau
\[\left [Δp=mΔv=\dfrac{h}{(2Δx)} \right ]=\mathrm{\dfrac{(1.055×10^{−34}\:kg\: m^2/s)}{(2×1×10^{−12}\:m)}=5×10^{−23}\:kg\: m/s.} \nonumber \]
Thamani ya si kubwa, hivyo kutokuwa na uhakika katika nafasi au kasi ya kitu kikubwa kama baseball ni muhimu sana kuchunguza. Hata hivyo, masi ya kitu microscopic kama vile elektroni ni ndogo ya kutosha kwamba kutokuwa na uhakika unaweza kuwa kubwa na muhimu.
Ikumbukwe kwamba kanuni ya kutokuwa na uhakika wa Heisenberg sio tu mdogo kwa uhakika katika nafasi na kasi, lakini pia inaunganisha vigezo vingine vya nguvu. Kwa mfano, wakati atomi inachukua fotoni na inafanya mpito kutoka hali moja ya nishati hadi nyingine, kutokuwa na uhakika katika nishati na kutokuwa na uhakika wakati unaohitajika kwa mpito ni sawa, kama Δ E Δ t ≥\(\dfrac{ℏ}{2}\). Kama itakavyojadiliwa baadaye, hata vipengele vya vector vya kasi ya angular haziwezi kutajwa hasa wakati huo huo.
Kanuni ya Heisenberg inatia mipaka ya mwisho juu ya kile kinachojulikana katika sayansi. Kanuni ya kutokuwa na uhakika inaweza kuonyeshwa kuwa matokeo ya duality ya wimbi-chembe, ambayo iko katika moyo wa kile kinachofafanua nadharia ya kisasa ya quantum kutoka kwa mechanics classical. Kumbuka kwamba usawa wa mwendo uliopatikana kutoka kwa mechanics ya classical ni trajectories ambapo, kwa papo yoyote iliyotolewa kwa wakati, nafasi zote na kasi ya chembe zinaweza kuamua hasa. Kanuni ya kutokuwa na uhakika ya Heisenberg ina maana kwamba mtazamo huo hauwezi kushindwa katika uwanja wa microscopic na kwamba kuna mapungufu ya msingi inayoongoza mwendo wa chembe za quantum. Hii haina maana kwamba chembe microscopic hazihamia katika trajectories, ni kwamba vipimo vya trajectories ni mdogo kwa usahihi wao. Katika eneo la mechanics quantum, vipimo vinaanzisha mabadiliko katika mfumo unaozingatiwa.
Mfano wa Quantum—Mitambo ya Atom
Muda mfupi baada ya de Broglie kuchapishwa mawazo yake kwamba elektroni katika atomi hidrojeni inaweza kuwa bora mawazo ya kama kuwa mviringo amesimama wimbi badala ya chembe kusonga katika quantized mviringo orbits, kama Bohr alikuwa alisema, Erwin Schrödinger kupanuliwa de Broglie kazi kwa kuchanganya de Broglie uhusiano katika wimbi equation, deriving nini leo inajulikana kama Schrödinger equation. Wakati Schrödinger alitumia equation yake kwa atomi za hidrojeni, aliweza kuzaliana na kujieleza kwa Bohr kwa nishati na, kwa hiyo, formula ya Rydberg inayoongoza spectra ya hidrojeni, na alifanya hivyo bila ya kuomba mawazo ya Bohr ya majimbo ya stationary na orbits quantized, momenta angular, na nguvu; quantization katika nadharia Schrödinger ilikuwa matokeo ya asili ya hisabati ya msingi ya equation wimbi. Kama de Broglie, Schrödinger awali kutazamwa elektroni katika hidrojeni kama kuwa wimbi kimwili badala ya chembe, lakini ambapo de Broglie mawazo ya elektroni katika suala la mawimbi mviringo stationary, Schrödinger vizuri mawazo katika suala la mawimbi tatu-dimensional stationary, au wavefunctions, inawakilishwa na barua ya Kigiriki psi,. Miaka michache baadaye, Max Born alipendekeza tafsiri ya wavefunction ambayo bado inakubaliwa leo: Electroni bado ni chembe, na hivyo mawimbi yanayowakilishwa na si mawimbi ya kimwili lakini, badala yake, ni uwezekano mkubwa amplitudes. Mraba wa ukubwa wa wimbi la mawimbi\(∣ψ∣^2\) huelezea uwezekano wa chembe ya quantum iko karibu na eneo fulani katika nafasi. Hii inamaanisha kuwa mawimbi yanaweza kutumiwa kuamua usambazaji wa wiani wa elektroni kuhusiana na kiini katika atomu. Kwa fomu ya jumla, equation ya Schrödinger inaweza kuandikwa kama:
\[\hat{H}ψ=Eψ \nonumber \]
\(\hat{H}\)ni operator wa Hamilton, seti ya shughuli za hisabati zinazowakilisha nishati ya jumla ya chembe ya quantum (kama vile elektroni katika atomi), ni wimbi la chembe hii ambayo inaweza kutumika kupata usambazaji maalum wa uwezekano wa kupata chembe, na \(E\)ni thamani halisi ya nishati ya jumla ya chembe.
Kazi ya Schrödinger, pamoja na ile ya Heisenberg na wanasayansi wengine wengi wakifuata nyayo zao, kwa ujumla hujulikana kama mechanics ya quantum.
Kuelewa Nadharia ya Quantum ya Electroni katika Atomi
Lengo la sehemu hii ni kuelewa orbitals elektroni (eneo la elektroni katika atomi), nguvu zao tofauti, na mali nyingine. Matumizi ya nadharia ya quantum hutoa uelewa bora kwa mada hizi. Maarifa haya ni mtangulizi wa kuunganisha kemikali.
Kama ilivyoelezwa hapo awali, elektroni katika atomi zinaweza kuwepo tu kwenye viwango vya nishati za kipekee lakini si kati yao. Inasemekana ya kwamba nishati ya elektroni katika atomu inahesabiwa, yaani inaweza kuwa sawa na maadili fulani maalum tu na inaweza kuruka kutoka ngazi moja ya nishati hadi nyingine lakini si mpito vizuri au kukaa kati ya viwango hivi.
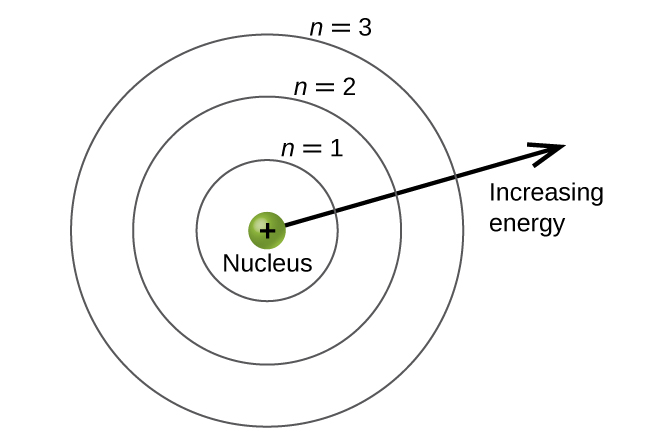
Viwango vya nishati vinatajwa na thamani ya n, ambapo n = 1, 2, 3,... Kwa ujumla, nishati ya elektroni katika atomu ni kubwa zaidi kwa maadili makubwa ya n. Nambari hii, n, inajulikana kama namba kuu ya quantum. Nambari kuu ya quantum inafafanua eneo la kiwango cha nishati. Kimsingi ni dhana sawa na n katika maelezo ya chembe ya Bohr. Jina jingine kwa nambari kuu ya quantum ni nambari ya shell. Makombora ya atomu yanaweza kufikiriwa ya miduara ya makini inayojitokeza kutoka kiini. Elektroni ambazo ni za ganda maalum zina uwezekano mkubwa wa kupatikana ndani ya eneo la mviringo linalofanana. Zaidi tunaendelea kutoka kiini, juu ya idadi ya shell, na hivyo kiwango cha juu cha nishati (Kielelezo\(\PageIndex{5}\)). Protoni za kushtakiwa vyema katika kiini huimarisha orbitals za elektroniki na mvuto wa umeme kati ya mashtaka mazuri ya protoni na mashtaka hasi ya elektroni. Hivyo mbali zaidi elektroni inatoka kiini, zaidi nishati inayo.
Mfano huu wa mitambo ya quantum kwa mahali ambapo elektroni huishi katika atomu inaweza kutumika kutazama mabadiliko ya elektroniki, matukio wakati elektroni inakwenda kutoka ngazi moja ya nishati hadi nyingine. Ikiwa mpito ni kiwango cha juu cha nishati, nishati inafyonzwa, na mabadiliko ya nishati yana thamani nzuri. Ili kupata kiasi cha nishati muhimu kwa ajili ya mpito kwa kiwango cha juu cha nishati, photon inachukuliwa na atomi. Mpito kwa ngazi ya chini ya nishati inahusisha kutolewa kwa nishati, na mabadiliko ya nishati ni hasi. Utaratibu huu unaambatana na chafu ya photon na atomi. Equation ifuatayo inafupisha mahusiano haya na inategemea atomu ya hidrojeni:
\[ \begin{align*} ΔE &=E_\ce{final}−E_\ce{initial} \\[4pt] &=−2.18×10^{−18}\left(\dfrac{1}{n^2_\ce f}−\dfrac{1}{n^2_\ce i}\right)\:\ce J \end{align*} \nonumber \]
Maadili n f na n i ni majimbo ya mwisho na ya awali ya nishati ya elektroni.
Nambari kuu ya quantum ni moja ya namba tatu za quantum zinazotumiwa kutambulisha orbital. Orbital atomiki, ambayo ni tofauti na obiti, ni kanda ya jumla katika atomu ambayo elektroni inawezekana zaidi kuishi. Mfano wa mitambo ya quantum hufafanua uwezekano wa kupata elektroni katika nafasi tatu-dimensional karibu na kiini na inategemea ufumbuzi wa equation Schrödinger. Aidha, idadi kuu ya quantum inafafanua nishati ya elektroni katika atomi ya hidrojeni au hidrojeni kama au ioni (atomi au ion yenye elektroni moja tu) na eneo la jumla ambalo viwango vya nishati vya elektroni katika atomi nyingi za elektroni na ions ziko.
Nambari nyingine ya quantum ni l, idadi ya kasi ya angular quantum. Ni integer inayofafanua sura ya orbital, na inachukua maadili, l = 0, 1, 2,..., n — 1. Hii ina maana kwamba orbital na n = 1 inaweza kuwa na thamani moja tu ya l, l = 0, ambapo n = 2 vibali l = 0 na l = 1, na kadhalika. Nambari kuu ya quantum inafafanua ukubwa wa jumla na nishati ya orbital. Thamani ya l inataja sura ya orbital. Orbitals na thamani sawa ya l kuunda subshell. Kwa kuongeza, idadi kubwa ya kasi ya angular, zaidi ni kasi ya angular ya elektroni katika orbital hii.
Orbitals na l = 0 huitwa s orbitals (au s subshells). Thamani l = 1 inalingana na orbitals p. Kwa n iliyotolewa, p orbitals hufanya p subshell (kwa mfano, 3 p kama n = 3). Orbitals na l = 2 huitwa orbitals d, ikifuatiwa na f-, g-, na h- orbitals kwa l = 3, 4, 5, na kuna maadili ya juu ambayo hatuwezi kuzingatia.
Kuna umbali fulani kutoka kiini ambako uwezekano wiani wa kutafuta elektroni iko kwenye orbital fulani ni sifuri. Kwa maneno mengine, thamani ya wimbi ni sifuri kwa umbali huu kwa orbital hii. Thamani hiyo ya radius r inaitwa node ya radial. Idadi ya nodes radial katika orbital ni n — l — 1.
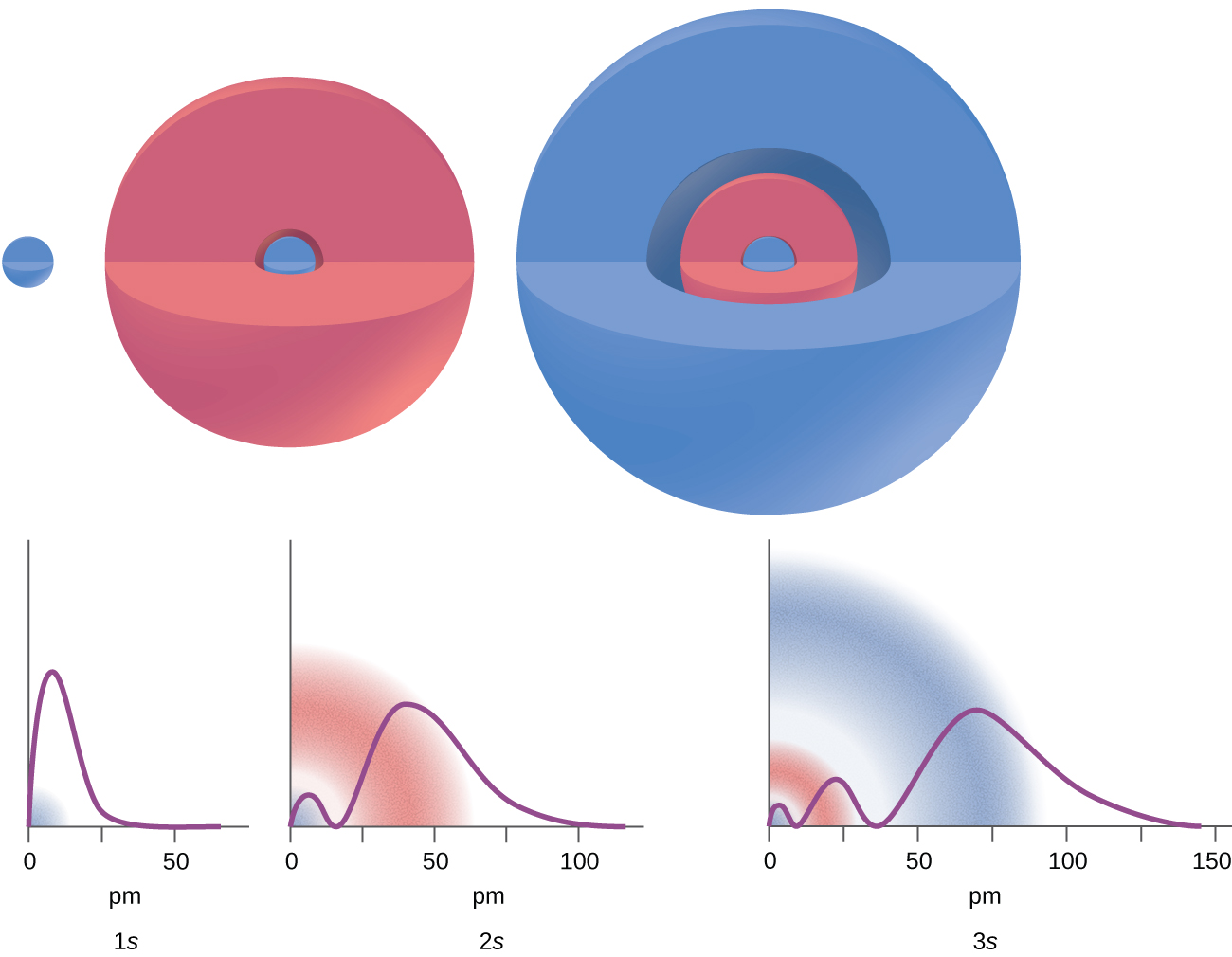
Fikiria mifano katika Kielelezo\(\PageIndex{7}\). Orbitals iliyoonyeshwa ni ya aina ya s, hivyo l = 0 kwa wote. Inaweza kuonekana kutoka kwenye grafu ya msongamano wa uwezekano kwamba kuna 1 — 0 — 1 = 0 mahali ambapo wiani ni sifuri (nodes) kwa 1 s (n = 1), 2 - 0 - 1 = 1 nodi kwa 2 s, na 3 - 0 - 1 = 2 nodes kwa orbitals 3 s.
Usambazaji wa wiani wa elektroni ni spherical na p subshell ina sura ya dumbbell. Orbitals d na f ni ngumu zaidi. Maumbo haya yanawakilisha mikoa tatu-dimensional ndani ambayo elektroni inawezekana kupatikana.
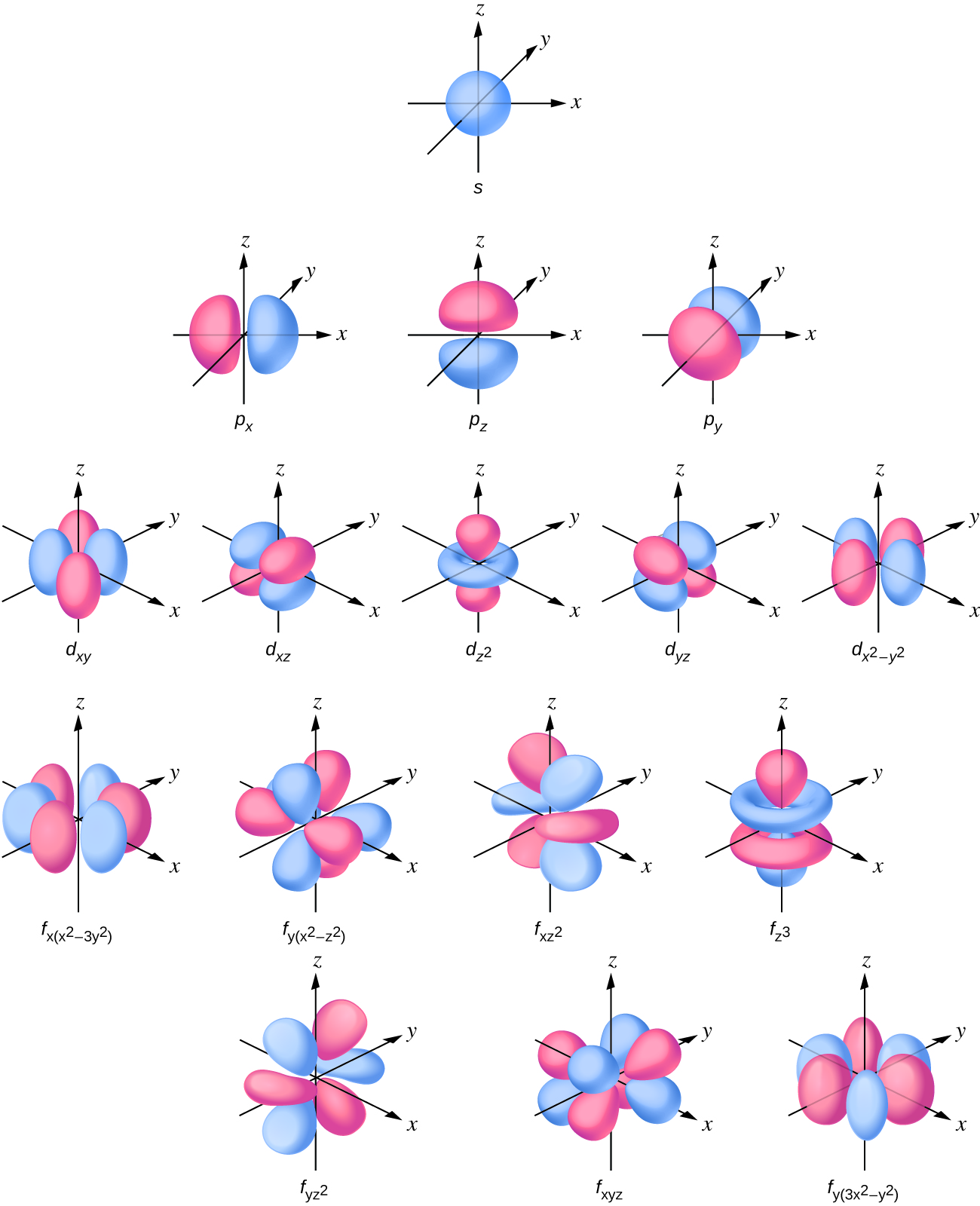
Ikiwa elektroni ina kasi ya angular (l ∙ 0), basi vector hii inaweza kuelezea kwa njia tofauti. Kwa kuongeza, sehemu ya z ya kasi ya angular inaweza kuwa na thamani zaidi ya moja. Hii inamaanisha kwamba ikiwa uwanja wa magnetic unatumiwa katika mwelekeo wa z, orbitals yenye maadili tofauti ya sehemu ya z ya kasi ya angular itakuwa na nguvu tofauti zinazosababishwa na kuingiliana na shamba. Nambari ya quantum ya magnetic , inayoitwa m l, inataja sehemu ya z ya kasi ya angular kwa orbital fulani. Kwa mfano, kwa s orbital, l = 0, na thamani pekee ya m l ni sifuri. Kwa orbitals p, l = 1, na m l inaweza kuwa sawa na -1, 0, au +1. Kwa ujumla, m l inaweza kuwa sawa na — l, — (l — 1),..., -1, 0, +1,..., (l — 1), l. Idadi ya orbitals iwezekanavyo na thamani sawa ya l (subshell) ni 2 l + 1. Kwa hiyo, kuna s -orbital moja kwa ml = 0, kuna tatu p -orbitals kwa ml = 1, tano d -orbitals kwa ml = 2, saba f -orbitals kwa ml = 3, na kadhalika. Nambari kuu ya quantum inafafanua thamani ya jumla ya nishati ya umeme. Nambari ya quantum ya kasi ya angular huamua sura ya orbital. Na idadi ya magnetic quantum inabainisha mwelekeo wa orbital katika nafasi, kama inavyoonekana katika Kielelezo\(\PageIndex{7}\).
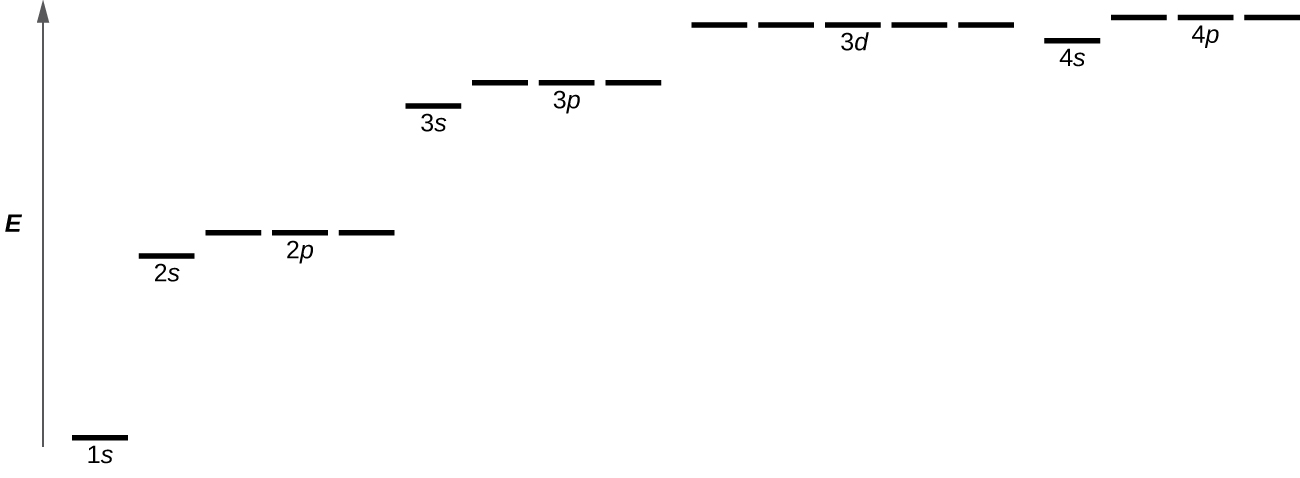
Kielelezo\(\PageIndex{8}\) unaeleza viwango vya nishati kwa orbitals mbalimbali. Nambari kabla ya jina la orbital (kama vile 2 s, 3 p, na kadhalika) inasimama kwa idadi kuu ya quantum, n. Barua katika jina la orbital inafafanua subshell na idadi maalum ya angular kasi ya quantum l = 0 kwa s orbitals, 1 kwa p orbitals, 2 kwa d orbitals. Hatimaye, kuna orbitals zaidi ya moja iwezekanavyo kwa l ≥ 1, kila sambamba na thamani maalum ya m l. Katika kesi ya atomi ya hidrojeni au ioni moja ya elektroni (kama vile Yeye +, Li 2 +, na kadhalika), nguvu za orbitals zote zilizo na n sawa ni sawa. Hii inaitwa kuzorota, na viwango vya nishati kwa idadi sawa ya quantum kuu, n, huitwa viwango vya nishati vinavyoharibika. Hata hivyo, katika atomi zilizo na elektroni zaidi ya moja, upunguvu huu huondolewa na mwingiliano wa elektroni-elektroni, na orbitali ambazo ni za subshells tofauti zina nguvu tofauti. Orbitals ndani ya subshell sawa (kwa mfano ns, np, nd, nf, kama 2 p, 3 s) bado ni degenerate na kuwa na nishati sawa.
Wakati namba tatu za quantum zilizojadiliwa katika aya zilizopita zinafanya kazi vizuri kwa kuelezea orbitals za elektroni, baadhi ya majaribio yalionyesha kuwa hawakuwa wa kutosha kueleza matokeo yote yaliyoonekana. Ilionyeshwa katika miaka ya 1920 kwamba wakati spectra ya hidrojeni ya mstari inachunguzwa kwa azimio la juu sana, baadhi ya mistari ni kweli sio peaks moja lakini, badala yake, jozi ya mistari ya karibu. Hii ni kinachojulikana kama muundo mzuri wa wigo, na inamaanisha kuwa kuna tofauti ndogo zaidi katika nguvu za elektroni hata wakati ziko katika orbital sawa. Uchunguzi huu ulisababisha Samuel Goudsmit na George Uhlenbeck kupendekeza kwamba elektroni zina namba ya nne ya quantum. Waliita hii namba ya quantum ya spin, au m s.
Nambari nyingine tatu za quantum, n, l, na m l, ni mali ya orbitals maalum ya atomiki ambayo pia hufafanua katika sehemu gani ya nafasi elektroni inawezekana kuwa iko. Orbitals ni matokeo ya kutatua equation Schrödinger kwa elektroni katika atomi. Spin ya elektroni ni aina tofauti ya mali. Ni jambo la quantum kabisa na hakuna analogues katika eneo la classical. Kwa kuongeza, haiwezi kutokana na kutatua equation ya Schrödinger na haihusiani na viwianishi vya kawaida vya anga (kama vile x, y, na z). Spin ya elektroni inaelezea elektroni ya ndani “mzunguko” au “inazunguka.” Kila elektroni hufanya kazi kama sumaku ndogo au kitu kidogo cha kupokezana na kasi ya angular, ingawa mzunguko huu hauwezi kuzingatiwa katika suala la kuratibu anga.
Ukubwa wa spin ya jumla ya elektroni inaweza kuwa na thamani moja tu, na elektroni inaweza tu “spin” katika moja ya majimbo mawili yaliyohesabiwa. Moja inaitwa hali α, na sehemu ya z ya spin kuwa katika mwelekeo mzuri wa mhimili z. Hii inalingana na idadi ya quantum ya spin\(m_s=\dfrac{1}{2}\). Nyingine inaitwa hali β, na sehemu z ya spin kuwa hasi na\(m_s=−\dfrac{1}{2}\). Electron yoyote, bila kujali orbital ya atomiki iko, inaweza tu kuwa na moja ya maadili hayo mawili ya nambari ya quantum ya spin. Nguvu za elektroni zilizo\(m_s=−\dfrac{1}{2}\) na\(m_s=\dfrac{1}{2}\) tofauti ikiwa shamba la nje la magnetic linatumika.
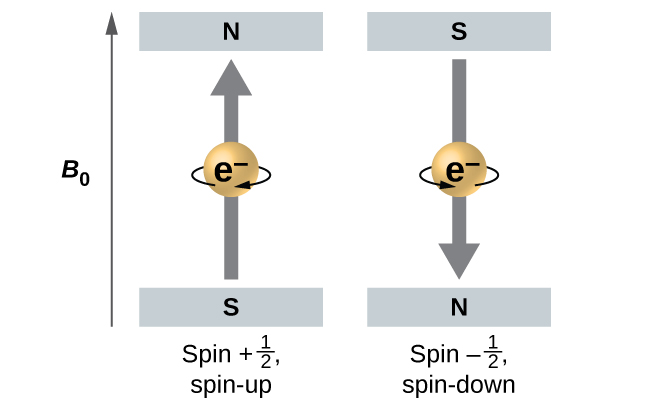
Kielelezo\(\PageIndex{9}\) unaeleza jambo hili. Electroni hufanya kama sumaku ndogo. Muda wake unaelekezwa juu (katika mwelekeo mzuri wa mhimili wa z) kwa idadi ya quantum ya\(\dfrac{1}{2}\) spin na chini (katika mwelekeo mbaya z) kwa idadi ya quantum ya spin\(−\ce{1/2}\). Sumaku ina nishati ya chini ikiwa wakati wake wa magnetic unaendana na shamba la nje la magnetic (elektroni ya kushoto) na nishati ya juu kwa wakati wa magnetic kuwa kinyume na shamba lililotumika. Hii ni kwa nini elektroni na\(m_s=\dfrac{1}{2}\) ina nishati kidogo chini katika uwanja wa nje katika mwelekeo chanya z, na elektroni na\(m_s=−\dfrac{1}{2}\) ina nishati ya juu kidogo katika uwanja huo. Hii ni kweli hata kwa elektroni inayotumia orbital ileile katika atomu. Mstari wa spectral unaohusiana na mpito kwa elektroni kutoka kwa orbital sawa lakini kwa namba tofauti za quantum ina maadili mawili iwezekanavyo ya nishati; hivyo, mstari katika wigo utaonyesha muundo mzuri wa kugawanyika.
Kanuni ya Kutengwa kwa Pauli
Electron katika atomi inaelezewa kabisa na namba nne za quantum: n, l, m l, na m s. Nambari tatu za kwanza za quantum zinafafanua orbital na nambari ya nne ya quantum inaelezea mali ya elektroni ya ndani inayoitwa spin. Mwanafizikia wa Austria Wolfgang Pauli aliandaa kanuni ya jumla inayotoa kipande cha mwisho cha habari ambacho tunahitaji kuelewa tabia ya jumla ya elektroni katika atomi. Kanuni ya kutengwa kwa Pauli inaweza kuundwa kama ifuatavyo: Hakuna elektroni mbili katika atomu moja zinaweza kuwa na seti sawa ya namba zote nne za quantum. Hii inamaanisha kwamba elektroni zinaweza kushiriki orbital sawa (seti sawa ya namba za quantum n, l, na m l), lakini tu ikiwa namba zao za quantum za spin m zina maadili tofauti. Kwa kuwa namba ya quantum ya spin inaweza kuwa na maadili mawili tu\(\left(±\dfrac{1}{2}\right)\), si zaidi ya elektroni mbili zinaweza kuchukua orbital sawa (na kama elektroni mbili ziko katika orbital sawa, lazima ziwe na spins kinyume). Kwa hiyo, orbital yoyote ya atomiki inaweza kuwa na wakazi na elektroni tu, moja, au mbili. Mali na maana ya idadi ya quantum ya elektroni katika atomi ni muhtasari kwa ufupi katika Jedwali\(\PageIndex{1}\).
| Jina | Mkono | Maadili ya kuruhusiwa | Maana ya kimwili |
|---|---|---|---|
| nambari kuu ya quantum | n | 1, 2, 3, 4,... | shell, mkoa wa jumla kwa thamani ya nishati kwa ajili ya elektroni juu ya orbital |
| kasi ya angular au idadi ya azimuthal quantum | l | 0 ≤ l ≤ n — 1 | subshell, sura ya orbital |
| idadi ya magnetic quantum | m l | — l ≤ m l ≤ l | mwelekeo wa orbital |
| spin idadi quantum | m s | \(\dfrac{1}{2},\:−\dfrac{1}{2}\) | mwelekeo wa quantum ya ndani “inazunguka” ya elektroni |
Eleza idadi ya subshells, idadi ya orbitals katika kila subshell, na maadili ya l na m l kwa orbitals katika n = 4 shell ya atomi.
Suluhisho
Kwa n = 4, l inaweza kuwa na maadili ya 0, 1, 2, na 3. Hivyo, s, p, d, na f subshells hupatikana katika n = 4 shell ya atomi. Kwa l = 0 (s subshell), m l inaweza tu kuwa 0. Kwa hiyo, kuna moja tu ya 4 s orbital. Kwa l = 1 (p -aina orbitals), m unaweza kuwa na maadili ya -1, 0, +1, hivyo sisi kupata tatu 4 p orbitals. Kwa l = 2 (d -aina orbitals), m l inaweza kuwa na maadili ya -2, -1, 0, +1, +2, hivyo tuna tano 4 d orbitals. Wakati l = 3 (f -aina orbitals), m l unaweza kuwa na maadili ya -3, -2, -1, 0, +1, +2, +3, na tunaweza kuwa na saba 4 f orbitals. Hivyo, tunapata jumla ya orbitals 16 katika n = 4 shell ya atomi.
Tambua subshell ambayo elektroni na namba zifuatazo za quantum zinapatikana:
- n = 3, l = 1;
- n = 5, l = 3;
- n = 2, l = 0.
- Jibu
-
3 p
- Jibu b
-
50 g
- Jibu c
-
2s
Tumia idadi kubwa ya elektroni ambayo inaweza kuchukua shell na (a) n = 2, (b) n = 5, na (c) n kama kutofautiana. Kumbuka wewe ni kuangalia tu orbitals na maalum n thamani, si wale walio na nguvu ya chini.
Suluhisho
(a) Wakati n = 2, kuna orbitals nne (moja 2 s orbital, na orbitals tatu kinachoitwa 2 p). Orbitali hizi nne zinaweza kuwa na elektroni nane.
(b) Wakati n = 5, kuna subshells tano za orbitals ambazo tunahitaji jumla:
&\ njozi {+}\ maandishi {1 orbital kinachoitwa} 5s\\
&\ Phantom {+}\ textrm {3 orbitals kinachoitwa} 5p\\
&\ njozi {+}\ maandishi {+}\ maandishi {5 orbitals kinachoitwa} 5d\\
&\ Phantom {+}\ maandishi {7 orbitals kinachoitwa} 5f\\
&\ kusisitiza {+\ maandishi {9 orbitals kinachoitwa} 5g}\\
&\,\ textrm {25 orbitals jumla}
\ mwisho {align*}\)
Tena, kila orbital ina elektroni mbili, hivyo elektroni 50 zinaweza kufaa katika ganda hili.
(c) Idadi ya orbitals katika shell yoyote n itakuwa sawa n 2. Kunaweza kuwa na elektroni mbili katika kila orbital, hivyo idadi kubwa ya elektroni itakuwa 2 × n 2
Ikiwa shell ina kiwango cha juu cha elektroni 32, ni nambari gani kuu ya quantum, n?
- Jibu
-
n = 4
Jaza meza ifuatayo kwa orbitals ya atomiki:
| Orbital | n | l | m l kuzorota | Nodes za radial (hapana.) |
|---|---|---|---|---|
| 4 g | ||||
| 4 | 1 | |||
| 7 | 7 | 3 | ||
| 5 d |
Suluhisho
Jedwali linaweza kukamilika kwa kutumia sheria zifuatazo:
- Uteuzi wa orbital ni nl, ambapo l = 0, 1, 2, 3, 4, 5,... ni ramani kwa mlolongo wa barua s, p, d, f, g, h,...,
- Ukosefu wa m l ni idadi ya orbitals ndani ya l subshell, na hivyo ni 2 l + 1 (kuna moja s orbital, tatu p orbitals, tano d orbitals, saba f orbitals, na kadhalika).
- Idadi ya nodes radial ni sawa na n — l — 1.
| Orbital | n | l | m l kuzorota | Nodes za radial (hapana.) |
|---|---|---|---|---|
| 4 g | 4 | 3 | 7 | 0 |
| 4 p | 4 | 1 | 3 | 2 |
| 7 g | 7 | 3 | 7 | 3 |
| 5 d | 5 | 2 | 5 | 2 |
Ni njia ngapi ambazo zina l = 2 na n = 3?
- Jibu
-
tano degenerate 3 d orbitals
Muhtasari
Vitu vya macroscopic hufanya kama chembe Vitu vya microscopic (kama vile elektroni) vina mali ya chembe na wimbi. Trajectories yao halisi haiwezi kuamua. Mfano wa mitambo ya quantum wa atomi unaelezea msimamo wa tatu-dimensional wa elektroni kwa namna ya uwezekano kulingana na kazi ya hisabati inayoitwa wavefunction, mara nyingi inaashiria kama. Kazi za mawimbi ya atomiki pia huitwa orbitals. Ukubwa wa mraba wa kazi ya wimbi inaelezea usambazaji wa uwezekano wa kupata elektroni katika eneo fulani katika nafasi. Kwa hiyo orbitali atomia huelezea maeneo katika atomu ambako elektroni zina uwezekano mkubwa wa kupatikana.
Orbital ya atomiki ina sifa ya namba tatu za quantum. Nambari kuu ya quantum, n, inaweza kuwa integer yoyote nzuri. Eneo la jumla kwa thamani ya nishati ya orbital na umbali wa wastani wa elektroni kutoka kiini ni kuhusiana na n. Orbitals kuwa thamani sawa ya n inasemekana kuwa katika ganda moja. Angular kasi quantum idadi, l, inaweza kuwa na thamani yoyote integer kutoka 0 kwa n - 1. Nambari hii ya quantum inaelezea sura au aina ya orbital. Orbitals na idadi sawa ya quantum na thamani sawa l ni mali ya subshell sawa. Nambari ya quantum ya magnetic, m l, na 2 l + maadili ya 1 kuanzia — l hadi + l, inaelezea mwelekeo wa orbital katika nafasi. Aidha, kila elektroni ina idadi ya quantum ya spin, m s, ambayo inaweza kuwa sawa na\(±\dfrac{1}{2}\). Hakuna elektroni mbili katika atomi moja zinaweza kuwa na seti sawa ya maadili kwa namba zote nne za quantum.
faharasa
- angular kasi quantum idadi (l)
- nambari ya quantum kutofautisha maumbo tofauti ya orbitals; pia ni kipimo cha kasi ya angular ya orbital
- atomiki orbital
- kazi ya hisabati inayoelezea tabia ya elektroni katika atomu (pia inaitwa wimbi la mawimbi), inaweza kutumika kupata uwezekano wa kupata elektroni katika eneo maalumu karibu na kiini, pamoja na vigezo vingine vya nguvu
- d orbital
- kanda ya nafasi yenye wiani wa juu wa elektroni yaani ama nne lobed au ina dumbbell na torus sura; inaelezea orbitals na l = 2. Electron katika orbital hii inaitwa elektroni d
- wiani wa elektroni
- kipimo cha uwezekano wa kupata elektroni katika eneo fulani la nafasi, ni sawa na thamani kamili ya mraba ya kazi ya wimbi
- f orbital
- eneo la multilobed la nafasi na wiani wa juu wa elektroni, inaelezea orbitals na l = 3. Electroni katika orbital hii inaitwa an f electron
- Heisenberg kutokuwa na uhakika kanuni
- utawala na kusema kwamba haiwezekani kuamua hasa mali zote mbili zinazojumuisha nguvu kama vile kasi na nafasi ya chembe kwa wakati mmoja. Kanuni ya kutokuwa na uhakika ni matokeo ya chembe za quantum zinazoonyesha duality ya wimbi-chembe
- idadi ya quantum ya magnetic (m l)
- nambari ya quantum inayoashiria mwelekeo wa orbital ya atomiki karibu na kiini; orbitals yenye maadili tofauti ya m l lakini thamani sawa ya l ina nishati sawa (hupungua), lakini uharibifu huu unaweza kuondolewa kwa matumizi ya magnetic ya nje uwanja
- p orbital
- Eneo la umbo la dumbbell la nafasi na wiani wa juu wa elektroni, inaelezea orbitals na l = 1. Electroni katika orbital hii inaitwa p elektroni
- Kanuni ya kutengwa kwa Pauli
- inabainisha kuwa hakuna elektroni mbili katika atomi zinaweza kuwa na thamani sawa kwa namba zote nne za quantum
- nambari kuu ya quantum (n)
- idadi quantum kubainisha shell elektroni inachukuwa katika atomi
- quantum mechanics
- uwanja wa utafiti kuwa ni pamoja na quantization ya nishati, wimbi-chembe duality, na Heisenberg uhakika kanuni kuelezea jambo
- s orbital
- eneo la spherical ya nafasi na wiani wa juu wa elektroni, inaelezea orbitals na l = 0. Electroni katika orbital hii inaitwa an s elektroni
- ganda
- seti ya orbitals na idadi sawa ya quantum kuu, n
- spin idadi quantum (m s)
- idadi ya kubainisha elektroni spin mwelekeo, ama\(+\dfrac{1}{2}\) au\(−\dfrac{1}{2}\)
- subshell
- seti ya orbitals katika atomi na maadili sawa ya n na l
- kazi ya wimbi ()
- maelezo ya hisabati ya orbital atomiki inayoelezea sura ya orbital; inaweza kutumika kuhesabu uwezekano wa kutafuta elektroni mahali popote katika orbital, pamoja na vigezo vya nguvu kama vile nishati na kasi ya angular


