6.2: Mfano wa Bohr
- Page ID
- 176139
- Eleza mfano wa Bohr wa atomi ya hidrojeni
- Tumia equation ya Rydberg kuhesabu nguvu za mwanga lilio au kufyonzwa na atomi za hidrojeni.
Kufuatia kazi ya Ernest Rutherford na wenzake mwanzoni mwa karne ya ishirini, picha ya atomi yenye viini vidogo vidogo vilivyozungukwa na elektroni nyepesi na hata vidogo vilivyoendelea kusonga juu ya kiini ilianzishwa vizuri. Picha hii iliitwa mfano wa sayari, kwani ilionyesha atomi kama “mfumo wa jua” miniature na elektroni zinazozunguka kiini kama sayari zinazozunguka jua. Atomi rahisi ni hidrojeni, yenye protoni moja kama kiini ambacho elektroni moja inakwenda. Nguvu ya umeme inayovutia elektroni kwenye protoni inategemea tu umbali kati ya chembe hizo mbili.
\[ F_{gravity} = G \dfrac{ m_1 m_2}{r^2} \nonumber \]
na
- \(G\)ni mara kwa mara ya mvuto
- \(m_1\)na\(m_2\) ni raia wa chembe 1 na 2, kwa mtiririko huo
- \(r\)ni umbali kati ya chembe mbili
Nguvu ya umeme ina umbo sawa na nguvu ya mvuto kati ya chembe mbili za masi isipokuwa kuwa nguvu ya umeme inategemea ukubwa wa mashtaka kwenye chembe (+1 kwa protoni na -1 kwa elektroni) badala ya ukubwa wa raia wa chembe zinazotawala mvuto nguvu.
\[ F_{electrostatic} = k \dfrac{ m_1 m_2}{r^2} \nonumber \]
na
- \(k\)ni mara kwa mara
- \(m_1\)na\(m_2\) ni raia wa chembe 1 na 2, kwa mtiririko huo
- \(r\)ni umbali kati ya chembe mbili
Kwa kuwa majeshi yanaweza kupatikana kutokana na uwezekano, ni rahisi kufanya kazi na uwezekano badala yake, kwa kuwa ni aina ya nishati. Uwezo wa umeme pia huitwa uwezo wa Coulomb. Kwa sababu uwezo wa umeme una fomu sawa na uwezo wa mvuto, kulingana na mechanics ya classical, milinganyo ya mwendo inapaswa kuwa sawa, na elektroni inayozunguka kiini katika mzunguko wa mviringo au mviringo (hivyo studio “sayari” mfano wa atomi). Uwezekano wa fomu V (r) ambayo inategemea tu umbali wa radial\(r\) inajulikana kama uwezekano wa kati. Uwezekano wa kati una ulinganifu wa spherical, na hivyo badala ya kubainisha nafasi ya elektroni katika kuratibu za kawaida za Cartesian (x, y, z), ni rahisi zaidi kutumia viwianishi vya mviringo vya polar vinazingatia kiini, kilicho na kuratibu linear r na mbili kuratibu angular, kwa kawaida maalum na barua Kigiriki theta (η) na phi (Φ). Kuratibu hizi ni sawa na zile zinazotumiwa katika vifaa GPS na simu nyingi smart kwamba kufuatilia nafasi juu ya yetu (karibu) dunia spherical, na mbili kuratibu angular maalum na latitude na latitude, na linear kuratibu maalum na mwinuko wa ngazi ya bahari. Kwa sababu ya ulinganifu wa spherical wa uwezo wa kati, nishati na kasi ya angular ya atomi ya hidrojeni ya kawaida ni mara kwa mara, na njia zinakabiliwa na uongo katika ndege kama sayari zinazozunguka jua. Hii classical mechanics maelezo ya atomi haujakamilika, hata hivyo, kwa kuwa elektroni kusonga katika obiti elliptical itakuwa kasi (kwa kubadilisha mwelekeo) na, kulingana na electromagnetism classical, ni lazima kuendelea emit mionzi ya umeme. Hasara hii katika nishati orbital lazima kusababisha obiti ya elektroni kupata daima ndogo mpaka inazunguka ndani ya kiini, ikimaanisha kuwa atomi ni asili imara.
Katika 1913, Niels Bohr alijaribu kutatua kitendawili atomiki kwa kupuuza utabiri wa electromagnetism classical kwamba elektroni inayozunguka katika hidrojeni ingeendelea kutoa mwanga. Badala yake, yeye kuingizwa katika classical mechanics maelezo ya mawazo ya atomi Planck ya quantization na kutafuta Einstein kwamba mwanga lina photons ambao nishati ni sawia na frequency yao. Bohr alidhani kuwa elektroni inayozunguka kiini bila kawaida emit mionzi yoyote (hali ya stationary hypothesis), lakini ingekuwa emit au kunyonya fotoni kama kuhamia obiti tofauti. Nishati iliyofyonzwa au iliyotolewa ingeonyesha tofauti katika nguvu za orbital kulingana na equation hii:
\[ |ΔE|=|E_f−E_i|=h u=\dfrac{hc}{\lambda} \label{6.3.1} \]
Katika equation hii, h ni mara kwa mara ya Planck na E i na E f ni nguvu za awali na za mwisho za orbital, kwa mtiririko huo. Thamani kamili ya tofauti ya nishati hutumiwa, kwani frequency na wavelengths daima ni chanya. Badala ya kuruhusu maadili ya kuendelea kwa kasi ya angular, nishati, na mzunguko radius, Bohr alidhani kuwa maadili pekee ya haya yanaweza kutokea (kwa kweli, quantizing yoyote ya hizi ingekuwa kuashiria kwamba wengine wawili pia ni quantized). Maneno ya Bohr kwa nguvu zilizohesabiwa ni:
\[E_n=−\dfrac{k}{n^2} \label{6.3.2} \]
na\(n=1,2,3, ...\)
Katika maneno haya,\(k\) ni mara kwa mara inahusu constants msingi kama vile molekuli elektroni na malipo na mara kwa mara Planck ya. Kuingiza kujieleza kwa nguvu obiti katika equation kwa\(ΔE\) anatoa
\[ \color{red} ΔE=k \left(\dfrac{1}{n^2_1}−\dfrac{1}{n_2^2}\right)=\dfrac{hc}{\lambda} \label{6.3.3} \]
au
\[ \dfrac{1}{\lambda}=\dfrac{k}{hc} \left(\dfrac{1}{n^2_1}−\dfrac{1}{n_2^2}\right) \label{6.3.4} \]
Viwango vya chini vya nishati vichache vinaonyeshwa kwenye Kielelezo\(\PageIndex{1}\). Moja ya sheria za msingi za fizikia ni kwamba jambo ni imara zaidi na nishati ya chini kabisa iwezekanavyo. Hivyo, elektroni katika atomu ya hidrojeni huenda kwa kawaida katika\(n = 1\) obiti, obiti ambayo ina nishati ya chini kabisa. Wakati elektroni iko katika obiti hii ya chini kabisa ya nishati, atomu inasemekana kuwa katika hali yake ya umeme ya ardhi (au hali tu ya ardhi). Ikiwa atomu inapokea nishati kutoka chanzo cha nje, inawezekana kwa elektroni kuhamia obiti yenye\(n\) thamani ya juu na atomi sasa iko katika hali ya umeme ya msisimko (au tu hali ya msisimko) yenye nishati ya juu. Wakati mabadiliko ya elektroni kutoka hali ya msisimko (juu ya nishati obiti) kwa hali ya chini ya msisimko, au hali ya ardhi, tofauti katika nishati hutolewa kama photon. Vile vile, ikiwa photon inafyonzwa na atomi, nishati ya photon husababisha elektroni kutoka kwenye obiti ya chini ya nishati hadi moja ya msisimko zaidi.
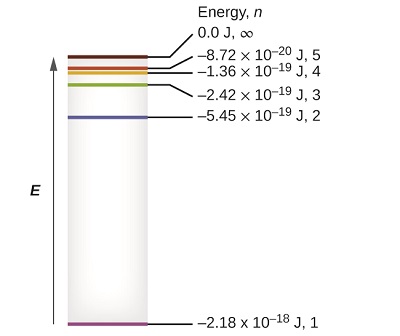
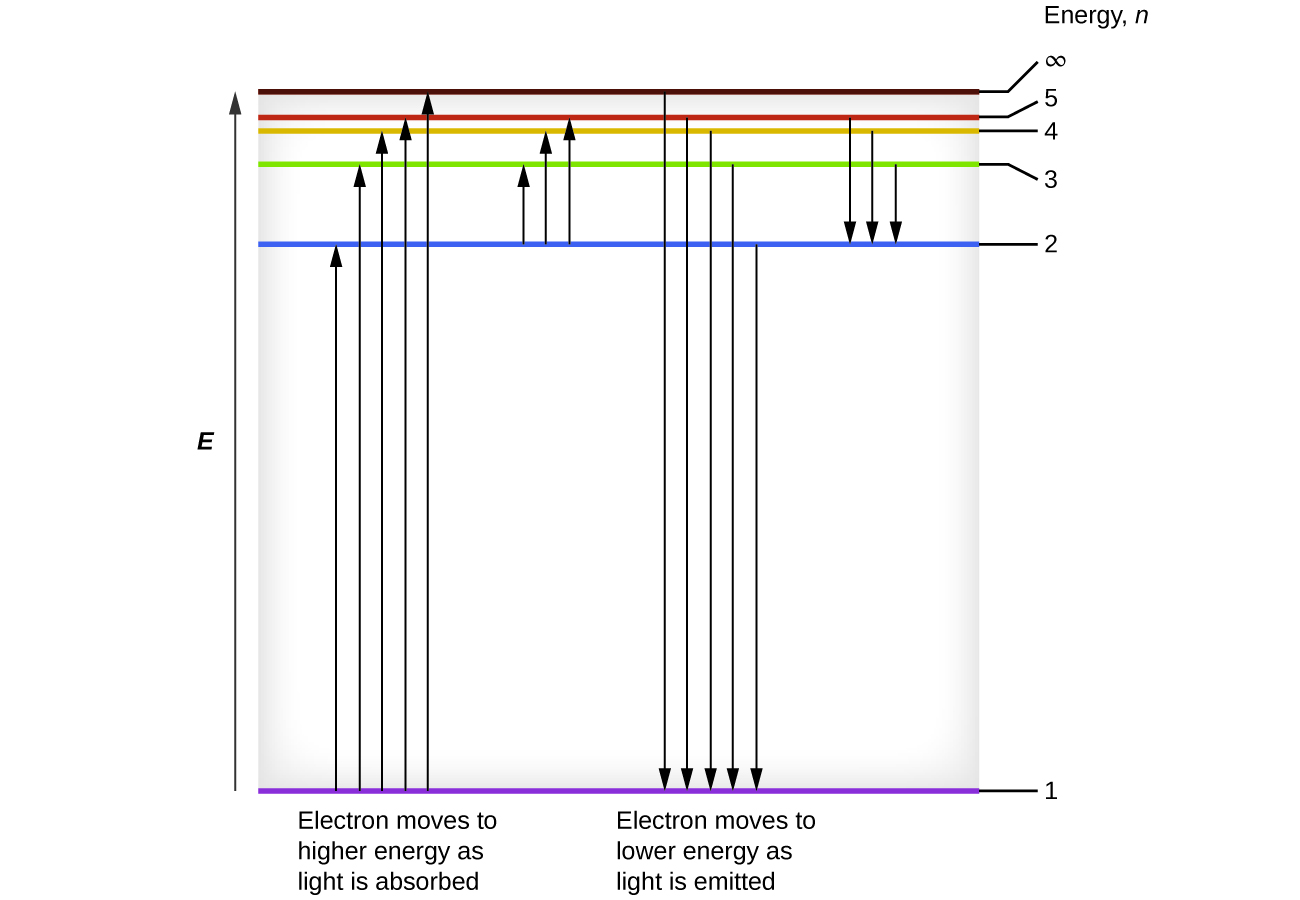
Tunaweza kuhusisha nishati ya elektroni katika atomi na yale tuliyojifunza hapo awali kuhusu nishati. Sheria ya uhifadhi wa nishati inasema kwamba hatuwezi kuunda wala kuharibu nishati. Hivyo, kama kiasi fulani cha nishati ya nje inahitajika kusisimua elektroni kutoka ngazi moja ya nishati hadi nyingine, kiasi hicho cha nishati kitatolewa wakati elektroni inarudi kwenye hali yake ya awali (Kielelezo\(\PageIndex{2}\)). Kwa kweli atomu inaweza “kuhifadhi” nishati kwa kuitumia kukuza elektroni kwa hali yenye nishati ya juu na kuitoa wakati elektroni inarudi hali ya chini. Nishati inaweza kutolewa kama quantum moja ya nishati, kama elektroni inarudi kwenye hali yake ya ardhi (\(n = 5\)kwa mfano, kutoka kwa\(n = 1\)), au inaweza kutolewa kama quanta mbili au zaidi ndogo kama elektroni iko kwenye hali ya kati, kisha kwa hali ya ardhi (sema, kutoka\(n = 5\) kwa\(n = 4\), kutotoa moja quantum, basi\(n = 1\), kutotoa quantum pili).
Kwa kuwa mfano wa Bohr ulihusisha elektroni moja tu, inaweza pia kutumika kwa ions moja ya elektroni Yeye +, Li 2 +, Kuwa 3 +, na kadhalika, ambayo hutofautiana na hidrojeni tu katika mashtaka yao ya nyuklia, na hivyo atomi moja ya elektroni na ions ni pamoja inajulikana kama atomi hidrojeni kama au hidrojeni. Nishati kujieleza kwa atomi hidrojeni - generalization ya hidrojeni atomi nishati, ambayo\(Z\) ni malipo ya nyuklia (+1 kwa hidrojeni, +2 kwa He, +3 kwa Li, na kadhalika) na\(k\) ina thamani ya\(2.179 \times 10^{–18}\; J\).
\[ \color{red} E_n=−\dfrac{kZ^2}{n^2} \label{6.3.5} \]
Ukubwa wa mizunguko ya mviringo kwa atomi kama hidrojeni hutolewa kwa suala la radii yao kwa maneno yafuatayo, ambayo\(a_o\) ni mara kwa mara inayoitwa radius Bohr, yenye thamani ya\(5.292 \times 10^{−11}\; m\):
\[ \color{red} r=\dfrac{n^2}{Z} a_0 \label{6.3.6} \]
Equation pia inatuonyesha kwamba kadiri nishati ya elektroni\(n\) inavyoongezeka (kama inavyoongezeka), elektroni hupatikana kwa umbali mkubwa kutoka kiini. Hii inamaanisha utegemezi wa kinyume\(r\) katika uwezo wa Coulomb, kwa kuwa, kama elektroni inakwenda mbali na kiini, mvuto wa umeme kati yake na kiini hupungua, na hufanyika chini sana katika atomi. Kumbuka kuwa kama\(n\) inakuwa kubwa na orbits kupata kubwa, nguvu zao kupata karibu na sifuri, na hivyo mipaka\(n⟶∞\) na\(r⟶∞\) kuashiria kwamba\(E = 0\) sambamba na kikomo ionization ambapo elektroni ni kuondolewa kabisa kutoka kiini. Hivyo, kwa hidrojeni katika hali ya ardhi\(n = 1\), nishati ya ionization itakuwa:
\[ ΔE=E_{n⟶∞} −E_1=0+k=k \label{6.3.7} \]
Kwa paradoxes tatu za kushangaza sana sasa kutatuliwa (mionzi ya blackbody, athari ya photoelectric, na atomi ya hidrojeni), na yote yanayohusisha mara kwa mara ya Planck kwa namna ya msingi, ikawa wazi kwa wanafizikia wengi wakati huo kwamba nadharia za kawaida zilizofanya kazi vizuri katika ulimwengu wa macroscopic zilikuwa kimsingi kiujanja na hakuweza kupanuliwa chini katika uwanja microscopic ya atomi na molekuli. Kwa bahati mbaya, licha ya mafanikio ya ajabu Bohr katika deriving kujieleza kinadharia kwa mara kwa mara Rydberg, hakuweza kupanua nadharia yake kwa atomi ijayo rahisi, Yeye, ambayo tu ina elektroni mbili. Bohr mfano ilikuwa vibaya sana, kwa kuwa bado ni msingi wa classical mechanics dhana ya orbits sahihi, dhana ambayo baadaye kupatikana katika uwanja microscopic, wakati ilianzishwa mfano sahihi wa quantum mechanics supersede classical mechanics.
Watafiti wa awali walifurahi sana walipoweza kutabiri nishati ya elektroni kwa umbali fulani kutoka kiini katika atomu ya hidrojeni. Ikiwa cheche inakuza elektroni katika atomi ya hidrojeni kuwa obiti na\(n = 3\), ni nishati gani iliyohesabiwa, katika joules, ya elektroni?
Suluhisho
Nishati ya elektroni hutolewa na Equation\(\ref{6.3.5}\):
\[ E=\dfrac{−kZ^2}{n^2} \nonumber \]
Nambari ya atomiki\(Z\),, ya hidrojeni ni 1\(k = 2.179 \times 10^{–18}\; J\);; na elektroni ina sifa ya thamani n ya\(3\). Hivyo,
\[E=\dfrac{−(2.179 \times 10^{−18}\;J)×(1)^2}{(3)^2}=−2.421 \times 10^{−19}\;J \nonumber \]
Electron katika Mfano\(\PageIndex{1}\) katika\(n=3\) hali inakuzwa hata zaidi kwa obiti na\(n = 6\). Nishati yake mpya ni nini?
- Jibu
-
TBD
Nishati (katika joules) na wavelength (katika mita) ya mstari katika wigo wa hidrojeni ambayo inawakilisha harakati ya elektroni kutoka obiti ya Bohr na n = 4 hadi obiti na n = 6? Katika sehemu gani ya wigo wa umeme tunapata mionzi hii?
Suluhisho
Katika kesi hiyo, elektroni huanza na\(n = 4\), hivyo\(n_1 = 4\). Inakuja kupumzika katika\(n = 6\) obiti, hivyo\(n_2 = 6\). Tofauti katika nishati kati ya majimbo mawili hutolewa kwa maneno haya:
\[ΔE=E_1−E_2=2.179 \times 10^{−18}\left(\dfrac{1}{n^2_1}−\dfrac{1}{n_2^2}\right) \nonumber \]
\[ΔE=2.179 \times 10^{−18} \left(\dfrac{1}{4^2}−\dfrac{1}{6^2}\right)\; J \nonumber \]
\[ΔE=2.179 \times 10^{−18} \left(\dfrac{1}{16}−\dfrac{1}{36}\right)\;J \nonumber \]
\[ΔE=7.566 \times 10^{−20}\;J \nonumber \]
Tofauti hii ya nishati ni chanya, kuonyesha photon inaingia kwenye mfumo (inafyonzwa) ili kusisimua elektroni kutoka kwenye obiti ya n = 4 hadi\(n = 6\) obiti. Urefu wa photon na nishati hii hupatikana kwa maneno\(E=hc \lambda\). Rearrangement inatoa:
\[ \lambda=\dfrac{hc}{E} \nonumber \]
Kutoka kwa takwimu ya mionzi ya umeme, tunaweza kuona kwamba wavelength hii inapatikana katika sehemu ya infrared ya wigo wa umeme.
Je! Ni nishati gani katika joules na wavelength katika mita za photon zinazozalishwa wakati elektroni inapoanguka kutoka\(n = 5\) hadi\(n = 3\) ngazi katika\(He^+\) ion (\(Z = 2\)kwa\(He^+\))?
- Jibu
-
\(6.198 \times 10^{–19}\; J\)na\(3.205 \times 10^{−7}\; m\)
Mfano wa Bohr wa atomi ya hidrojeni hutoa ufahamu juu ya tabia ya jambo katika ngazi ya microscopic, lakini haina akaunti kwa mwingiliano wa elektroni-elektroni katika atomi zenye elektroni zaidi ya moja. Inaanzisha vipengele kadhaa muhimu vya mifano yote inayotumiwa kuelezea usambazaji wa elektroni katika atomu. Makala haya ni pamoja na yafuatayo:
- Nguvu za elektroni (viwango vya nishati) katika atomi zinahesabiwa, zilizoelezwa na namba za quantum: namba integer zilizo na thamani maalum tu ya kuruhusiwa na kutumika kwa tabia ya mpangilio wa elektroni katika atomi.
- Nishati ya elektroni huongezeka kwa umbali unaoongezeka kutoka kiini.
- Nguvu za kipekee (mistari) katika spectra ya vipengele hutokana na nguvu za elektroniki zilizohesabiwa.
Kati ya vipengele hivi, muhimu zaidi ni postulate ya viwango vya nishati quantized kwa elektroni katika atomi. Matokeo yake, mfano huo uliweka msingi wa mfano wa mitambo ya quantum ya atomi. Bohr alishinda Tuzo ya Nobel katika Fizikia kwa michango yake katika uelewa wetu wa muundo wa atomi na jinsi hiyo inahusiana na uzalishaji wa spectra ya mstari.
Muhtasari
Bohr kuingizwa Planck na Einstein ya quantization mawazo katika mfano wa atomi hidrojeni kwamba kutatuliwa kitendawili ya utulivu atomi na kipekee spectra. Mfano wa Bohr wa atomi ya hidrojeni unaelezea uhusiano kati ya quantization ya photoni na chafu quantized kutoka atomi. Bohr alielezea atomi ya hidrojeni kwa suala la elektroni inayohamia katika obiti ya mviringo kuhusu kiini. Alidai kuwa elektroni ilikuwa imezuiwa kwa njia fulani zinazojulikana na nguvu za kipekee. Mabadiliko kati ya njia hizi za kuruhusiwa husababisha ngozi au uchafu wa photons. Wakati elektroni inapoondoka kwenye obiti ya juu-nishati hadi imara zaidi, nishati hutolewa kwa njia ya photon. Ili kuhamisha elektroni kutoka obiti imara hadi moja ya msisimko zaidi, photon ya nishati inapaswa kufyonzwa. Kutumia mfano wa Bohr, tunaweza kuhesabu nishati ya elektroni na radius ya obiti yake katika mfumo wowote wa elektroni.
faharasa
- Mfano wa Bohr wa atomi ya hidrojeni
- mfano wa kimuundo ambao elektroni huzunguka kiini tu katika njia za mviringo, kila mmoja na radius maalum ya kuruhusiwa; elektroni inayozunguka haina kawaida hutoa mionzi ya umeme, lakini inafanya hivyo wakati wa kubadilisha kutoka obiti moja hadi nyingine.
- hali ya msisimko
- hali ya kuwa na nishati kubwa kuliko nishati ya ardhi-hali
- hali ya ardhi
- hali ambayo elektroni katika chembe, ion, au molekuli na nishati ya chini iwezekanavyo
- idadi ya quantum
- idadi integer kuwa tu maalum kuruhusiwa maadili na kutumika tabia ya utaratibu wa elektroni katika atomi


