26.2: Doenças bacterianas do sistema nervoso
- Page ID
- 181688
Objetivos de
- Identifique as bactérias mais comuns que podem causar infecções do sistema nervoso
- Compare as principais características de doenças bacterianas específicas que afetam o sistema nervoso
As infecções bacterianas que afetam o sistema nervoso são graves e podem ser fatais. Felizmente, existem apenas algumas espécies bacterianas comumente associadas a infecções neurológicas.
Meningite bacteriana
A meningite bacteriana é uma das formas mais graves de meningite. As bactérias que causam meningite geralmente obtêm acesso ao SNC através da corrente sanguínea após um trauma ou como resultado da ação de toxinas bacterianas. As bactérias também podem se espalhar por estruturas no trato respiratório superior, como orofaringe, nasofaringe, seios nasais e ouvido médio. Pacientes com ferimentos na cabeça ou implantes cocleares (um dispositivo eletrônico colocado no ouvido interno) também correm o risco de desenvolver meningite.
Muitas das bactérias que podem causar meningite são comumente encontradas em pessoas saudáveis. As causas mais comuns de meningite bacteriana não neonatal são Neisseria meningitidis, Streptococcus pneumoniae e Haemophilus influenzae. Todos esses três patógenos bacterianos são transmitidos de pessoa para pessoa pelas secreções respiratórias. Cada um pode colonizar e atravessar as membranas mucosas da orofaringe e da nasofaringe e entrar no sangue. Uma vez no sangue, esses patógenos podem se disseminar por todo o corpo e são capazes de estabelecer uma infecção e desencadear inflamação em qualquer local do corpo, incluindo as meninges (Figura\(\PageIndex{1}\)). Sem terapia antibacteriana sistêmica apropriada, a taxa de letalidade pode chegar a 70%, e 20% desses sobreviventes podem ficar com danos irreversíveis nos nervos ou destruição tecidual, resultando em perda auditiva, deficiência neurológica ou perda de um membro. As taxas de mortalidade são muito mais baixas (tão baixas quanto 15%) em populações onde medicamentos terapêuticos apropriados e vacinas preventivas estão disponíveis. 1
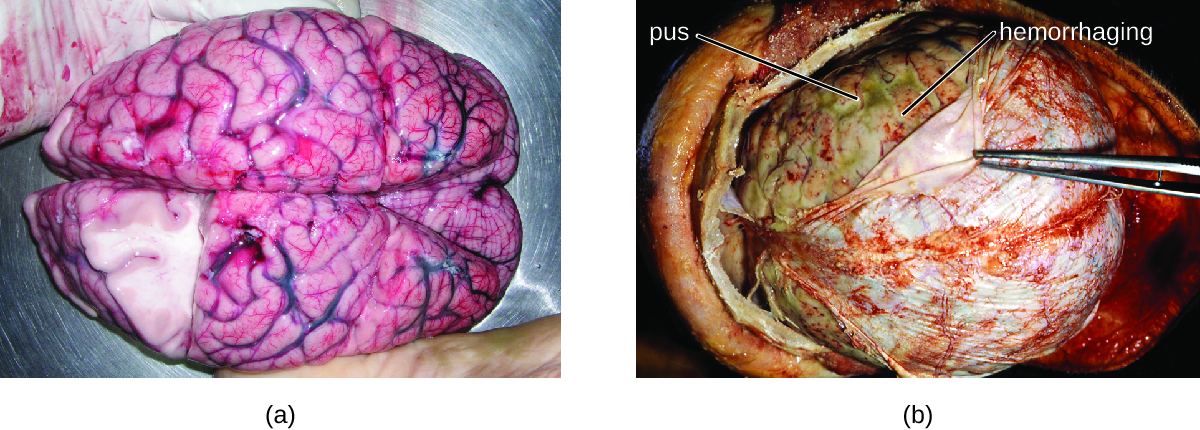
Uma variedade de outras bactérias, incluindo Listeria monocytogenes e Escherichia coli, também são capazes de causar meningite. Essas bactérias causam infecções da aracnóide e do LCR após se espalharem pela circulação no sangue ou por uma infecção dos seios nasais ou da nasofaringe. Streptococcus agalactiae, comumente encontrado na microbiota da vagina e do trato gastrointestinal, também pode causar meningite bacteriana em recém-nascidos após a transmissão da mãe antes ou durante o parto.
A inflamação profunda causada por esses micróbios pode resultar em sintomas precoces que incluem dor de cabeça intensa, febre, confusão, náuseas, vômitos, fotofobia e rigidez no pescoço. As respostas inflamatórias sistêmicas associadas a alguns tipos de meningite bacteriana podem causar hemorragias e lesões purpúricas na pele, seguidas por condições ainda mais graves que incluem choque, convulsões, coma e morte — em alguns casos, em apenas algumas horas.
O diagnóstico de meningite bacteriana é melhor confirmado pela análise do LCR obtido por punção lombar. Níveis anormais de neutrófilos polimorfonucleares (PMNs) (> 10 PMNs/mm 3) e glicose (< 45 mg/dL), and protein (> 45 mg/dL) no líquido cefalorraquidiano são sugestivos de meningite bacteriana. 2 As características de formas específicas de meningite bacteriana estão detalhadas nas subseções a seguir.
Meningite meningocócica
A meningite meningocócica é uma infecção grave causada pelo coco gram-negativo N. meningitidis. Em alguns casos, a morte pode ocorrer dentro de algumas horas após o início dos sintomas. Casos não fatais podem resultar em danos nervosos irreversíveis, resultando em perda auditiva e danos cerebrais ou amputação de extremidades devido à necrose tecidual.
A meningite meningocócica pode infectar pessoas de qualquer idade, mas sua prevalência é maior entre bebês, adolescentes e adultos jovens. 3 A meningite meningocócica já foi a causa mais comum de epidemias de meningite em populações humanas. Esse ainda é o caso em uma faixa da África Subsaariana conhecida como cinturão da meningite, mas as epidemias de meningite meningocócica se tornaram raras na maioria das outras regiões, graças às vacinas meningocócicas. No entanto, surtos ainda podem ocorrer em comunidades, escolas, faculdades, prisões e outras populações onde as pessoas estão em contato direto próximo.
N. meningitidis tem uma alta afinidade pelas membranas mucosas da orofaringe e nasofaringe. O contato com secreções respiratórias contendo N. meningitidis é um meio eficaz de transmissão. A patogenicidade da N. meningitidis é reforçada por fatores de virulência que contribuem para a rápida progressão da doença. Isso inclui endotoxina de lipooligossacarídeo (LOS), pili tipo IV para fixação nos tecidos do hospedeiro e cápsulas de polissacarídeos que ajudam as células a evitar a fagocitose e a morte mediada pelo complemento. Outros fatores de virulência incluem protease IgA (que decompõe os anticorpos IgA), os fatores de invasão Opa, Opc e porina (que facilitam a entrada transcelular através da barreira hematoencefálica), fatores de absorção de ferro (que retiram as unidades heme da hemoglobina nas células hospedeiras e as usam para o crescimento) e estresse proteínas que protegem as bactérias das moléculas reativas de oxigênio.
Um sinal único de meningite meningocócica é a formação de uma erupção petequial na pele ou nas membranas mucosas, caracterizada por lesões hemorrágicas minúsculas, vermelhas, planas. Essa erupção cutânea, que aparece logo após o início da doença, é uma resposta à endotoxina LOS e aos fatores de virulência de adesão que interrompem as células endoteliais dos capilares e pequenas veias da pele. A ruptura dos vasos sanguíneos desencadeia a formação de pequenos coágulos sanguíneos, fazendo com que o sangue vaze para o tecido circundante. Conforme a infecção progride, os níveis dos fatores de virulência aumentam e as lesões hemorrágicas podem aumentar de tamanho à medida que o sangue continua vazando para os tecidos. Lesões maiores que 1,0 cm geralmente ocorrem em pacientes que desenvolvem choque, pois os fatores de virulência causam aumento da hemorragia e formação de coágulos. A sepse, como resultado de danos sistêmicos causados por fatores de virulência meningocócica, pode levar à falência rápida de múltiplos órgãos, choque, coagulação intravascular disseminada e morte.
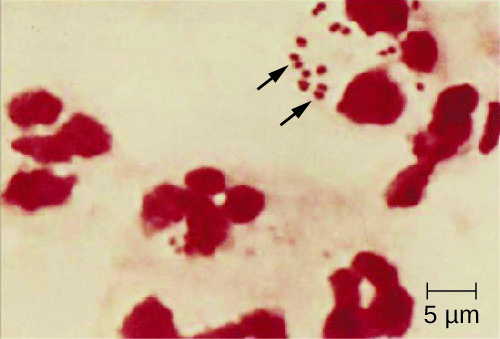
Como a meningite meningocócica progride tão rapidamente, uma maior variedade de amostras clínicas é necessária para a detecção oportuna de N. meningitidis. As amostras necessárias podem incluir sangue, líquido cefalorraquiano, esfregaços nasofaríngeos e orofaríngeos, compressas uretrais e endocervicais, aspirados petequiais e biópsias. Os protocolos de segurança para manuseio e transporte de amostras suspeitas de conter N. meningitidis devem sempre ser seguidos, uma vez que casos de doença meningocócica fatal ocorreram em profissionais de saúde expostos a gotículas ou aerossóis de amostras de pacientes. O diagnóstico presuntivo imediato de meningite meningocócica pode ocorrer quando o LCR é avaliado diretamente pela coloração de Gram, revelando diplococos gram-negativos extras e intracelulares com uma morfologia microscópica distinta do grão de café associada aos PMNs (Figura\(\PageIndex{2}\)). A identificação também pode ser feita diretamente do LCR usando aglutinação de látex e testes imunocromatográficos de diagnóstico rápido específicos para N. meningitidis. A identificação de espécies também pode ser realizada usando esquemas de tipagem baseados em sequências de DNA para proteínas hipervariáveis de membrana externa de N. meningitidis, que substituíram a sero (sub) tipagem.
As infecções meningocócicas podem ser tratadas com antibioticoterapia, e as cefalosporinas de terceira geração são mais frequentemente empregadas. No entanto, como os resultados podem ser negativos mesmo com o tratamento, a vacinação preventiva é a melhor forma de tratamento. Em 2010, os países do cinturão de meningite da África começaram a usar uma nova vacina conjugada meningocócica do sorogrupo A. Este programa reduziu drasticamente o número de casos de meningite meningocócica ao conferir imunidade individual e coletiva.
Sabe-se que existem doze sorotipos capsulares diferentes de N. meningitidis. Os sorotipos A, B, C, W, X e Y são os mais prevalentes em todo o mundo. O CDC recomenda que crianças entre 11 e 12 anos sejam vacinadas com uma dose única de uma vacina quadrivalente que protege contra os sorotipos A, C, W e Y, com um reforço aos 16 anos. 4 Um reforço ou injeções adicionais da vacina meningocócica do sorogrupo B podem ser administrados a indivíduos em ambientes de alto risco (como surtos epidêmicos em campi universitários).
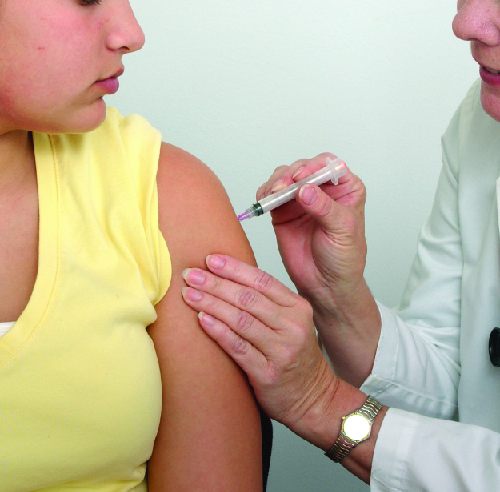
Meningite no campus
Estudantes universitários que moram em dormitórios ou moradias comunitárias correm maior risco de contrair meningite epidêmica. De 2011 a 2015, houve pelo menos nove surtos de meningococos em campi universitários nos Estados Unidos. Esses incidentes envolveram um total de 43 estudantes (dos quais quatro morreram). 5 Apesar do diagnóstico rápido e do tratamento antimicrobiano agressivo, vários sobreviventes sofreram amputações ou problemas neurológicos graves.
A vacinação profilática de estudantes universitários do primeiro ano que moram em dormitórios é recomendada pelo CDC, e as seguradoras agora cobrem a vacinação meningocócica para estudantes em dormitórios universitários. Algumas faculdades determinaram a vacinação com a vacina meningocócica conjugada para certos estudantes que ingressam na faculdade (Figura\(\PageIndex{3}\)).
Meningite pneumocócica
A meningite pneumocócica é causada pela bactéria gram-positiva encapsulada S. pneumoniae (pneumococo, também chamado de pneumococo estreptocócico). Esse organismo é comumente encontrado na microbiota da faringe de 30 a 70% das crianças pequenas, dependendo do método de amostragem, enquanto o S. pneumoniae pode ser encontrado em menos de 5% dos adultos saudáveis. Embora geralmente esteja presente sem sintomas de doença, esse micróbio pode atravessar a barreira hematoencefálica em indivíduos suscetíveis. Em alguns casos, também pode resultar em septicemia. Desde a introdução da vacina contra o Hib, S. pneumoniae tornou-se a principal causa de meningite em humanos de 2 meses até a idade adulta.
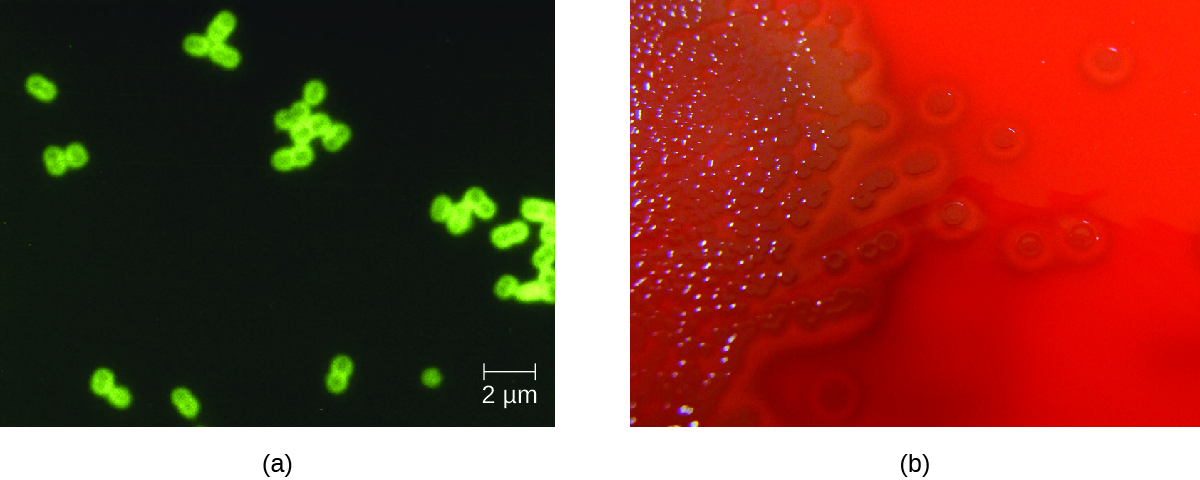
S. pneumoniae pode ser identificado em amostras de LCR usando amostras coradas por grama, aglutinação de látex e RDT imunocromatográfico específico para S. pneumoniae. Em amostras coradas por grama, S. pneumoniae aparece como diplococos gram-positivos em forma de lanceta (Figura\(\PageIndex{4}\)). A identificação de S. pneumoniae também pode ser obtida usando culturas de líquido cefalorraquidiano e sangue, e pelo menos 93 sorotipos distintos podem ser identificados com base na reação de supressão a polissacarídeos capsulares únicos. Os ensaios de PCR e RT-PCR também estão disponíveis para confirmar a identificação.
Os principais fatores de virulência produzidos por S. pneumoniae incluem pilina PI-1 para adesão às células hospedeiras (aderência pneumocócica) e fator de virulência B (PaVb) para ligação às células do trato respiratório; proteínas de ligação à colina (CBPa) que se ligam às células epiteliais e interferem com os fatores imunológicos IgA e C3; e a toxina bacteriana citoplasmática pneumolisina que desencadeia uma resposta inflamatória.
Com o surgimento de cepas resistentes a medicamentos de S. pneumoniae, a meningite pneumocócica é normalmente tratada com antibióticos de amplo espectro, como levofloxacina, cefotaxima, penicilina ou outros antibióticos β-lactâmicos. As duas vacinas pneumocócicas disponíveis estão descritas em Infecções Bacterianas do Trato Respiratório.
Haemophilus influenzae Tipo b
A meningite causada pelo sorotipo b do H. influenzae (Hib), um coccobacilo gram-negativo pleomórfico encapsulado, agora é incomum na maioria dos países, devido ao uso da vacina eficaz contra o Hib. Sem o uso da vacina contra o Hib, o H. influenzae pode ser a principal causa de meningite em crianças de 2 meses a 5 anos de idade. H. influenzae pode ser encontrada na garganta de indivíduos saudáveis, incluindo bebês e crianças pequenas. Aos cinco anos de idade, a maioria das crianças desenvolveu imunidade a esse micróbio. Bebês com mais de 2 meses de idade, no entanto, não produzem uma resposta protetora suficiente de anticorpos e são suscetíveis a doenças graves. A pressão intracraniana causada por essa infecção leva a uma taxa de mortalidade de 5% e 20% de incidência de surdez ou dano cerebral em sobreviventes. 6
H. influenzae produz pelo menos 16 fatores de virulência diferentes, incluindo LOS, que desencadeia inflamação, e fator de adesão e penetração de Haemophilus (Hap), que auxilia na fixação e invasão das células epiteliais respiratórias. A bactéria também tem uma cápsula de polissacarídeo que ajuda a evitar a fagocitose, além de fatores como a protease IgA1 e a proteína P2 que permitem evitar anticorpos secretados pelas membranas mucosas. Além disso, fatores como a proteína de ligação à hemoglobina (Hgp) e a proteína de ligação à transferrina (Tbp) adquirem ferro da hemoglobina e da transferrina, respectivamente, para o crescimento bacteriano.
O diagnóstico preliminar das infecções por H. influenzae pode ser feito por PCR direta e um esfregaço do LCR. Os esfregaços corados revelarão PMNs intracelulares e extracelulares com cocobacilos pequenos, pleomórficos e gram-negativos ou formas filamentosas que são características do H. influenzae. A confirmação inicial desse gênero pode ser baseada em seu crescimento exigente em ágar de chocolate. A identificação é confirmada com os requisitos de cofatores de crescimento bioquímico exógeno NAD e heme (por MALDI-TOF), aglutinação de látex e RT-PCR.
A meningite causada por H. influenzae geralmente é tratada com doxiciclina, fluoroquinolonas, cefalosporinas de segunda e terceira geração e carbapenêmicos. O melhor meio de prevenir a infecção por H. influenza é com o uso da vacina conjugada polissacarídica Hib. Recomenda-se que todas as crianças recebam esta vacina aos 2, 4 e 6 meses de idade, com uma dose final de reforço aos 12 a 15 meses de idade. 7
Meningite neonatal
S. agalactiae, estreptococo do grupo B (GBS), é uma bactéria gram-positiva encapsulada que é a causa mais comum de meningite neonatal, termo que se refere à meningite que ocorre em bebês de até 3 meses de idade. 8 S. agalactiae também pode causar meningite em pessoas de todas as idades e pode ser encontrada na microbiota urogenital e gastrointestinal de cerca de 10 a 30% dos humanos.
A infecção neonatal ocorre como doença de início precoce ou tardio. A doença de início precoce é definida como ocorrendo em bebês de até 7 dias de idade. O bebê inicialmente é infectado por S. agalactiae durante o parto, quando a bactéria pode ser transferida da vagina da mãe. A incidência de meningite neonatal de início precoce pode ser bastante reduzida com a administração de antibióticos intravenosos à mãe durante o trabalho de parto.
A meningite neonatal de início tardio ocorre em bebês entre 1 semana e 3 meses de idade. Bebês nascidos de mães com S. agalactiae no trato urogenital têm maior risco de meningite de início tardio, mas infecções de início tardio podem ser transmitidas de outras fontes além da mãe; muitas vezes, a fonte da infecção é desconhecida. Bebês que nascem prematuramente (antes das 37 semanas de gravidez) ou de mães que desenvolvem febre também têm um risco maior de contrair meningite neonatal de início tardio.
Os sinais e sintomas da doença de início precoce incluem instabilidade da temperatura, apneia (cessação da respiração), bradicardia (batimento cardíaco lento), hipotensão, dificuldade de alimentação, irritabilidade e magreza. Ao dormir, pode ser difícil acordar o bebê. Os sintomas da doença de início tardio são mais prováveis de incluir convulsões, fontanela protuberante (ponto fraco), rigidez no pescoço, hemiparesia (fraqueza em um lado do corpo) e opistotonos (corpo rígido com costas arqueadas e cabeça voltada para trás).
S. agalactiae produz pelo menos 12 fatores de virulência que incluem fBSA que se liga às proteínas da superfície da célula hospedeira, PI-1 pili que promove a invasão de células endoteliais humanas, uma cápsula polissacarídica que impede a ativação da via alternativa do complemento e inibe a fagocitose, e o fator toxina CAMP, que forma poros nas membranas celulares hospedeiras e se liga aos anticorpos IgG e IgM.
O diagnóstico de meningite neonatal é frequentemente, mas não uniformemente, confirmado por resultados positivos de culturas de LCR ou sangue. Os testes incluem cultura de rotina, detecção de antígenos por imunoensaio enzimático, sorotipagem de diferentes tipos de cápsulas, PCR e RT-PCR. Geralmente é tratado com antibióticos β-lactâmicos, como penicilina intravenosa ou ampicilina mais gentamicina. Mesmo com o tratamento, cerca de 10% de mortalidade é observada em recém-nascidos infectados. 9
Exercício\(\PageIndex{1}\)
- Quais grupos são mais vulneráveis a cada uma das doenças da meningite bacteriana?
- Para quais das doenças da meningite bacteriana existem vacinas atualmente disponíveis?
- Qual organismo pode causar meningite epidêmica?
Doenças associadas ao clostrídio
As espécies do gênero Clostridium são bastonetes gram-positivos formadores de endosporos que são anaeróbios obrigatórios. Os endosporos de Clostridium spp. são difundidos na natureza, comumente encontrados no solo, água, fezes, esgoto e sedimentos marinhos. Clostridium spp. produz mais tipos de exotoxinas proteicas do que qualquer outro gênero bacteriano, incluindo duas exotoxinas com atividade proteásica que são as toxinas biológicas mais potentes conhecidas: a neurotoxina botulínica (BoNT) e a neurotoxina tetânica (TenT). Essas duas toxinas têm doses letais de 0,2—10 ng por kg de peso corporal.
A BoNT pode ser produzida por cepas únicas de C. butyricum e C. baratii; no entanto, está associada principalmente à C. botulinum e à condição de botulismo. A TenT, que causa o tétano, é produzida apenas por C. tetani. Essas poderosas exotoxinas neurais são os principais fatores de virulência desses patógenos. O modo de ação dessas toxinas foi descrito em Fatores de Virulência de Patógenos Bacterianos e Virais e ilustrado na Figura 15.3.7.
O diagnóstico de tétano ou botulismo geralmente envolve bioensaios que detectam a presença de BoNT e TenT em amostras fecais, sangue (soro) ou alimentos suspeitos. Além disso, tanto C. botulinum quanto C. tetani podem ser isolados e cultivados usando meios comercialmente disponíveis para anaeróbios. Os testes ELISA e RT-PCR também estão disponíveis.
Tétano
O tétano é uma doença não transmissível caracterizada por espasmos musculares incontroláveis (contrações) causados pela ação da TenT. Geralmente ocorre quando C. tetani infecta uma ferida e produz TenT, que se liga rapidamente ao tecido neural, resultando em uma intoxicação (envenenamento) dos neurônios. Dependendo do local e da extensão da infecção, os casos de tétano podem ser descritos como localizados, cefálicos ou generalizados. O tétano generalizado que ocorre em um recém-nascido é chamado de tétano neonatal.
O tétano localizado ocorre quando a TenT afeta apenas os grupos musculares próximos ao local da lesão. Não há envolvimento do SNC e os sintomas geralmente são leves, com espasmos musculares localizados causados por uma disfunção nos neurônios circundantes. Indivíduos com imunidade parcial — especialmente indivíduos previamente vacinados que deixam de tomar as doses de reforço recomendadas — têm maior probabilidade de desenvolver tétano localizado como resultado da infecção por C. tetani de uma ferida por punção.
O tétano cefálico é uma forma rara e localizada de tétano geralmente associada a feridas na cabeça ou na face. Em casos raros, ocorreu em casos de otite média (infecção do ouvido médio). O tétano cefálico geralmente faz com que os pacientes vejam imagens duplas, devido aos espasmos que afetam os músculos que controlam o movimento ocular.
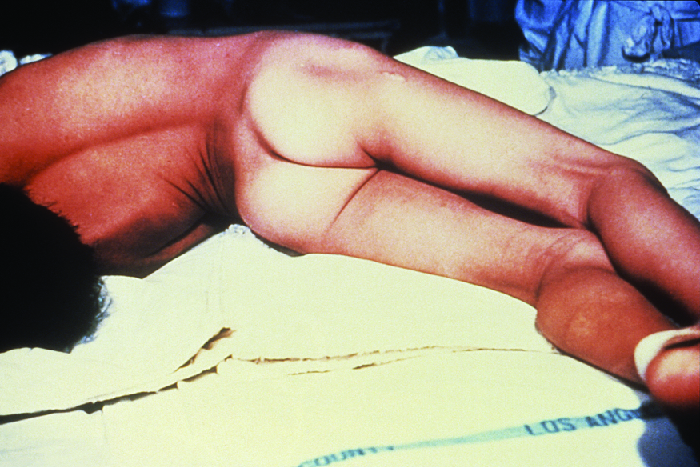
Tanto o tétano localizado quanto o cefálico podem evoluir para tétano generalizado - uma condição muito mais grave - se a TenT for capaz de se espalhar ainda mais pelos tecidos do corpo. No tétano generalizado, a TenT entra nos neurônios do PNS. A partir daí, a TenT viaja do local da ferida, geralmente em uma extremidade do corpo, retrógrada (de volta) para neurônios inibitórios no SNC. Lá, impede a liberação do ácido gama-aminobutírico (GABA), o neurotransmissor responsável pelo relaxamento muscular. Os espasmos musculares resultantes geralmente ocorrem primeiro nos músculos da mandíbula, levando ao sintoma característico da mandíbula (incapacidade de abrir a boca). À medida que a toxina continua bloqueando progressivamente a liberação de neurotransmissores, outros músculos se envolvem, resultando em espasmos musculares repentinos e incontroláveis, poderosos o suficiente para causar a ruptura dos tendões e a fratura dos ossos. Espasmos nos músculos do pescoço, costas e pernas podem fazer com que o corpo forme um arco rígido e rígido, uma postura chamada opistotonos (Figura\(\PageIndex{5}\)). Espasmos na laringe, no diafragma e nos músculos do tórax restringem a capacidade do paciente de engolir e respirar, levando à morte por asfixia (suprimento insuficiente de oxigênio).
O tétano neonatal geralmente ocorre quando o coto do cordão umbilical está contaminado com esporos de C. tetani após o parto. Embora essa condição seja rara nos Estados Unidos, o tétano neonatal é uma das principais causas de mortalidade infantil em países que não têm imunização materna contra o tétano e onde o parto geralmente ocorre em condições insalubres. No final da primeira semana de vida, os bebês infectados ficam irritados, se alimentam mal e desenvolvem rigidez com espasmos. O tétano neonatal tem um prognóstico muito ruim, com uma taxa de mortalidade de 70% a 100%. 10
O tratamento para pacientes com tétano inclui respiração assistida por meio do uso de um ventilador, desbridamento da ferida, balanço hídrico e antibioticoterapia com metronidazol ou penicilina para impedir o crescimento de C. tetani. Além disso, os pacientes são tratados com a antitoxina TenT, preferencialmente na forma de imunoglobulina humana para neutralizar a toxina não fixa e os benzodiazepínicos para aumentar o efeito do GABA no relaxamento muscular e na ansiedade.
Uma vacina contra o toxóide tetânico (TT) está disponível para proteção e prevenção do tétano. É o componente T de vacinas como DTaP, Tdap e Td. O CDC recomenda que as crianças recebam doses da vacina DTaP aos 2, 4, 6 e 15—18 meses de idade e outra aos 4—6 anos de idade. Uma dose de Td é recomendada para adolescentes e adultos como um reforço de TT a cada 10 anos. 11
Botulismo
O botulismo é uma doença rara, mas frequentemente fatal, causada pela intoxicação por BoNT. Pode ocorrer como resultado de uma infecção por C. botulinum, caso em que a bactéria produz BoNT in vivo ou como resultado de uma introdução direta de BoNT nos tecidos.
A infecção e a produção de BoNT in vivo podem resultar em botulismo de feridas, botulismo infantil e toxemia intestinal em adultos. O botulismo da ferida geralmente ocorre quando o C. botulinum é introduzido diretamente em uma ferida após uma lesão traumática, ferida por punção profunda ou local da injeção. O botulismo infantil, que ocorre em bebês com menos de 1 ano de idade, e a toxemia intestinal em adultos, que ocorre em adultos imunocomprometidos, resultam da ingestão de endósporos de C. botulinum nos alimentos. Os endosporos germinam no corpo, resultando na produção de BoNT no trato intestinal.
As intoxicações ocorrem quando o BoNT é produzido fora do corpo e depois introduzido diretamente no corpo por meio de alimentos (botulismo alimentar), ar (botulismo por inalação) ou um procedimento clínico (botulismo iatrogênico). O botulismo alimentar, a mais comum dessas formas, ocorre quando o BoNT é produzido em alimentos contaminados e depois ingerido junto com o alimento (lembre-se de Case in Point: A Streak of Bad Potluck). O botulismo por inalação é raro porque o BoNT é instável como um aerossol e não ocorre na natureza; no entanto, ele pode ser produzido em laboratório e foi usado (sem sucesso) como arma biológica por terroristas no Japão na década de 1990. Alguns casos de botulismo por inalação acidental também ocorreram. O botulismo iatrogênico também é raro; está associado a injeções de BoNT usadas para fins cosméticos (consulte Microconexões: usos medicinais da toxina botulínica).
Quando a BoNT entra na corrente sanguínea no trato gastrointestinal, ferida ou pulmões, ela é transferida para as junções neuromusculares dos neurônios motores, onde se liga irreversivelmente às membranas pré-sinápticas e impede a liberação de acetilcolina do terminal pré-sináptico dos neurônios motores para o neuromuscular junção. A consequência da prevenção da liberação de acetilcolina é a perda da atividade muscular, levando ao relaxamento muscular e, eventualmente, à paralisia.
Se a BoNT for absorvida pelo trato gastrointestinal, os primeiros sintomas do botulismo incluem visão turva, pálpebras caídas, dificuldade em engolir, cólicas abdominais, náuseas, vômitos, constipação ou possivelmente diarreia. Isso é seguido por paralisia flácida progressiva, enfraquecimento gradual e perda de controle sobre os músculos. A experiência do paciente pode ser particularmente assustadora, porque a audição permanece normal, a consciência não é perdida e ele está totalmente ciente da progressão de sua condição. Em bebês, sinais notáveis de botulismo incluem choro fraco, diminuição da capacidade de mamar e hipotonia (flacidez da cabeça ou do corpo). Eventualmente, o botulismo termina na morte por insuficiência respiratória causada pela paralisia progressiva dos músculos das vias aéreas superiores, do diafragma e do tórax.
O botulismo é tratado com uma antitoxina específica para BoNT. Se administrada a tempo, a antitoxina interrompe a progressão da paralisia, mas não a reverte. Depois que a antitoxina for administrada, o paciente recuperará lentamente a função neurológica, mas isso pode levar várias semanas ou meses, dependendo da gravidade do caso. Durante a recuperação, os pacientes geralmente devem permanecer hospitalizados e receber assistência respiratória por meio de um ventilador.
Exercício\(\PageIndex{2}\)
- Com que frequência a vacinação contra o tétano deve ser atualizada em adultos?
- Quais são as causas mais comuns de botulismo?
- Por que o botulismo não é tratado com um antibiótico?
Usos medicinais da toxina botulínica
Embora seja o material biológico mais tóxico conhecido pelo homem, a toxina botulínica é frequentemente injetada intencionalmente em pessoas para tratar outras condições. A toxina botulínica tipo A é usada cosmeticamente para reduzir as rugas. A injeção de pequenas quantidades dessa toxina no rosto causa o relaxamento dos músculos faciais, dando à pele uma aparência mais suave. A contração das pálpebras e os olhos cruzados também podem ser tratados com injeções de toxina botulínica. Outros usos dessa toxina incluem o tratamento da hiperidrose (transpiração excessiva). De fato, a toxina botulínica pode ser usada para moderar os efeitos de várias outras doenças aparentemente não microbianas que envolvem função nervosa inadequada. Essas doenças incluem paralisia cerebral, esclerose múltipla e doença de Parkinson. Cada uma dessas doenças é caracterizada por uma perda de controle sobre as contrações musculares; o tratamento com toxina botulínica serve para relaxar os músculos contraídos.
Listeriose
Listeria monocytogenes é um bastonete gram-positivo não encapsulado, não esporulante e um patógeno de origem alimentar que causa a listeriose. Os grupos de risco incluem mulheres grávidas, recém-nascidos, idosos e imunocomprometidos (lembre-se dos estudos de caso do Clinical Focus em Crescimento Microbiano e Mecanismos Microbianos de Patogenicidade). A listeriose causa meningite em cerca de 20% dos casos, principalmente neonatos e pacientes com mais de 60 anos. O CDC identifica a listeriose como a terceira principal causa de morte por doenças transmitidas por alimentos, com taxas de mortalidade geral atingindo 16%. 12 Em mulheres grávidas, a listeriose também pode causar aborto espontâneo em mulheres grávidas devido à capacidade única do patógeno de atravessar a placenta.
L. monocytogenes geralmente é introduzido em alimentos por contaminação com solo ou esterco animal usado como fertilizante. Os alimentos comumente associados à listeriose incluem frutas e vegetais frescos, vegetais congelados, carnes processadas, queijos macios e leite cru. 13 Ao contrário da maioria dos outros patógenos de origem alimentar, a Listeria é capaz de crescer em temperaturas entre 0° C e 50° C e, portanto, pode continuar a crescer, mesmo em alimentos refrigerados.
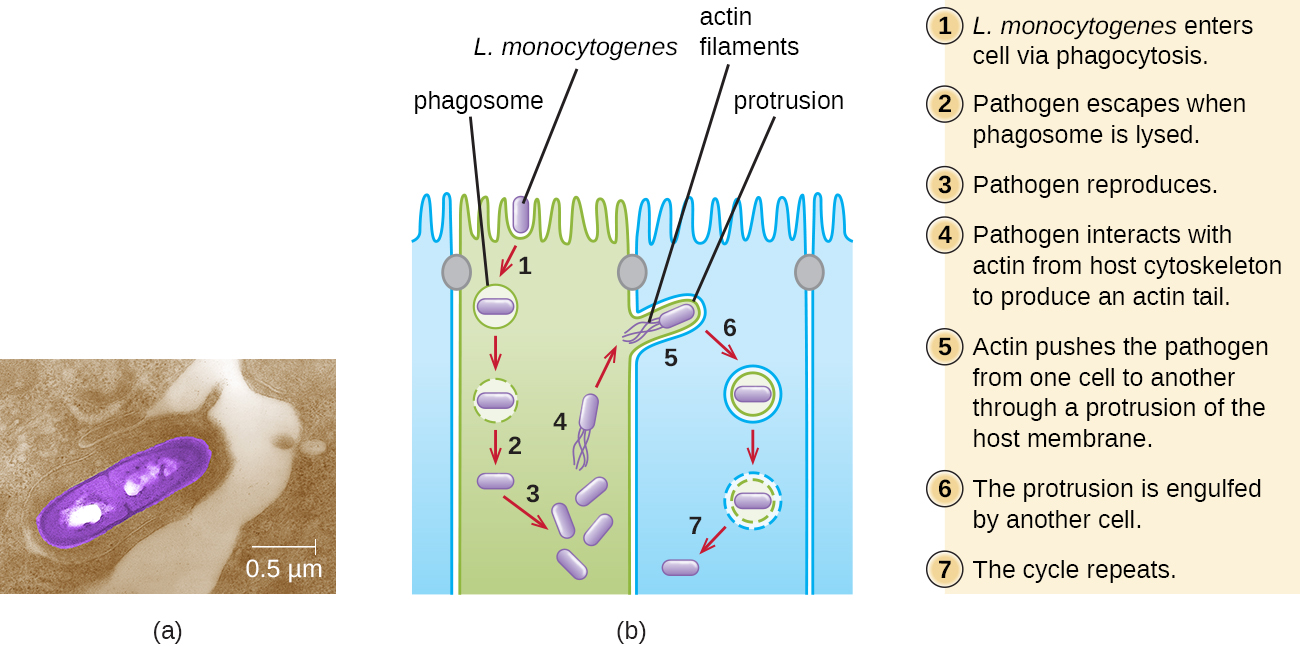
A ingestão de alimentos contaminados leva inicialmente à infecção do trato gastrointestinal. No entanto, L. monocytogenes produz vários fatores de virulência únicos que lhe permitem atravessar a barreira intestinal e se espalhar para outros sistemas corporais. Proteínas de superfície chamadas internalinas (InLa e InLb) ajudam L. monocytogenes a invadir células e tecidos não fagocíticos, penetrando na parede intestinal e se disseminando pelos sistemas circulatório e linfático. As internalinas também permitem que L. monocytogenes quebre outras barreiras importantes, incluindo a barreira hematoencefálica e a placenta. Dentro dos tecidos, L. monocytogenes usa outras proteínas chamadas listeriolisina O e ActA para facilitar o movimento intercelular, permitindo que a infecção se espalhe de célula para célula (Figura\(\PageIndex{6}\)).
L. monocytogenes é geralmente identificado pelo cultivo de amostras de um local normalmente estéril (por exemplo, sangue ou líquido cefalorraquidiano). A recuperação de organismos viáveis pode ser melhorada usando o enriquecimento a frio, incubando amostras em um caldo a 4 °C por uma semana ou mais. A distinção de tipos e subtipos de L. monocytogenes - uma etapa importante para o diagnóstico e a epidemiologia - geralmente é feita usando eletroforese em gel de campo pulsado. A identificação também pode ser obtida usando ensaios de sonda de DNA por quimioluminescência e MALDI-TOF.
O tratamento da listeriose envolve antibioticoterapia, mais comumente com ampicilina e gentamicina. Não há vacina disponível.
Exercício\(\PageIndex{3}\)
Como a Listeria entra no sistema nervoso?
Doença de Hansen (Lepra)
A hanseníase (também conhecida como hanseníase) é causada por uma bactéria longa, fina e filamentosa, em forma de bastonete, Mycobacterium leprae, um patógeno intracelular obrigatório. M. leprae é classificada como bactéria gram-positiva, mas é melhor visualizada microscopicamente com uma coloração ácido-resistente e geralmente é chamada de bactéria ácido-resistente. A hanseníase afeta o SNP, causando danos permanentes e perda de apêndices ou outras partes do corpo.
A hanseníase é transmissível, mas não altamente contagiosa; aproximadamente 95% da população humana não pode ser facilmente infectada porque tem uma imunidade natural ao M. leprae. A transmissão de pessoa para pessoa ocorre por inalação na mucosa nasal ou contato prolongado e repetido com a pele infectada. Os tatus, um dos únicos cinco mamíferos suscetíveis à hanseníase, também foram implicados na transmissão de alguns casos. 14
No corpo humano, M. leprae cresce melhor nas temperaturas mais baixas encontradas nos tecidos periféricos, como nariz, dedos dos pés, dedos das mãos e orelhas. Alguns dos fatores de virulência que contribuem para a patogenicidade do M. leprae estão localizados na cápsula e na parede celular da bactéria. Esses fatores de virulência permitem que ele se ligue e invada as células de Schwann, resultando em desmielinização progressiva que destrói gradualmente os neurônios do PNS. A perda da função neuronal leva à hipoestesia (dormência) nas lesões infectadas. M. leprae é facilmente fagocitado pelos macrófagos, mas é capaz de sobreviver dentro dos macrófagos, em parte neutralizando as espécies reativas de oxigênio produzidas na explosão oxidativa do fagolisossomo. Como L. monocytogenes, M. leprae também pode se mover diretamente entre macrófagos para evitar a eliminação por fatores imunológicos.
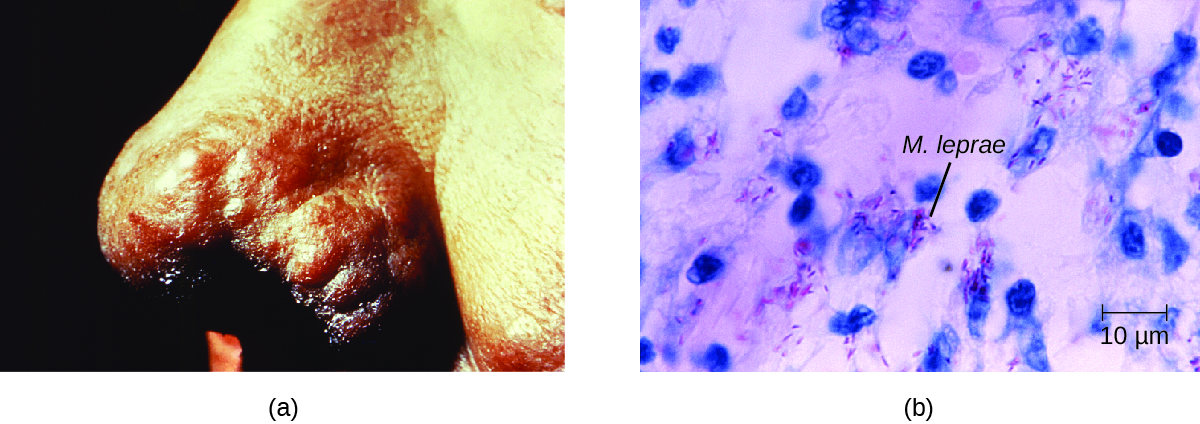
A extensão da doença está relacionada à resposta imune do paciente. Os sintomas iniciais podem não aparecer por até 2 a 5 anos após a infecção. Geralmente começam com áreas pequenas, branqueadas e dormentes da pele. Na maioria dos indivíduos, eles se resolvem espontaneamente, mas alguns casos podem evoluir para uma forma mais grave da doença. A hanseníase tuberculoide (paucibacilar) é marcada pela presença de relativamente poucas (três ou menos) lesões cutâneas planas e branqueadas, com pequenos nódulos nas bordas e poucas bactérias presentes na lesão. Embora essas lesões possam persistir por anos ou décadas, as bactérias são controladas por uma resposta imune eficaz, incluindo citotoxicidade mediada por células. Indivíduos que não conseguem conter a infecção podem posteriormente desenvolver a hanseníase lepromatosa (multibacilar). Esta é uma forma progressiva da doença caracterizada por nódulos preenchidos com bacilos e macrófagos ácido-resistentes. O comprometimento da função das células de Schwann infectadas leva a danos nos nervos periféricos, resultando em perda sensorial que leva a úlceras, deformidades e fraturas. A lesão do nervo ulnar (no punho) causada pelo M. leprae é uma das causas mais comuns de paralisação da mão. Em alguns casos, danos crônicos nos tecidos podem levar à perda dos dedos das mãos ou dos pés. Quando os tecidos mucosos também estão envolvidos, lesões desfigurantes do nariz e da face também podem ocorrer (Figura\(\PageIndex{7}\)).
A hanseníase é diagnosticada com base nos sinais e sintomas clínicos da doença e confirmada pela presença de bacilos ácido-resistentes em esfregaços cutâneos ou em amostras de biópsia de pele (Figura\(\PageIndex{7}\)). M. leprae não cresce in vitro em nenhum meio laboratorial conhecido, mas pode ser identificado por meio de cultivo in vivo nos pés de camundongos ou tatus de laboratório. Quando necessário, a PCR e a genotipagem do DNA de M. leprae em tecido humano infectado podem ser realizadas para diagnóstico e epidemiologia.
A hanseníase responde bem ao tratamento e, se diagnosticada e tratada precocemente, não causa incapacidade. Nos Estados Unidos, a maioria dos pacientes com hanseníase é tratada em ambulatórios nas principais cidades pelo programa Nacional da Doença de Hansen, a única instituição nos Estados Unidos dedicada exclusivamente à hanseníase. Desde 1995, a OMS tem disponibilizado gratuitamente a terapia multimedicamentosa para a hanseníase para todos os pacientes em todo o mundo. Como resultado, a prevalência global da hanseníase diminuiu de cerca de 5,2 milhões de casos em 1985 para cerca de 176.000 em 2014. 15 A terapia multimedicamentosa consiste em dapsona e rifampicina para todos os pacientes e um terceiro medicamento, clofazimina, para pacientes com doença multibacilar.
Atualmente, não existe uma vacina universalmente aceita para a hanseníase. A Índia e o Brasil usam uma vacina contra a tuberculose contra a hanseníase porque ambas as doenças são causadas por espécies de Mycobacterium. A eficácia desse método é questionável, no entanto, pois parece que a vacina funciona em algumas populações, mas não em outras.
Exercício\(\PageIndex{4}\)
- O que impede a progressão da lepra tuberculoide para lepromatus?
- Por que a hanseníase geralmente afeta os nervos das extremidades?
Colônias de leprosos
Doenças mortais e desfigurantes, como a lepra, têm sido estigmatizadas historicamente em muitas culturas. Antes que a lepra fosse compreendida, as vítimas eram frequentemente isoladas em colônias de leprosos, uma prática frequentemente mencionada em textos antigos, incluindo a Bíblia. Mas as colônias de leprosos não são apenas um artefato do mundo antigo. No Havaí, uma colônia de leprosos estabelecida no final do século XIX persistiu até meados do século XX, seus residentes foram forçados a viver em condições deploráveis. 16 Embora a hanseníase seja uma doença transmissível, ela não é considerada contagiosa (facilmente transmissível) e certamente não representa uma ameaça suficiente para justificar o isolamento permanente de suas vítimas. Hoje, reservamos as práticas de isolamento e quarentena para pacientes com doenças mais perigosas, como o Ebola ou bactérias resistentes a vários medicamentos, como Mycobacterium tuberculosis e Staphylococcus aureus. O argumento ético para essa prática é que isolar pacientes infectados é necessário para evitar a transmissão e disseminação de doenças altamente contagiosas, mesmo quando isso vai contra a vontade do paciente.
É claro que é muito mais fácil justificar a prática da quarentena clínica temporária do que a segregação social permanente, como ocorreu nas colônias de leprosos. Na década de 1980, houve apelos de alguns grupos para estabelecer acampamentos para pessoas infectadas com AIDS. Embora essa ideia nunca tenha sido realmente implementada, ela levanta a questão: onde traçamos o limite? Os campos de isolamento ou colônias permanentes são sempre justificáveis médica ou socialmente? Suponha que tenha ocorrido um surto de uma doença contagiosa fatal para a qual não há tratamento. Seria justificável impor isolamento social às pessoas que sofrem com a doença? Como equilibraríamos os direitos dos infectados com o risco que eles representam para os outros? Até que ponto a sociedade deve esperar que os indivíduos coloquem sua própria saúde em risco para tratar os outros com humanidade?
Infecções bacterianas do sistema nervoso
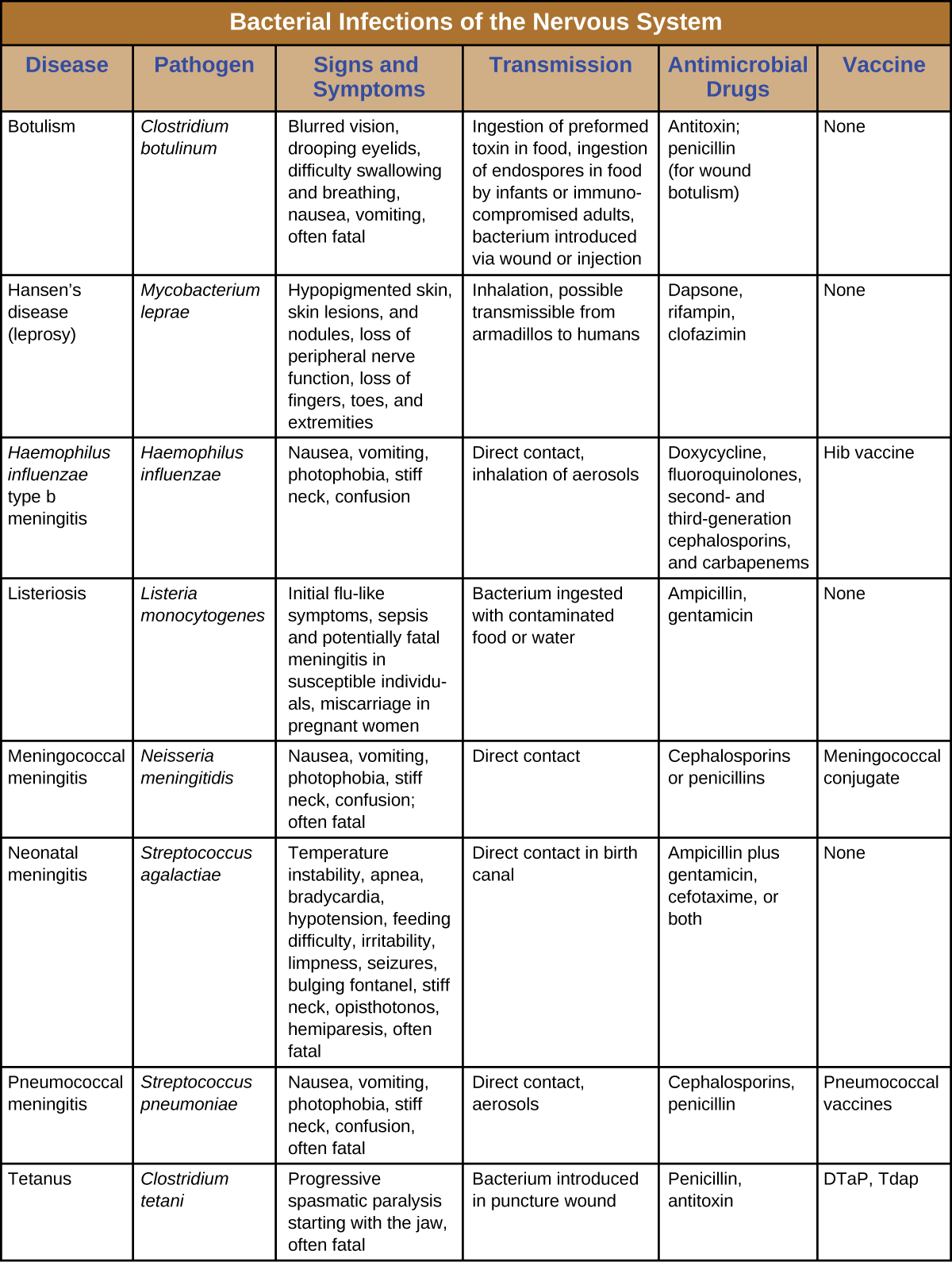
Apesar das formidáveis defesas que protegem o sistema nervoso, sabe-se que vários patógenos bacterianos causam infecções graves do SNC ou do SNP. Infelizmente, essas infecções costumam ser graves e fatais. A figura\(\PageIndex{8}\) resume algumas infecções importantes do sistema nervoso.
Conceitos principais e resumo
- A meningite bacteriana pode ser causada por várias espécies de bactérias encapsuladas, incluindo Haemophilus influenzae, Neisseria meningitidis, Streptococcus pneumoniae e Streptococcus agalactiae (estreptococos do grupo B). H. influenzae afeta principalmente crianças pequenas e recém-nascidos, N. meningitidis é o único patógeno transmissível e afeta principalmente crianças e adultos jovens, S. pneumoniae afeta principalmente crianças pequenas e S. agalactiae afeta recém-nascidos durante ou em breve após o nascimento.
- Os sintomas da meningite bacteriana incluem febre, rigidez do pescoço, dor de cabeça, confusão, convulsões, coma e morte.
- O diagnóstico de meningite bacteriana é feito por meio de observações e cultura de organismos no LCR. A meningite bacteriana é tratada com antibióticos. H. influenzae e N. meningitidis têm vacinas disponíveis.
- As espécies de Clostridium causam doenças neurológicas, incluindo botulismo e tétano, ao produzirem neurotoxinas potentes que interferem na liberação de neurotransmissores. O PNS geralmente é afetado. O tratamento da infecção por Clostridium é eficaz somente por meio do diagnóstico precoce com administração de antibióticos para controlar a infecção e antitoxinas para neutralizar a endotoxina antes que elas entrem nas células.
- Listeria monocytogenes é um patógeno de origem alimentar que pode infectar o SNC, causando meningite. A infecção pode ser transmitida pela placenta até o feto. O diagnóstico é feito por meio de cultura de sangue ou LCR. O tratamento é feito com antibióticos e não há vacina.
- A hanseníase (hanseníase) é causada pelo parasita intracelular Mycobacterium leprae. As infecções causam desmilenação dos neurônios, resultando em diminuição da sensação nos apêndices periféricos e nos locais do corpo. O tratamento é feito com antibioticoterapia multimedicamentosa e não existe uma vacina universalmente reconhecida.
Notas de pé
- 1 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., “Meningite bacteriana nos Estados Unidos, 1998—2007”, New England Journal of Medicine 364, nº 21 (2011): 2016-25.
- 2 Popovic, T., et al. Organização Mundial da Saúde, “Manual de Laboratório para o Diagnóstico da Meningite Causada por Neisseria meningitidis, Streptococcus pneumoniae e Haemophilus influenza”, 1999.
- 3 Centros de Controle e Prevenção de Doenças dos EUA, “Doença Meningocócica”, 5 de agosto de 2015. Acessado em 28 de junho de 2015. www.cdc.gov/meningococcal/sur... nce/index.html.
- 4 Centros dos EUA para Controle e Prevenção de Doenças, “Cronograma de Imunização Recomendado para Pessoas de 0 a 18 anos, Estados Unidos, 2016”, 1º de fevereiro de 2016. Acessado em 28 de junho de 2016. www.cdc.gov/vaccines/schedule... dolescent.html.
- 5 National Meningitis Association, “Surtos de doenças meningocócicas do sorogrupo B em campus universitários dos EUA”, 2016. Acessado em 28 de junho de 2016. http://www.nmaus.org/disease-prevent...ase/outbreaks/.
- 6 Departamento de Saúde e Serviços Humanos dos Estados Unidos, “Hib (Haemophilus Influenzae Type B)”, acessado em 28 de junho de 2016. http://www.vaccines.gov/diseases/hib/ #.
- 7 Centros dos EUA para Controle e Prevenção de Doenças, “Doença Meningocócica, Tendências de Doenças”, 2015. Acessado em 13 de setembro de 2016. www.cdc.gov/meningococcal/sur... nce/index.html.
- 8 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., “Meningite bacteriana nos Estados Unidos, 1998—2007”, New England Journal of Medicine 364, nº 21 (2011): 2016-25.
- 9 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., “Meningite bacteriana nos Estados Unidos, 1998—2007”, New England Journal of Medicine 364, nº 21 (2011): 2016-25; Heath, Paul T., Gail Balfour, Abbie M. Weisner, Androulla Efstratiou, Theresa L. Lamagni, Helen Tighe, Liam AF O'Connell et al., “Doença estreptocócica do grupo B no Reino Unido e na Irlanda em bebês menores de 90 dias”, The Lancet 363, nº 9405 (2004): 292-4.
- 10 UNFPA, UNICEF WHO, “Eliminação do tétano materno e neonatal até 2005”, 2000. www.unicef.org/immunization/f... tegy_paper.pdf.
- 11 Centros dos EUA para Controle e Prevenção de Doenças, “Vacinação contra o Tétano”, 2013. Acessado em 29 de junho de 2016. http://www.cdc.gov/tetanus/vaccination.html.
- 12 Scallan, Elaine, Robert M. Hoekstra, Frederick J. Angulo, Robert V. Tauxe, Marc-Alain Widdowson, Sharon L. Roy, Jeffery L. Jones e Patricia M. Griffin, “Foodborne Illness Acquired in the United States—Major Pathogens”, Emerging Infectious Diseases 17, nº 1 (2011): 7-15.
- 13 Centros de Controle e Prevenção de Doenças dos EUA, “Surtos de Listeria”, 2016. Acessado em 29 de junho de 2016. https://www.cdc.gov/listeria/outbreaks/index.html.
- 14 Sharma, Rahul, Pushpendra Singh, W. J. Loughry, J. Mitchell Lockhart, W. Barry Inman, Malcolm S. Duthie, Maria T. Pena et al., “Lepra zoonótica no sudeste dos Estados Unidos”, Doenças Infecciosas Emergentes 21, nº 12 (2015): 2127-34.
- 15 Organização Mundial da Saúde, “Leprosy Fact Sheet”, 2016. Acessado em 13 de setembro de 2016. http://www.who.int/mediacentre/factsheets/fs101/en/.
- 16 National Park Service, “A Brief History of Kalaupapa”, acessado em 2 de fevereiro de 2016. www.nps.gov/kala/learn/histor... -kalaupapa.htm.


