25.4: Infecções parasitárias dos sistemas circulatório e linfático
- Page ID
- 181670
Objetivos de
- Identifique parasitas comuns que causam infecções dos sistemas circulatório e linfático
- Compare as principais características de doenças parasitárias específicas que afetam os sistemas circulatório e linfático
Alguns protozoários e vermes parasitas também são capazes de causar infecções no sistema circulatório humano. Embora essas infecções sejam raras nos EUA, elas continuam a causar sofrimento generalizado no mundo em desenvolvimento hoje. As infecções fúngicas do sistema circulatório são muito raras. Portanto, eles não são discutidos neste capítulo.
Malária
Apesar de mais de um século de intensas pesquisas e avanços clínicos, a malária continua sendo uma das doenças infecciosas mais importantes do mundo atualmente. Sua ampla distribuição coloca em risco mais da metade da população mundial. Em 2015, a OMS estimou que havia cerca de 214 milhões de casos de malária em todo o mundo, resultando em cerca de 438.000 mortes; cerca de 88% dos casos e 91% das mortes ocorreram na África. 1 Embora a malária não seja atualmente uma grande ameaça nos EUA, a possibilidade de sua reintrodução é preocupante. A malária é causada por vários protozoários parasitas do gênero Plasmodium: P. falciparum, P. knowlesi, P. malariae, P. ovale e P. vivax. O plasmódio infecta principalmente os glóbulos vermelhos e é transmitido pela picada dos mosquitos Anopheles.
Atualmente, P. falciparum é a causa mais comum e letal da malária, frequentemente chamada de malária falciparum. A malária falciparum está disseminada em regiões altamente povoadas da África e da Ásia, colocando muitas pessoas em risco de contrair a forma mais grave da doença.
Os sinais e sintomas clássicos da malária são ciclos de febre extrema e calafrios. Os sintomas repentinos e violentos da malária começam com mal-estar, calafrios abruptos e febre (39—41° C [102,2—105,8° F]), pulso rápido e fraco, poliúria, dor de cabeça, mialgia, náuseas e vômitos. Após 2 a 6 horas desses sintomas, a febre diminui e a sudorese abundante ocorre por 2 a 3 horas, seguida de fadiga extrema. Esses sintomas são resultado do Plasmodium emergindo dos glóbulos vermelhos de forma síncrona, levando à ruptura simultânea de um grande número de glóbulos vermelhos, resultando em danos ao baço, fígado, linfonodos e medula óssea. O dano orgânico resultante da hemólise faz com que os pacientes desenvolvam lodo sanguíneo (ou seja, sangue no qual os glóbulos vermelhos se aglutinam em aglomerados) que podem levar à falta de oxigênio, necrose dos vasos sanguíneos, falência de órgãos e morte.
Em infecções estabelecidas, ciclos de malária de febre e calafrios geralmente ocorrem a cada 2 dias na doença descrita como malária terciana, causada por P. vivax e P. ovale. Os ciclos ocorrem a cada 3 dias na doença descrita como malária quartana, causada por P. malariae. Esses intervalos podem variar entre os casos.
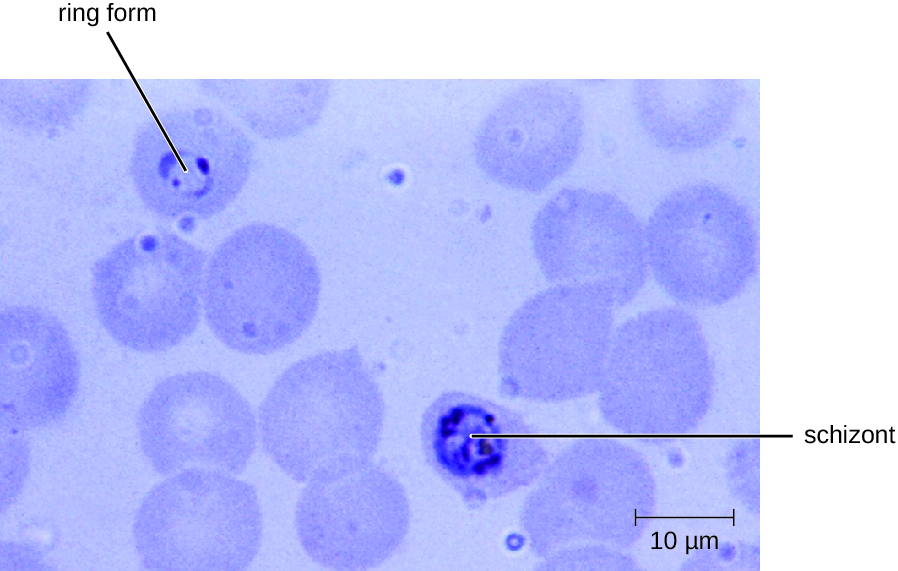
O plasmódio tem um ciclo de vida complexo que inclui vários estágios de desenvolvimento produzidos alternadamente em mosquitos e humanos (Figura\(\PageIndex{1}\)). Quando um mosquito infectado toma uma refeição de sangue, os esporozoítos na glândula salivar do mosquito são injetados no sangue do hospedeiro. Esses parasitas circulam para o fígado, onde se transformam em esquizontes. Os esquizontes então sofrem esquizogonia, resultando na liberação de muitos merozoítos de uma só vez. Os merozoítos se movem para a corrente sanguínea e infectam os glóbulos vermelhos. Dentro dos glóbulos vermelhos, os merozoítos se transformam em trofozoítos que produzem mais merozoítos. A liberação síncrona de merozoítos dos glóbulos vermelhos à noite leva aos sintomas da malária.
Além disso, alguns trofozoítos se desenvolvem alternativamente em gametócitos masculinos e femininos. Os gametócitos são absorvidos quando o mosquito toma uma refeição de sangue de um indivíduo infectado. A esporogonia sexual ocorre no intestino do mosquito. Os gametócitos se fundem para formar zigotos no intestino do inseto. Os zigotos se tornam móveis e se alongam em um ookinete. Essa forma penetra na parede do intestino médio e se transforma em um oocisto. Finalmente, o oocisto libera novos esporozoítos que migram para as glândulas salivares do mosquito para completar o ciclo de vida.
O diagnóstico da malária é feito pela observação microscópica das formas de desenvolvimento do Plasmodium em exames de sangue e ensaios rápidos de EIA que detectam antígenos ou enzimas do Plasmodium (Figura\(\PageIndex{2}\)). Medicamentos como cloroquina, atovaquona, artemeter e lumefantrina podem ser prescritos tanto para terapia aguda quanto profilática, embora alguns Plasmodium spp. tenham demonstrado resistência a medicamentos antimaláricos. O uso de inseticidas e mosquiteiros tratados com inseticida pode limitar a propagação da malária. Apesar dos esforços para desenvolver uma vacina contra a malária, nenhuma está disponível atualmente.
![Ciclo de vida do Plasmodium. [Estágios do fígado humano] 1 - O mosquito toma uma refeição de sangue e injeta plasmódio em um ser humano. 2 - O plasmódio infecta a célula do fígado. 3 - O plasmódio se multiplica na célula do fígado. [Estágios do sangue humano] 4 - O plasmódio entra no sangue. Um estágio anelar imaturo parece um anel de sinete em um glóbulo vermelho. Isso se torna um estágio anelar maduro e sofre mitose para produzir esquizontes que são liberados pela ruptura dos glóbulos vermelhos. 5 - Gametas (1n) produzidos pela meiose. [Estágios do mosquito] 6 - O mosquito toma uma refeição de sangue e ingere gametas. 7 - Os microgametas fertilizam o macrogameta. 8 - O zigoto (2n) se forma. 9 - O zigoto sofre mitose. 10 - O parasita se diferencia e entra na saliva do mosquito.](https://bio.libretexts.org/@api/deki/files/9172/OSC_Microbio_25_04_Malaria.jpg)
A campanha Nothing But Nets, uma iniciativa da Fundação das Nações Unidas, fez parceria com a Fundação Bill e Melinda Gates para disponibilizar mosquiteiros em países em desenvolvimento na África. Visite o site para saber mais sobre seus esforços para prevenir a malária.
Exercício\(\PageIndex{1}\)
Por que a malária é uma das doenças infecciosas mais importantes?
Toxoplasmose
A doença toxoplasmose é causada pelo protozoário Toxoplasma gondii. T. gondii é encontrado em uma grande variedade de aves e mamíferos, 2 e infecções humanas são comuns. Os Centros de Controle e Prevenção de Doenças (CDC) estimam que 22,5% da população com 12 anos ou mais foi infectada com T. gondii; mas indivíduos imunocompetentes são normalmente assintomáticos, no entanto. 3 Os gatos domésticos são os únicos hospedeiros definitivos conhecidos para os estágios sexuais do T. gondii e, portanto, são os principais reservatórios da infecção. Gatos infectados eliminam oocistos de T. gondii em suas fezes, e esses oocistos normalmente se espalham para humanos por meio do contato com matéria fecal no corpo dos gatos, em caixas sanitárias ou em canteiros onde gatos ao ar livre defecam.
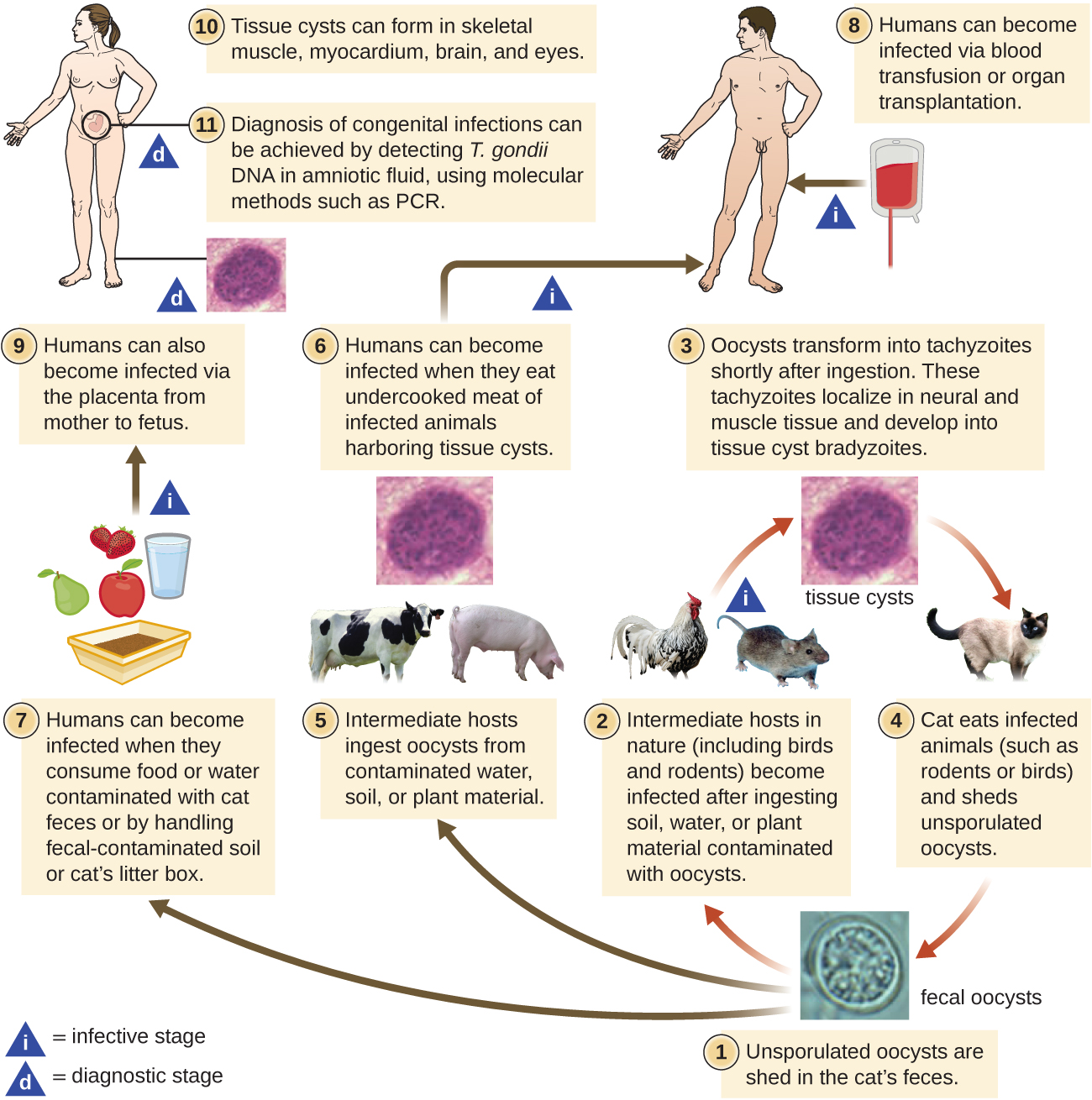
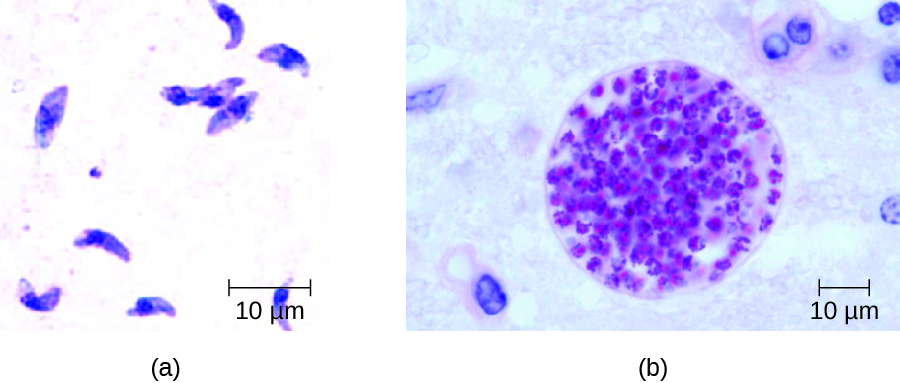
T. gondii tem um ciclo de vida complexo que envolve vários hospedeiros. O ciclo de vida do T. gondii começa quando oocistos não esporulados são eliminados nas fezes do gato. Esses oocistos levam de 1 a 5 dias para esporular no meio ambiente e se tornarem infecciosos. Os hospedeiros intermediários na natureza incluem pássaros e roedores, que são infectados após a ingestão de solo, água ou material vegetal contaminado com os oocistos infecciosos. Uma vez ingeridos, os oocistos se transformam em taquizoítos que se localizam no tecido neural e muscular do pássaro ou roedor, onde se desenvolvem em cistos teciduais. Os gatos podem ser infectados após consumir pássaros e roedores que abrigam cistos nos tecidos. Gatos e outros animais também podem ser infectados diretamente pela ingestão de oocistos esporulados no ambiente. Curiosamente, a infecção por Toxoplasma parece ser capaz de modificar o comportamento do hospedeiro. Camundongos infectados pelo Toxoplasma perdem o medo dos feromônios dos gatos. Como resultado, eles se tornam presas mais fáceis para os gatos, facilitando a transmissão do parasita para o hospedeiro definitivo do gato 4 (Figura\(\PageIndex{3}\)).
As infecções por toxoplasma em humanos são extremamente comuns, mas a maioria das pessoas infectadas é assintomática ou tem sintomas subclínicos. Alguns estudos sugerem que o parasita pode ser capaz de influenciar a personalidade e o desempenho psicomotor de humanos infectados, da mesma forma que modifica o comportamento em outros mamíferos. 5 Quando os sintomas ocorrem, eles tendem a ser leves e semelhantes aos da mononucleose. No entanto, a toxoplasmose assintomática pode se tornar problemática em determinadas situações. Os cistos podem se alojar em uma variedade de tecidos humanos e permanecer dormentes por anos. A reativação dessas infecções quiescentes pode ocorrer em pacientes imunocomprometidos após transplante, terapia contra o câncer ou o desenvolvimento de um distúrbio imunológico, como a AIDS. Em pacientes com AIDS que têm toxoplasmose, o sistema imunológico não consegue combater o crescimento de T. gondii nos tecidos do corpo; como resultado, esses cistos podem causar encefalite, retinite, pneumonite, distúrbios cognitivos e convulsões que podem eventualmente ser fatais.
A toxoplasmose também pode representar um risco durante a gravidez, pois os taquizoítos podem atravessar a placenta e causar infecções graves no feto em desenvolvimento. A extensão do dano fetal resultante da toxoplasmose depende da gravidade da doença materna, do dano à placenta, da idade gestacional do feto quando infectado e da virulência do organismo. A toxoplasmose congênita geralmente leva à perda fetal ou parto prematuro e pode resultar em danos ao sistema nervoso central, manifestando-se como retardo mental, surdez ou cegueira. Consequentemente, as mulheres grávidas são aconselhadas pelo CDC a tomarem cuidado especial ao preparar carne, jardinar e cuidar de gatos de estimação. 6 O diagnóstico da infecção por toxoplasmose durante a gravidez geralmente é feito por sorologia, incluindo o teste TORCH (o “T” em TORCH significa toxoplasmose). O diagnóstico de infecções congênitas também pode ser feito pela detecção do DNA de T. gondii no líquido amniótico, usando métodos moleculares como PCR.
Em adultos, o diagnóstico de toxoplasmose pode incluir a observação de cistos teciduais em amostras de tecido. Cistos teciduais podem ser observados em amostras de biópsia coradas por Giemsa ou Wright, e tomografia computadorizada, ressonância magnética e punção lombar também podem ser usadas para confirmar a infecção (Figura\(\PageIndex{4}\)).
Prevenir infecções é a melhor defesa de primeira linha contra a toxoplasmose. As medidas preventivas incluem lavar bem as mãos após manusear carne crua, solo ou maca de gato e evitar o consumo de vegetais possivelmente contaminados com fezes de gato. Toda carne deve ser cozida a uma temperatura interna de 73,9—76,7 °C (165—170 °F).
A maioria dos pacientes imunocompetentes não necessita de intervenção clínica para infecções por Toxoplasma. No entanto, recém-nascidos, mulheres grávidas e pacientes imunocomprometidos podem ser tratados com pirimetamina e sulfadiazina, exceto durante o primeiro trimestre da gravidez, porque esses medicamentos podem causar defeitos congênitos. A espiramicina tem sido usada com segurança para reduzir a transmissão em mulheres grávidas com infecção primária durante o primeiro trimestre porque não atravessa a placenta.
Exercício\(\PageIndex{2}\)
Como o T. gondii infecta humanos?
Babesiose
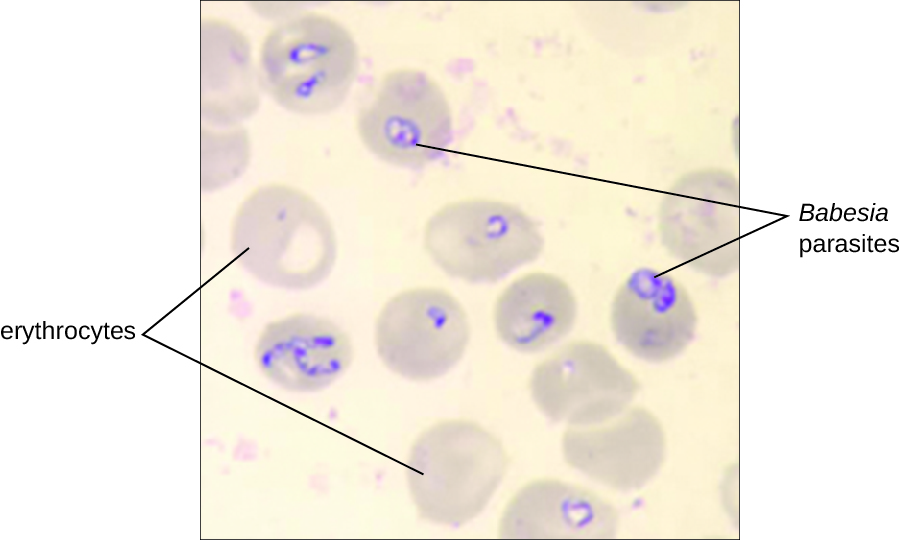
A babesiose é uma doença infecciosa zoonótica rara causada por Babesia spp. Esses protozoários parasitas infectam vários animais selvagens e domésticos e podem ser transmitidos aos humanos por carrapatos Ixodes de patas pretas. Em humanos, a Babesia infecta os glóbulos vermelhos e se replica dentro da célula até que ela se rompa. A Babesia liberada pela ruptura dos glóbulos vermelhos continua o ciclo de crescimento invadindo outros glóbulos vermelhos. Os pacientes podem ser assintomáticos, mas aqueles que apresentam sintomas geralmente apresentam inicialmente mal-estar, fadiga, calafrios, febre, dor de cabeça, mialgia e artralgia. Em casos raros, particularmente em pacientes asplênicos (ausência do baço), idosos e pacientes com AIDS, a babesiose pode se assemelhar à malária falciparum, com febre alta, anemia hemolítica, hemoglobinúria (hemoglobina ou sangue na urina), icterícia e insuficiência renal, e a infecção pode ser fatal. A infecção assintomática por Babesia adquirida anteriormente pode se tornar sintomática se uma esplenectomia for realizada.
O diagnóstico é baseado principalmente na observação microscópica de parasitas em exames de sangue (Figura\(\PageIndex{5}\)). A detecção sorológica e de anticorpos pelo IFA também pode ser realizada e testes baseados em PCR estão disponíveis. Muitas pessoas não necessitam de intervenção clínica para infecções por Babesia, no entanto, infecções graves podem ser eliminadas com uma combinação de atovaquona e azitromicina ou uma combinação de clindamicina e quinina.
Doença de Chagas
Também chamada de tripanossomíase americana, a doença de Chagas é uma zoonose classificada como doença tropical negligenciada (DTN). É causada pelo protozoário flagelado Trypanosoma cruzi e é mais comumente transmitida a animais e pessoas por meio das fezes de insetos triatomíneos. O inseto triatomíneo é apelidado de percevejo beijador porque freqüentemente pica humanos no rosto ou ao redor dos olhos; o inseto geralmente defeca perto da picada e a matéria fecal infectada pode ser esfregada na ferida pela picada pelo indivíduo picado (Figura\(\PageIndex{6}\)). A picada em si é indolor e, inicialmente, muitas pessoas não apresentam sinais da doença. Modos alternativos de transmissão incluem transfusões de sangue contaminado, transplantes de órgãos de doadores infectados e transmissão congênita da mãe para o feto.
A doença de Chagas é endêmica em grande parte do México, América Central e América do Sul, onde, de acordo com a OMS, estima-se que entre 6 milhões e 7 milhões de pessoas estejam infectadas. 7 Atualmente, a doença de Chagas não é endêmica nos EUA, embora os triatomíneos sejam encontrados na metade sul do país.
Os triatomíneos geralmente são ativos à noite, quando fazem refeições com sangue mordendo o rosto e os lábios de pessoas ou animais enquanto dormem e geralmente defecam perto do local da picada. A infecção ocorre quando o hospedeiro esfrega as fezes nos olhos, na boca, na picada ou em outra fenda na pele. O protozoário então entra no sangue e invade tecidos do coração e do sistema nervoso central, além de macrófagos e monócitos. Os reservatórios não humanos de parasitas do T. cruzi incluem animais selvagens e animais domesticados, como cães e gatos, que também atuam como reservatórios do patógeno. 8
Existem três fases da doença de Chagas: aguda, intermediária e crônica. Essas fases podem ser assintomáticas ou potencialmente fatais, dependendo do estado de imunocompetência do paciente.
Na fase aguda da doença, os sintomas incluem febre, dor de cabeça, mialgia, erupção cutânea, vômitos, diarreia e aumento do baço, fígado e linfonodos. Além disso, um nódulo localizado chamado chagoma pode se formar no portal de entrada, e o inchaço das pálpebras ou da lateral da face, chamado sinal de Romaña, pode ocorrer próximo à ferida da picada. Os sintomas da fase aguda podem desaparecer espontaneamente, mas se não for tratada, a infecção pode persistir nos tecidos, causando danos irreversíveis ao coração ou ao cérebro. Em casos raros, crianças pequenas podem morrer de miocardite ou meningoencefalite durante a fase aguda da doença de Chagas.
Após a fase aguda, há uma fase intermediária prolongada, durante a qual poucos ou nenhum parasita é encontrado no sangue e a maioria das pessoas é assintomática. Muitos pacientes permanecerão assintomáticos por toda a vida; no entanto, décadas após a exposição, estima-se que 20% a 30% das pessoas infectadas desenvolverão doenças crônicas que podem ser debilitantes e às vezes fatais. Na fase crônica, os pacientes podem desenvolver inchaço doloroso do cólon, levando a fortes torções, constipação e obstrução intestinal; inchaço doloroso do esôfago, levando à disfagia e desnutrição; e cardiomegalia flácida (aumento do coração), que pode levar à insuficiência cardíaca e morte súbita .
O diagnóstico pode ser confirmado por meio de vários testes diferentes, incluindo observação microscópica direta de tripanossomas no sangue, IFA, EIAs, PCR e cultura em meio artificial. Em regiões endêmicas, xenodiagnósticos podem ser usados; esse método envolve permitir que percevejos não infectados se alimentem do paciente e, em seguida, examinar suas fezes para detectar a presença de T. cruzi.
Os medicamentos nifurtimox e benznidazol são tratamentos eficazes durante a fase aguda da doença de Chagas. A eficácia desses medicamentos é muito menor quando a doença está na fase crônica. Evitar a exposição ao patógeno por meio do controle vetorial é o método mais eficaz para limitar essa doença.
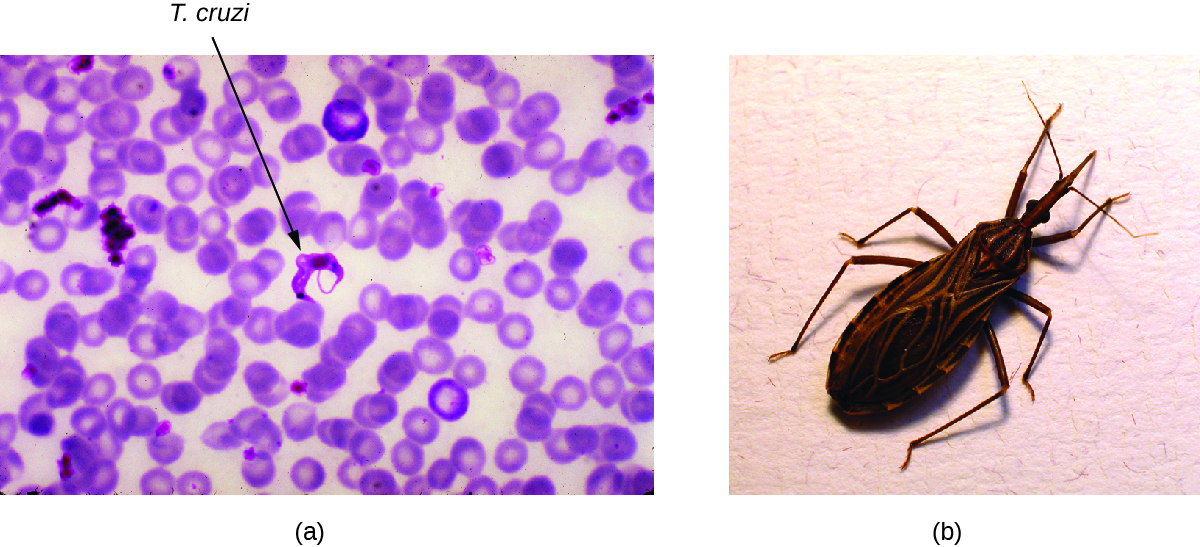
Exercício\(\PageIndex{3}\)
Como os insetos beijadores infectam humanos com o Trypanosoma cruzi?
Leishmaniose
Embora seja classificada como uma DTN, a leishmaniose é relativamente difundida nas regiões tropicais e subtropicais, afetando pessoas em mais de 90 países. É causada por aproximadamente 20 espécies diferentes de Leishmania, protozoários parasitas que são transmitidos por vetores de flebotomíneos, como Phlebotomus spp. e Lutzomyia spp. Cães, gatos, ovelhas, cavalos, gado, roedores e humanos podem servir como reservatórios.
O protozoário Leishmania é fagocitado por macrófagos, mas usa fatores de virulência para evitar a destruição dentro do fagolisossomo. Os fatores de virulência inibem as enzimas fagolisossomas que, de outra forma, destruiriam o parasita. O parasita se reproduz dentro do macrófago, o lisa e a progênie infecta novos macrófagos (consulte Microconexões: quando a fagocitose falha).
As três principais formas clínicas da leishmaniose são cutânea (ferida oriental, fervura de Delhi, fervura de Alepo), visceral (calazar, febre de Dumdum) e mucosa (espundia). A forma mais comum de doença é a leishmaniose cutânea, que se caracteriza pela formação de feridas no local da picada do inseto que podem começar como pápulas ou nódulos antes de se transformarem em grandes úlceras (Figura\(\PageIndex{7}\)).
A leishmaniose visceral pode levar meses e, às vezes, anos para se desenvolver, levando ao aumento dos gânglios linfáticos, fígado, baço e medula óssea. Os danos a esses locais do corpo provocam febre, perda de peso e inchaço do baço e do fígado. Também causa uma diminuição no número de glóbulos vermelhos (anemia), glóbulos brancos (leucopenia) e plaquetas (trombocitopenia), fazendo com que o paciente fique imunocomprometido e mais suscetível a infecções fatais nos pulmões e no trato gastrointestinal.
A forma mucosa da leishmaniose é uma das formas menos comuns da doença. Causa uma lesão semelhante à forma cutânea, mas a leishmaniose mucosa está associada às membranas mucosas da boca, narinas ou faringe e pode ser destrutiva e desfigurante. A leishmaniose mucosa ocorre com menos frequência quando a infecção cutânea (pele) original é prontamente tratada.
O diagnóstico definitivo da leishmaniose é feito pela visualização de organismos em esfregaços corados com Giemsa, pelo isolamento de protozoários de Leishmania em culturas ou por ensaios de PCR de aspirados de tecidos infectados. Sondas de DNA específicas ou análises de parasitas em cultura podem ajudar a distinguir espécies de Leishmania que causam leishmaniose cutânea simples daquelas capazes de causar leishmaniose mucosa.
A leishmaniose cutânea geralmente não é tratada. As lesões desaparecerão após semanas (ou vários meses), mas podem resultar em cicatrizes. As taxas de recorrência são baixas para esta doença. Infecções mais graves podem ser tratadas com estibogluconato (gluconato de antimônio), anfotericina B e miltefosina.

Exercício\(\PageIndex{4}\)
Compare as formas mucosa e cutânea da leishmaniose.
Esquistossomose
A esquistossomose (bilharzia) é uma DTN causada por vermes sanguíneos do gênero Schistosoma que são nativos do Caribe, América do Sul, Oriente Médio, Ásia e África. A maioria dos casos de esquistossomose humana é causada por Schistosoma mansoni, S. haematobium ou S. japonicum. Os esquistossomas são os únicos trematódeos que invadem a pele; todos os outros trematódeos infectam pela ingestão. A OMS estima que pelo menos 258 milhões de pessoas precisaram de tratamento preventivo para a esquistossomose em 2014. 9
Hospedeiros humanos infectados liberam ovos de Schistosoma na urina e nas fezes, o que pode contaminar os habitats de água doce de caracóis que servem como hospedeiros intermediários. Os ovos eclodem na água, liberando miracídios, um estágio intermediário de crescimento do Schistosoma que infecta os caramujos. Os miracídios amadurecem e se multiplicam dentro dos caramujos, transformando-se em cercárias que saem do caracol e entram na água, onde podem penetrar na pele de nadadores e banhistas. As cercárias migram pelo tecido humano e entram na corrente sanguínea, onde amadurecem e se transformam em vermes adultos machos e fêmeas que se acasalam e liberam óvulos fertilizados. Os óvulos viajam pela corrente sanguínea e penetram em vários locais do corpo, incluindo a bexiga ou o intestino, dos quais são excretados na urina ou nas fezes para reiniciar o ciclo de vida (Figura 5.2.4).
Alguns dias após a infecção, os pacientes podem desenvolver uma erupção cutânea ou coceira na pele associada ao local de penetração das cercárias. Dentro de 1 a 2 meses após a infecção, os sintomas podem se desenvolver, incluindo febre, calafrios, tosse e mialgia, pois os óvulos que não são excretados circulam pelo corpo. Após anos de infecção, os óvulos se alojam nos tecidos e provocam inflamações e cicatrizes que podem danificar o fígado, o sistema nervoso central, o intestino, o baço, os pulmões e a bexiga. Isso pode causar dor abdominal, aumento do fígado, sangue na urina ou nas fezes e problemas na urina. O aumento do risco de câncer de bexiga também está associado à infecção crônica por Schistosoma. Além disso, crianças infectadas repetidamente podem desenvolver desnutrição, anemia e dificuldades de aprendizagem.
O diagnóstico da esquistossomose é feito pela observação microscópica de ovos em amostras de fezes ou urina, intestino ou tecido vesical ou testes sorológicos. O medicamento praziquantel é eficaz no tratamento de todas as infecções esquistossomáticas. Melhorar o gerenciamento de águas residuais e educar as populações em risco para limitar a exposição à água contaminada pode ajudar a controlar a propagação da doença.
Dermatite cervical
A cercária de algumas espécies de Schistosoma só pode se transformar em vermes adultos e completar seu ciclo de vida em animais hospedeiros, como aves migratórias e mamíferos. As cercárias desses vermes ainda são capazes de penetrar na pele humana, mas não conseguem estabelecer uma infecção produtiva no tecido humano. Ainda assim, a presença da cercária em pequenos vasos sanguíneos desencadeia uma resposta imune, resultando em inchaços elevados com coceira, chamados de dermatite cercária (também conhecida como coceira de nadador ou coceira de escavador de moluscos). Embora seja desconfortável, a dermatite cercária geralmente é autolimitada e raramente é grave. Anti-histamínicos e antipruríticos podem ser usados para limitar a inflamação e a coceira, respectivamente.
Exercício\(\PageIndex{5}\)
Como ocorrem as infecções por esquistossomo em humanos?
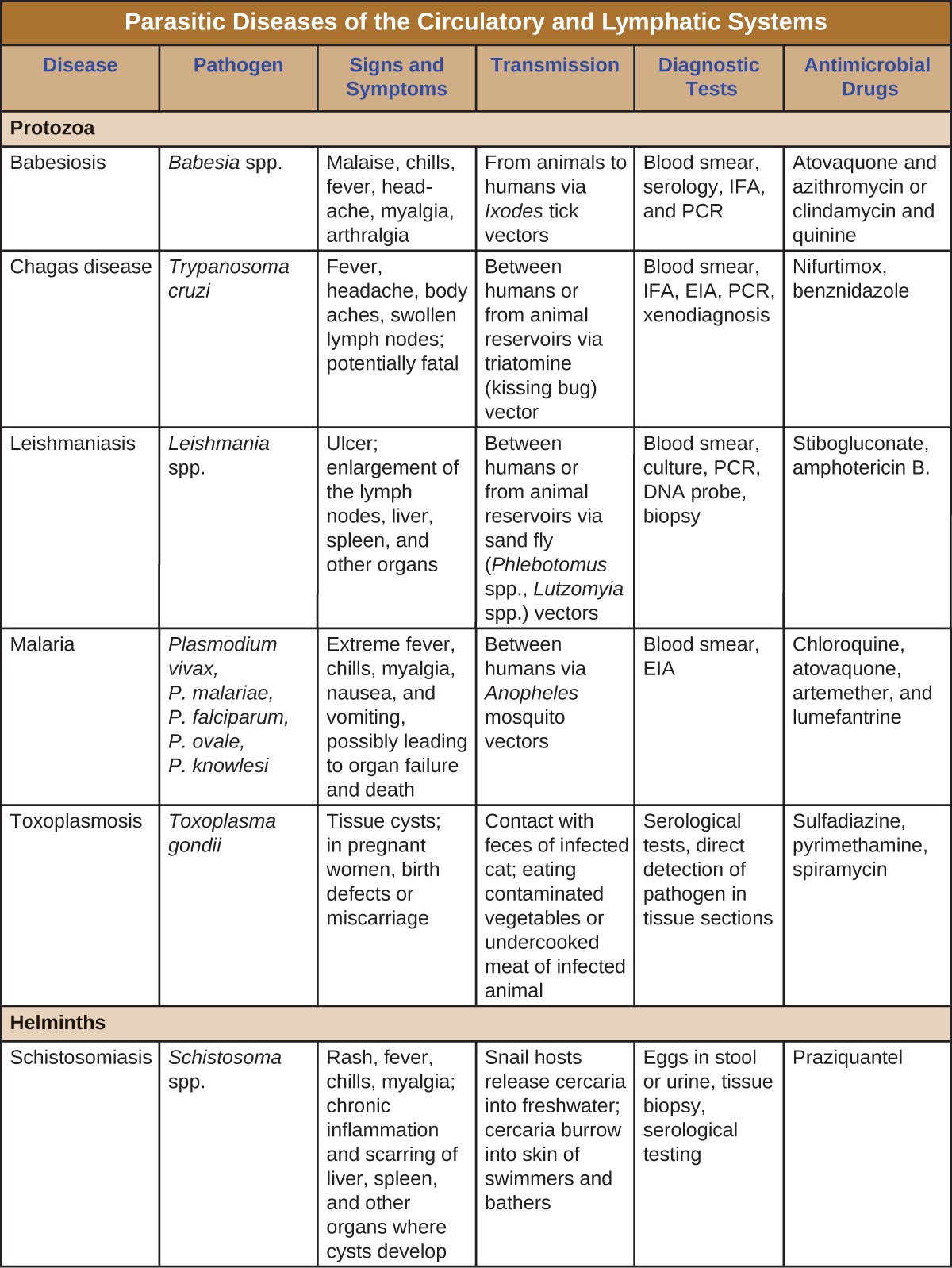
Patógenos eucarióticos comuns do sistema circulatório humano
As infecções por protozoários e helmintos são prevalentes no mundo em desenvolvimento. Algumas das infecções parasitárias mais importantes estão resumidas na Figura\(\PageIndex{8}\).
Apesar do tratamento contínuo com antibióticos e da remoção do cateter venoso, a condição de Barbara diminuiu ainda mais. Ela começou a mostrar sinais de choque e sua pressão arterial caiu para 77/50 mmHg. Antiinflamatórios e drotrecogina-α foram administrados para combater a sepse. No entanto, no sétimo dia de hospitalização, Barbara teve insuficiência hepática e renal e morreu.
O Staphylococcus aureus provavelmente formou um biofilme na superfície do cateter de Barbara. A partir daí, a bactéria foi introduzida cronicamente em sua circulação e produziu os sintomas clínicos iniciais. As terapias quimioterápicas falharam em grande parte por causa do isolado de MRSA resistente a medicamentos. Fatores de virulência como leucocidina e hemolisinas também interferiram em sua resposta imune. O declínio final de Barbara pode ter sido uma consequência da produção de enterotoxinas e da toxina da síndrome do choque tóxico (TSST), que podem iniciar o choque tóxico.
Cateteres venosos são intervenções comuns que salvam vidas para muitos pacientes que necessitam de administração de medicamentos ou fluidos a longo prazo. No entanto, eles também são locais comuns de infecções da corrente sanguínea. A Organização Mundial da Saúde estima que haja até 80.000 infecções da corrente sanguínea relacionadas ao cateter a cada ano nos EUA, resultando em cerca de 20.000 mortes. 10
Conceitos principais e resumo
- A malária é um protozoário parasita que continua sendo uma importante causa de morte principalmente nos trópicos. Várias espécies do gênero Plasmodium são responsáveis pela malária e todas são transmitidas pelos mosquitos Anopheles. O plasmódio infecta e destrói os glóbulos vermelhos humanos, causando danos aos órgãos, anemia, necrose dos vasos sanguíneos e morte. A malária pode ser tratada com vários medicamentos antimaláricos e prevenida por meio do controle vetorial.
- A toxoplasmose é uma infecção protozoária generalizada que pode causar infecções graves em fetos imunocomprometidos e em fetos em desenvolvimento. Os gatos domésticos são o hospedeiro definitivo.
- A babesiose é uma infecção geralmente assintomática dos glóbulos vermelhos que pode causar sintomas semelhantes aos da malária em pacientes idosos, imunocomprometidos ou asplênicos.
- A doença de Chagas é uma doença tropical transmitida por insetos triatomíneos. O tripanossomo infecta coração, tecidos neurais, monócitos e fagócitos, muitas vezes permanecendo latente por muitos anos antes de causar danos graves e às vezes fatais ao sistema digestivo e ao coração.
- A leishmaniose é causada pelo protozoário Leishmania e é transmitida por flebotomíneos. Os sintomas geralmente são leves, mas casos graves podem causar danos aos órgãos, anemia e perda da competência imune.
- A esquistossomose é causada por um verme transmitido por caracóis. O verme se move por todo o corpo na corrente sanguínea e infecta cronicamente vários tecidos, causando danos aos órgãos.
Notas de pé
- 1 Organização Mundial da Saúde. “Relatório Mundial sobre Malária 2015: Resumo”. 2015. http://www.who.int/malaria/publicati...015/report/en/. Acessado em 28 de julho de 2016.
- 2 da manhã Tenter et al.. “Toxoplasma gondii: dos animais aos humanos”. Jornal Internacional de Parasitologia 30 no. 12-13 (2000) :1217—1258.
- 3 Centros de Controle e Prevenção de Doenças. “Parasitas - Toxoplasmose (infecção por toxoplasma). Epidemiologia e fatores de risco.” 2015 http://www.cdc.gov/parasites/toxoplasmosis/epi.html. Acessado em 28 de julho de 2016.
- 4 J. Flegr. “Efeitos do Toxoplasma no comportamento humano”. Boletim de Esquizofrenia 33, nº 3 (2007) :757—760.
- 5 Ibidem
- 6 Centros de Controle e Prevenção de Doenças. “Parasitas - Toxoplasmose (infecção por Toxoplasma). Perguntas frequentes sobre toxoplasmose (FAQs).” 2013. http://www.cdc.gov/parasites/toxopla...info/faqs.html. Acessado em 28 de julho de 2016.
- 7 Organização Mundial da Saúde. “Doença de Chagas (tripanossomíase americana). Folha informativa.” 2016. http://www.who.int/mediacentre/factsheets/fs340/en/. Acessado em 29 de julho de 2016.
- 8 C.E. Reisenman et al. “Infecção de percevejos pelo Trypanosoma cruzi, Tucson, Arizona, EUA.” Doenças infecciosas emergentes 16 no. 3 (2010) :400—405.
- 9 Organização Mundial da Saúde. “Esquistossomose. Folha informativa.” 2016. http://www.who.int/mediacentre/factsheets/fs115/en/. Acessado em 29 de julho de 2016.
- 10 Organização Mundial da Saúde. “Segurança do paciente, prevenção de infecções da corrente sanguínea a partir de cateteres venosos da linha central”. 2016. www.who.int/patientsafety/imp... tation/bsi/en/. Acessado em 29 de julho de 2016.


