24.3: Infecções bacterianas do trato gastrointestinal
- Page ID
- 181807
Objetivos de
- Identifique as bactérias mais comuns que podem causar infecções do trato gastrointestinal
- Compare as principais características de doenças bacterianas específicas que afetam o trato gastrointestinal
Uma ampla gama de doenças gastrointestinais é causada pela contaminação bacteriana dos alimentos. Lembre-se de que doenças transmitidas por alimentos podem surgir de infecção ou intoxicação. Em ambos os casos, as toxinas bacterianas são normalmente responsáveis por produzir sinais e sintomas da doença. A distinção está em onde as toxinas são produzidas. Em uma infecção, o agente microbiano é ingerido, coloniza o intestino e, em seguida, produz toxinas que danificam as células hospedeiras. Em uma intoxicação, as bactérias produzem toxinas nos alimentos antes de serem ingeridos. Em ambos os casos, as toxinas causam danos às células que revestem o trato gastrointestinal, normalmente o cólon. Isso leva a sinais e sintomas comuns de diarreia ou fezes aquosas e cólicas abdominais, ou disenteria mais grave. Os sintomas de doenças transmitidas por alimentos também costumam incluir náuseas e vômitos, que são mecanismos que o corpo usa para expulsar os materiais tóxicos.
A maioria das doenças gastrointestinais bacterianas é de curta duração e autolimitada; no entanto, a perda de fluidos devido a doenças diarreicas graves pode levar à desidratação que pode, em alguns casos, ser fatal sem tratamento adequado. A terapia de reidratação oral com soluções eletrolíticas é um aspecto essencial do tratamento para a maioria dos pacientes com doenças gastrointestinais, especialmente em crianças e bebês.
Intoxicação alimentar estafilocócica
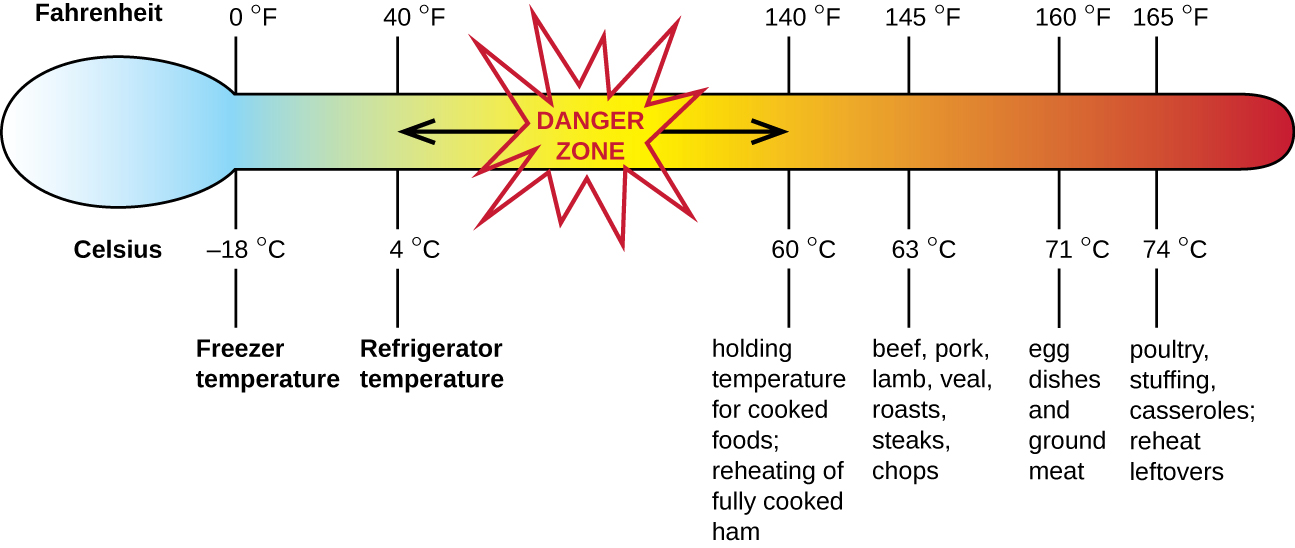
A intoxicação alimentar estafilocócica é uma forma de intoxicação alimentar. Quando o Staphylococcus aureus cresce em alimentos, ele pode produzir enterotoxinas que, quando ingeridas, podem causar sintomas como náuseas, diarreia, cólicas e vômitos em uma a seis horas. Em alguns casos graves, pode causar dor de cabeça, desidratação e alterações na pressão arterial e na frequência cardíaca. Os sinais e sintomas desaparecem em 24 a 48 horas. O S. aureus é frequentemente associado a uma variedade de alimentos crus ou mal cozidos e cozidos, incluindo carne (por exemplo, carne enlatada, presunto e salsichas) e laticínios (por exemplo, queijos, leite e manteiga). Também é comumente encontrado nas mãos e pode ser transmitido aos alimentos preparados por meio de falta de higiene, incluindo lavagem inadequada das mãos e uso de superfícies contaminadas de preparação de alimentos, como tábuas de corte. O maior risco é o alimento deixado em uma temperatura abaixo de 60° C (140° F), o que permite que a bactéria cresça. Os alimentos cozidos geralmente devem ser reaquecidos a pelo menos 60° C (140° F) por segurança e a maioria das carnes cruas deve ser cozida em temperaturas internas ainda mais altas (Figura\(\PageIndex{1}\)).
Existem pelo menos 21 enterotoxinas estafilocócicas e toxinas semelhantes às enterotoxinas estafilocócicas que podem causar intoxicação alimentar. As enterotoxinas são proteínas resistentes ao baixo pH, permitindo que elas passem pelo estômago. Eles são estáveis ao calor e não são destruídos pela fervura a 100 °C. Embora a própria bactéria possa ser morta, as enterotoxinas sozinhas podem causar vômitos e diarreia, embora os mecanismos não sejam totalmente compreendidos. Pelo menos alguns dos sintomas podem ser causados pelo funcionamento da enterotoxina como um superantígeno e provocar uma forte resposta imune ao ativar a proliferação de células T.
O rápido início dos sinais e sintomas ajuda a diagnosticar essa doença de origem alimentar. Como a bactéria não precisa estar presente para que a toxina cause sintomas, o diagnóstico é confirmado pela identificação da toxina em uma amostra de alimento ou em amostras biológicas (fezes ou vômito) do paciente. Técnicas sorológicas, incluindo ELISA, também podem ser usadas para identificar a toxina em amostras de alimentos.
A condição geralmente se resolve de forma relativamente rápida, em 24 horas, sem tratamento. Em alguns casos, pode ser necessário tratamento de suporte em um hospital.
Exercício\(\PageIndex{1}\)
Como o S. aureus pode causar intoxicação alimentar?
Shigelose (disenteria bacilar)
Quando a doença gastrointestinal está associada à bactéria gram-negativa Shigella, em forma de bastonete, ela é chamada de disenteria bacilar ou shigelose. As infecções podem ser causadas por S. dysenteriae, S. flexneri, S. boydii e/ou S. sonnei que colonizam o trato gastrointestinal. A shigelose pode ser transmitida da mão para a boca ou por meio de alimentos e água contaminados. Mais comumente, é transmitida pela via fecal-oral.
A bactéria Shigella invade as células epiteliais intestinais. Quando inseridos em um fagossomo, eles podem escapar e viver dentro do citoplasma da célula ou se mover para células adjacentes. À medida que os organismos se multiplicam, o epitélio e as estruturas com células M das manchas de Peyer no intestino podem ficar ulcerados e causar perda de fluido. Cólicas estomacais, febre e diarreia aquosa, que também podem conter pus, muco e/ou sangue, geralmente se desenvolvem. Casos mais graves podem resultar em ulceração da mucosa, desidratação e sangramento retal. Além disso, os pacientes podem desenvolver posteriormente a síndrome hemolítica urêmica (SHU), uma condição grave na qual células sanguíneas danificadas se acumulam nos rins e podem causar insuficiência renal, ou artrite reativa, uma condição na qual a artrite se desenvolve em várias articulações após a infecção. Os pacientes também podem desenvolver a síndrome crônica do intestino irritável pós-infecção (SII).
S. dysenteriae tipo 1 é capaz de produzir a toxina Shiga, que tem como alvo as células endoteliais de pequenos vasos sanguíneos no intestino delgado e grosso por meio da ligação a um glicoesfingolipídeo. Uma vez dentro das células endoteliais, a toxina atinge a grande subunidade ribossômica, afetando a síntese protéica dessas células. Podem ocorrer hemorragias e lesões no cólon. A toxina pode atingir o glomérulo do rim, os vasos sanguíneos onde começa a filtração do sangue no rim, resultando em SHU.
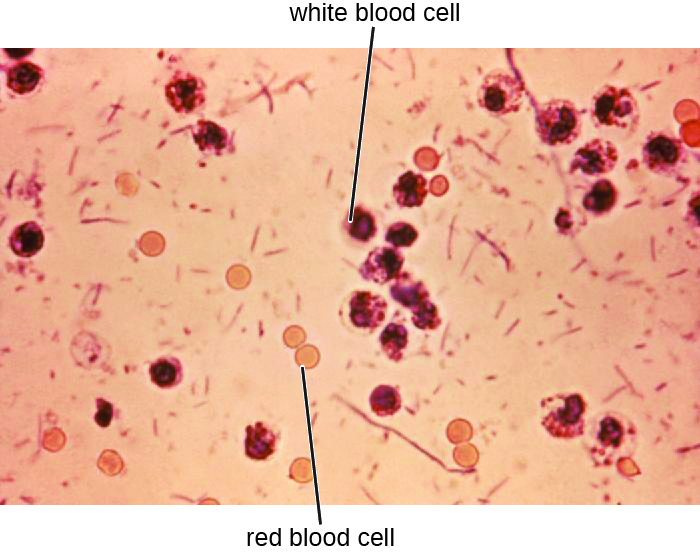
As amostras de fezes, que devem ser processadas imediatamente, são analisadas usando técnicas sorológicas ou moleculares. Um método comum é realizar imunoensaios para S. dysenteriae. (Outros métodos que podem ser usados para identificar Shigella incluem tiras de teste de API, sistemas Enterotube ou testes de PCR. A presença de glóbulos brancos e sangue nas amostras fecais ocorre em cerca de 70% dos pacientes 1 (Figura\(\PageIndex{2}\)). Casos graves podem requerer antibióticos como ciprofloxacina e azitromicina, mas devem ser prescritos com cuidado, pois a resistência é cada vez mais comum.
Exercício\(\PageIndex{2}\)
Compare e contraste infecções e intoxicações por Shigella.
Salmonelose
A gastroenterite por Salmonella, também chamada de salmonelose, é causada pela bactéria gram-negativa em forma de bastonete, Salmonella. Duas espécies, S. enterica e S. bongori, causam doenças em humanos, mas S. enterica é a mais comum. Os sorotipos mais comuns de S. enterica são Enteritidis e Typhi. Discutiremos a febre tifóide causada pelos sorotipos Typhi e Paratyphi A separadamente. Aqui, vamos nos concentrar na salmonelose causada por outros sorotipos.
A salmonela faz parte da microbiota intestinal normal de muitos indivíduos. No entanto, a salmonelose é causada por agentes exógenos e a infecção pode ocorrer dependendo do sorotipo, tamanho do inóculo e saúde geral do hospedeiro. A infecção é causada pela ingestão de alimentos contaminados, pelo manuseio de cascas de ovos ou pela exposição a certos animais. A salmonela faz parte da microbiota das aves, portanto, a exposição a ovos crus e aves cruas pode aumentar o risco de infecção. Lavar as mãos e cozinhar bem os alimentos reduz muito o risco de transmissão. A bactéria Salmonella pode sobreviver ao congelamento por longos períodos, mas não pode sobreviver a altas temperaturas.
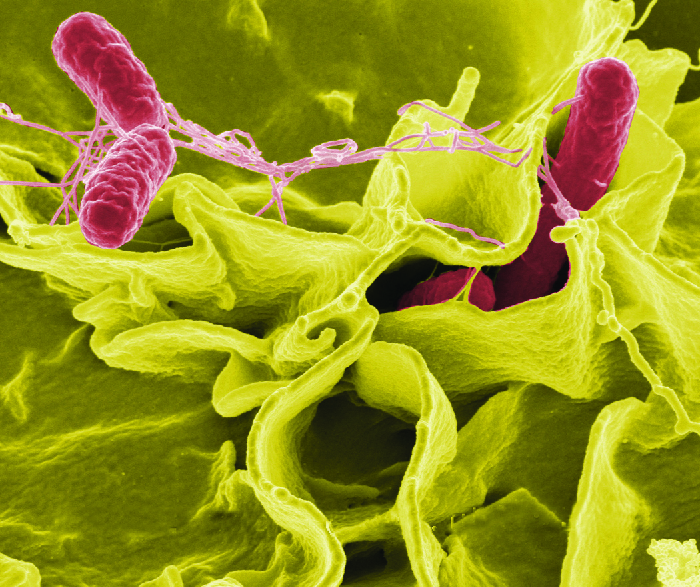
Uma vez ingeridas, as bactérias se multiplicam no intestino e penetram nas células epiteliais da mucosa através das células M, onde continuam a crescer (Figura\(\PageIndex{3}\)). Eles desencadeiam processos inflamatórios e a hipersecreção de fluidos. Uma vez dentro do corpo, eles podem persistir dentro dos fagossomos dos macrófagos. A salmonela pode atravessar a membrana celular epitelial e entrar na corrente sanguínea e no sistema linfático. Algumas cepas de Salmonella também produzem uma enterotoxina que pode causar intoxicação.
Indivíduos infectados desenvolvem febre, náuseas, cólicas abdominais, vômitos, dor de cabeça e diarreia. Esses sinais e sintomas geralmente duram de alguns dias a uma semana. De acordo com os Centros de Controle e Prevenção de Doenças (CDC), há 1.000.000 de casos anualmente, com 380 mortes a cada ano. 2 No entanto, como a doença geralmente é autolimitada, muitos casos não são relatados aos médicos e a incidência geral pode estar subnotificada. O diagnóstico envolve cultura seguida de serotipagem e impressão digital de DNA, se necessário. Os resultados positivos são reportados ao CDC. Quando um sorotipo incomum é detectado, as amostras são enviadas ao CDC para análise posterior. A serotipagem é importante para determinar o tratamento. A terapia de reidratação oral é comumente usada. Antibióticos são recomendados apenas para casos graves. Quando são necessários antibióticos, como em pacientes imunocomprometidos, são recomendadas fluoroquinolonas, cefalosporinas de terceira geração e ampicilina. A resistência aos antibióticos é uma preocupação séria.
Febre tifoide
Certos sorotipos de S. enterica, principalmente o sorotipo Typhi (S. typhi), mas também de Paratyphi, causam um tipo mais grave de salmonelose chamado febre tifóide. Essa doença grave, que tem uma taxa de mortalidade não tratada de 10%, causa febre alta, dores no corpo, dor de cabeça, náuseas, letargia e uma possível erupção cutânea.
Alguns indivíduos são portadores de S. typhi sem apresentar sinais ou sintomas (conhecidos como portadores assintomáticos) e os eliminam continuamente pelas fezes. Esses portadores geralmente têm a bactéria na vesícula biliar ou no epitélio intestinal. Indivíduos que consomem alimentos ou água contaminados com essas fezes podem ser infectados.
O S. typhi penetra na mucosa intestinal, cresce dentro dos macrófagos e é transportado pelo corpo, principalmente para o fígado e a vesícula biliar. Eventualmente, os macrófagos se lisam, liberando S. typhi na corrente sanguínea e no sistema linfático. A mortalidade pode resultar da ulceração e perfuração do intestino. Uma ampla gama de complicações, como pneumonia e icterícia, pode ocorrer com a doença disseminada.
S. typhi tem ilhas de patogenicidade de Salmonella (SPIs) que contêm os genes de muitos de seus fatores de virulência. Dois exemplos de toxinas tifóides importantes são o antígeno Vi, que codifica a produção de cápsulas, e a toxina quimérica A2B5, que causa muitos dos sinais e sintomas da fase aguda da febre tifóide.
O exame clínico e a cultura são usados para fazer o diagnóstico. A bactéria pode ser cultivada a partir de fezes, urina, sangue ou medula óssea. A sorologia, incluindo ELISA, é usada para identificar as cepas mais patogênicas, mas a confirmação com testes de DNA ou cultura é necessária. Um teste de PCR também pode ser usado, mas não está amplamente disponível.
O tratamento antibiótico recomendado envolve fluoroquinolonas, ceftriaxona e azitromicina. Os indivíduos devem ser extremamente cuidadosos para evitar infectar outras pessoas durante o tratamento. A febre tifóide pode ser prevenida por meio da vacinação para indivíduos que viajam para partes do mundo onde é comum.
Exercício\(\PageIndex{3}\)
Por que a serotipagem é particularmente importante nas infecções por Salmonella e na febre tifóide?
Mary Mallon era uma imigrante irlandesa que trabalhou como cozinheira em Nova York no início do século XX. Durante sete anos, de 1900 a 1907, Mallon trabalhou para várias famílias diferentes, espalhando, sem saber, doenças para as pessoas que viviam em cada uma. Em 1906, uma família contratou George Soper, especialista em epidemias de febre tifóide, para determinar a causa das doenças em sua casa. Eventualmente, Soper localizou Mallon e vinculou diretamente 22 casos de febre tifóide a ela. Ele descobriu que Mallon era portadora da febre tifóide, mas ela mesma estava imune a ela. Embora os portadores ativos tenham sido reconhecidos anteriormente, essa foi a primeira vez que um portador assintomático da infecção foi identificado.
Como ela mesma nunca esteve doente, Mallon achou difícil acreditar que ela pudesse ser a fonte da doença. Ela fugiu de Soper e das autoridades porque não queria ficar em quarentena ou ser forçada a abandonar sua profissão, que era relativamente bem paga para alguém com seu passado. No entanto, Mallon acabou sendo capturada e mantida em uma instalação de isolamento no Bronx, onde permaneceu até 1910, quando o departamento de saúde de Nova York a libertou sob a condição de que ela nunca mais trabalhasse com comida. Infelizmente, Mallon não concordou e logo começou a trabalhar como cozinheira novamente. Depois que novos casos começaram a aparecer, resultando na morte de dois indivíduos, as autoridades a localizaram novamente e a devolveram ao isolamento, onde ela permaneceu por mais 23 anos até sua morte em 1938. Os epidemiologistas conseguiram rastrear 51 casos de febre tifóide e três mortes diretamente em Mallon, que não é lisonjeiramente lembrado como “Maria tifóide”.
O caso Typhoid Mary tem correlações diretas no setor de saúde. Considere Kaci Hickox, uma enfermeira americana que tratou pacientes com ebola na África Ocidental durante a epidemia de 2014. Depois de retornar aos Estados Unidos, Hickox ficou em quarentena contra sua vontade por três dias e depois descobriu que não tinha ebola. Hickox se opôs veementemente à quarentena. Em um editorial publicado no jornal britânico The Guardian, 3 Hickox argumentou que colocar em quarentena profissionais de saúde assintomáticos que não tivessem testado positivo para uma doença não apenas impediria que esses indivíduos praticassem sua profissão, mas desencorajaria outros a se voluntariarem para trabalhar em áreas cheias de doenças onde os profissionais de saúde são desesperadamente necessários.
Qual é a responsabilidade de uma pessoa como Mary Mallon de mudar seu comportamento para proteger os outros? O que acontece quando um indivíduo acredita que ela não é um risco, mas outros acreditam que ela é? Como você reagiria se estivesse no lugar de Mallon e fosse colocado em uma quarentena que não acreditava ser necessária, às custas de sua própria liberdade e possivelmente de sua carreira? Importaria se você estivesse definitivamente infectado ou não?
Infecções por E. coli
A haste gram-negativa Escherichia coli é um membro comum da microbiota normal do cólon. Embora a grande maioria das cepas de E. coli sejam bactérias comensais úteis, algumas podem ser patogênicas e causar doenças diarreicas perigosas. As cepas patogênicas têm fatores de virulência adicionais, como fímbrias do tipo 1, que promovem a colonização do cólon ou podem produzir toxinas (consulte Fatores de virulência de patógenos bacterianos e virais). Esses fatores de virulência são adquiridos por meio da transferência horizontal de genes.
A doença extraintestinal pode ocorrer se a bactéria se espalhar pelo trato gastrointestinal. Embora essas bactérias possam ser transmitidas de pessoa para pessoa, elas geralmente são adquiridas por meio de alimentos ou água contaminados. Existem seis grupos patogênicos reconhecidos de E. coli, mas vamos nos concentrar aqui nos quatro que são mais comumente transmitidos por alimentos e água.
A E. coli enterotoxigênica (ETEC), também conhecida como diarreia do viajante, causa doenças diarreicas e é comum em países menos desenvolvidos. No México, a infecção por ETEC é chamada de Vingança de Montezuma. Após a ingestão de alimentos ou água contaminados, os indivíduos infectados desenvolvem diarreia aquosa, cólicas abdominais, mal-estar (sensação de mal-estar) e febre baixa. A ETEC produz uma enterotoxina estável ao calor semelhante à toxina da cólera e adesinas chamadas fatores de colonização que ajudam a bactéria a se fixar na parede intestinal. Algumas cepas de ETEC também produzem toxinas termicamente láveis. A doença geralmente é relativamente leve e autolimitada. O diagnóstico envolve cultura e PCR. Se necessário, o tratamento antibiótico com fluoroquinolonas, doxiciclina, rifaximina e trimetoprim-sulfametoxazol (TMP/SMZ) pode reduzir a duração da infecção. No entanto, a resistência aos antibióticos é um problema.
A E. coli enteroinvasiva (EIEC) é muito semelhante à shigelose, incluindo sua patogênese de invasão intracelular no tecido epitelial intestinal. Essa bactéria carrega um grande plasmídeo que está envolvido na penetração das células epiteliais. A doença geralmente é autolimitada, com sintomas que incluem diarreia aquosa, calafrios, cólicas, mal-estar, febre e disenteria. A cultura e o teste de PCR podem ser usados para o diagnóstico. O tratamento com antibióticos não é recomendado, portanto, a terapia de suporte é usada se necessário.
A E. coli enteropatogênica (EPEC) pode causar diarreia potencialmente fatal, especialmente em bebês e em países menos desenvolvidos. Febre, vômito e diarreia podem causar desidratação severa. Essas E. coli injetam uma proteína (Tir) que se liga à superfície das células epiteliais intestinais e desencadeia o rearranjo da actina da célula hospedeira das microvilosidades aos pedestais. O Tir também é o receptor da intimina, uma proteína de superfície produzida pela EPEC, permitindo assim que a E. coli “se sente” no pedestal. Os genes necessários para essa formação de pedestal estão codificados no locus da ilha de patogenicidade do apagamento de enterócitos (LEE). Assim como no ETEC, o diagnóstico envolve cultura e PCR. O tratamento é semelhante ao da ETEC.
As cepas mais perigosas são a E. coli enterohemorrágica (EHEC), que são as cepas capazes de causar epidemias. Em particular, a cepa O157:H7 foi responsável por vários surtos recentes. Lembre-se de que O e H se referem a antígenos de superfície que contribuem para a patogenicidade e desencadeiam uma resposta imune do hospedeiro (“O” se refere à cadeia lateral O do lipopolissacarídeo e o “H” se refere aos flagelos). Semelhante ao EPEC, o EHEC também forma pedestais. O EHEC também produz uma toxina semelhante à Shiga. Como o genoma dessa bactéria foi sequenciado, sabe-se que os genes da toxina Shiga provavelmente foram adquiridos por meio de transdução (transferência horizontal de genes). Os genes da toxina Shiga se originaram da Shigella dysenteriae. Profago de um bacteriófago que previamente infectou Shigella integrado ao cromossomo de E. coli. A toxina do tipo Shiga é frequentemente chamada de verotoxina.
O EHEC pode causar doenças que variam de relativamente leves a fatais. Os sintomas incluem diarreia com sangue com cólicas severas, mas sem febre. Embora muitas vezes seja autolimitada, pode causar colite hemorrágica e sangramento abundante. Uma possível complicação é a SHU. O diagnóstico envolve cultura, geralmente usando MacConkey com ágar sorbitol para diferenciar entre E. coli O157:H7, que não fermenta sorbitol, e outras cepas menos virulentas de E. coli que podem fermentar sorbitol.
A tipagem sorológica ou o teste de PCR também podem ser usados, bem como testes genéticos para a toxina Shiga. Para distinguir o EPEC do EHEC, porque ambos formam pedestais nas células epiteliais intestinais, é necessário testar os genes que codificam tanto para a toxina do tipo Shiga quanto para o LEE. Tanto o EPEC quanto o EHEC têm LEE, mas o EPEC não tem o gene da toxina Shiga. A antibioticoterapia não é recomendada e pode piorar a SHU devido às toxinas liberadas quando as bactérias são mortas, portanto, terapias de suporte devem ser usadas. A tabela\(\PageIndex{1}\) resume as características dos quatro grupos patogênicos mais comuns.
| Grupo | Fatores de virulência e genes | Sinais e sintomas | Testes de diagnóstico | Tratamento |
|---|---|---|---|---|
| E. coli enterotoxigênica (ETEC) | Enterotoxina estável ao calor semelhante à toxina da cólera | Diarreia aquosa relativamente leve | Cultura, PCR | Autolimitado; se necessário, fluoroquinolonas, doxiciclina, rifaximina, TMP/SMZ; a resistência aos antibióticos é um problema |
| E. coli enteroinvasiva (EIEC) | Genes Inv (plasmídeo invasivo) | Diarreia aquosa relativamente leve; pode ocorrer disenteria ou colite inflamatória | Cultura, PCR; teste do gene inv; ensaios adicionais para distinguir da Shigella | Somente terapia de suporte; antibióticos não recomendados |
| E. coli enteropatogênica (EPEC) | Locus da ilha de patogenicidade do apagamento de enterócitos (LEE) | Febre intensa, vômitos, diarreia sem sangue, desidratação; potencialmente fatal | Cultivo, PCR; detecção de LEE sem genes de toxinas do tipo Shiga | Autolimitado; se necessário, fluoroquinolonas, doxiciclina, rifaximina (TMP/SMZ); a resistência aos antibióticos é um problema |
| E. coli enterohemorrágica (EHEC) | Verotoxina | Pode ser leve ou muito grave; diarreia com sangue; pode resultar em SHU | Cultivo; placa em ágar MacConkey com ágar sorbitol, pois não fermenta sorbitol; detecção por PCR de LEE contendo genes de toxinas semelhantes a Shiga | Antibióticos não são recomendados devido ao risco de SHU |
Exercício\(\PageIndex{4}\)
Compare e contraste os fatores de virulência e os sinais e sintomas de infecções com os quatro principais grupos de E. coli.
Cólera e outros vibrios
A doença gastrointestinal cólera é uma infecção grave frequentemente associada à falta de saneamento, especialmente após desastres naturais, porque é transmitida por meio de água e alimentos contaminados que não foram aquecidos a temperaturas altas o suficiente para matar a bactéria. É causada pelo Vibrio cholerae, sorotipo O1, uma bactéria gram-negativa flagelada em forma de bastonete curvo (vibrio). De acordo com o CDC, a cólera causa cerca de 3 a 5 milhões de casos e 100.000 mortes a cada ano. 4
Como a V. cholerae é morta pelo ácido estomacal, doses relativamente grandes são necessárias para que algumas células microbianas sobrevivam e cheguem ao intestino e causem infecções. As células móveis viajam pela camada mucosa do intestino, onde se ligam às células epiteliais e liberam a enterotoxina da cólera. A toxina é uma toxina A-B com atividade através da adenilato ciclase (consulte Fatores de virulência de patógenos bacterianos e virais). Dentro da célula intestinal, os níveis de AMP cíclico (cAMP) aumentam, o que ativa um canal de cloreto e resulta na liberação de íons no lúmen intestinal. Esse aumento na pressão osmótica no lúmen faz com que a água também entre no lúmen. Quando a água e os eletrólitos deixam o corpo, isso causa desidratação rápida e desequilíbrio eletrolítico. A diarreia é tão abundante que costuma ser chamada de “fezes com água de arroz”, e os pacientes são colocados em berços com um orifício para monitorar a perda de fluido (Figura\(\PageIndex{4}\)).
A cólera é diagnosticada pela coleta de uma amostra de fezes e pela cultura de Vibrio. As bactérias são oxidase positivas e apresentam fermentação sem lactose no ágar MacConkey. Os fermentadores de lactose gram-negativa produzirão colônias vermelhas, enquanto os não fermentadores produzirão colônias brancas/incolores. Bactérias Gram-positivas não crescerão no MacConkey. A fermentação da lactose é comumente usada para identificação de patógenos porque a microbiota normal geralmente fermenta a lactose, enquanto os patógenos não. V. cholerae também pode ser cultivada em ágar sacarose (TCBS), sais biliares de citrato de tiossulfato, um meio seletivo e diferencial para Vibrio spp., que produzem uma colônia amarela distinta.
A cólera pode ser autolimitada e o tratamento envolve reidratação e reposição de eletrólitos. Embora os antibióticos normalmente não sejam necessários, eles podem ser usados para doenças graves ou disseminadas. As tetraciclinas são recomendadas, mas podem ser usadas doxiciclina, eritromicina, orfloxacina, ciprofloxacina e TMP/SMZ. Evidências recentes sugerem que a azitromicina também é um bom antibiótico de primeira linha. Um bom saneamento — incluindo tratamento adequado de esgoto, suprimentos limpos para cozinhar e água potável purificada — é importante para evitar infecções (Figura\(\PageIndex{4}\))

V. cholera não é a única espécie de Vibrio que pode causar doenças. V. parahemolyticus está associado ao consumo de frutos do mar contaminados e causa doenças gastrointestinais com sinais e sintomas como diarreia aquosa, náuseas, febre, calafrios e cólicas abdominais. A bactéria produz uma hemolisina estável ao calor, causando disenteria e possível disseminação de doenças. Às vezes, também causa infecções na ferida. V. parahemolyticus é diagnosticado usando culturas de sangue, fezes ou feridas. Tal como acontece com o V. cholera, o meio seletivo (especialmente o agar TCBS) funciona bem. A tetraciclina e a ciprofloxacina podem ser usadas para tratar casos graves, mas geralmente não são necessários antibióticos.
O Vibrio vulnificus é encontrado na água quente do mar e, ao contrário do V. cholerae, não está associado a condições sanitárias precárias. A bactéria pode ser encontrada em frutos do mar crus e a ingestão causa doenças gastrointestinais. Também pode ser adquirido por indivíduos com feridas cutâneas abertas que são expostos à água com altas concentrações do patógeno. Em alguns casos, a infecção se espalha para a corrente sanguínea e causa septicemia. A infecção da pele pode causar edema, equimose (descoloração da pele devido ao sangramento) e abscessos. Pacientes com doença subjacente têm uma alta taxa de letalidade de cerca de 50%. É particularmente preocupante para indivíduos com doença hepática crônica ou que são imunodeficientes, porque um sistema imunológico saudável geralmente pode impedir o desenvolvimento de infecções. V. vulnificus é diagnosticado pela cultura do patógeno a partir de amostras de fezes, amostras de sangue ou abscessos cutâneos. Pacientes adultos são tratados com doxiciclina combinada com uma cefalosporina de terceira geração ou com fluoroquinolonas, e as crianças são tratadas com TMP/SMZ.
Dois outros vibrios, Aeromonas hydrophila e Plesiomonas shigelloides, também estão associados a ambientes marinhos e frutos do mar crus; eles também podem causar gastroenterite. Como V. vulnificus, A. hydrophila é mais frequentemente associada a infecções em feridas, geralmente aquelas adquiridas na água. Em alguns casos, também pode causar septicemia. Outras espécies de Aeromonas podem causar doenças. O P. shigelloides às vezes é associado a infecções sistêmicas mais graves se ingerido em alimentos ou água contaminados. A cultura pode ser usada para diagnosticar infecções por A. hydrophila e P. shigelloides, para as quais a antibioticoterapia geralmente não é necessária. Quando necessário, a tetraciclina e a ciprofloxacina, entre outros antibióticos, podem ser usadas para o tratamento de A. hydrophila, e as fluoroquinolonas e o trimetoprim são os tratamentos eficazes para P. shigelloides.
Exercício\(\PageIndex{5}\)
Como a infecção por V. cólera causa desidratação rápida?
Gastroenterite por Campylobacter jejuni
Campylobacter é um gênero de bactérias gram-negativas, espirais ou curvas. Eles podem ter um ou dois flagelos. A gastroenterite por Campylobacter jejuni, uma forma de campilobacteriose, é uma doença generalizada causada pelo Campylobacter jejuni. A principal via de transmissão é por meio de aves que são contaminadas durante o abate. O manuseio do frango cru, por sua vez, contamina as superfícies de cozimento, utensílios e outros alimentos. Leite não pasteurizado ou água contaminada também são veículos potenciais de transmissão. Na maioria dos casos, a doença é autolimitada e inclui febre, diarreia, cólicas, vômitos e, às vezes, disenteria. Às vezes ocorrem sinais e sintomas mais graves, como bacteremia, meningite, pancreatite, colecistite e hepatite. Também tem sido associada a doenças autoimunes, como a síndrome de Guillain-Barré, uma doença neurológica que ocorre após algumas infecções e resulta em paralisia temporária. HUS após a infecção também pode ocorrer. A virulência em muitas cepas é o resultado da produção de hemolisina e da presença da toxina distensora citoletal (CDT) de Campylobacter, uma poderosa desoxirribonuclease (DNase) que danifica irreversivelmente o DNA da célula hospedeira.
O diagnóstico envolve cultura sob condições especiais, como temperatura elevada, baixa tensão de oxigênio e, muitas vezes, suplementação média com agentes antimicrobianos. Essas bactérias devem ser cultivadas em meio seletivo (como Campy CV, meio seletivo de carvão vegetal ou ágar desoxicolato de carvão vegetal com cefaperazona) e incubadas em condições microaerofílicas por pelo menos 72 horas a 42 °C. Geralmente, não é necessário tratamento com antibióticos, mas podem ser usadas eritromicina ou ciprofloxacina.
Úlceras pépticas
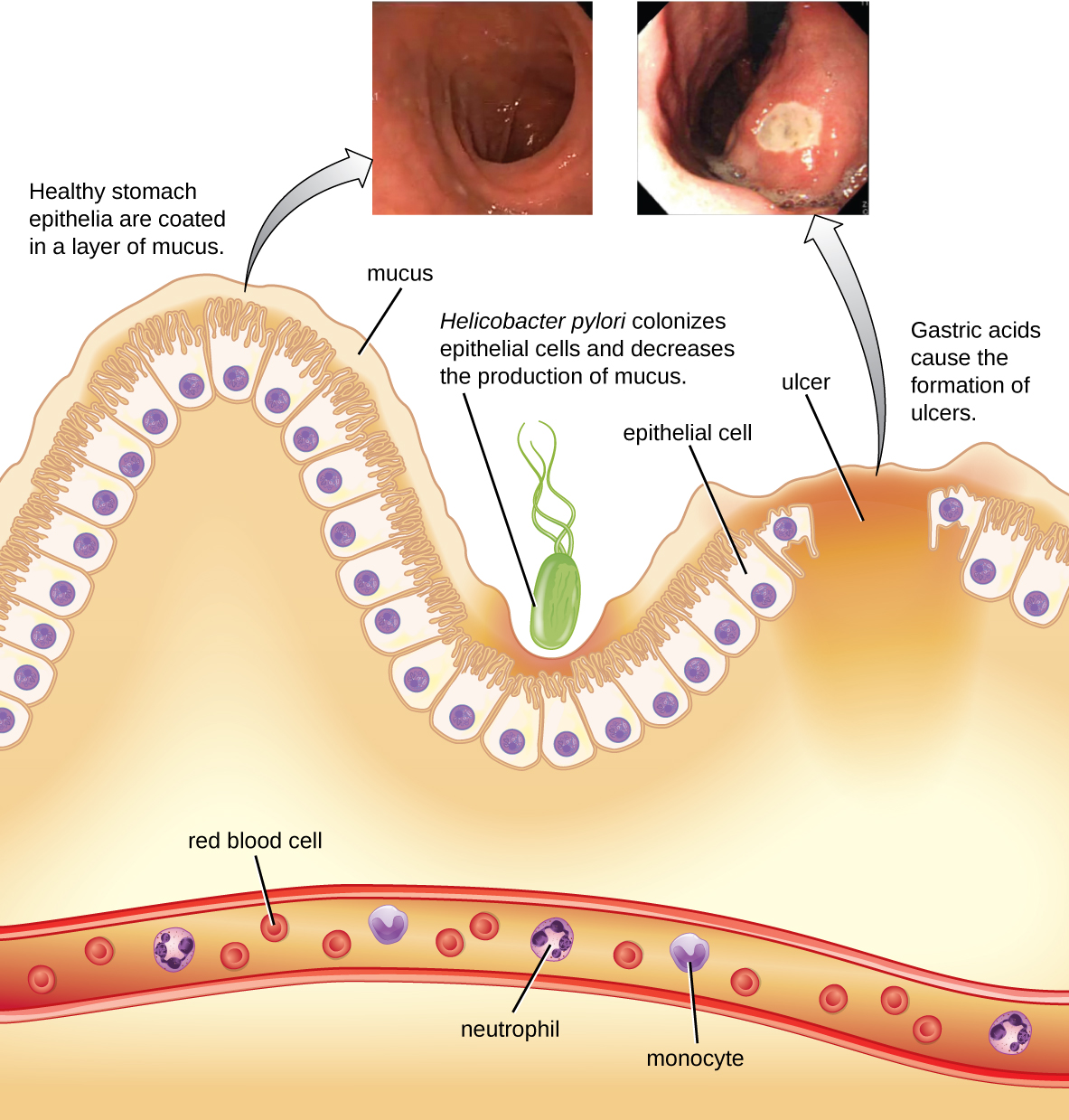
A bactéria gram-negativa Helicobacter pylori é capaz de tolerar o ambiente ácido do estômago humano e demonstrou ser uma das principais causas de úlceras pépticas, que são úlceras do estômago ou duodeno. A bactéria também está associada ao aumento do risco de câncer de estômago (Figura\(\PageIndex{5}\)). De acordo com o CDC, aproximadamente dois terços da população está infectada com H. pylori, mas menos de 20% têm risco de desenvolver úlceras ou câncer de estômago. O H. pylori é encontrado em aproximadamente 80% das úlceras estomacais e em mais de 90% das úlceras duodenais. 5
O H. pylori coloniza as células epiteliais do estômago usando pili para adesão. Essas bactérias produzem urease, que estimula uma resposta imune e cria amônia que neutraliza os ácidos estomacais para fornecer um microambiente mais hospitaleiro. A infecção danifica as células do revestimento do estômago, incluindo aquelas que normalmente produzem o muco protetor que serve como uma barreira entre o tecido e o ácido estomacal. Como resultado, ocorre inflamação (gastrite) e as úlceras podem se desenvolver lentamente. A formação de úlceras também pode ser causada pela atividade da toxina. Foi relatado que 50% dos isolados clínicos de H. pylori têm níveis detectáveis de atividade de exotoxinas in vitro. 6 Essa toxina, VacA, induz a formação de vacúolos nas células hospedeiras. O VacA não tem homologia de sequência primária com outras toxinas bacterianas e, em um modelo de camundongo, há uma correlação entre a presença do gene da toxina, a atividade da toxina e o dano ao tecido epitelial gástrico.
Os sinais e sintomas incluem náuseas, falta de apetite, inchaço, arrotos e perda de peso. As úlceras hemorrágicas podem produzir fezes escuras. Se nenhum tratamento for fornecido, as úlceras podem se tornar mais profundas, mais tecidos podem ser envolvidos e pode ocorrer perfuração estomacal. Como a perfuração permite que enzimas digestivas e ácidos vazem para o corpo, é uma condição muito séria.
Para diagnosticar a infecção por H. pylori, vários métodos estão disponíveis. Em um teste respiratório, o paciente engole uréia radiomarcada. Se o H. pylori estiver presente, a bactéria produzirá urease para decompor a uréia. Essa reação produz dióxido de carbono radiomarcado que pode ser detectado no hálito do paciente. O exame de sangue também pode ser usado para detectar anticorpos contra o H. pylori. A própria bactéria pode ser detectada por meio de um teste de fezes ou uma biópsia da parede do estômago.
Antibióticos podem ser usados para tratar a infecção. No entanto, exclusiva do H. pylori, a recomendação da Food and Drug Administration dos EUA é usar uma terapia tripla. Os protocolos atuais são 10 dias de tratamento com omeprazol, amoxicilina e claritromicina (OAC); 14 dias de tratamento com subsalicilato de bismuto, metronidazol e tetraciclina (BMT); ou 10 ou 14 dias de tratamento com lansoprazol, amoxicilina e claritromicina (LAC). O omeprazol, o subsalicilato de bismuto e o lansoprazol não são antibióticos, mas são usados para diminuir os níveis de ácido porque o H. pylori prefere ambientes ácidos.
Embora o tratamento geralmente seja valioso, também há riscos para a erradicação do H. pylori. A infecção por H. pylori pode realmente proteger contra alguns tipos de câncer, como adenocarcinoma de esôfago e doença do refluxo gastroesofágico. 7 8
Exercício\(\PageIndex{6}\)
Como o H. pylori causa úlceras pépticas?
Gastroenterite por Clostridium perfringens
A gastroenterite por Clostridium perfringens é uma doença geralmente leve transmitida por alimentos que está associada a carnes mal cozidas e outros alimentos. C. perfringens é uma bactéria anaeróbica gram-positiva, em forma de bastonete e formadora de endosporos, que é tolerante a altas e baixas temperaturas. Em altas temperaturas, a bactéria pode formar endosporos que germinarão rapidamente nos alimentos ou no intestino. A intoxicação alimentar por cepas do tipo A é comum. Essa cepa sempre produz uma enterotoxina, às vezes também presente em outras cepas, que causa os sintomas clínicos de cólicas e diarreia. Uma forma mais grave da doença, chamada pig-bel ou enterite necrótica, causa hemorragia, dor, vômitos e inchaço. Pode ocorrer gangrena do intestino. Essa forma tem uma alta taxa de mortalidade, mas é rara nos Estados Unidos.
O diagnóstico envolve a detecção da toxina C. perfringens em amostras de fezes usando técnicas de biologia molecular (detecção por PCR do gene da toxina) ou técnicas de imunologia (ELISA). A bactéria em si também pode ser detectada em alimentos ou em amostras fecais. O tratamento inclui terapia de reidratação, reposição eletrolítica e fluidos intravenosos. Antibióticos não são recomendados porque podem prejudicar o equilíbrio da microbiota intestinal e há preocupações com a resistência aos antibióticos. A doença pode ser evitada por meio do manuseio e cozimento adequados dos alimentos, incluindo refrigeração imediata em temperaturas suficientemente baixas e cozimento de alimentos a uma temperatura suficientemente alta.
Clostridium difficile
O Clostridium difficile é um bastonete gram-positivo que pode ser uma bactéria comensal como parte da microbiota normal de indivíduos saudáveis. Quando a microbiota normal é interrompida pelo uso prolongado de antibióticos, ela pode permitir o crescimento excessivo dessa bactéria, resultando em diarreia associada a antibióticos causada por C. difficile. A diarreia associada a antibióticos também pode ser considerada uma doença nosocomial. Pacientes com maior risco de infecção por C. difficile são aqueles que estão imunocomprometidos, estão em serviços de saúde há longos períodos, são mais velhos, tomaram antibióticos recentemente, realizaram procedimentos gastrointestinais ou usam inibidores da bomba de prótons, que reduzem a acidez estomacal e permitir a proliferação de C. difficile. Como essa espécie pode formar endósporos, ela pode sobreviver por longos períodos de tempo no meio ambiente sob condições adversas e é uma preocupação considerável em ambientes de saúde.
Essa bactéria produz duas toxinas, a toxina A de Clostridium difficile (TcDA) e a toxina B de Clostridium difficile (TcDB). Essas toxinas inativam pequenas proteínas de ligação ao GTP, resultando em condensação de actina e arredondamento celular, seguido pela morte celular. As infecções começam com necrose focal, depois ulceração com exsudato e podem evoluir para colite pseudomembranosa, que envolve inflamação do cólon e desenvolvimento de uma pseudomembrana de fibrina contendo células epiteliais mortas e leucócitos (Figura\(\PageIndex{6}\)). Podem ocorrer diarreia aquosa, desidratação, febre, perda de apetite e dor abdominal. A perfuração do cólon pode ocorrer, levando à septicemia, choque e morte. C. difficile também está associada à enterocolite necrosante em bebês prematuros e à enterocolite neutropênica associada a terapias contra o câncer.
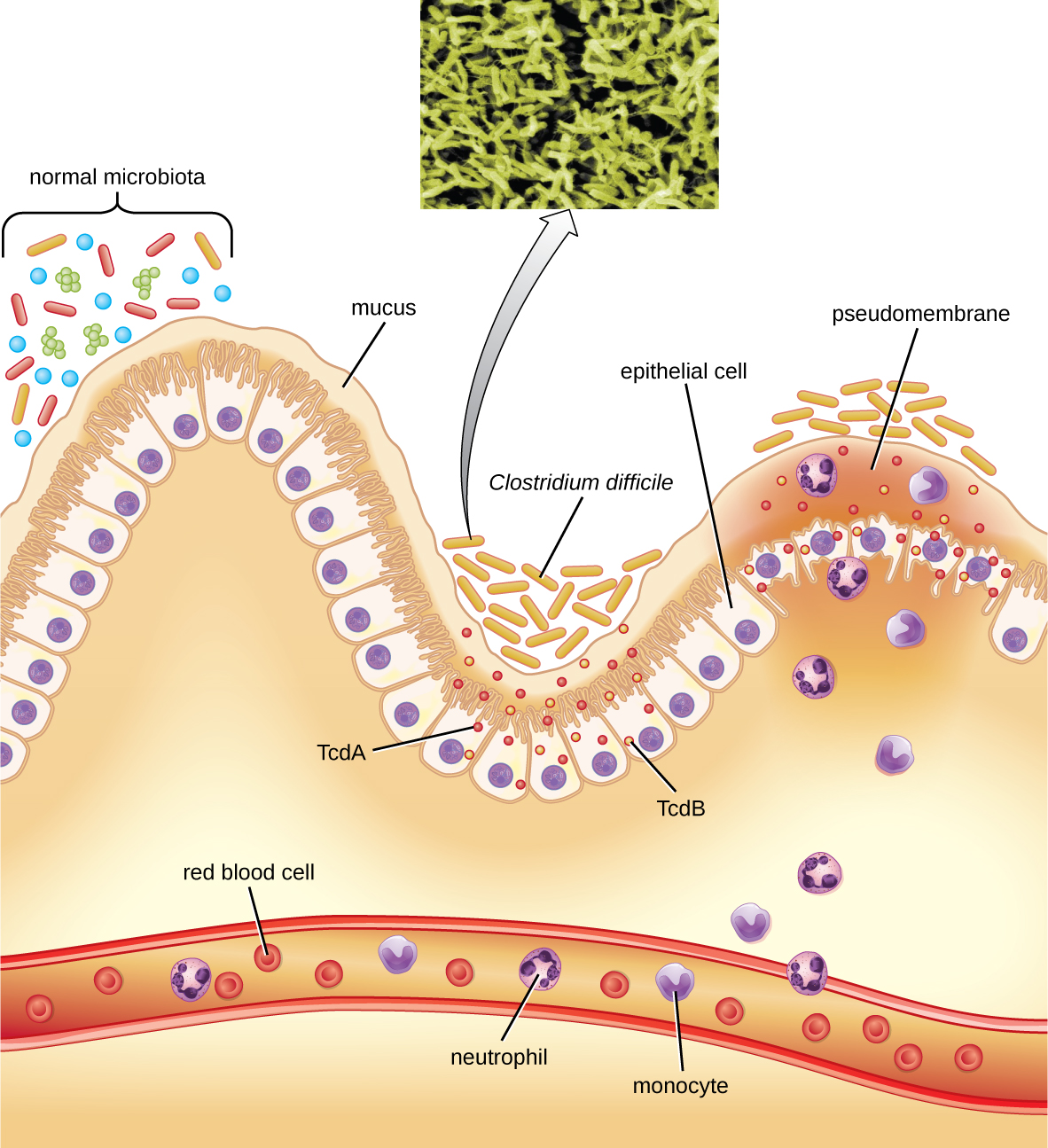
O diagnóstico é feito considerando a história do paciente (como exposição a antibióticos), apresentação clínica, imagem, endoscopia, exames laboratoriais e outros dados disponíveis. A detecção da toxina em amostras de fezes é usada para confirmar o diagnóstico. Embora a cultura seja preferida, ela raramente é prática na prática clínica porque a bactéria é um anaeróbio obrigatório. Os testes de amplificação de ácido nucleico, incluindo PCR, são considerados preferíveis aos testes ELISA para análise molecular.
A primeira etapa do tratamento convencional é interromper o uso de antibióticos e, em seguida, fornecer terapia de suporte com reposição de eletrólitos e fluidos. O metronidazol é o tratamento preferido se o diagnóstico de C. difficile tiver sido confirmado. A vancomicina também pode ser usada, mas deve ser reservada para pacientes nos quais o metronidazol foi ineficaz ou que atendem a outros critérios (por exemplo, menores de 10 anos, grávidas ou alérgicos ao metronidazol).
Uma nova abordagem de tratamento, conhecida como transplante fecal, se concentra na restauração da microbiota intestinal para combater a infecção. Nesse procedimento, um indivíduo saudável doa uma amostra de fezes, que é misturada com solução salina e transplantada para o receptor por meio de colonoscopia, endoscopia, sigmoidoscopia ou enema. Foi relatado que esse procedimento tem mais de 90% de sucesso na resolução de infecções por C. difficile. 9
Exercício\(\PageIndex{7}\)
Como o uso de antibióticos causa infecções por C. difficile?
Doença transmitida por alimentos causada pelo Bacillus cereus
O Bacillus cereus, comumente encontrado no solo, é uma bactéria gram-positiva formadora de endosporos que às vezes pode causar doenças transmitidas por alimentos. Os endosporos de B. cereus podem sobreviver ao cozimento e produzir enterotoxinas nos alimentos após serem aquecidos; doenças geralmente ocorrem após a ingestão de arroz e outros alimentos preparados deixados em temperatura ambiente por muito tempo. Os sinais e sintomas aparecem poucas horas após a ingestão e incluem náuseas, dor e cólicas abdominais. B. cereus produz duas toxinas: uma causando diarreia e a outra causando vômitos. Às vezes, sinais e sintomas mais graves podem se desenvolver.
O diagnóstico pode ser feito isolando bactérias de amostras de fezes ou vômitos e alimentos infectados não consumidos. O tratamento envolve reidratação e terapia de suporte. Normalmente, antibióticos não são necessários, pois a doença geralmente é relativamente leve e se deve à atividade da toxina.
Doença transmitida por alimentos devido à Yersinia
O gênero Yersinia é mais conhecido por Yersinia pestis, uma vara gram-negativa que causa a peste. No entanto, Y. enterocolitica e Y. pseudotuberculosis podem causar gastroenterite. A infecção geralmente é transmitida pela via fecal-oral, com ingestão de alimentos ou água contaminados pelas fezes. A intoxicação também pode resultar da atividade de sua endotoxina e exotoxinas (fator necrosante de enterotoxinas e citotoxinas). A doença normalmente é relativamente leve e autolimitada. No entanto, diarreia e disenteria graves podem se desenvolver em bebês. Em adultos, a infecção pode se espalhar e causar complicações como artrite reativa, distúrbios da tireoide, endocardite, glomerulonefrite, inflamação ocular e/ou eritema nodoso. A bacteremia pode se desenvolver em casos raros.
O diagnóstico geralmente é feito pela detecção da bactéria em amostras de fezes. As amostras também podem ser obtidas de outros tecidos ou fluidos corporais. O tratamento geralmente é de suporte, incluindo reidratação, sem antibióticos. Se houver bacteremia ou outra doença sistêmica, antibióticos como fluoroquinolonas, aminoglicosídeos, doxiciclina e trimetoprim-sulfametoxazol podem ser usados. A recuperação pode levar até duas semanas.
Exercício\(\PageIndex{8}\)
Compare e contraste doenças transmitidas por alimentos causadas por B. cereus e Yersinia.
Infecções bacterianas do trato gastrointestinal
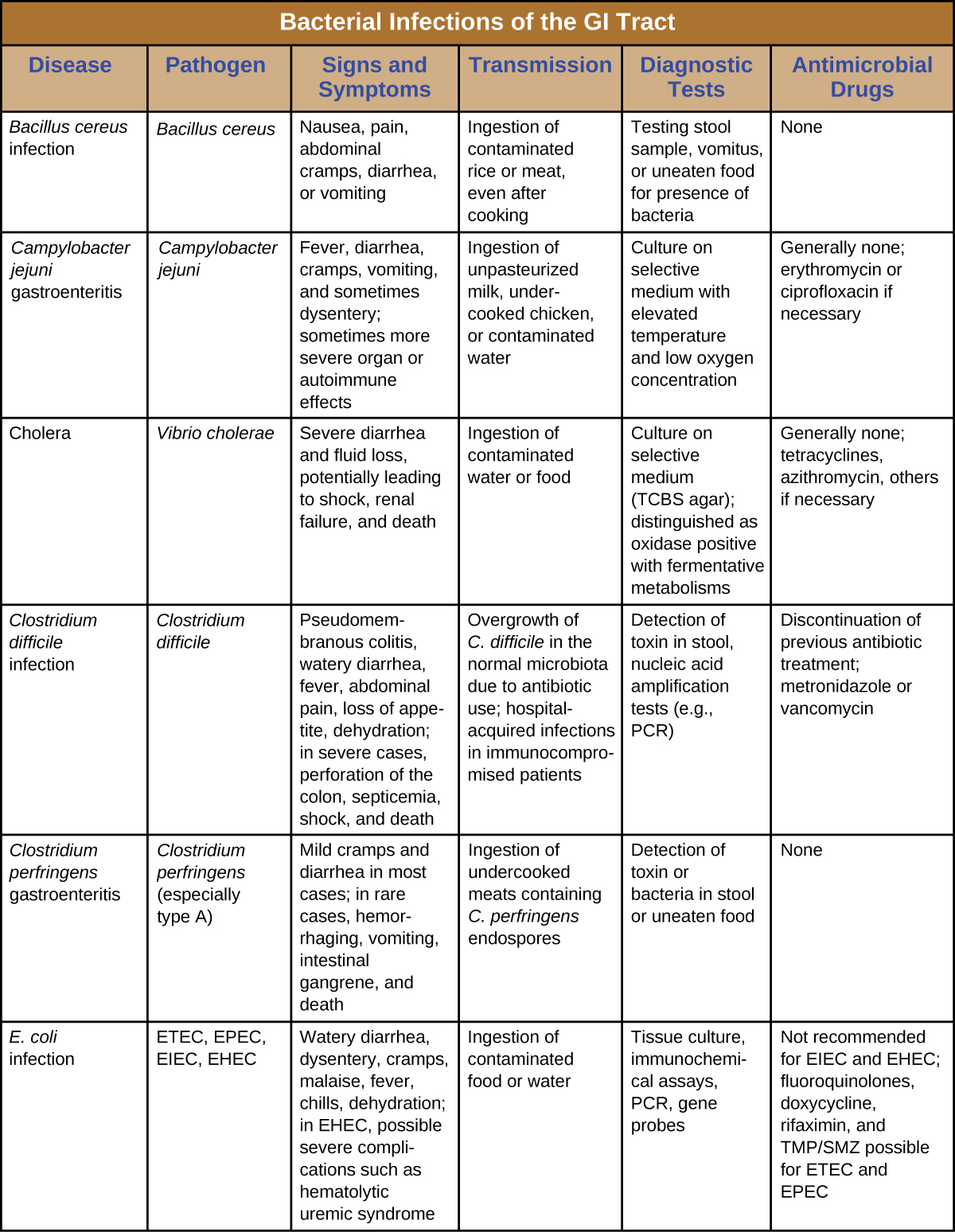
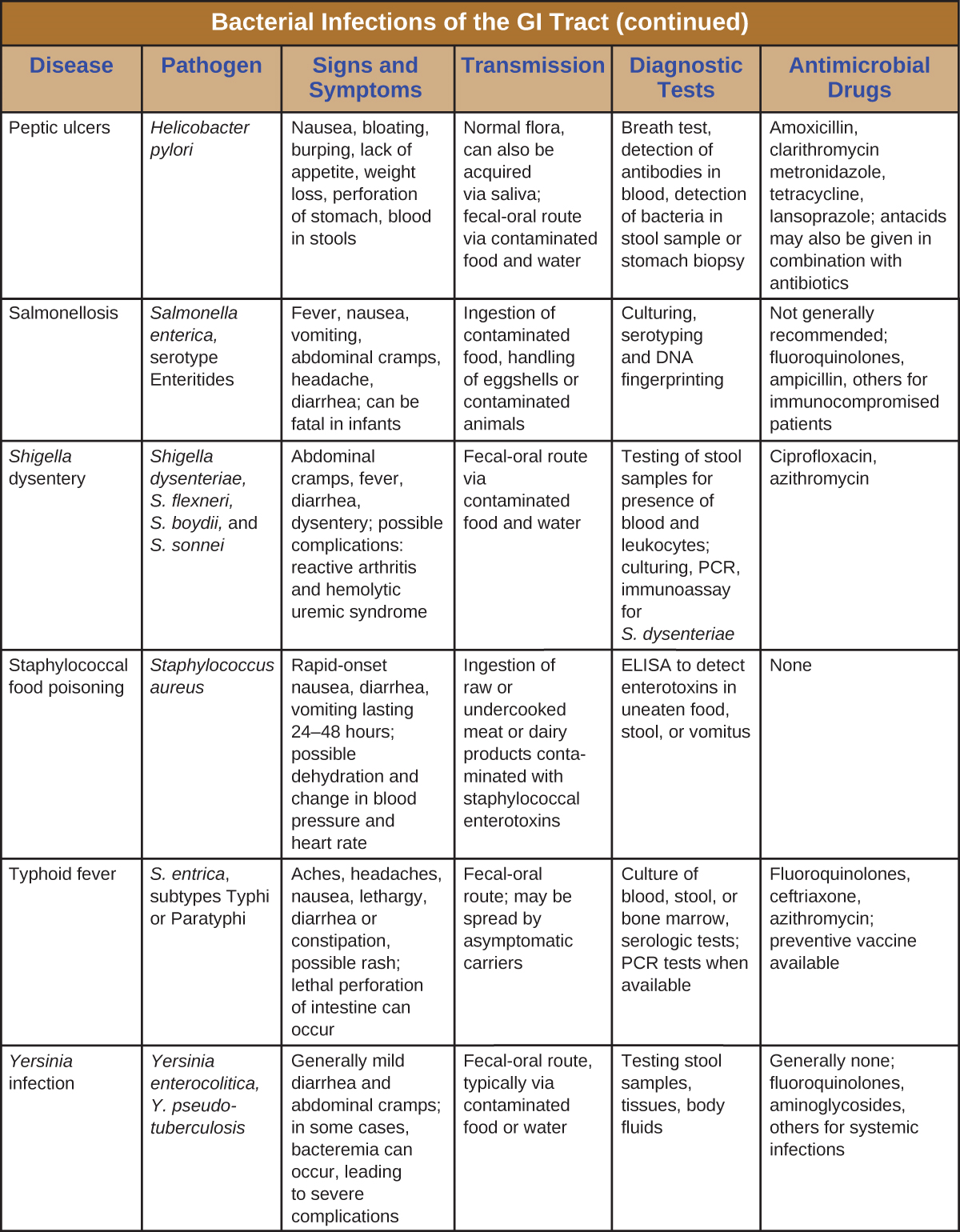
As infecções bacterianas do trato gastrointestinal geralmente ocorrem quando bactérias ou toxinas bacterianas são ingeridas em alimentos ou água contaminados. Toxinas e outros fatores de virulência podem produzir inflamação gastrointestinal e sintomas gerais, como diarreia e vômitos. As infecções gastrointestinais bacterianas podem variar amplamente em termos de gravidade e tratamento. Alguns podem ser tratados com antibióticos, mas em outros casos os antibióticos podem ser ineficazes no combate às toxinas ou até mesmo contraproducentes se comprometerem a microbiota gastrointestinal. Figura\(\PageIndex{7}\) e figura\(\PageIndex{8}\) as principais características das infecções gastrointestinais bacterianas comuns.
Foco clínico: Parte 2
No hospital, o médico de Carli começou a pensar nas possíveis causas de seu grave problema gastrointestinal. Uma possibilidade era intoxicação alimentar, mas ninguém mais em sua família estava doente. O médico perguntou sobre o que Carli havia comido no dia anterior; sua mãe mencionou que ela tinha comido ovos no almoço e que eles poderiam estar um pouco mal cozidos. O médico coletou uma amostra das fezes de Carli e a enviou para exames laboratoriais como parte de sua investigação. Ela suspeitava que Carli poderia ter um caso de gastroenterite bacteriana ou viral, mas precisava conhecer a causa para prescrever um tratamento adequado.
No laboratório, os técnicos identificaram microscopicamente bacilos gram-negativos na amostra de fezes de Carli. Eles também estabeleceram uma cultura pura da bactéria e a analisaram em busca de antígenos. Este teste mostrou que o agente causador era a Salmonella.
Exercício\(\PageIndex{9}\)
O que o médico deve fazer agora para tratar Carli?
Conceitos principais e resumo
- As principais causas de doenças gastrointestinais incluem Salmonella spp., Staphylococcus spp., Helicobacter pylori, Clostridium perfringens, Clostridium difficile, Bacillus cereus e bactéria Yersinia.
- C. difficile é uma importante causa de infecção hospitalar adquirida.
- O Vibrio cholerae causa cólera, que pode ser uma doença diarreica grave.
- Diferentes cepas de E. coli, incluindo ETEC, EPEC, EIEC e EHEC, causam doenças diferentes com vários graus de gravidade.
- O H. pylori está associado a úlceras pépticas.
- Os sorotipos de Salmonella enterica podem causar febre tifóide, uma doença mais grave do que a salmonelose.
- A reidratação e outras terapias de suporte são frequentemente usadas como tratamentos gerais.
- O uso cuidadoso de antibióticos é necessário para reduzir o risco de causar infecções por C. difficile e no tratamento de infecções resistentes a antibióticos.
Notas de pé
- 1 Jaya Sureshbabu. “Investigação da infecção por Shigella”. Medscape. Atualizado em 28 de junho de 2016. http://emedicine.medscape.com/article/968773-workup.
- 2 Centros de Controle e Prevenção de Doenças. Salmonela. Atualizado em 25 de agosto de 2016. https://www.cdc.gov/salmonella.
- 3 Kaci Hickox. “Pare de me chamar de 'enfermeira do ebola'”. O Guardião. 17 de novembro de 2014. www.theguardian.com/commmentis... se-kaci-hickox.
- 4 Centros de Controle e Prevenção de Doenças. Infecção por Cholera-Vibrio cholerae. Atualizado em 6 de novembro de 2014. http://www.cdc.gov/cholera/general. Acessado em 14 de setembro de 2016.
- 5 Centros de Controle e Prevenção de Doenças. “Helicobacter pylori: ficha informativa para profissionais de saúde.” Atualizado em julho de 1998. www.cdc.gov/ulcer/files/hpfacts.pdf.
- Capa de 6 T. L. “A citotoxina vacuolante do Helicobacter pylori.” Microbiologia Molecular 20 (1996) 2: pp. 241—246. http://www.ncbi.nlm.nih.gov/pubmed/8733223.
- 7 Martin J. Blaser. “Microbiota em desaparecimento: proteção do Helicobacter pylori contra o adenocarcinoma esofágico.” Pesquisa de Prevenção do Câncer 1 (2008) 5: pp. 308—311. http://cancerpreventionresearch.aacr....full.pdf+html.
- 8 Ivan F. N. Hung e Benjamin C. Y. Wong. “Avaliando os riscos e benefícios do tratamento da infecção por Helicobacter pylori.” Avanços terapêuticos em gastroenterologia 2 (2009) 3: pp, 141—147. doi: 10.1177/1756283X08100279.
- 9 Faith Rohlke e Neil Stollman. “Transplante de microbiota fecal na infecção recidivante por Clostridium difficile”, Avanços terapêuticos em gastroenterologia 5 (2012) 6:403—420. doi: 10.1177/1756283X12453637.


