20.5: Técnicas de autoanticorpos fluorescentes
- Page ID
- 181604
objetivos de aprendizagem
- Descreva os benefícios dos ensaios de anticorpos imunofluorescentes em comparação com os ensaios não fluorescentes
- Compare ensaios de anticorpos fluorescentes diretos e indiretos
- Explicar como um citômetro de fluxo pode ser usado para quantificar subconjuntos específicos de células presentes em uma mistura complexa de tipos celulares
- Explicar como um classificador de células ativado por fluorescência pode ser usado para separar tipos exclusivos de células
A visualização rápida de bactérias de uma amostra clínica, como um esfregaço na garganta ou escarro, pode ser obtida por meio de técnicas de anticorpos fluorescentes (FA) que ligam um marcador fluorescente (fluorogênio) à região constante de um anticorpo, resultando em uma molécula repórter que é rápida de usar, fácil de ver ou medir, e capaz de se ligar a marcadores-alvo com alta especificidade. Também podemos rotular células, o que nos permite quantificar com precisão subconjuntos específicos de células ou até mesmo purificar esses subconjuntos para pesquisas futuras.
Assim como nos ensaios enzimáticos, os métodos de FA podem ser diretos, nos quais um mAb marcado se liga a um antígeno, ou indiretos, nos quais anticorpos policlonais secundários se ligam aos anticorpos do paciente que reagem a um antígeno preparado. As aplicações desses dois métodos foram demonstradas na Figura 2.3.8. Os métodos de FA também são usados em sistemas automatizados de contagem e classificação de células para enumerar ou segregar subpopulações marcadas de células em uma amostra.
Técnicas de anticorpos fluorescentes diretos
Os testes de anticorpos fluorescentes diretos (DFA) usam um mAb marcado com fluorescência para ligar e iluminar um antígeno alvo. Os testes de DFA são particularmente úteis para o diagnóstico rápido de doenças bacterianas. Por exemplo, anticorpos marcados com fluorescência contra Streptococcus pyogenes (estreptococos do grupo A) podem ser usados para obter um diagnóstico de faringite estreptocócica a partir de um esfregaço na garganta. O diagnóstico fica pronto em questão de minutos e o paciente pode começar a tomar antibióticos antes mesmo de sair da clínica. As técnicas de DFA também podem ser usadas para diagnosticar pneumonia causada por Mycoplasma pneumoniae ou Legionella pneumophila a partir de amostras de escarro (Figura\(\PageIndex{1}\)). Os anticorpos fluorescentes se ligam às bactérias em uma lâmina de microscópio, permitindo a detecção imediata da bactéria usando um microscópio de fluorescência. Portanto, a técnica DFA é valiosa para visualizar certas bactérias que são difíceis de isolar ou cultivar a partir de amostras de pacientes.
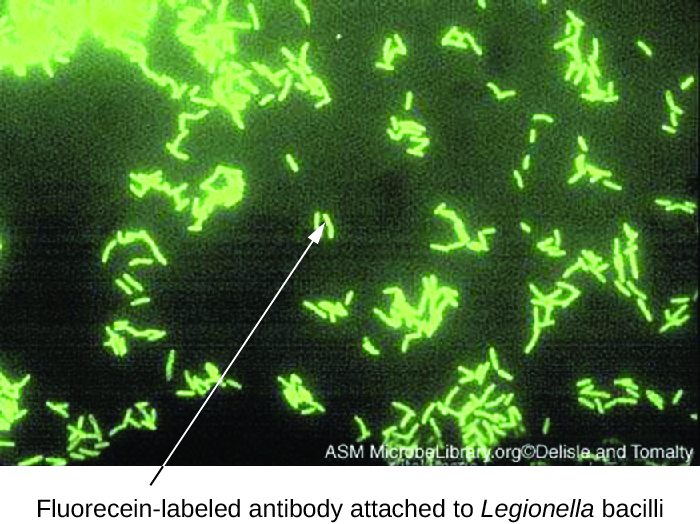
Exercício\(\PageIndex{1}\)
Em um teste direto de anticorpos fluorescentes, a que o anticorpo fluorescente se liga?
Técnicas de anticorpos fluorescentes indiretos
Os testes de anticorpos fluorescentes indiretos (IFA) (Figura\(\PageIndex{2}\)) são usados para procurar anticorpos no soro do paciente. Por exemplo, um teste IFA para o diagnóstico da sífilis usa células de T. pallidum isoladas de um animal de laboratório (a bactéria não pode ser cultivada em meio de laboratório) e um esfregaço preparado em uma lâmina de vidro. O soro do paciente é espalhado pelo esfregaço e os anticorpos antitreponêmicos, se presentes, podem se ligar. O soro é lavado e um anticorpo secundário adicionado. O anticorpo secundário é uma imunoglobulina anti-humana conjugada a um fluorogênio. No exame, a bactéria T. pallidum só será visível se estiver ligada aos anticorpos do soro do paciente.
O teste IFA para sífilis fornece um complemento importante ao teste VDRL discutido em Detecção de complexos antígeno-anticorpo. O VDRL tem maior probabilidade de gerar reações falso-positivas do que o teste IFA; no entanto, o VDRL é um teste melhor para determinar se uma infecção está ativa no momento.
Os testes IFA também são úteis para o diagnóstico de doenças autoimunes. Por exemplo, o lúpus eritematoso sistêmico (LES) (ver Distúrbios autoimunes) é caracterizado por níveis elevados de expressão de anticorpos antinucleares (ANA). Esses autoanticorpos podem ser expressos contra uma variedade de proteínas de ligação ao DNA e até mesmo contra o próprio DNA. Como a autoimunidade geralmente é difícil de diagnosticar, especialmente no início da progressão da doença, o teste de ANA pode ser uma pista valiosa para fazer um diagnóstico e iniciar o tratamento adequado.
O IFA para ANA começa fixando as células cultivadas em cultura em uma lâmina de vidro e tornando-as permeáveis aos anticorpos. As lâminas são então incubadas com diluições seriadas do soro do paciente. Após a incubação, a lâmina é lavada para remover as proteínas não ligadas e o anticorpo fluorescente (IgG anti-humano conjugado a um fluorogênio) adicionado. Após uma incubação e lavagem, as células podem ser examinadas quanto à fluorescência evidente ao redor do núcleo (Figura\(\PageIndex{3}\)). O título de ANA no soro é determinado pela maior diluição que mostra fluorescência. Como muitas pessoas saudáveis expressam ANA, o Colégio Americano de Reumatologia recomenda que o título seja de pelo menos 1:40 na presença de sintomas envolvendo dois ou mais sistemas orgânicos para ser considerado indicativo de LES. 1
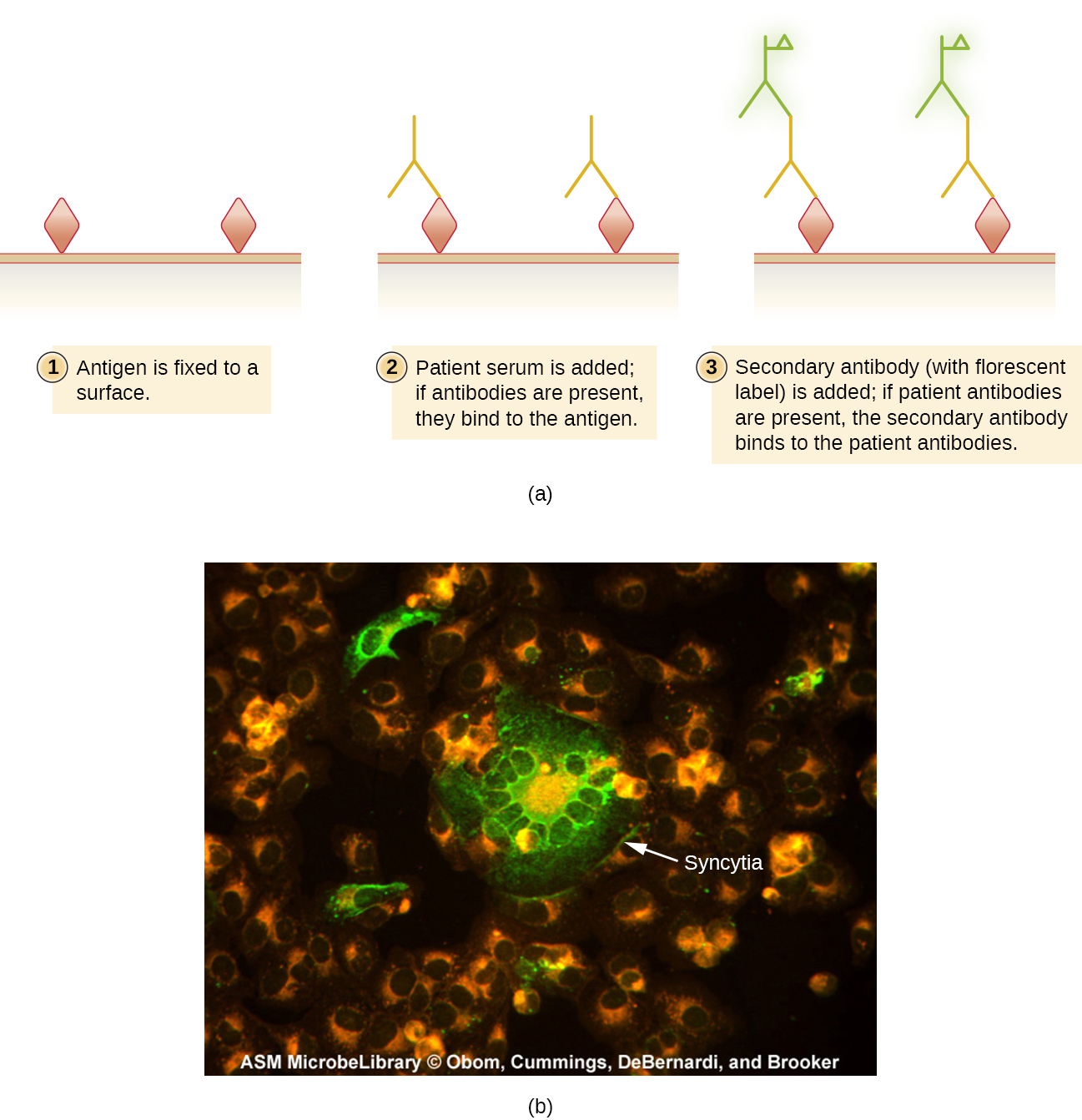
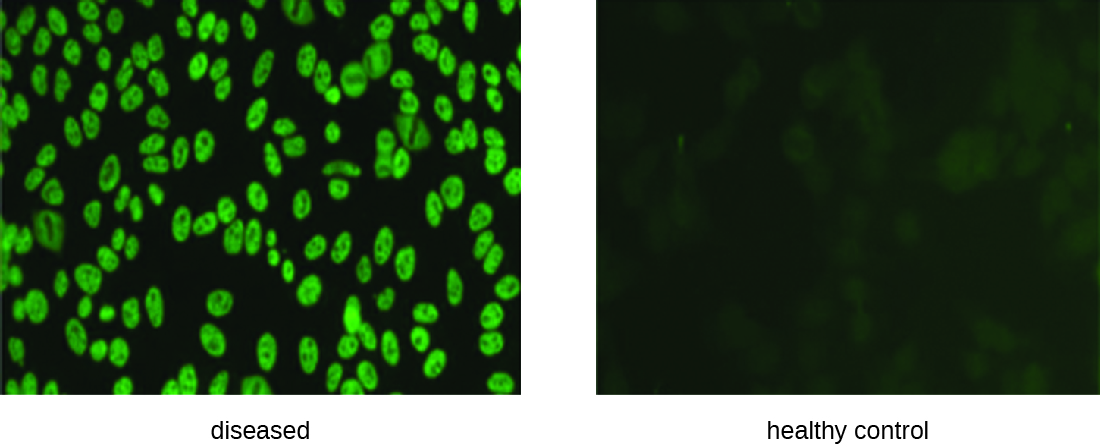
Exercício\(\PageIndex{2}\)
- Em um teste indireto de anticorpos fluorescentes, a que o anticorpo fluorescente se liga?
- O que o teste ANA está procurando?
Citometria de fluxo
Anticorpos marcados com fluorescência podem ser usados para quantificar células de um tipo específico em uma mistura complexa usando citometria de fluxo (Figura\(\PageIndex{4}\)), um sistema automatizado de contagem de células que detecta células fluorescentes à medida que elas passam por um tubo estreito, uma célula por vez. Por exemplo, nas infecções por HIV, é importante conhecer o nível de células T CD4 no sangue do paciente; se os números caírem abaixo de 500 por μL de sangue, o paciente se torna mais propenso a adquirir infecções oportunistas; abaixo de 200 por μL, o paciente não poderá mais gerar uma resposta imune adaptativa útil. A análise começa com a incubação de uma população de células mistas (por exemplo, glóbulos brancos de um doador) com um mAb marcado fluorescentemente específico para uma subpopulação de células (por exemplo, anti-CD4). Alguns experimentos analisam dois marcadores celulares simultaneamente, adicionando um fluorogênio diferente ao mAb apropriado. As células são então introduzidas no citômetro de fluxo por meio de um capilar estreito que força as células a passarem em fila única. Um laser é usado para ativar o fluorogênio. A luz fluorescente irradia em todas as direções, então o detector de fluorescência pode ser posicionado em um ângulo da luz laser incidente.
A figura\(\PageIndex{4}\) mostra a barra de obscurecimento na frente do detector de dispersão frontal que impede que a luz do laser atinja o detector. Quando uma célula passa pela barra de laser, o detector de dispersão frontal detecta a luz espalhada ao redor da barra de obscurecimento. A luz dispersa é transformada em um pulso de voltagem e o citômetro conta uma célula. A fluorescência de uma célula marcada é detectada pelos detectores de dispersão lateral. A luz passa por vários espelhos dicróicos, de forma que a luz emitida pelo fluoróforo seja recebida pelo detector correto.
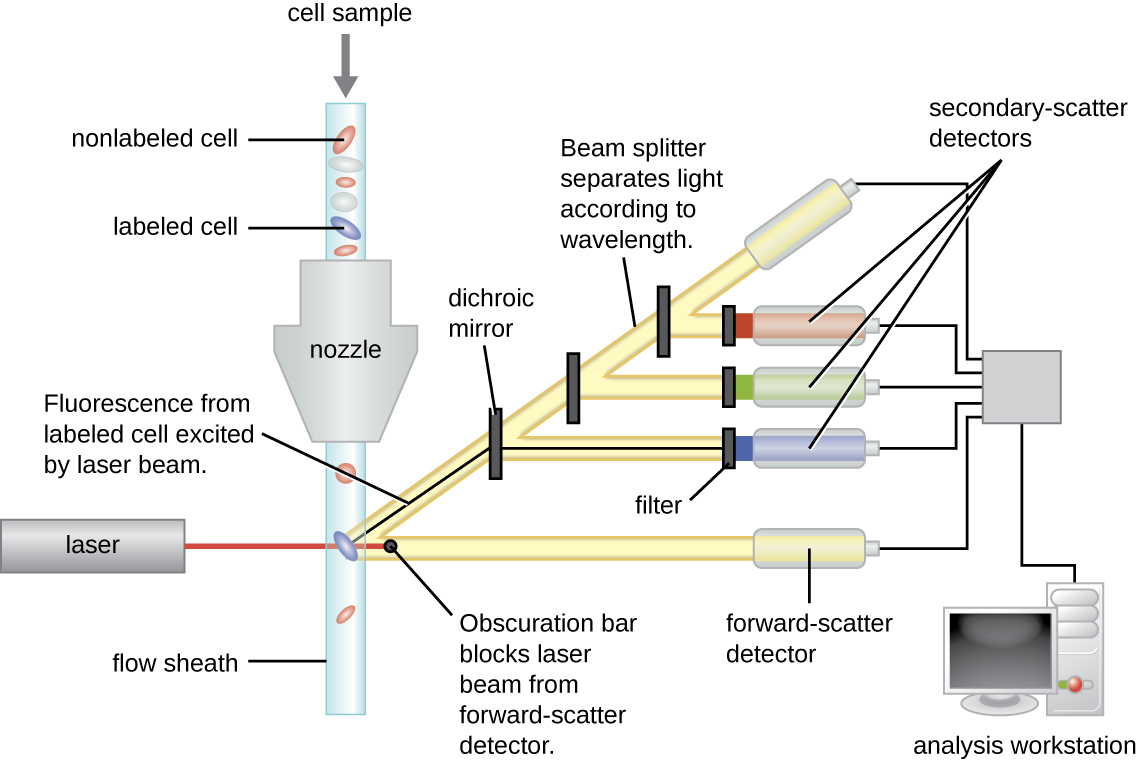
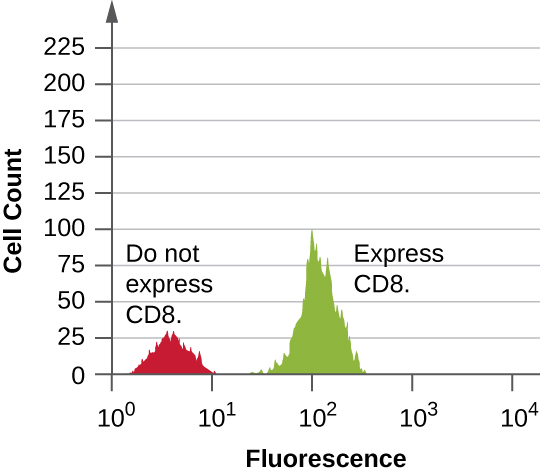
Os dados são coletados dos detectores de dispersão frontal e lateral. Uma forma pela qual esses dados podem ser apresentados é na forma de um histograma. A dispersão direta é colocada no eixo y (para representar o número de células) e a dispersão lateral é colocada no eixo x (para representar a fluoresência de cada célula). A escala para o eixo x é logarítmica, então a intensidade da fluorescência aumenta em um fator de 10 com cada aumento de unidade ao longo do eixo. A figura\(\PageIndex{5}\) mostra um exemplo em que uma cultura de células é combinada com um anticorpo ligado a um fluoróforo para detectar células CD8 e depois analisada por citometria de fluxo. O histograma tem dois picos. O pico à esquerda tem leituras de fluorescência mais baixas, representando o subconjunto da população celular (aproximadamente 30 células) que não fluoresce; portanto, elas não estão ligadas por anticorpos e, portanto, não expressam CD8. O pico à direita tem leituras de fluorescência mais altas, representando o subconjunto da população celular (aproximadamente 100 células) que mostra fluorescência; portanto, elas estão ligadas pelo anticorpo e, portanto, expressam CD8.
Exercício\(\PageIndex{3}\)
- Qual é a finalidade do laser em um citômetro de fluxo?
- Na saída de um citômetro de fluxo, a área abaixo do histograma é equivalente a quê?
Foco clínico: Resolução
Depois de notificar todos os 1300 pacientes, o hospital começa a agendar o rastreamento do HIV. As consultas foram agendadas no mínimo 3 semanas após a última visita do paciente ao hospital para minimizar o risco de falsos negativos. Como alguns falsos positivos foram antecipados, o médico de saúde pública estabeleceu um protocolo de aconselhamento para qualquer paciente cujo ELISA indireto deu positivo.
Dos 1300 pacientes, oito testaram positivo usando o ELISA. Cinco desses testes foram invalidados por testes negativos de Western Blot, mas um western blot deu positivo, confirmando que o paciente realmente havia contraído o HIV. As duas manchas ocidentais restantes voltaram indeterminadas. Esses indivíduos tiveram que se submeter a um terceiro teste, um PCR, para confirmar a presença ou ausência de sequências de HIV. Felizmente, ambos os pacientes testaram negativo.
Quanto ao único paciente confirmado como portador do HIV, os testes não podem provar ou refutar qualquer conexão com as seringas comprometida pelo ex-funcionário do hospital. Mesmo assim, o seguro do hospital cobrirá totalmente o tratamento do paciente, que começou imediatamente.
Embora agora tenhamos medicamentos que normalmente são eficazes no controle da progressão do HIV e da AIDS, ainda não há cura. Se não for tratado ou se o regime medicamentoso falhar, o paciente experimentará um declínio gradual no número de células T auxiliares CD4, resultando em comprometimento grave de todas as funções imunes adaptativas. Mesmo declínios moderados do número de células T auxiliares podem resultar em imunodeficiência, deixando o paciente suscetível a infecções oportunistas. Para monitorar o status das células T auxiliares do paciente, o hospital usará a citometria de fluxo. Esse teste sensível permite que os médicos determinem com precisão o número de células T auxiliares para que possam ajustar o tratamento se o número cair abaixo de 500 células/µL.
Classificação de células usando imunofluorescência
O citômetro de fluxo e a imunofluorescência também podem ser modificados para classificar as células de uma única amostra em subpopulações purificadas de células para fins de pesquisa. Essa modificação do citômetro de fluxo é chamada de classificador de células ativado por fluorescência (FACS). Em um FACS, a fluorescência de uma célula induz o dispositivo a colocar uma carga em uma gota do fluido transportador que contém essa célula. A carga é específica para o comprimento de onda da luz fluorescente, o que permite a classificação diferencial por essas diferentes cargas. A classificação é realizada por um defletor eletrostático que move a gota carregada contendo a célula para um recipiente coletor ou outro. O processo resulta em subpopulações de células altamente purificadas.
Uma limitação de um FACS é que ele só funciona em células isoladas. Assim, o método funcionaria na classificação dos glóbulos brancos, já que eles existem como células isoladas. Mas para células em um tecido, a citometria de fluxo só pode ser aplicada se pudermos excisar o tecido e separá-lo em células únicas (usando proteases para clivar as moléculas de adesão célula-célula) sem interromper a integridade celular. Esse método pode ser usado em tumores, mas, mais frequentemente, a imunohistoquímica e a imunocitoquímica são usadas para estudar células nos tecidos.
Assista a vídeos para saber mais sobre como a citometria de fluxo e um FACS funcionam.
Exercício\(\PageIndex{4}\)
Na classificação de células ativadas por fluorescência, qual característica das células-alvo permite que elas sejam separadas?
A tabela\(\PageIndex{1}\) compara os mecanismos das técnicas de anticorpos fluorescentes discutidas nesta seção.
| Tipo de ensaio | Mecanismo | Exemplos |
|---|---|---|
| Anticorpo fluorescente direto (DFA) | Usa conjugados de anticorpos fluorogênicos para rotular bactérias de amostras de pacientes | Visualizando Legionella pneumophila a partir de um cotonete na garganta |
| Anticorpo fluorescente indireto (IFA) | Detecta anticorpos específicos de doenças no soro patenteado | Diagnóstico da sífilis; detecção de anticorpos antinucleares (ANA) para lúpus e outras doenças autoimunes |
| Citometria de fluxo | Rotula as membranas celulares com marcadores conjugados de anticorpos fluorogênicos excitados por um laser; a máquina conta a célula e registra a fluorescência relativa | Contando o número de células CD4 ou CD8 marcadas com fluorescência em uma amostra |
| Classificador de células ativadas por fluorescência (FACS) | Forma de citometria de fluxo que conta as células e as separa fisicamente em grupos de células de alta e baixa fluorescência | Classificação de células cancerosas |
Conceitos principais e resumo
- Os ensaios de imunofluorescência usam conjugados anticorpo-fluorogênio para iluminar antígenos para uma detecção fácil e rápida.
- A imunofluorescência direta pode ser usada para detectar a presença de bactérias em amostras clínicas, como escarro.
- A imunofluorescência indireta detecta a presença de anticorpos antígenos específicos nos soros dos pacientes. O anticorpo fluorescente se liga ao anticorpo específico do antígeno em vez do antígeno.
- O uso de ensaios de imunofluorescência indireta para detectar anticorpos antinucleares é uma ferramenta importante no diagnóstico de várias doenças autoimunes.
- A citometria de fluxo usa mAbs fluorescentes contra proteínas da membrana celular para quantificar subconjuntos específicos de células em misturas complexas.
- Os classificadores de células ativados por fluorescência são uma extensão da citometria de fluxo na qual a intensidade de fluorescência é usada para separar fisicamente as células em populações de alta e baixa fluorescência.
Notas de pé
- 1 Gill, James M., ANNA M. Quisel, PETER V. Rocca e DENE T. Walters. “Diagnóstico do lúpus eritematoso sistêmico.” Médico de família americano 68, nº 11 (2003): 2179-2186.


