20.4: Imunoensaios enzimáticos (EIA) e ensaios de imunoabsorção enzimática (ELISA)
- Page ID
- 181603
Objetivos de
- Explique as diferenças e semelhanças entre EIA, FEIA e ELISA
- Descreva a diferença e as semelhanças entre imuno-histoquímica e imunocitoquímica
- Descreva os diferentes propósitos do ELISA direto e indireto
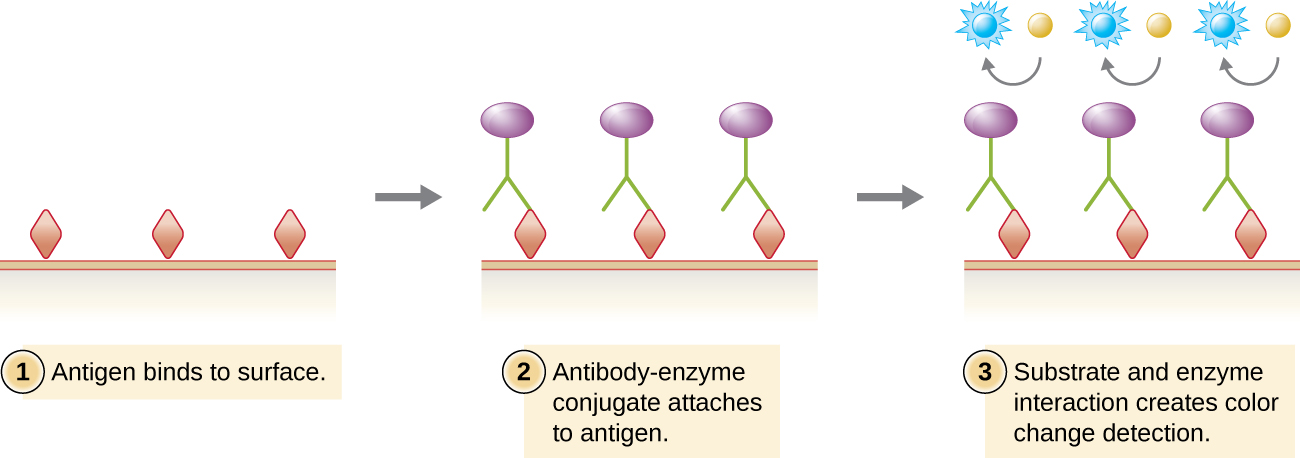
Semelhante ao western blot, os imunoensaios enzimáticos (EIAs) usam anticorpos para detectar a presença de antígenos. No entanto, os EIAs diferem dos western blots porque os ensaios são conduzidos em placas de microtitulação ou in vivo, em vez de em uma membrana absorvente. Existem muitos tipos diferentes de EIAs, mas todos eles envolvem uma molécula de anticorpo cuja região constante se liga a uma enzima, deixando a região variável livre para se ligar ao seu antígeno específico. A adição de um substrato para a enzima permite que o antígeno seja visualizado ou quantificado (Figura\(\PageIndex{1}\)).
Em EIAs, o substrato da enzima é, na maioria das vezes, um cromógeno, uma molécula incolor que é convertida em um produto final colorido. As enzimas mais amplamente usadas são a fosfatase alcalina e a peroxidase de rábano, para as quais substratos apropriados estão prontamente disponíveis. Em alguns EIAs, o substrato é um fluorogênio, uma molécula não fluorescente que a enzima converte em uma forma fluorescente. Os EIAs que utilizam um fluorogênio são chamados de imunoensaios enzimáticos fluorescentes (FEIAs). A fluorescência pode ser detectada por um microscópio de fluorescência ou por um espectrofotômetro.
O título MMR
A vacina MMR é uma vacina combinada que fornece proteção contra sarampo, caxumba e rubéola (sarampo alemão). A maioria das pessoas recebe a vacina MMR quando crianças e, portanto, tem anticorpos contra essas doenças. No entanto, por vários motivos, até mesmo indivíduos vacinados podem se tornar suscetíveis a essas doenças novamente mais tarde na vida. Por exemplo, algumas crianças podem receber apenas uma rodada da vacina MMR em vez das duas recomendadas. Além disso, o título de anticorpos protetores no corpo de um indivíduo pode começar a diminuir com a idade ou como resultado de algumas condições médicas.
Para determinar se o título de anticorpo na corrente sanguínea de um indivíduo é suficiente para fornecer proteção, um teste de título MMR pode ser realizado. O teste é um imunoensaio simples que pode ser feito rapidamente com uma amostra de sangue. Os resultados do teste indicarão se o indivíduo ainda tem imunidade ou precisa de outra dose da vacina MMR.
Submeter-se a um título de MMR costuma ser um requisito pré-contratado para profissionais de saúde, especialmente aqueles que frequentemente entrarão em contato com crianças pequenas ou pacientes imunocomprometidos. Se um profissional de saúde fosse infectado com sarampo, caxumba ou rubéola, o indivíduo poderia facilmente transmitir essas doenças a pacientes suscetíveis, levando a um surto. Dependendo dos resultados do título MMR, os profissionais de saúde podem precisar ser revacinados antes de começarem a trabalhar.
Imunomarcação
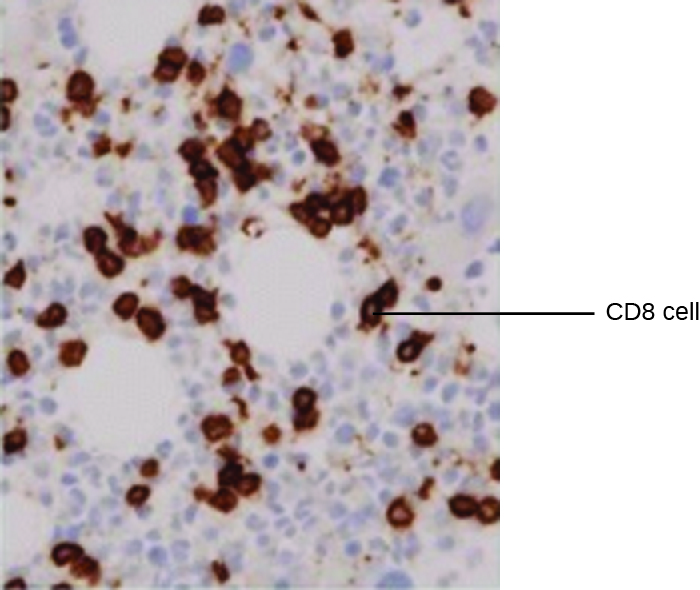
Um uso poderoso da EIA é a imunomarcação, na qual os conjugados anticorpo-enzima melhoram a microscopia. A imunohistoquímica (IHC) é usada para examinar tecidos inteiros. Como visto na Figura\(\PageIndex{2}\), uma seção do tecido pode ser corada para visualizar os vários tipos de células. Neste exemplo, um mAb contra CD8 foi usado para colorir células CD8 em uma seção do tecido da amígdala. Agora é possível contar o número de células CD8, determinar seus números relativos em relação aos outros tipos de células presentes e determinar a localização dessas células dentro desse tecido. Esses dados seriam úteis para estudar doenças como a AIDS, nas quais a função normal das células CD8 é crucial para retardar a progressão da doença.
A imunocitoquímica (ICC) é outra forma valiosa de imunomarcação. Embora semelhante ao IHC, no ICC, o material da matriz extracelular é removido e a membrana celular é gravada com álcool para torná-la permeável aos anticorpos. Isso permite que os anticorpos passem pela membrana celular e se liguem a alvos específicos dentro da célula. Organelas, componentes do citoesqueleto e outras estruturas intracelulares podem ser visualizados dessa forma. Embora algumas técnicas de ICC usem EIA, a enzima pode ser substituída por uma molécula fluorescente, tornando-a um imunoensaio fluorescente.
Exercício\(\PageIndex{1}\)
- Qual é a diferença entre imunohistoquímica e imunocitoquímica?
- O que deve ser verdade sobre o produto da reação enzimática usada na imunohistoquímica?
Ensaios de imunoabsorção enzimática (ELISAs)
Os ensaios de imunoabsorção enzimática (ELISAs) são EIAs amplamente utilizados. No ELISA direto, os antígenos são imobilizados no poço de uma placa de microtitulação. Um anticorpo específico para um antígeno específico e conjugado a uma enzima é adicionado a cada poço. Se o antígeno estiver presente, o anticorpo se ligará. Após a lavagem para remover quaisquer anticorpos não ligados, um substrato incolor (cromogênio) é adicionado. A presença da enzima converte o substrato em um produto final colorido (Figura\(\PageIndex{1}\)). Embora essa técnica seja mais rápida porque requer apenas o uso de um anticorpo, ela tem a desvantagem de que o sinal de um ELISA direto seja menor (menor sensibilidade).
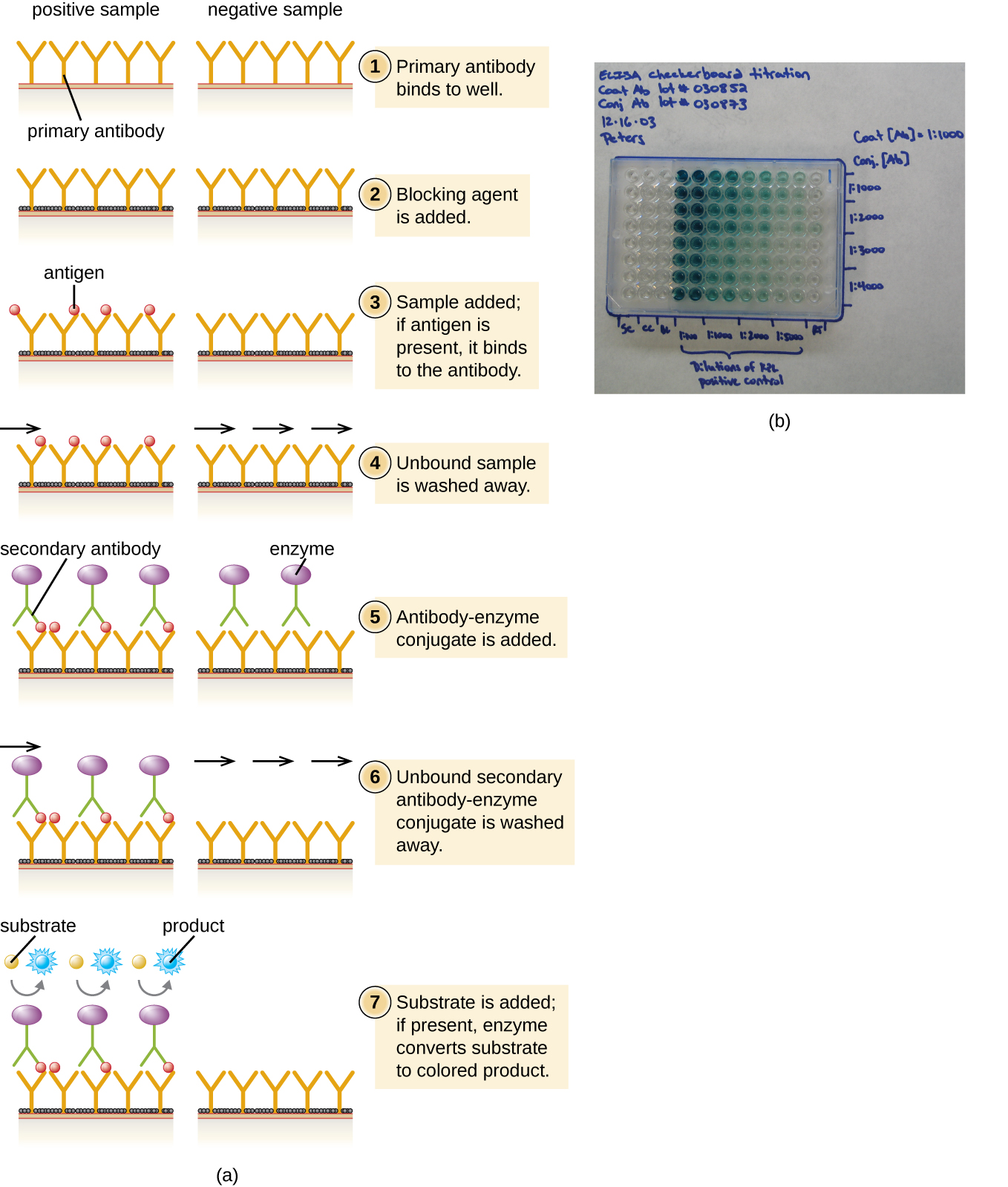
Em um sanduíche ELISA, o objetivo é usar anticorpos para quantificar com precisão o antígeno específico presente em uma solução, como o antígeno de um patógeno, uma proteína sérica ou um hormônio do sangue ou da urina, para listar apenas alguns exemplos. A primeira etapa de um ELISA em sanduíche é adicionar o anticorpo primário a todos os poços de uma placa de microtitulação (Figura\(\PageIndex{3}\)). O anticorpo adere ao plástico por meio de interações hidrofóbicas. Após um tempo de incubação apropriado, qualquer anticorpo não ligado é removido. Lavagens comparáveis são usadas entre cada uma das etapas subsequentes para garantir que apenas moléculas especificamente ligadas permaneçam presas à placa. Uma proteína bloqueadora é então adicionada (por exemplo, albumina ou a proteína caseína do leite) para ligar os locais de ligação à proteína não específicos restantes no poço. Alguns dos poços receberão quantidades conhecidas de antígeno para permitir a construção de uma curva padrão, e soluções de antígeno desconhecidas serão adicionadas aos outros poços. O anticorpo primário captura o antígeno e, após uma lavagem, o anticorpo secundário é adicionado, que é um anticorpo policlonal conjugado a uma enzima. Após uma lavagem final, um substrato incolor (cromogênio) é adicionado e a enzima o converte em um produto final colorido. A intensidade da cor da amostra causada pelo produto final é medida com um espectrofotômetro. A quantidade de cor produzida (medida como absorbância) é diretamente proporcional à quantidade de enzima, que por sua vez é diretamente proporcional ao antígeno capturado. Os ELISAs são extremamente sensíveis, permitindo que o antígeno seja quantificado na faixa de nanogramas (10 —9 g) por mL.
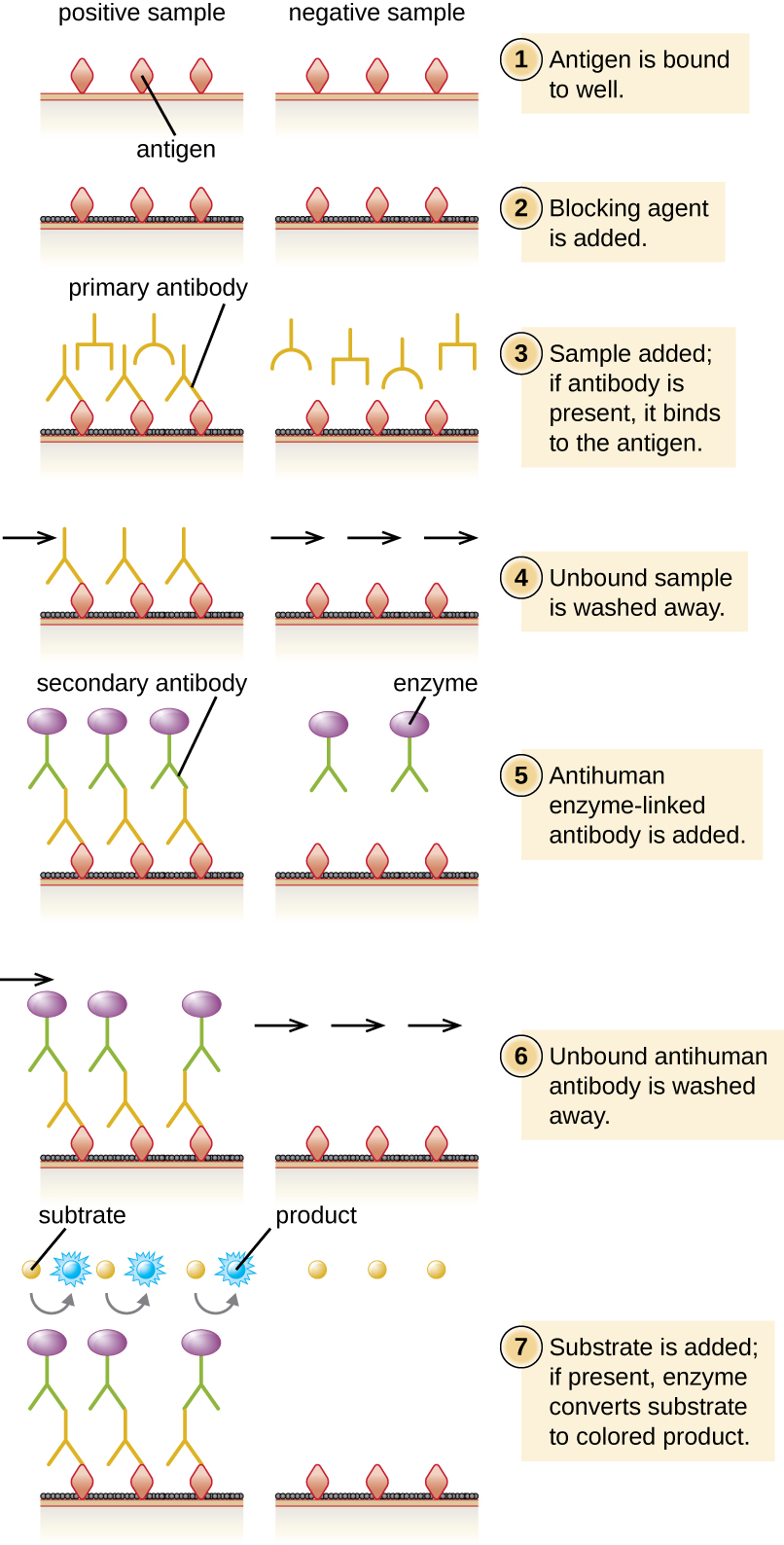
Em um ELISA indireto, quantificamos o anticorpo específico do antígeno em vez do antígeno. Podemos usar o ELISA indireto para detectar anticorpos contra muitos tipos de patógenos, incluindo Borrelia burgdorferi (doença de Lyme) e HIV. Existem três diferenças importantes entre ELISAs indiretos e diretos, conforme mostrado na Figura\(\PageIndex{4}\). Em vez de usar anticorpos para capturar antígeno, o ELISA indireto começa com a ligação do antígeno conhecido (por exemplo, peptídeos do HIV) ao fundo dos poços da placa microtitular. Depois de bloquear os locais de não ligação na placa, o soro do paciente é adicionado; se estiverem presentes anticorpos (anticorpo primário), eles se ligarão ao antígeno. Depois de remover quaisquer proteínas não ligadas, o anticorpo secundário com sua enzima conjugada é direcionado contra o anticorpo primário (por exemplo, imunoglobulina anti-humana). O anticorpo secundário nos permite quantificar a quantidade de anticorpo específico do antígeno presente no soro do paciente pela intensidade da cor produzida pela reação conjugada enzima-cromogênio.
Como em vários outros testes de anticorpos discutidos neste capítulo, sempre há preocupação com a reatividade cruzada com anticorpos direcionados contra algum outro antígeno, o que pode levar a resultados falsos positivos. Portanto, não podemos diagnosticar definitivamente uma infecção por HIV (ou qualquer outro tipo de infecção) com base em um único ensaio ELISA indireto. Devemos confirmar qualquer teste positivo suspeito, que geralmente é feito usando um imunolote que realmente identifica a presença de peptídeos específicos do patógeno ou um teste para identificar os ácidos nucléicos associados ao patógeno, como PCR da transcriptase reversa (RT-PCR) ou um antígeno de ácido nucléico teste.
Exercício\(\PageIndex{2}\)
- Qual é a finalidade do anticorpo secundário em um ELISA direto?
- O que os ELISAs diretos e indiretos quantificam?
Foco clínico: Parte 2
Embora contatar e testar o HIV em 1300 pacientes fosse demorado e caro, os administradores esperavam minimizar a responsabilidade do hospital procurando e tratando proativamente as possíveis vítimas do crime cometido por funcionários desonestos. A detecção precoce do HIV é importante e o tratamento imediato pode retardar a progressão da doença.
Há uma variedade de testes de rastreamento para o HIV, mas o mais amplamente usado é o ELISA indireto. Como acontece com outros ELISAs indiretos, o teste funciona ligando o antígeno (neste caso, peptídeos do HIV) a um poço em uma placa de 96 poços. Se o paciente for HIV positivo, os anticorpos anti-HIV se ligarão ao antígeno e serão identificados pelo segundo conjugado anticorpo-enzima.
Exercício\(\PageIndex{3}\)
- Qual é a precisão de um teste ELISA indireto para HIV e quais fatores podem impactar a precisão do teste?
- O hospital deve usar outros testes para confirmar os resultados do ELISA indireto?
Imunofiltração e ensaios imunocromatográficos
Para algumas situações, pode ser necessário detectar ou quantificar antígenos ou anticorpos que estão presentes em concentrações muito baixas em solução. Técnicas de imunofiltração foram desenvolvidas para tornar isso possível. Na imunofiltração, um grande volume de fluido passa por uma membrana porosa para uma almofada absorvente. Um antígeno ligado à membrana porosa capturará o anticorpo à medida que ele passa; alternativamente, também podemos conectar um anticorpo à membrana para capturar o antígeno.
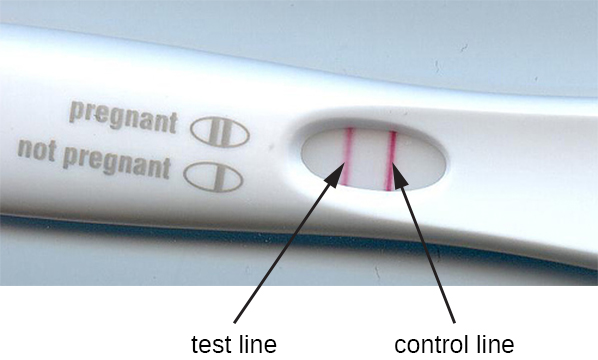
O método de imunofiltração foi adaptado no desenvolvimento de ensaios imunocromatográficos, comumente conhecidos como testes de fluxo lateral ou testes em tiras. Esses testes são rápidos e fáceis de realizar, tornando-os populares para uso no local de atendimento (ou seja, no consultório médico) ou em casa. Um exemplo é o teste TORCH, que permite que os médicos examinem mulheres grávidas ou recém-nascidos quanto à infecção por uma série de vírus e outros patógenos (Toxoplasma, outros vírus, rubéola, citomegalovírus, herpes simplex). Os testes de gravidez em casa são outro exemplo amplamente usado de teste de fluxo lateral (Figura\(\PageIndex{5}\)). Os testes de imunofiltração também são populares nos países em desenvolvimento, pois são baratos e não requerem refrigeração constante dos reagentes secos. No entanto, a tecnologia também está incorporada em alguns equipamentos de laboratório sofisticados.
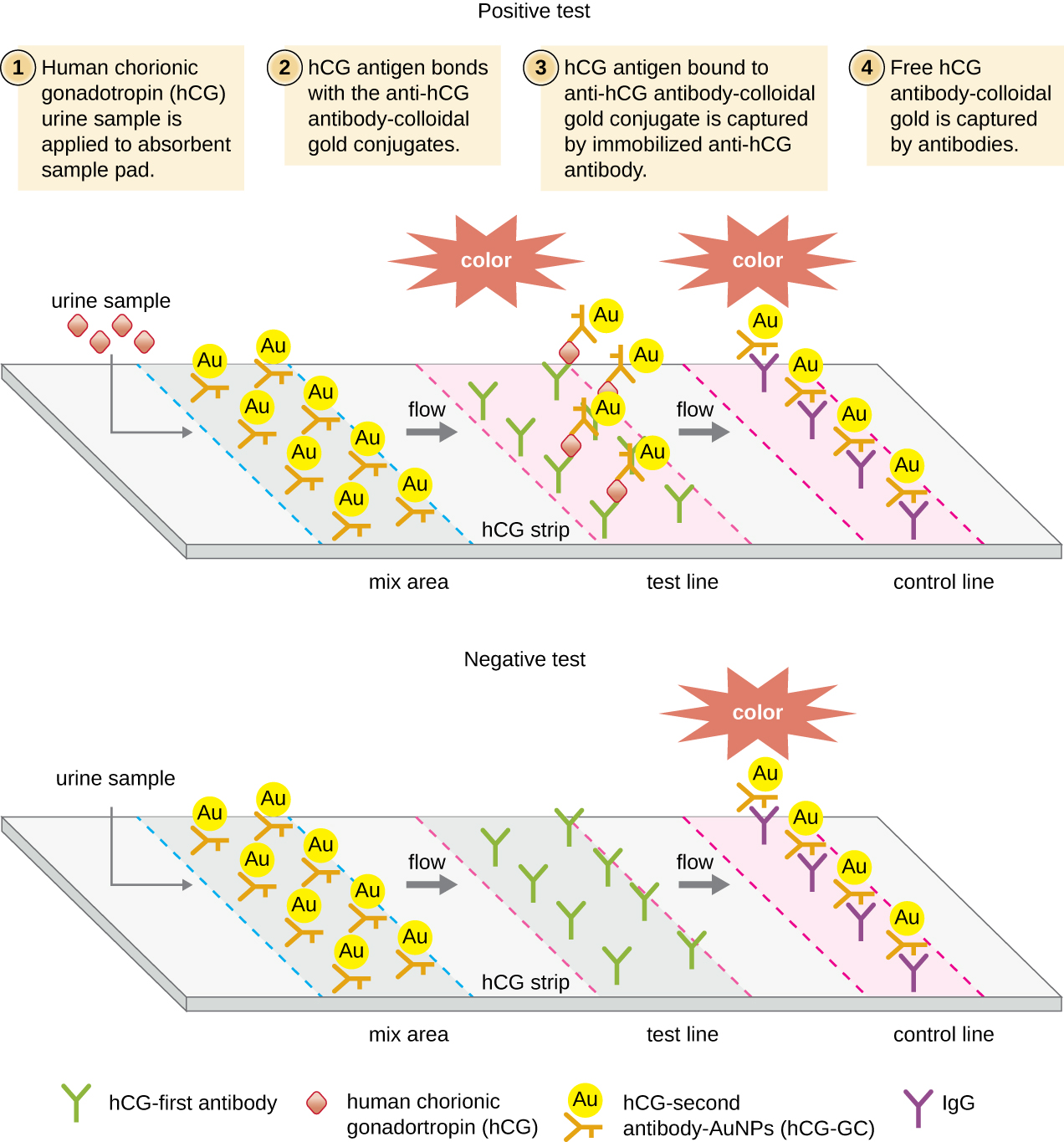
Nos testes de fluxo lateral (Figura\(\PageIndex{6}\)), fluidos como urina são aplicados em uma almofada absorvente na tira de teste. O fluido flui por ação capilar e se move através de uma faixa de esferas com anticorpos presos às suas superfícies. O fluido na amostra realmente hidrata os reagentes, que estão presentes em estado seco na faixa. Esferas revestidas com anticorpos feitas de látex ou pequenas partículas de ouro se ligam aos antígenos no fluido de teste. Os complexos anticorpo-antígeno então fluem sobre uma segunda faixa que tem anticorpo imobilizado contra o antígeno; essa faixa reterá as esferas que se uniram ao antígeno. Uma terceira faixa de controle une qualquer grânulo. Uma cor vermelha (de partículas de ouro) ou azul (de esferas de látex) se desenvolvendo na linha de teste indica um teste positivo. Se a cor só se desenvolver na linha de controle, o teste será negativo.
Assim como as técnicas de ELISA, os testes de fluxo lateral aproveitam os sanduíches de anticorpos, fornecendo sensibilidade e especificidade. Embora não sejam tão quantitativos quanto o ELISA, esses testes têm a vantagem de serem rápidos, baratos e não dependentes de equipamentos especiais. Assim, eles podem ser executados em qualquer lugar por qualquer pessoa. Há algumas preocupações em colocar esses testes de diagnóstico poderosos nas mãos de pessoas que podem não entender as limitações dos testes, como a possibilidade de resultados falsos positivos. Embora os testes de gravidez caseiros tenham se tornado amplamente aceitos, os testes caseiros de detecção de anticorpos para doenças como o HIV levantaram algumas preocupações na comunidade médica. Alguns questionaram se a autoadministração de tais testes deveria ser permitida na ausência de pessoal médico que possa explicar os resultados do teste e solicitar exames confirmatórios apropriados. No entanto, com o crescente número de testes de fluxo lateral se tornando disponível e o rápido desenvolvimento da tecnologia de laboratório em um chip (Figura 20.1), é provável que os exames médicos domiciliares se tornem ainda mais comuns no futuro.
Exercício\(\PageIndex{4}\)
- Qual processo físico o método de fluxo lateral requer para funcionar?
- Explique o propósito da terceira faixa em um ensaio de fluxo lateral.
A tabela\(\PageIndex{1}\) compara alguns dos principais mecanismos e exemplos de alguns dos EIAs discutidos nesta seção, bem como imunoblotes, que foram discutidos em Detecção de complexos antígeno-anticorpo.
| Tipo de ensaio | Mecanismo | Procedimentos específicos | Exemplos |
|---|---|---|---|
| Imunoblots | Usa conjugados enzima-anticorpo para identificar proteínas específicas que foram transferidas para uma membrana absorvente | Western blot: detecta a presença de uma proteína específica | Detecção da presença de peptídeos do HIV (ou peptídeos de outros agentes infecciosos) nos soros dos pacientes |
| Imunomarcação | Usa conjugados enzima-anticorpo para manchar moléculas específicas nas células ou nas células | Imunohistoquímica: usada para colorir células específicas em um tecido | Mancha para presença de células CD8 no tecido hospedeiro |
| Ensaio de imunoabsorção enzimática (ELISA) | Usa conjugados enzima-anticorpo para quantificar moléculas alvo | ELISA direto: usa um único anticorpo para detectar a presença de um antígeno | Detecção do antígeno HIV p24 até um mês após a infecção |
| ELISA indireto: mede a quantidade de anticorpo produzido contra um antígeno | Detecção de anticorpos contra o HIV no soro | ||
| Ensaios imunocromatográficos (fluxo lateral) | As técnicas usam a captura de complexos de antígeno-anticorpo fluidos e marcados com cores por anticorpo fixo para diagnóstico de doenças | ELISA em sanduíche: mede a quantidade de antígeno ligado ao anticorpo | Detecção de anticorpos para vários patógenos em soros de pacientes (por exemplo, estreptococos rápidos, vareta de malária) |
| Teste de gravidez detectando gonadotrofina coriônica humana na urina |
Foco clínico: Parte 3
Embora o ELISA indireto para o HIV seja um ensaio sensível, existem várias considerações complicadoras. Primeiro, se uma pessoa infectada for testada logo após ser infectada, o teste pode produzir resultados falsos negativos. A janela de soroconversão geralmente é de cerca de três semanas, mas em alguns casos, pode levar mais de dois meses.
Além dos falsos negativos, também podem ocorrer falsos positivos, geralmente devido a infecções anteriores por outros vírus que induzem anticorpos de reação cruzada. A taxa de falsos positivos depende da marca específica do teste usado, mas 0,5% não é incomum. 1 Devido à possibilidade de um falso positivo, todos os testes positivos são acompanhados por um teste confirmatório. Esse teste confirmatório geralmente é um imunoblot (western blot) no qual os peptídeos de HIV do sangue do paciente são identificados usando um conjugado da enzima Mab específico para o HIV. Uma mancha ocidental positiva confirmaria uma infecção pelo HIV e uma mancha negativa confirmaria a ausência do HIV, apesar do ELISA positivo.
Infelizmente, as manchas ocidentais para antígenos do HIV geralmente produzem resultados indeterminantes; nesse caso, elas não confirmam nem invalidam os resultados do ELISA indireto. De fato, a taxa de indeterminantes pode ser de 10 a 49% (é por isso que, combinado com seu custo, os western blots não são usados para triagem). Semelhante ao ELISA indireto, um western blot indeterminado pode ocorrer devido à reatividade cruzada ou a infecções virais anteriores, vacinações ou doenças autoimunes.
Exercício\(\PageIndex{5}\)
- Dos 1300 pacientes que estão sendo testados, quantos testes ELISA falso-positivos seriam esperados?
- Dos falsos positivos, quantas manchas ocidentais indeterminadas poderiam ser esperadas?
- Como o hospital trataria os casos em que a mancha ocidental de um paciente fosse indeterminada?
Conceitos principais e resumo
- Os imunoensaios enzimáticos (EIA) são usados para visualizar e quantificar antígenos. Eles usam um anticorpo conjugado a uma enzima para se ligar ao antígeno, e a enzima converte um substrato em um produto final observável. O substrato pode ser um cromógeno ou um fluorogênio.
- A imunomarcação é uma técnica de EIA para visualizar células em um tecido (imunohistoquímica) ou examinar estruturas intracelulares (imunocitoquímica).
- O ELISA direto é usado para quantificar um antígeno em solução. O anticorpo primário captura o antígeno e o anticorpo secundário libera uma enzima. A produção do produto final a partir do substrato cromogênico é diretamente proporcional à quantidade de antígeno capturado.
- O ELISA indireto é usado para detectar anticorpos no soro do paciente, ligando o antígeno ao poço de uma placa de microtítulo, permitindo que o anticorpo (primário) do paciente se ligue ao antígeno e um anticorpo secundário conjugado com enzimas para detectar o anticorpo primário.
- Os ensaios de imunofiltração e imunocromatográficos são usados em testes de fluxo lateral, que podem ser usados para diagnosticar a gravidez e várias doenças, detectando complexos antígeno-anticorpo marcados com cores na urina ou em outras amostras de fluidos
Notas de pé
- 1 Thomas, Justin G., Victor Jaffe, Judith Shaffer e Jose Abreu, “Teste de HIV: Recomendações dos EUA 2014”, Médico de Família Osteopática 6, nº 6 (2014).


