20.3: Ensaios de aglutinação
- Page ID
- 181587
Objetivos de
- Compare a aglutinação direta e indireta
- Identificar vários usos da hemaglutinação no diagnóstico da doença
- Explique como os tipos sanguíneos são determinados
- Explique as etapas usadas para comparar o sangue a ser usado em uma transfusão
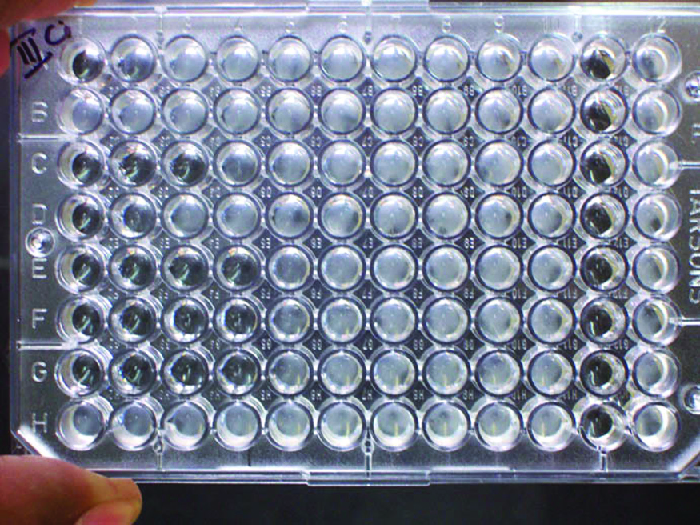
Além de causar precipitação de moléculas solúveis e floculação de moléculas em suspensão, os anticorpos também podem agrupar células ou partículas (por exemplo, esferas de látex revestidas com antígeno) em um processo chamado aglutinação (Figura 18.1.8). A aglutinação pode ser usada como um indicador da presença de anticorpos contra bactérias ou glóbulos vermelhos. Os ensaios de aglutinação geralmente são rápidos e fáceis de realizar em uma lâmina de vidro ou placa de microtitulação (Figura\(\PageIndex{1}\)). As placas de microtitulação têm uma série de poços para conter pequenos volumes de reagentes e observar reações (por exemplo, aglutinação) visualmente ou usando um espectrofotômetro especialmente projetado. Os poços vêm em muitos tamanhos diferentes para ensaios envolvendo diferentes volumes de reagentes.
Aglutinação de bactérias e vírus
O uso de testes de aglutinação para identificar bactérias estreptocócicas foi desenvolvido na década de 1920 por Rebecca Lancefield trabalhando com seus colegas A.R. Dochez e Oswald Avery. 1 Ela usou anticorpos para identificar a proteína M, um fator de virulência nos estreptococos que é necessário para a capacidade da bactéria de causar faringite estreptocócica. A produção de anticorpos contra a proteína M é crucial para montar uma resposta protetora contra a bactéria.
Lancefield usou antissoros para mostrar que diferentes cepas da mesma espécie de estreptococos expressam diferentes versões da proteína M, o que explica por que as crianças podem ter faringite estreptocócica repetidamente. Lancefield classificou os estreptococos beta-hemolíticos em muitos grupos com base nas diferenças antigênicas nos polissacarídeos específicos do grupo localizados na parede celular bacteriana. As cepas são chamadas de sorovares porque são diferenciadas usando antissoros. Identificar os sorovares presentes em um surto de doença é importante porque alguns sorovares podem causar doenças mais graves do que outros.
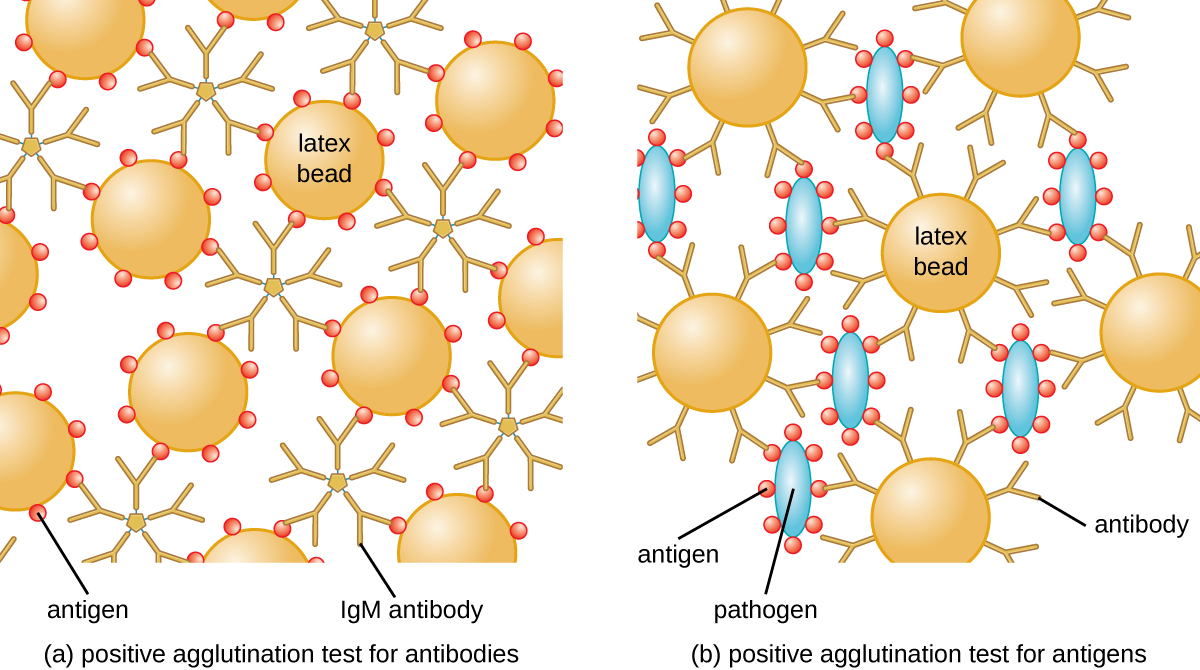
O método desenvolvido por Lancefield é um ensaio de aglutinação direta, já que as próprias células bacterianas se aglutinam. Uma estratégia semelhante é mais comumente usada atualmente na identificação de sorovares de bactérias e vírus; no entanto, para melhorar a visualização da aglutinação, os anticorpos podem estar ligados a esferas de látex inertes. Essa técnica é chamada de ensaio de aglutinação indireta (ou ensaio de fixação de látex), porque a aglutinação das esferas é um marcador de ligação de anticorpos a algum outro antígeno (Figura\(\PageIndex{2}\)). Ensaios indiretos podem ser usados para detectar a presença de anticorpos ou antígenos específicos.
Para identificar anticorpos no soro de um paciente, o antígeno de interesse é ligado às esferas de látex. Quando misturados ao soro do paciente, os anticorpos se ligam ao antígeno, reticulando as esferas de látex e fazendo com que as esferas se aglutinem indiretamente; isso indica a presença do anticorpo (Figura\(\PageIndex{3}\)). Essa técnica é usada com mais frequência ao procurar anticorpos IgM, porque sua estrutura fornece o máximo de reticulação. Um exemplo amplamente utilizado desse ensaio é um teste de fator reumatóide (RF) para confirmar o diagnóstico de artrite reumatoide. A RF é, na verdade, a presença de anticorpos IgM que se ligam à própria IgG do paciente. O RF aglutinará esferas de látex revestidas com IgG.
No teste inverso, antígenos solúveis podem ser detectados no soro de um paciente ligando anticorpos específicos (geralmente mAbs) às esferas de látex e misturando esse complexo com o soro (Figura\(\PageIndex{3}\)).
Os testes de aglutinação são amplamente usados em países subdesenvolvidos que podem não ter instalações apropriadas para o cultivo de bactérias. Por exemplo, o teste de Widal, usado para o diagnóstico da febre tifóide, busca a aglutinação da subespécie typhi de Salmonella enterica em soros de pacientes. O teste de Widal é rápido, barato e útil para monitorar a extensão de um surto; no entanto, não é tão preciso quanto os testes que envolvem o cultivo da bactéria. O teste de Widal freqüentemente produz falsos positivos em pacientes com infecções anteriores por outras subespécies de Salmonella, bem como falsos negativos em pacientes com hiperproteinemia ou deficiências imunológicas.
Além disso, os testes de aglutinação são limitados pelo fato de que os pacientes geralmente não produzem níveis detectáveis de anticorpos durante a primeira semana (ou mais) de uma infecção. Diz-se que um paciente sofreu soroconversão quando os níveis de anticorpos atingem o limite de detecção. Normalmente, a soroconversão coincide com o início dos sinais e sintomas da doença. No entanto, em uma infecção por HIV, por exemplo, geralmente leva 3 semanas para que a soroconversão ocorra e, em alguns casos, pode levar muito mais tempo.
Semelhante às técnicas do teste do anel de precipitina e dos ensaios de placa, é rotineiro preparar diluições seriadas duplas do soro do paciente e determinar o título do anticorpo aglutinante presente. Como os níveis de anticorpos mudam com o tempo nas respostas imunes primárias e secundárias, ao verificar as amostras ao longo do tempo, mudanças no título de anticorpos podem ser detectadas. Por exemplo, uma comparação entre o título durante a fase aguda de uma infecção e o título da fase de convalescença distinguirá se uma infecção é atual ou ocorreu no passado. Também é possível monitorar o quão bem o sistema imunológico do paciente está respondendo ao patógeno.
Assista a este vídeo que demonstra reações de aglutinação com esferas de látex.
Exercício\(\PageIndex{1}\)
- Como a aglutinação é usada para distinguir os sorovares uns dos outros?
- Em um ensaio de látex para testar anticorpos no soro de um paciente, com o que as esferas são revestidas?
- O que aconteceu quando um paciente é submetido à soroconversão?
Hemaglutinação
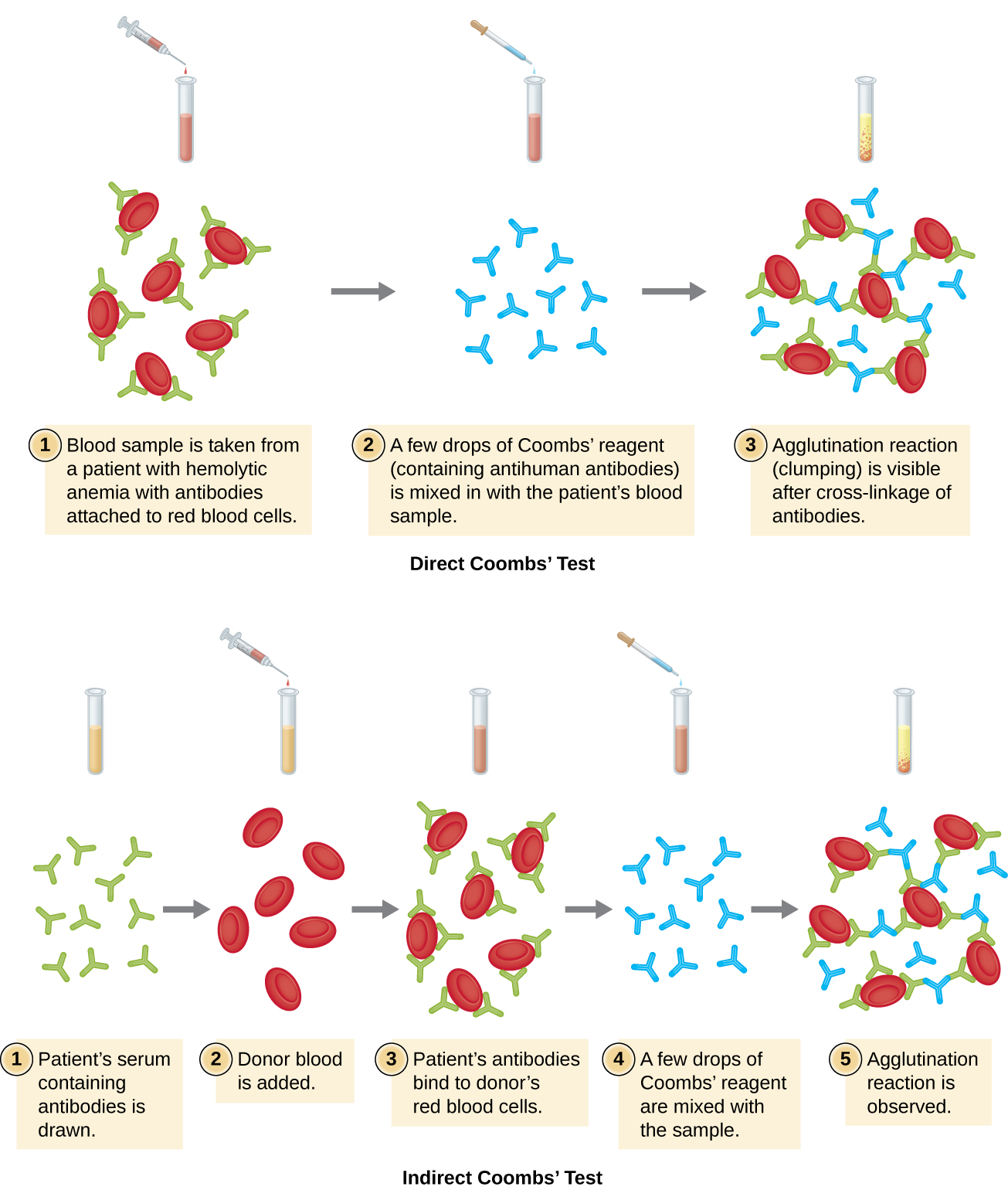
A aglutinação dos glóbulos vermelhos é chamada de hemaglutinação. Um ensaio comum que usa hemaglutinação é o teste direto de Coombs, também chamado de teste direto de globulina anti-humana (DAT), que geralmente busca anticorpos não aglutinantes. O teste também pode detectar o complemento ligado aos glóbulos vermelhos.
O teste de Coombs é frequentemente empregado quando um recém-nascido tem icterícia, amarelecimento da pele causado por altas concentrações de bilirrubina no sangue, um produto da degradação da hemoglobina no sangue. O teste de Coombs é usado para determinar se os glóbulos vermelhos da criança foram ligados pelos anticorpos da mãe. Esses anticorpos ativariam o complemento, levando à lise dos glóbulos vermelhos e à subsequente icterícia. Outras condições que podem causar testes diretos de Coombs positivos incluem reações de transfusão hemolítica, anemia hemolítica autoimune, mononucleose infecciosa (causada pelo vírus Epstein-Barr), sífilis e pneumonia por Mycoplasma. Um teste de Coombs direto positivo também pode ser visto em alguns tipos de câncer e como uma reação alérgica a alguns medicamentos (por exemplo, penicilina).
Os anticorpos ligados aos glóbulos vermelhos nessas condições são, na maioria das vezes, IgG e, devido à orientação dos sítios de ligação ao antígeno na IgG e ao tamanho comparativamente grande de um glóbulo vermelho, é improvável que ocorra qualquer aglutinação visível. No entanto, a presença de IgG ligada aos glóbulos vermelhos pode ser detectada pela adição do reagente de Coombs, um antissoro contendo anticorpos IgG anti-humanos (que podem ser combinados com anticomplemento) (Figura\(\PageIndex{4}\)). O reagente de Coombs liga o IgG ligado aos glóbulos vermelhos vizinhos e, portanto, promove a aglutinação.
Há também um teste indireto de Coombs conhecido como teste indireto de antiglobulina (IAT). Isso rastreia um indivíduo em busca de anticorpos contra antígenos de glóbulos vermelhos (além dos antígenos A e B) que não estão ligados no soro do paciente (Figura\(\PageIndex{4}\)). O IAT pode ser usado para rastrear mulheres grávidas em busca de anticorpos que podem causar doença hemolítica do recém-nascido. Também pode ser usado antes de administrar transfusões de sangue. Mais detalhes sobre como o IAT é realizado são discutidos abaixo.
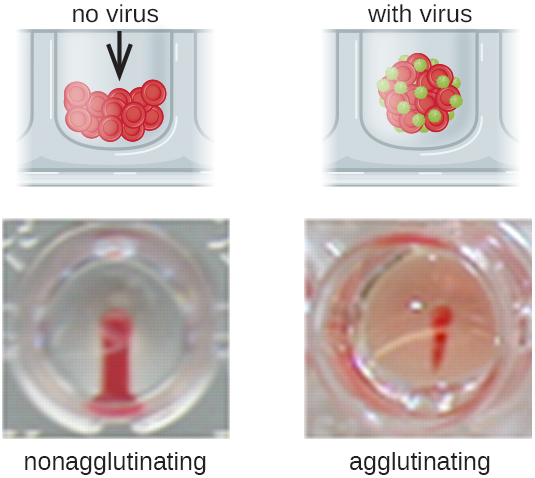
Os anticorpos que se ligam aos glóbulos vermelhos não são a única causa da hemaglutinação. Alguns vírus também se ligam aos glóbulos vermelhos, e essa ligação pode causar aglutinação quando os vírus se ligam aos glóbulos vermelhos. Por exemplo, os vírus da gripe têm dois tipos diferentes de picos virais chamados neuraminidase (N) e hemaglutinina (H), esta última denominada por sua capacidade de aglutinar os glóbulos vermelhos (ver Vírus). Assim, podemos usar glóbulos vermelhos para detectar a presença do vírus influenza por meio de ensaios de hemaglutinação direta (HA), nos quais o vírus causa aglutinação visível dos glóbulos vermelhos. Os vírus da caxumba e da rubéola também podem ser detectados usando o HA.
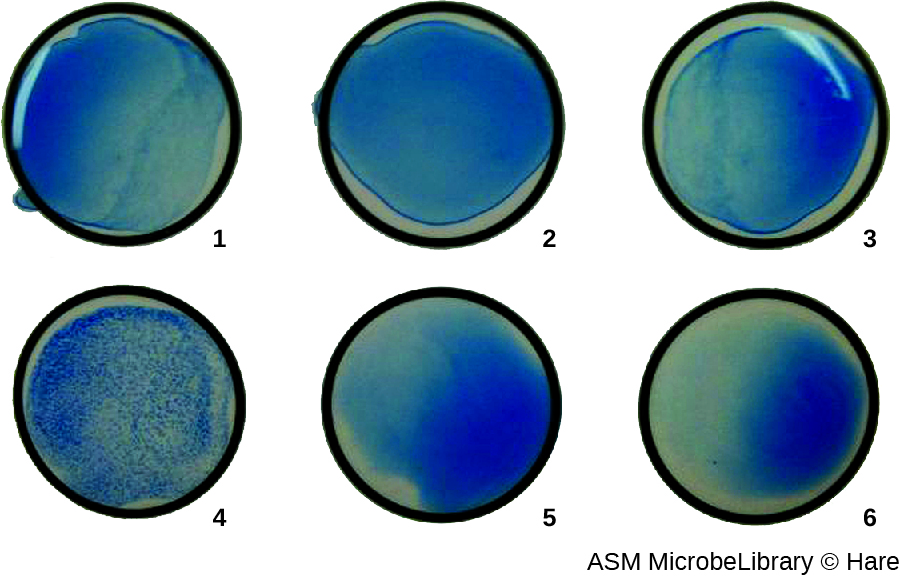
Mais frequentemente, um ensaio de aglutinação viral de diluição em série é usado para medir o título ou estimar a quantidade de vírus produzida na cultura celular ou para a produção de vacinas. Um título viral pode ser determinado usando um HA direto, fazendo uma diluição em série da amostra que contém o vírus, começando com uma alta concentração da amostra que é então diluída em uma série de poços. A maior diluição que produz aglutinação visível é o título. O ensaio é realizado em uma placa de microtitulação com poços de fundo em V ou redondo. Na presença de vírus aglutinantes, os glóbulos vermelhos e o vírus se agrupam e produzem uma camada difusa sobre o fundo do poço. Na ausência de vírus, os glóbulos vermelhos rolam ou sedimentos para o fundo do poço e formam um pellet denso, razão pela qual os poços de fundo plano não podem ser usados (Figura\(\PageIndex{5}\)).
Uma modificação do ensaio de HA pode ser usada para determinar o título de anticorpos antivirais. A presença desses anticorpos no soro de um paciente ou em um antissoro produzido em laboratório neutralizará o vírus e impedirá que ele aglutine os glóbulos vermelhos, tornando-o um ensaio de inibição da hemaglutinação viral (HIA). Neste ensaio, o soro do paciente é misturado com uma quantidade padronizada de vírus. Após uma breve incubação, uma quantidade padronizada de glóbulos vermelhos é adicionada e a hemaglutinação é observada. O título do soro do paciente é a maior diluição que bloqueia a aglutinação (Figura\(\PageIndex{6}\)).

Exercício\(\PageIndex{2}\)
- Qual é o mecanismo pelo qual os vírus são detectados em um ensaio de hemaglutinação?
- Qual resultado da hemaglutinação nos diz o título do vírus em uma amostra?
Animais no laboratório
Muito do que sabemos hoje sobre o sistema imunológico humano foi aprendido por meio de pesquisas conduzidas usando animais — principalmente mamíferos — como modelos. Além da pesquisa, os mamíferos também são usados para a produção da maioria dos anticorpos e outros componentes do sistema imunológico necessários para o imunodiagnóstico. Vacinas, diagnósticos, terapias e medicina translacional em geral foram desenvolvidos por meio de pesquisas com modelos animais.
Considere alguns dos usos comuns de animais de laboratório para produzir componentes do sistema imunológico. As cobaias são usadas como fonte de complemento, e os camundongos são a principal fonte de células para a produção de mAbs. Esses mABs podem ser usados em pesquisas e para fins terapêuticos. Os antissoros são criados em uma variedade de espécies, incluindo cavalos, ovelhas, cabras e coelhos. Ao produzir um antissoro, o animal geralmente é injetado pelo menos duas vezes, e adjuvantes podem ser usados para aumentar a resposta do anticorpo. Os animais maiores usados para fazer antissoros terão sangue coletado repetidamente por longos períodos de tempo, com poucos danos aos animais, mas isso geralmente não é o caso dos coelhos. Embora possamos obter alguns mililitros de sangue das veias das orelhas dos coelhos, geralmente precisamos de volumes maiores, o que resulta na morte dos animais.
Também usamos animais para o estudo de doenças. A única maneira de cultivar Treponema pallidum para o estudo da sífilis é em animais vivos. Muitos vírus podem ser cultivados em culturas celulares, mas o crescimento na cultura celular nos diz muito pouco sobre como o sistema imunológico responderá ao vírus. Quando trabalhamos em uma doença recém-descoberta, ainda empregamos os postulados de Koch, que exigem causar doenças em animais de laboratório usando patógenos da cultura pura como uma etapa crucial para provar que um determinado microrganismo é a causa de uma doença. Estudar a proliferação de bactérias e vírus em hospedeiros animais e como o sistema imunológico do hospedeiro responde tem sido fundamental para a pesquisa microbiológica há mais de 100 anos.
Embora a prática de usar animais de laboratório seja essencial para pesquisas científicas e diagnósticos médicos, muitas pessoas se opõem fortemente à exploração de animais para benefício humano. Esse argumento ético não é novo — na verdade, uma das filhas de Charles Darwin era uma antivivisseccionista ativa (vivissecção é a prática de cortar ou dissecar um animal vivo para estudá-lo). A maioria dos cientistas reconhece que deve haver limites sobre até que ponto os animais podem ser explorados para fins de pesquisa. Considerações éticas levaram os Institutos Nacionais de Saúde (NIH) a desenvolver regulamentações rígidas sobre os tipos de pesquisa que podem ser realizadas. Esses regulamentos também incluem diretrizes para o tratamento humano de animais de laboratório, estabelecendo padrões para seu alojamento, cuidado e eutanásia. O documento do NIH “Guia para o cuidado e uso de animais de laboratório” deixa claro que o uso de animais em pesquisas é um privilégio concedido pela sociedade aos pesquisadores.
As diretrizes do NIH são baseadas no princípio dos três R's: substituir, refinar e reduzir. Os pesquisadores devem se esforçar para substituir modelos animais por modelos não vivos, substituir vertebrados por invertebrados sempre que possível ou usar modelos de computador quando aplicável. Eles devem refinar os procedimentos de criação e experimentais para reduzir a dor e o sofrimento, e usar projetos e procedimentos experimentais que reduzam o número de animais necessários para obter as informações desejadas. Para obter financiamento, os pesquisadores devem assegurar aos revisores do NIH que a pesquisa justifica o uso de animais e que seu uso está de acordo com as diretrizes.
No nível local, qualquer instalação que use animais e receba financiamento federal deve ter um Comitê Institucional de Uso e Cuidado de Animais (IACUC) que garanta que as diretrizes do NIH estejam sendo seguidas. O IACUC deve incluir pesquisadores, administradores, um veterinário e pelo menos uma pessoa sem vínculo com a instituição, ou seja, um cidadão preocupado. Esse comitê também realiza inspeções de laboratórios e protocolos. Para pesquisas envolvendo seres humanos, um Conselho de Revisão Institucional (IRB) garante que as diretrizes adequadas sejam seguidas.
Visite este site para ver o Guia do NIH para o cuidado e uso de animais de laboratório.
Tipagem sanguínea e correspondência cruzada
Além dos anticorpos contra bactérias e vírus aos quais foram expostos anteriormente, a maioria dos indivíduos também carrega anticorpos contra outros tipos de sangue que não os seus. Atualmente, existem 33 sistemas de tipo sanguíneo imunologicamente importantes, muitos dos quais estão restritos a vários grupos étnicos ou raramente resultam na produção de anticorpos. Os mais importantes e talvez mais conhecidos são os grupos sanguíneos ABO e Rh (veja a Figura 19.1.3).
Quando unidades de sangue estão sendo consideradas para transfusão, o exame de sangue pré-transfusional deve ser realizado. Para a unidade de sangue, anticorpos preparados comercialmente contra os antígenos A, B e Rh são misturados com os glóbulos vermelhos das unidades para confirmar inicialmente que o tipo sanguíneo na unidade é preciso. Depois que uma unidade de sangue é solicitada para transfusão, é de vital importância garantir que o doador (unidade de sangue) e o receptor (paciente) sejam compatíveis com esses antígenos cruciais. Além de confirmar o tipo sanguíneo da unidade, o tipo sanguíneo do paciente também é confirmado usando os mesmos anticorpos preparados comercialmente para A, B e Rh. Por exemplo, conforme mostrado na Figura\(\PageIndex{7}\), se o sangue do doador for A-positivo, ele se aglutinará com o antissoro anti-A e com o antissoro anti-RH. Se nenhuma aglutinação for observada com nenhum dos soros, o tipo sanguíneo seria O negativo.
Após a determinação do tipo sanguíneo, imediatamente antes da liberação do sangue para transfusão, é realizada uma combinação cruzada na qual uma pequena alíquota dos glóbulos vermelhos do doador é misturada com o soro do paciente aguardando a transfusão. Se o paciente tiver anticorpos contra os glóbulos vermelhos do doador, ocorrerá hemaglutinação. Para confirmar qualquer resultado negativo do teste e verificar se há glóbulos vermelhos sensibilizados, o reagente de Coombs pode ser adicionado à mistura para facilitar a visualização da interação entre o anticorpo e os glóbulos vermelhos.
Em algumas circunstâncias, uma pequena partida cruzada também pode ser realizada. Neste ensaio, uma pequena alíquota do soro do doador é misturada com os glóbulos vermelhos do paciente. Isso permite a detecção de anticorpos aglutinizantes no soro do doador. Esse teste raramente é necessário porque as transfusões geralmente usam concentrados de glóbulos vermelhos com a maior parte do plasma removido por centrifugação.
Os glóbulos vermelhos têm muitos outros antígenos além de ABO e Rh. Embora seja improvável que a maioria das pessoas tenha anticorpos contra esses antígenos, mulheres que tiveram gestações múltiplas ou pacientes que receberam várias transfusões podem tê-los devido à exposição repetida. Por esse motivo, um teste de triagem de anticorpos é usado para determinar se esses anticorpos estão presentes. O soro do paciente é comparado com glóbulos vermelhos do tipo O preparados comercialmente, agrupados, que expressam esses antígenos. Se ocorrer aglutinação, o antígeno ao qual o paciente está respondendo deve ser identificado e determinado como não presente na unidade doadora.

Exercício\(\PageIndex{3}\)
- Se o sangue de um paciente se aglutina com soro anti-B, qual é o tipo sanguíneo do paciente?
- O que é um ensaio de correspondência cruzada e por que ele é realizado?
A tabela\(\PageIndex{1}\) resume os vários tipos de ensaios de aglutinação discutidos nesta seção.
| Tipo de ensaio | Mecanismo | Exemplo |
|---|---|---|
| Aglutinação | Direto: O anticorpo é usado para agrupar células bacterianas ou outras estruturas grandes | Bactérias serotipadoras |
| Indireto: as esferas de látex são acopladas ao antígeno ou anticorpo para procurar anticorpo ou antígeno, respectivamente, no soro do paciente | Confirmando a presença do fator reumatoide (Ig de ligação a IgM) no soro do paciente | |
| Hemaglutinação | Direto: algumas bactérias e vírus reticulam os glóbulos vermelhos e os agrupam | Diagnóstico da gripe, caxumba e sarampo |
| Teste direto de Coombs (DAT): detecta anticorpos não aglutinantes ou proteínas do complemento nos glóbulos vermelhos in vivo | Verificação da ligação de anticorpos maternos aos glóbulos vermelhos neonatais | |
| Teste indireto de Coombs (IAT): examina um indivíduo em busca de anticorpos contra antígenos de glóbulos vermelhos (além dos antígenos A e B) que não estão ligados no soro de um paciente in vitro | Realizando exames de sangue pré-transfusionais | |
| Inibição da hemaglutinação viral: usa anticorpos de um paciente para inibir a aglutinação viral | Diagnosticar várias doenças virais pela presença de anticorpos do paciente contra o vírus | |
| Tipagem sanguínea e correspondência cruzada: detecta ABO, Rh e antígenos menores no sangue | Combina o sangue do doador com as necessidades imunológicas |
Conceitos principais e resumo
- Os anticorpos podem aglutinar células ou partículas grandes em uma matriz visível. Os testes de aglutinação geralmente são feitos em cartões ou em placas de microtitulação que permitem que várias reações ocorram lado a lado usando pequenos volumes de reagentes.
- O uso de antissoros contra certas proteínas permite a identificação de sorovares dentro de espécies de bactérias.
- Detectar anticorpos contra um patógeno pode ser uma ferramenta poderosa para diagnosticar doenças, mas há um período de tempo até que os pacientes passem pela soroconversão e o nível de anticorpos se torne detectável.
- A aglutinação de esferas de látex em ensaios de aglutinação indireta pode ser usada para detectar a presença de antígenos específicos ou anticorpos específicos no soro do paciente.
- A presença de alguns anticorpos antibacterianos e antivirais pode ser confirmada pelo uso do teste direto de Coombs, que usa o reagente de Coombs para reticular anticorpos ligados aos glóbulos vermelhos e facilitar a hemaglutinação.
- Alguns vírus e bactérias se ligam e aglutinam os glóbulos vermelhos; essa interação é a base do ensaio de hemaglutinação direta, mais frequentemente usado para determinar o título do vírus em solução.
- Os ensaios de neutralização quantificam o nível de anticorpo específico do vírus medindo a diminuição da hemaglutinação observada após a mistura do soro do paciente com uma quantidade padronizada de vírus.
- Os ensaios de hemaglutinação também são usados para rastrear e comparar o sangue do doador e do receptor para garantir que o receptor da transfusão não tenha anticorpos contra antígenos no sangue doado.
Notas de pé
- 1 Lancefield, Rebecca C., “O complexo antigênico do Streptococcus haemoliticus. I. Demonstração de uma substância específica de tipo em extratos de Streptococcus haemolyticus”, The Journal of Experimental Medicine 47, nº 1 (1928): 91-103.


