20.2: Detecção de complexos antígeno-anticorpo in vitro
- Page ID
- 181597
Objetivos de
- Descreva vários tipos de ensaios usados para encontrar complexos antígeno-anticorpo
- Descreva as circunstâncias em que os complexos antígeno-anticorpo precipitam da solução
- Explicar como os anticorpos no soro do paciente podem ser usados para diagnosticar doenças
Os testes laboratoriais para detectar anticorpos e antígenos fora do corpo (por exemplo, em um tubo de ensaio) são chamados de ensaios in vitro. Quando os anticorpos e seus antígenos correspondentes estão presentes em uma solução, muitas vezes podemos observar uma reação de precipitação na qual grandes complexos (redes) se formam e se depositam na solução. Nas próximas seções, discutiremos vários ensaios in vitro comuns.
Reações de precipitação
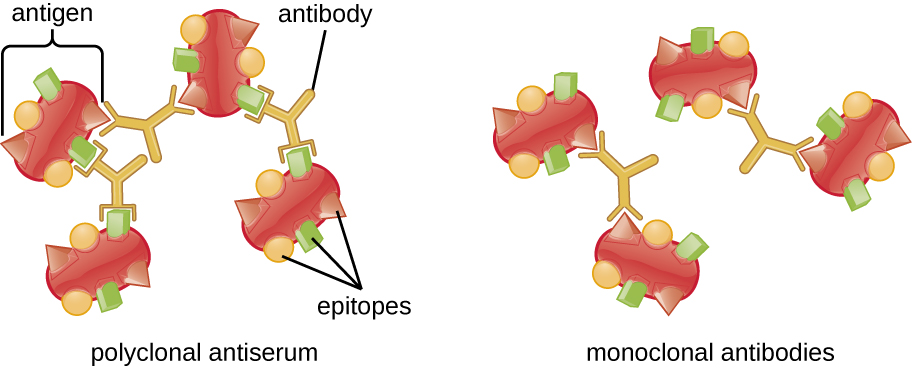
Um complexo antígeno-anticorpo visível é chamado de precipitina, e os ensaios in vitro que produzem uma precipitina são chamados de reações de precipitina. Uma reação de precipitina normalmente envolve a adição de antígenos solúveis a um tubo de ensaio contendo uma solução de anticorpos. Cada anticorpo tem dois braços, cada um dos quais pode se ligar a um epítopo. Quando um anticorpo se liga a dois antígenos, os dois antígenos se unem pelo anticorpo. Uma rede pode se formar à medida que os anticorpos se ligam mais e mais antígenos, resultando em uma precipitina (Figura\(\PageIndex{1}\)). A maioria dos testes de precipitina usa um antissoro policlonal em vez de anticorpos monoclonais porque os anticorpos policlonais podem se ligar a vários epítopos, tornando mais provável a formação de redes. Embora os mAbs possam se ligar a alguns antígenos, a ligação ocorrerá com menos frequência, tornando muito menos provável a formação de uma precipitina visível.
A quantidade de precipitação também depende de vários outros fatores. Por exemplo, a precipitação aumenta quando os anticorpos têm uma alta afinidade pelo antígeno. Enquanto a maioria dos anticorpos se liga ao antígeno com alta afinidade, mesmo a ligação de alta afinidade usa ligações não covalentes relativamente fracas, de modo que as interações individuais geralmente se quebram e novas interações ocorrem.
Além disso, para que a formação de precipitina seja visível, deve haver uma proporção ideal de anticorpo para antígeno. Não é provável que a proporção ideal seja uma relação antígeno-anticorpo de 1:1; ela pode variar dramaticamente, dependendo do número de epítopos no antígeno e da classe do anticorpo. Alguns antígenos podem ter apenas um ou dois epítopos reconhecidos pelo antissoro, enquanto outros antígenos podem ter muitos epítopos diferentes e/ou várias instâncias do mesmo epítopo em uma única molécula de antígeno.
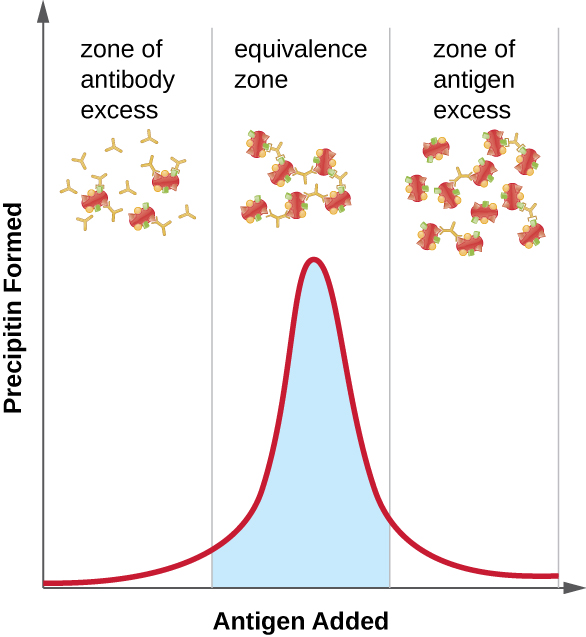
A figura\(\PageIndex{2}\) ilustra como a proporção de antígeno e anticorpo afeta a quantidade de precipitação. Para atingir a proporção ideal, o antígeno é adicionado lentamente a uma solução contendo anticorpos e a quantidade de precipitina é determinada qualitativamente. Inicialmente, não há antígeno suficiente para produzir a formação de rede visível; isso é chamado de zona de excesso de anticorpos. À medida que mais antígeno é adicionado, a reação entra na zona de equivalência (ou zona de equivalência), onde ocorre a interação ideal antígeno-anticorpo e a precipitação máxima. Se ainda mais antígeno fosse adicionado, a quantidade de antígeno se tornaria excessiva e, na verdade, faria com que a quantidade de precipitação diminuísse.
Exercício\(\PageIndex{1}\)
- O que é uma precipitina?
- Por que os antissoros policlonais produzem uma melhor reação à precipitação?
Teste de anel de precipitação
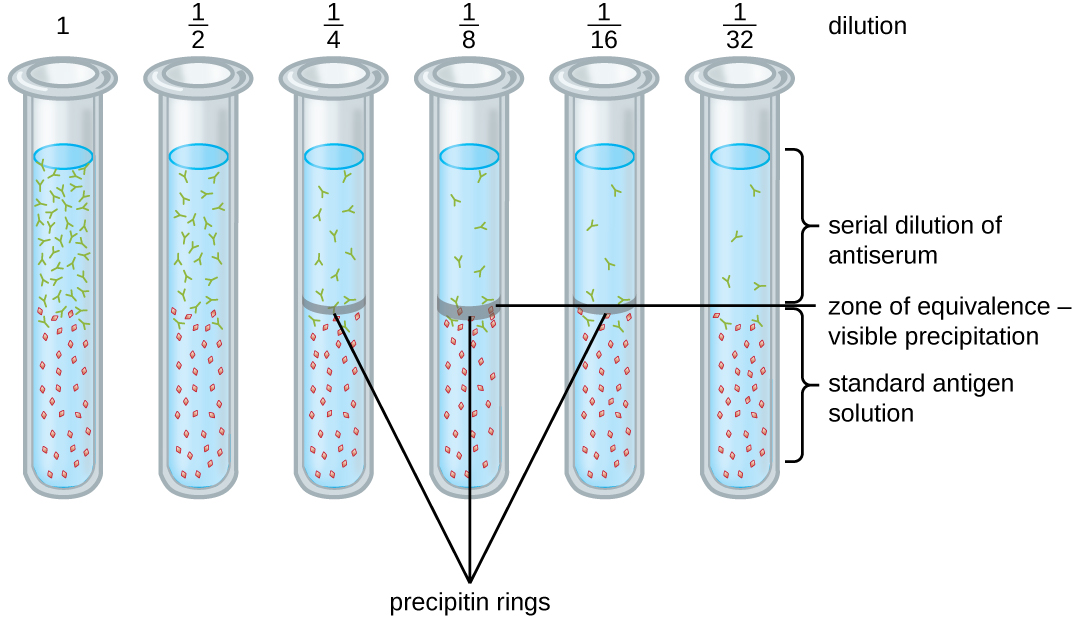
Uma variedade de técnicas nos permite usar a formação de precipitina para quantificar a concentração de antígeno ou a quantidade de anticorpo presente em um antissoro. Uma dessas técnicas é o teste do anel de precipitina (Figura\(\PageIndex{3}\)), que é usado para determinar a quantidade relativa de anticorpo específico do antígeno em uma amostra de soro. Para realizar esse teste, um conjunto de tubos de ensaio é preparado adicionando uma solução de antígeno na parte inferior de cada tubo. Cada tubo recebe o mesmo volume de solução e a concentração de antígenos é constante (por exemplo, 1 mg/mL). Em seguida, adiciona-se glicerol à solução de antígeno em cada tubo de ensaio, seguido por uma diluição em série do antissoro. O glicerol impede a mistura do antissoro com a solução de antígeno, permitindo que a ligação antígeno-anticorpo ocorra somente na interface das duas soluções. O resultado é um anel visível de precipitina nos tubos que têm uma relação antígeno-anticorpo dentro da zona de equivalência. Essa maior diluição com um anel visível é usada para determinar o título dos anticorpos. O título é o recíproco da maior diluição que mostra um resultado positivo, expresso como um número inteiro. Na Figura\(\PageIndex{3}\), o título é 16.
Embora a medição do título não nos diga em termos absolutos a quantidade de anticorpo presente, ela fornece uma medida da atividade biológica, que geralmente é mais importante do que a quantidade absoluta. Neste exemplo, não seria útil saber qual massa de IgG estava presente no antissoro, porque existem muitas especificidades diferentes de anticorpos presentes; mas é importante sabermos quanto da atividade de anticorpos no soro de um paciente é direcionada contra o antígeno de interesse (por exemplo, um patógeno ou alérgeno específico).
Ensaio de Ouchterlony
Embora o teste do anel de precipitina forneça informações sobre as interações anticorpo-antígeno, ele também tem algumas desvantagens. Requer o uso de grandes quantidades de soro e deve-se tomar muito cuidado para evitar misturar as soluções e romper o anel. A realização de um teste semelhante em uma matriz de gel de ágar pode minimizar esses problemas. Esse tipo de ensaio é chamado de imunodifusão dupla ou ensaio de Ouchterlony para Orjan Ouchterlony, 1 que descreveu a técnica pela primeira vez em 1948.
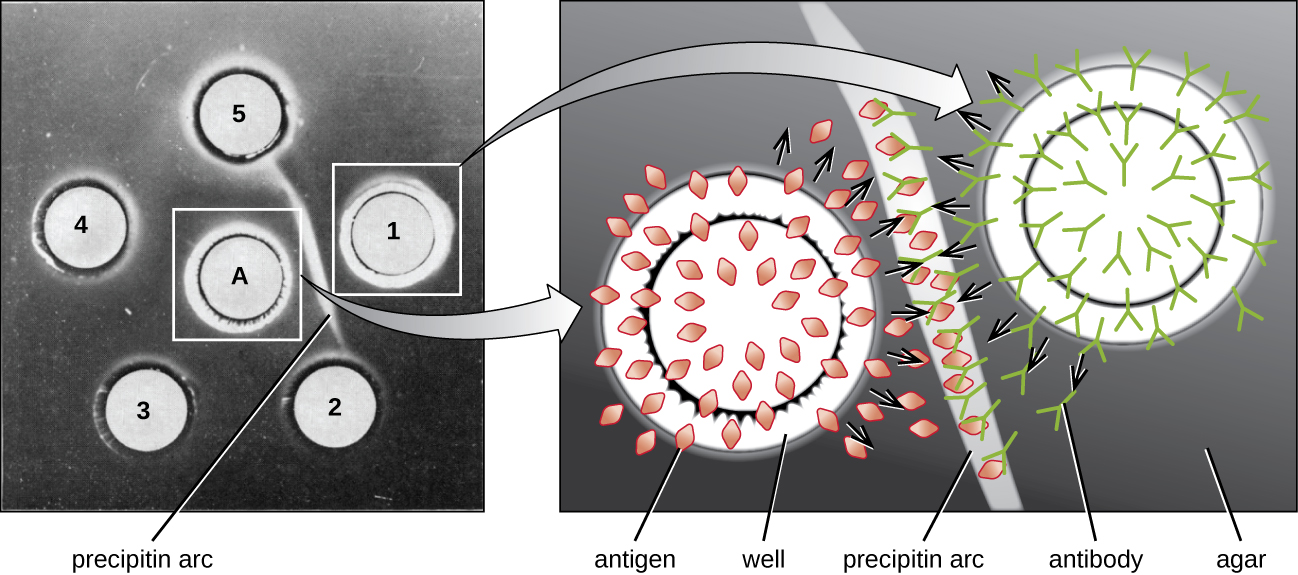
Quando o ágar é altamente purificado, ele produz um gel transparente e incolor. Furos são feitos no gel para formar poços, e antígenos e antissoros são adicionados aos poços vizinhos. As proteínas são capazes de se difundir através do gel e os arcos de precipitina se formam entre os poços na zona de equivalência. Como a rede de precipitina é muito grande para se difundir pelo gel, os arcos estão firmemente presos no lugar e são fáceis de ver (Figura\(\PageIndex{4}\)).
Embora agora existam métodos mais sensíveis e quantitativos de detecção de interações anticorpo-antígeno, o teste de Ouchterlony fornece uma maneira rápida e qualitativa de determinar se um antisoro tem anticorpos contra um antígeno específico. O teste de Ouchterlony é particularmente útil quando se busca reatividade cruzada. Podemos comparar um antissoro com um grupo de antígenos intimamente relacionados e ver quais combinações formam arcos de precipitina.
Ensaio de imunodifusão radial
O ensaio de imunodifusão radial (RID) é semelhante ao ensaio de Ouchterlony, mas é usado para quantificar com precisão a concentração de antígenos em vez de comparar diferentes antígenos. Neste ensaio, o antissoro é adicionado ao ágar temperado (ágar líquido ligeiramente acima de 45 °C), que é despejado em uma pequena placa de Petri ou em uma lâmina de vidro e deixado esfriar. Os poços são cortados no ágar resfriado e o antígeno é então adicionado aos poços e deixado se difundir. À medida que o antígeno e o anticorpo interagem, eles formam uma zona de precipitação. O quadrado do diâmetro da zona de precipitação é diretamente proporcional à concentração do antígeno. Medindo as zonas de precipitação produzidas por amostras de concentração conhecida (veja o anel externo das amostras na Figura\(\PageIndex{5}\)), podemos preparar uma curva padrão para determinar a concentração de uma solução desconhecida. O ensaio RID também é um teste útil para determinar a concentração de muitas proteínas séricas, como as proteínas do complemento C3 e C4, entre outras.
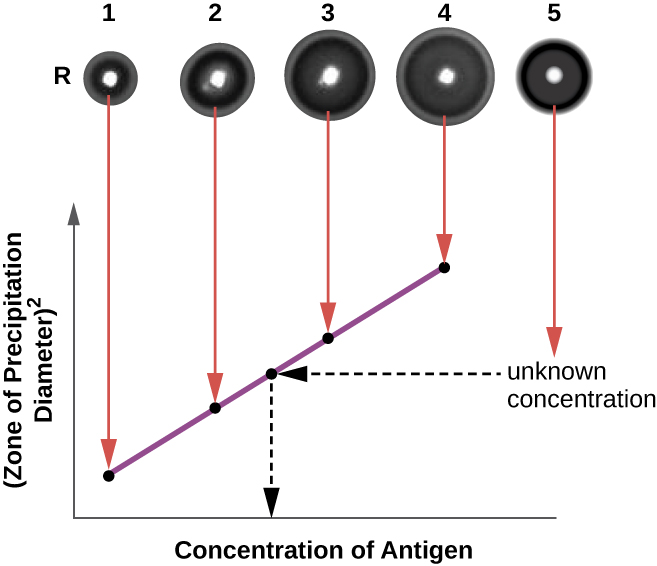
Exercício\(\PageIndex{2}\)
- Por que um anel de precipitina se forma em um teste de anel de precipitina e quais são algumas das razões pelas quais um anel pode não se formar?
- Compare e contraste as técnicas usadas em um ensaio de Ouchterlony e um ensaio de imunodifusão radial.
Ensaios de floculação
Um ensaio de floculação é semelhante a uma reação de precipitina, exceto pelo fato de envolver antígenos insolúveis, como lipídios. Um floculante é semelhante a uma precipitina, pois há uma rede visível de antígeno e anticorpo, mas como os lipídios são insolúveis em solução aquosa, eles não podem precipitar. Em vez de precipitação, a floculação (formação de espuma) é observada no fluido do tubo de ensaio.
Usando a floculação para testar a sífilis
A sífilis é uma infecção sexualmente transmissível que pode causar doenças crônicas graves em adultos. Além disso, é facilmente transmitido de mães infectadas para seus recém-nascidos durante a gravidez e o parto, muitas vezes resultando em natimorto ou sérios problemas de saúde de longo prazo para o bebê. Infelizmente, a sífilis também pode ser difícil de diagnosticar em gestantes, porque geralmente é assintomática, especialmente em mulheres. Além disso, o agente causador, a bactéria Treponema pallidum, é difícil de cultivar em meios laboratoriais convencionais e muito pequeno para ser visualizado usando microcópia de rotina. Por esses motivos, os diagnósticos presuntivos de sífilis geralmente são confirmados indiretamente em laboratório por meio de testes que detectam anticorpos contra antígenos treponêmicos.
Em 1906, o cientista alemão August von Wassermann (1866-1925) introduziu o primeiro teste para sífilis que se baseava na detecção de anticorpos antitreponêmicos no sangue do paciente. Os anticorpos detectados no teste de Wassermann foram anticorpos antifosfolipídicos não específicos para T. pallidum. Sua presença pode auxiliar no diagnóstico da sífilis, mas, por serem inespecíficos, também podem levar a resultados falso-positivos em pacientes com outras doenças e condições autoimunes. O teste original de Wasserman foi modificado ao longo dos anos para minimizar os falsos positivos e agora é conhecido como o teste do Venereal Disease Research Lab, mais conhecido por sua sigla, o teste VDRL.
Para realizar o teste VDRL, o soro do paciente ou o fluido espinhal cerebral são colocados em uma lâmina com uma mistura de cardiolipina (um fosfolipídio antigênico encontrado na membrana mitocondrial de vários patógenos), lecitina e colesterol. A lecitina e o colesterol estabilizam a reação e diminuem os falsos positivos. Os anticorpos antitreponêmicos do soro de um paciente infectado se ligarão à cardiolipina e formarão um floculante. Embora o teste VDRL seja mais específico do que o ensaio original de Wassermann, falsos positivos ainda podem ocorrer em pacientes com doenças autoimunes que causam danos celulares extensos (por exemplo, lúpus eritematoso sistêmico).
Ensaio de neutralização
Para causar infecção, os vírus devem se ligar aos receptores nas células hospedeiras. Os anticorpos antivirais podem neutralizar infecções virais revestindo os viriões, bloqueando a ligação (Figura 18.1.6). Essa atividade neutraliza os viriões e pode resultar na formação de grandes complexos anticorpo-vírus (que são facilmente removidos por fagocitose) ou pela ligação de anticorpos ao vírus e bloqueando sua ligação aos receptores da célula hospedeira. Essa atividade de neutralização é a base dos ensaios de neutralização, ensaios sensíveis usados para diagnósticos de infecções virais.
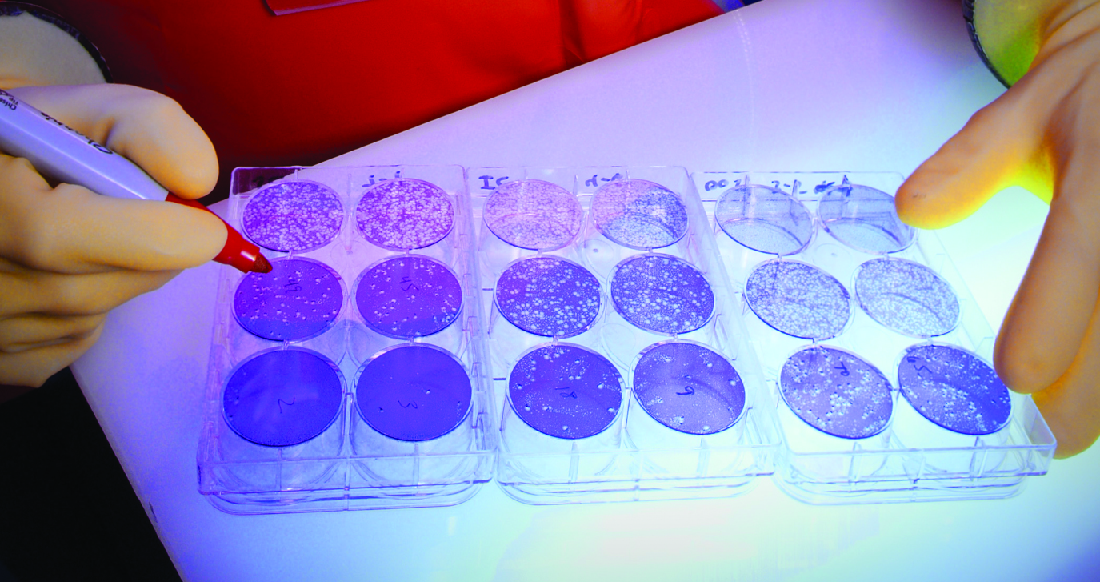
Quando os vírus infectam as células, eles geralmente causam danos (efeitos citopáticos) que podem incluir a lise das células hospedeiras. Os efeitos citopáticos podem ser visualizados cultivando células hospedeiras em uma placa de Petri, cobrindo as células com uma fina camada de ágar e, em seguida, adicionando vírus (consulte Isolamento, cultura e identificação de vírus). O vírus se difundirá muito lentamente pelo ágar. Um vírus entrará em uma célula hospedeira, proliferará (causando danos celulares), será liberado da célula hospedeira morta e depois se moverá para as células vizinhas. À medida que mais e mais células morrem, placas de células mortas se formarão (Figura\(\PageIndex{6}\)).
Durante o curso de uma infecção viral, o paciente apresentará uma resposta de anticorpos ao vírus, e podemos quantificar esses anticorpos usando um ensaio de redução de placa. Para realizar o ensaio, uma diluição em série é realizada em uma amostra de soro. Cada diluição é então misturada com uma quantidade padronizada do vírus suspeito. Qualquer anticorpo específico do vírus no soro neutralizará parte do vírus. As suspensões são então adicionadas às células hospedeiras em cultura para permitir que qualquer vírus não neutralizado infecte as células e forme placas após vários dias. O título é definido como o recíproco da maior diluição, mostrando uma redução de 50% nas placas. O título é sempre expresso como um número inteiro. Por exemplo, se uma diluição de 1/64 foi a maior diluição a mostrar 50% de redução da placa, o título é 64.
A presença de anticorpos no soro do paciente não nos diz se o paciente está infectado no momento ou se foi infectado no passado. As infecções atuais podem ser identificadas aguardando duas semanas e testando outra amostra de soro. Um aumento de quatro vezes no título de neutralização nesta segunda amostra indica uma nova infecção.
Exercício\(\PageIndex{3}\)
Em um ensaio de neutralização, se o soro de um paciente tiver um alto número de anticorpos antivirais, você esperaria ver mais ou menos placas?
Imunoeletroforese
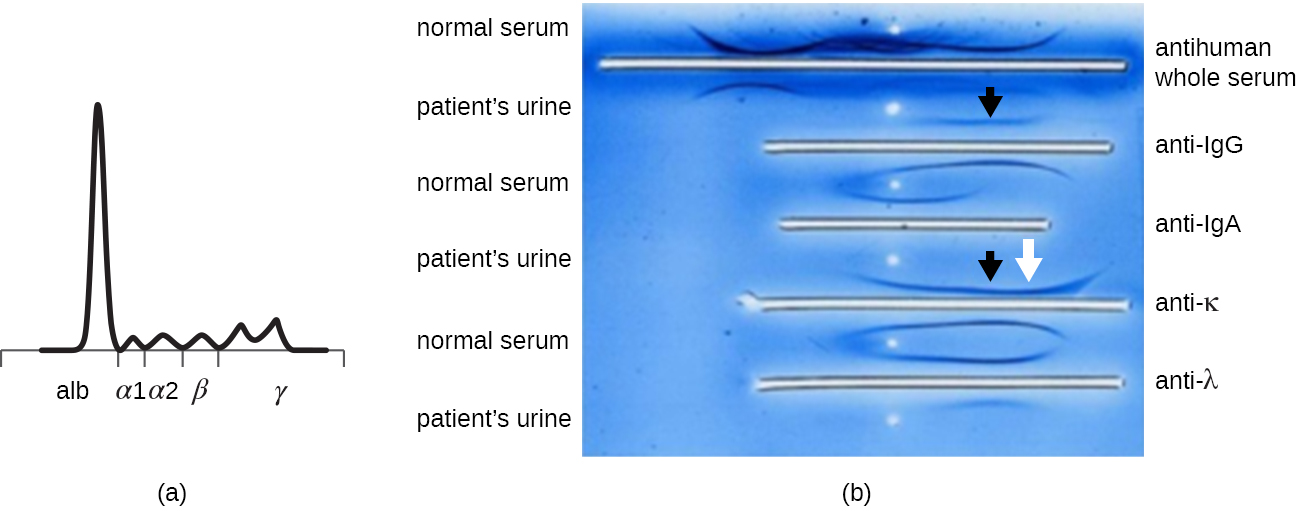
Quando um paciente tem níveis elevados de proteína no sangue ou está perdendo proteína na urina, um médico geralmente solicita um ensaio de eletroforese em gel de poliacrilamida (PAGE) (consulte Visualização e caracterização de DNA, RNA e proteína). Este ensaio compara a abundância relativa dos vários tipos de proteínas séricas. Padrões anormais de eletroforese de proteínas podem ser mais estudados usando imunoeletroforese (IEP). O IEP começa executando uma PÁGINA. Antissoros contra proteínas séricas selecionadas são adicionados a calhas paralelas à trilha de eletroforese, formando arcos de precipitina semelhantes aos observados em um ensaio de Ouchterlony (Figura\(\PageIndex{7}\)). Isso permite a identificação de proteínas anormais de imunoglobulina na amostra.
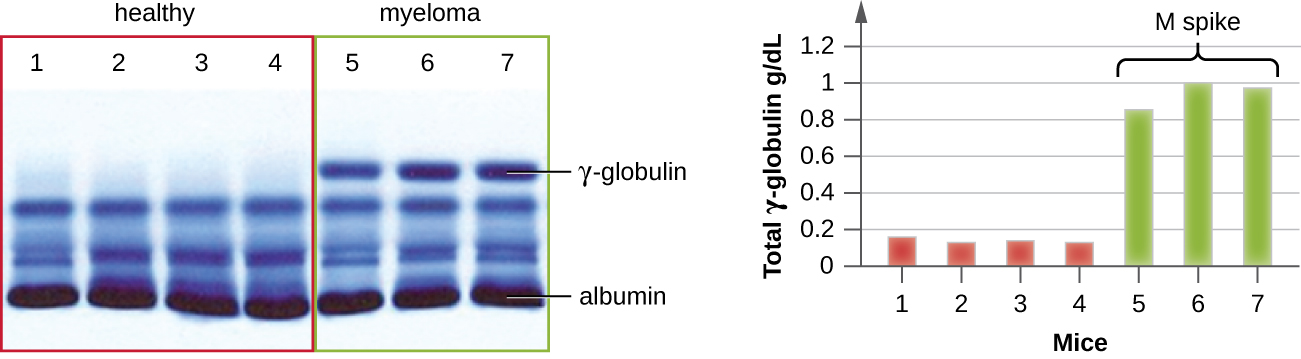
O IEP é particularmente útil no diagnóstico do mieloma múltiplo, um câncer de células secretoras de anticorpos. Pacientes com mieloma múltiplo não podem produzir anticorpos saudáveis; em vez disso, produzem anticorpos anormais que são proteínas monoclonais (proteínas M). Assim, pacientes com mieloma múltiplo apresentarão níveis elevados de proteína sérica que mostram uma banda distinta na região da gamaglobulina de um gel de eletroforese de proteína e um pico acentuado (em proteína M) na varredura do densitômetro, em vez do esfregaço amplo normal (Figura\(\PageIndex{7}\)). Quando anticorpos contra os vários tipos de cadeias pesadas e leves de anticorpos são usados para formar arcos de precipitina, a proteína M causará arcos distintamente distorcidos contra uma classe de cadeia pesada e uma classe de cadeia leve, conforme visto na Figura\(\PageIndex{7}\).
Eletroforese de proteínas e caracterização da estrutura da imunoglobulina
O advento da eletroforese acabou levando à pesquisa e compreensão da estrutura dos anticorpos. Quando o bioquímico sueco Arne Tiselius (1902—1971) publicou os primeiros resultados da eletroforese de proteínas em 1937, 2 ele conseguiu identificar a proteína albumina (a menor e mais abundante proteína sérica) pela faixa nítida que ela produzia no gel. As outras proteínas séricas não puderam ser resolvidas em uma simples eletroforese de proteínas, então ele chamou as três bandas largas, com muitas proteínas em cada banda, alfa, beta e gamaglobulinas. Dois anos depois, o imunologista americano Elvin Kabat (1914-2000) viajou para a Suécia para trabalhar com Tiselius usando essa nova técnica e mostrou que os anticorpos migraram como gamaglobulinas. 3 Com esse novo entendimento em mãos, os pesquisadores logo descobriram que o mieloma múltiplo, por ser um câncer de células secretoras de anticorpos, poderia ser diagnosticado provisoriamente pela presença de um grande pico de M na região da gama-globulina por eletroforese de proteínas. Antes dessa descoberta, os estudos sobre a estrutura da imunoglobulina eram mínimos, devido à dificuldade de obter amostras puras para estudar. Os soros de pacientes com mieloma múltiplo provaram ser uma excelente fonte de imunoglobulina monoclonal altamente enriquecida, fornecendo a matéria-prima para estudos nos próximos mais de 20 anos que resultaram na elucidação da estrutura da imunoglobulina.
Exercício\(\PageIndex{4}\)
Em geral, o que um ensaio de imunoeletroforese realiza?
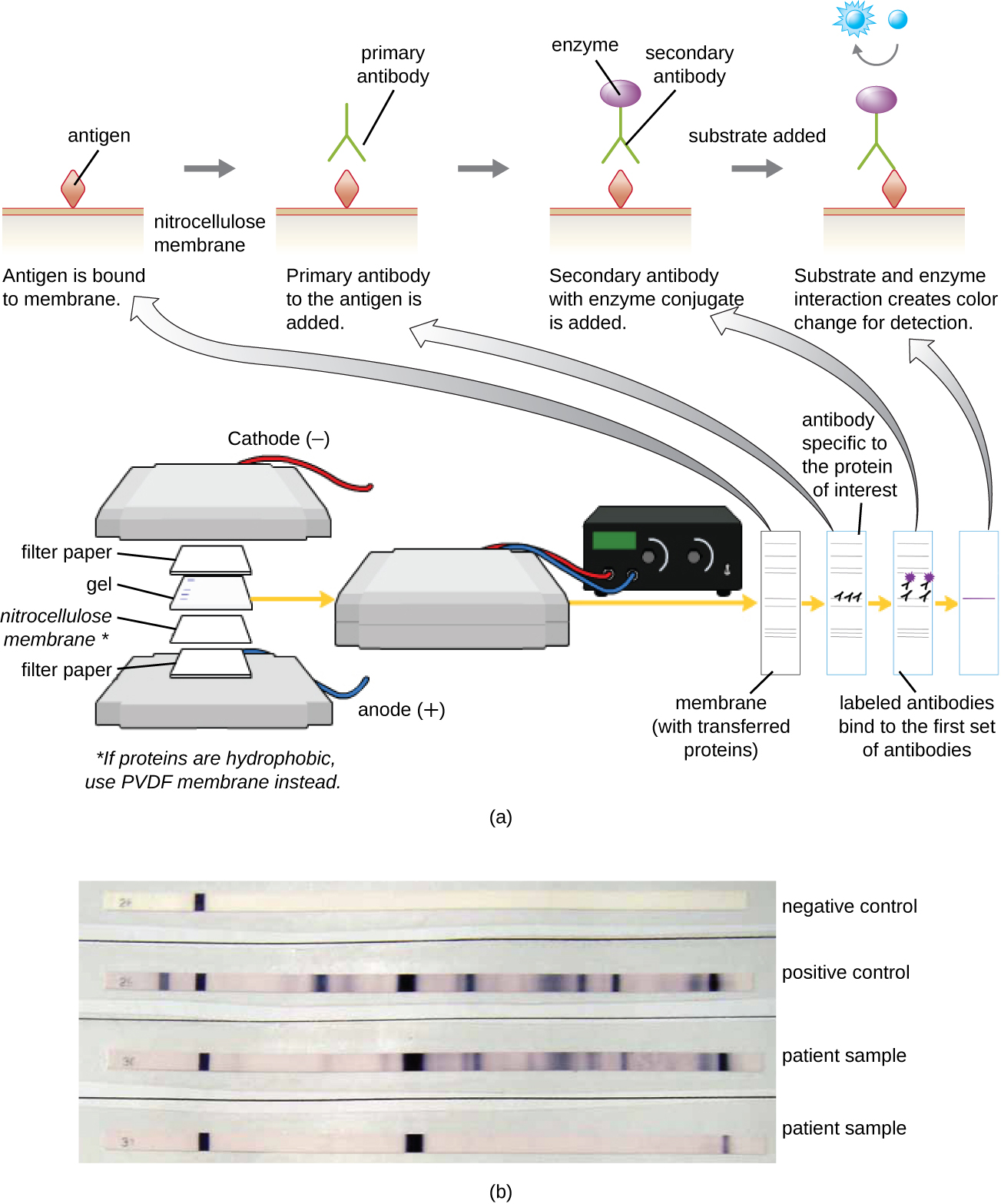
Ensaio Immunoblot: O Western Blot
Depois de realizar a eletroforese em gel protéico, proteínas específicas podem ser identificadas no gel usando anticorpos. Essa técnica é conhecida como western blot. Após a separação das proteínas por PAGE, os antígenos proteicos no gel são transferidos e imobilizados em uma membrana de nitrocelulose. Essa membrana pode então ser exposta a um anticorpo primário produzido para se ligar especificamente à proteína de interesse. Um segundo anticorpo equipado com um farol molecular se ligará então ao primeiro. Esses anticorpos secundários são acoplados a outra molécula, como uma enzima ou um fluoróforo (uma molécula que fluoresce quando excitada pela luz). Ao usar anticorpos acoplados a enzimas, um substrato cromogênico para a enzima é adicionado. Esse substrato geralmente é incolor, mas desenvolverá cor na presença do anticorpo. A fluorescência ou coloração do substrato identifica a localização da proteína específica na membrana à qual os anticorpos estão ligados (Figura\(\PageIndex{9}\)).
Normalmente, anticorpos policlonais são usados para ensaios de Western Blot. Eles são mais sensíveis do que os mAbs devido à sua capacidade de se ligarem a vários epítopos do antígeno primário, e o sinal dos anticorpos policlonais é normalmente mais forte do que o dos mAbs. Anticorpos monoclonais também podem ser usados; no entanto, eles são muito mais caros de produzir e são menos sensíveis, pois só são capazes de reconhecer um epítopo específico.
Várias variações do western blot são úteis na pesquisa. Em uma mancha do sudoeste, as proteínas são separadas por SDS-PAGE, borradas em uma membrana de nitrocelulose, deixadas renaturar e, em seguida, sondadas com uma sonda de DNA marcada com fluorescência ou radioatividade; o objetivo do sudoeste é identificar interações específicas de DNA e proteína. Manchas do extremo oeste são realizadas para determinar as interações proteína-proteína entre proteínas imobilizadas (separadas por SDS-PAGE, borradas em uma membrana de nitrocelulose e deixadas renaturar) e sondas de proteína sem anticorpos. As proteínas não anticorpos ligadas que interagem com as proteínas imobilizadas em uma mancha do extremo oeste podem ser detectadas por radiomarcação, fluorescência ou uso de um anticorpo com um farol molecular enzimático.
Exercício\(\PageIndex{5}\)
Qual é a função da enzima no ensaio de imunoblot?
Imunoensaio mediado por complemento
Uma das principais funções dos anticorpos é a ativação (fixação) do complemento. Quando o anticorpo se liga às bactérias, por exemplo, certas proteínas do complemento reconhecem o anticorpo ligado e ativam a cascata do complemento. Em resposta, outras proteínas do complemento se ligam às bactérias, onde algumas servem como opsoninas para aumentar a eficiência da fagocitose e outras criam buracos nas membranas celulares bacterianas gram-negativas, causando lise. Essa atividade lítica pode ser usada para detectar a presença de anticorpos contra antígenos específicos no soro.
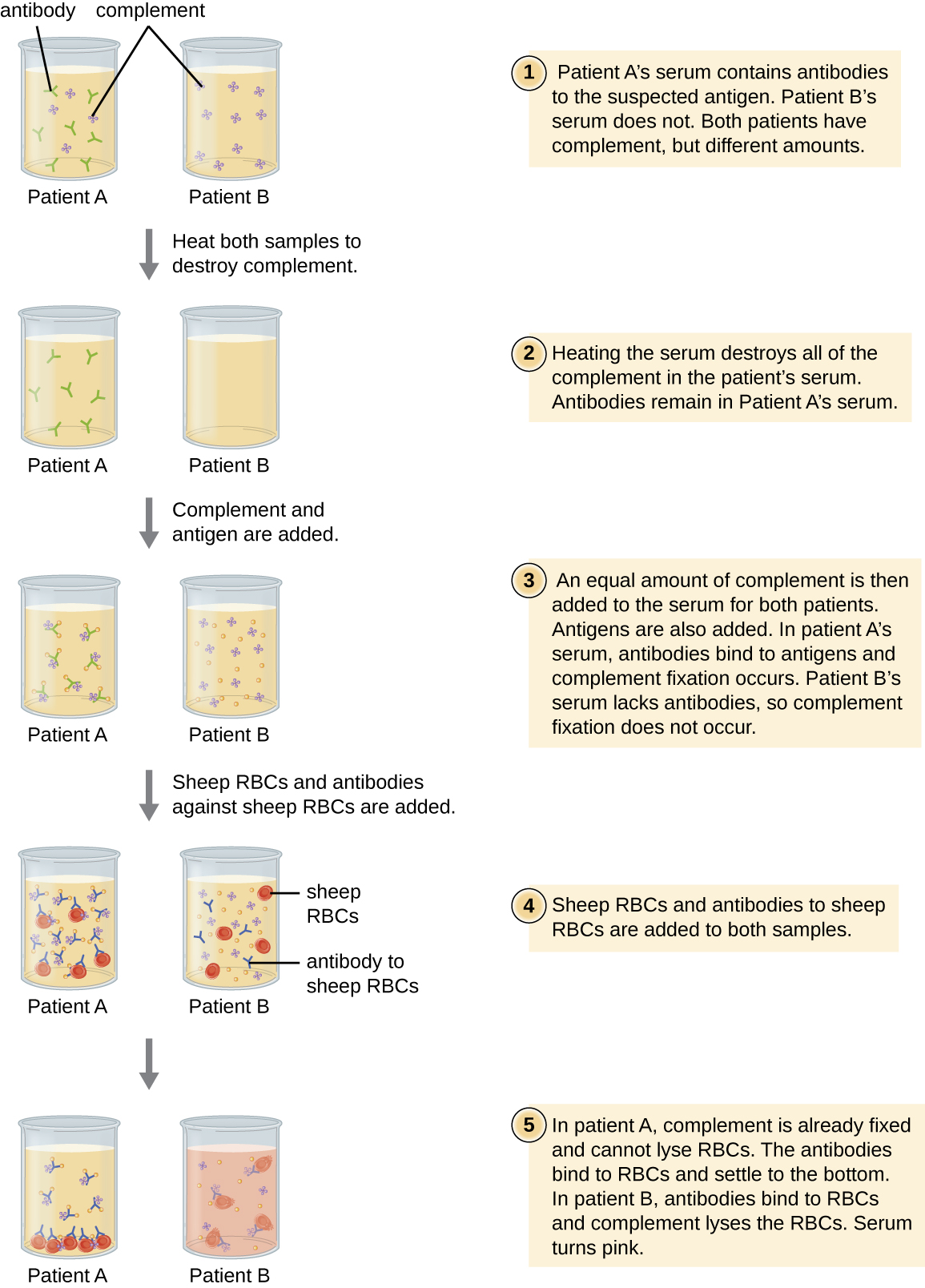
Os glóbulos vermelhos são bons indicadores a serem usados na avaliação da citólise mediada pelo complemento. A hemólise dos glóbulos vermelhos libera hemoglobina, que é um pigmento colorido, e a hemólise, mesmo de um pequeno número de glóbulos vermelhos, fará com que a solução fique visivelmente rosada (Figura\(\PageIndex{10}\)). Essa característica desempenha um papel no teste de fixação do complemento, que permite a detecção de anticorpos contra patógenos específicos. O teste de fixação do complemento pode ser usado para verificar a presença de anticorpos contra patógenos difíceis de cultivar em laboratório, como fungos, vírus ou a bactéria Chlamydia.
Para realizar o teste de fixação do complemento, o antígeno de um patógeno é adicionado ao soro do paciente. Se anticorpos contra o antígeno estiverem presentes, o anticorpo se ligará ao antígeno e fixará todo o complemento disponível. Quando os glóbulos vermelhos e os anticorpos contra os glóbulos vermelhos forem posteriormente adicionados à mistura, não haverá mais complemento para lisar os glóbulos vermelhos. Assim, se a solução permanecer clara, o teste é positivo. Se não houver anticorpos antipatógenos no soro do paciente, os anticorpos adicionados ativarão o complemento para lisar os glóbulos vermelhos, produzindo um teste negativo (Figura\(\PageIndex{10}\)).
Assista a este vídeo para ver um resumo das etapas do teste de fixação do complemento.
Exercício\(\PageIndex{6}\)
Em um teste de fixação do complemento, se o soro ficar rosado, o paciente tem anticorpos contra o antígeno ou não? Explique.
A tabela\(\PageIndex{1}\) resume os vários tipos de ensaios de anticorpo-antígeno discutidos nesta seção.
| Tipo de ensaio | Mecanismo | Exemplos |
|---|---|---|
| Precipitação | O anticorpo se liga ao antígeno solúvel, formando uma precipitina visível | Teste de anel de precipitina para visualizar a formação de rede em solução |
| Imunoeletroforese para examinar a distribuição de antígenos após eletroforese | ||
| Ensaio de ouchterlony para comparar diversos antígenos | ||
| Ensaio de imunodifusão radial para quantificar antígenos | ||
| Floculação | O anticorpo se liga a moléculas insolúveis em suspensão, formando agregados visíveis | Teste VDRL para sífilis |
| Neutralização | O anticorpo se liga ao vírus, bloqueando a entrada viral nas células-alvo e impedindo a formação de placas | Ensaio de redução de placa para detectar a presença de anticorpos neutralizantes nos soros dos pacientes |
| ativação do complemento | O anticorpo se liga ao antígeno, induzindo a ativação do complemento e não deixando complemento para lisar os glóbulos vermelhos | Teste de fixação do complemento para anticorpos de pacientes contra bactérias difíceis de cultivar, como a clamídia |
Conceitos principais e resumo
- Quando presentes na proporção correta, o anticorpo e o antígeno formarão uma precipitina, ou rede, que precipita da solução.
- Um teste de anel de precipitina pode ser usado para visualizar a formação da rede em solução. O ensaio de Ouchterlony demonstra a formação de treliça em um gel. O ensaio de imunodifusão radial é usado para quantificar o antígeno medindo o tamanho de uma zona de precipitação em um gel infundido com anticorpos.
- Antígenos insolúveis em suspensão formarão floculantes quando ligados por anticorpos. Essa é a base do teste VDRL para sífilis, no qual os anticorpos antitreponêmicos se ligam à cardiolipina em suspensão.
- As infecções virais podem ser detectadas pela quantificação de anticorpos neutralizadores de vírus no soro do paciente.
- Diferentes classes de anticorpos no plasma ou no soro são identificadas usando imunoeletroforese.
- A presença de antígenos específicos (por exemplo, proteínas bacterianas ou virais) no soro pode ser demonstrada por ensaios de western blot, nos quais as proteínas são transferidas para uma membrana de nitrocelulose e identificadas usando anticorpos marcados.
- No teste de fixação do complemento, o complemento é usado para detectar anticorpos contra vários patógenos.
Notas de pé
- 1 Ouchterlony, Örjan, “Método in vitro para testar a capacidade de produção de toxinas das bactérias da difteria”, Acta Pathologica Microbiologica Scandinavica 26, nº 4 (1949): 516-24.
- 2 Tiselius, Arne, “Eletroforese da globulina sérica: análise eletroforética de soros normais e imunes”, Biochemical Journal 31, nº 9 (1937): 1464.
- 3 Tiselius, Arne e Elvin A. Kabat. “Um estudo eletroforético de soros imunes e preparações de anticorpos purificados”, The Journal of Experimental Medicine 69, nº 1 (1939): 119-31.


