18.1: Arquitetura do Sistema Imunitário
- Page ID
- 181416
Objetivos de
- Defina memória, resposta primária, resposta secundária e especificidade
- Faça a distinção entre imunidade humoral e celular
- Diferencie antígenos, epítopos e haptenos
- Descreva a estrutura e a função dos anticorpos e faça a distinção entre as diferentes classes de anticorpos
Foco clínico: Parte 1
Olivia, uma criança de um ano de idade, é levada ao pronto-socorro por seus pais, que relatam seus sintomas: choro excessivo, irritabilidade, sensibilidade à luz, letargia incomum e vômitos. Um médico sente inchaço dos gânglios linfáticos na garganta e nas axilas de Olivia. Além disso, a área do abdômen sobre o baço está inchada e sensível.
Exercício\(\PageIndex{1}\)
- O que esses sintomas sugerem?
- Quais testes podem ser solicitados para tentar diagnosticar o problema?
A imunidade adaptativa é definida por duas características importantes: especificidade e memória. A especificidade se refere à capacidade do sistema imunológico adaptativo de atingir patógenos específicos, e a memória se refere à sua capacidade de responder rapidamente aos patógenos aos quais foi exposto anteriormente. Por exemplo, quando um indivíduo se recupera da varicela, o corpo desenvolve uma memória da infecção que o protegerá especificamente do agente causador, o vírus varicela-zoster, se for exposto ao vírus novamente mais tarde.
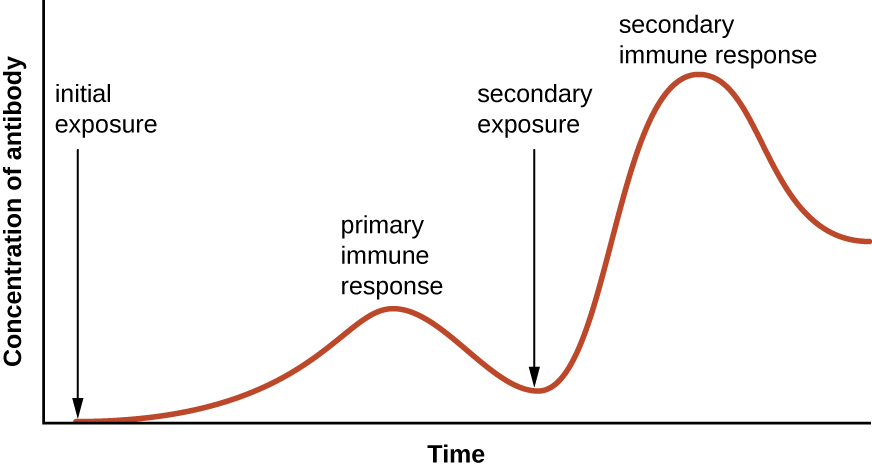
A especificidade e a memória são alcançadas programando essencialmente certas células envolvidas na resposta imune para responder rapidamente às exposições subsequentes do patógeno. Essa programação ocorre como resultado da primeira exposição a um patógeno ou vacina, que desencadeia uma resposta primária. As exposições subsequentes resultam em uma resposta secundária que é mais rápida e mais forte como resultado da memória do corpo da primeira exposição (Figura\(\PageIndex{1}\)). Essa resposta secundária, no entanto, é específica do patógeno em questão. Por exemplo, a exposição a um vírus (por exemplo, vírus varicela-zoster) não fornecerá proteção contra outras doenças virais (por exemplo, sarampo, caxumba ou poliomielite).
A imunidade específica adaptativa envolve as ações de dois tipos celulares distintos: linfócitos B (células B) e linfócitos T (células T). Embora as células B e T surjam de uma via comum de diferenciação de células-tronco hematopoiéticas, seus locais de maturação e seus papéis na imunidade adaptativa são muito diferentes.
As células B amadurecem na medula óssea e são responsáveis pela produção de glicoproteínas chamadas anticorpos ou imunoglobulinas. Os anticorpos estão envolvidos na defesa do organismo contra patógenos e toxinas no ambiente extracelular. Mecanismos de imunidade específica adaptativa que envolvem células B e produção de anticorpos são chamados de imunidade humoral. A maturação das células T ocorre no timo. As células T funcionam como orquestradoras centrais das respostas imunes inatas e adaptativas. Eles também são responsáveis pela destruição de células infectadas com patógenos intracelulares. O direcionamento e a destruição de patógenos intracelulares pelas células T são chamados de imunidade mediada por células ou imunidade celular.
Exercício\(\PageIndex{2}\)
- Liste as duas características definidoras da imunidade adaptativa.
- Explique a diferença entre uma resposta imune primária e secundária.
- Como a imunidade humoral e celular difere?
Antígenos
A ativação das defesas imunes adaptativas é desencadeada por estruturas moleculares específicas do patógeno chamadas antígenos. Os antígenos são semelhantes aos padrões moleculares associados a patógenos (PAMPs) discutidos em Reconhecimento de Patógenos e Fagocitose; no entanto, enquanto os PAMPs são estruturas moleculares encontradas em vários patógenos, os antígenos são exclusivos de um patógeno específico. Os antígenos que estimulam a imunidade adaptativa à varicela, por exemplo, são exclusivos do vírus varicela-zoster, mas significativamente diferentes dos antígenos associados a outros patógenos virais.
O termo antígeno foi usado inicialmente para descrever moléculas que estimulam a produção de anticorpos; na verdade, o termo vem de uma combinação das palavras anticorpo e gerador, e uma molécula que estimula a produção de anticorpos é considerada antigênica. No entanto, o papel dos antígenos não se limita à imunidade humoral e à produção de anticorpos; os antígenos também desempenham um papel essencial na estimulação da imunidade celular e, por esse motivo, os antígenos às vezes são chamados de imunógenos com mais precisão. Neste texto, no entanto, normalmente os chamaremos de antígenos.
Os patógenos possuem uma variedade de estruturas que podem conter antígenos. Por exemplo, antígenos de células bacterianas podem estar associados a suas cápsulas, paredes celulares, fímbrias, flagelos ou pili. Os antígenos bacterianos também podem estar associados a toxinas extracelulares e enzimas que eles secretam. Os vírus possuem uma variedade de antígenos associados a seus capsídeos, envelopes e estruturas de espigões que eles usam para se fixar nas células.
Os antígenos podem pertencer a qualquer número de classes moleculares, incluindo carboidratos, lipídios, ácidos nucléicos, proteínas e combinações dessas moléculas. Os antígenos de diferentes classes variam em sua capacidade de estimular as defesas imunológicas adaptativas, bem como no tipo de resposta que estimulam (humoral ou celular). A complexidade estrutural de uma molécula antigênica é um fator importante em seu potencial antigênico. Em geral, moléculas mais complexas são mais eficazes como antígenos. Por exemplo, a estrutura complexa tridimensional das proteínas as torna os antígenos mais eficazes e potentes, capazes de estimular a imunidade humoral e celular. Em comparação, os carboidratos têm uma estrutura menos complexa e, portanto, menos eficazes como antígenos; eles só podem estimular as defesas imunológicas humorais. Os lipídios e os ácidos nucléicos são as moléculas menos antigênicas e, em alguns casos, só podem se tornar antigênicos quando combinados com proteínas ou carboidratos para formar glicolipídios, lipoproteínas ou nucleoproteínas.
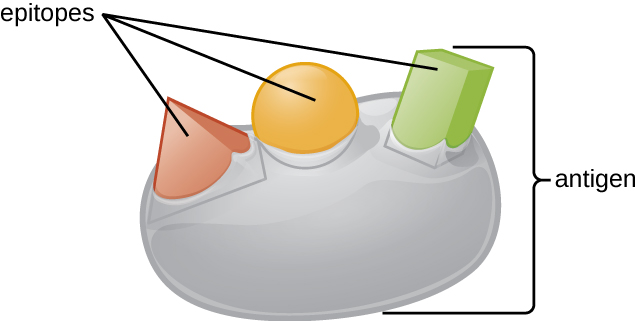
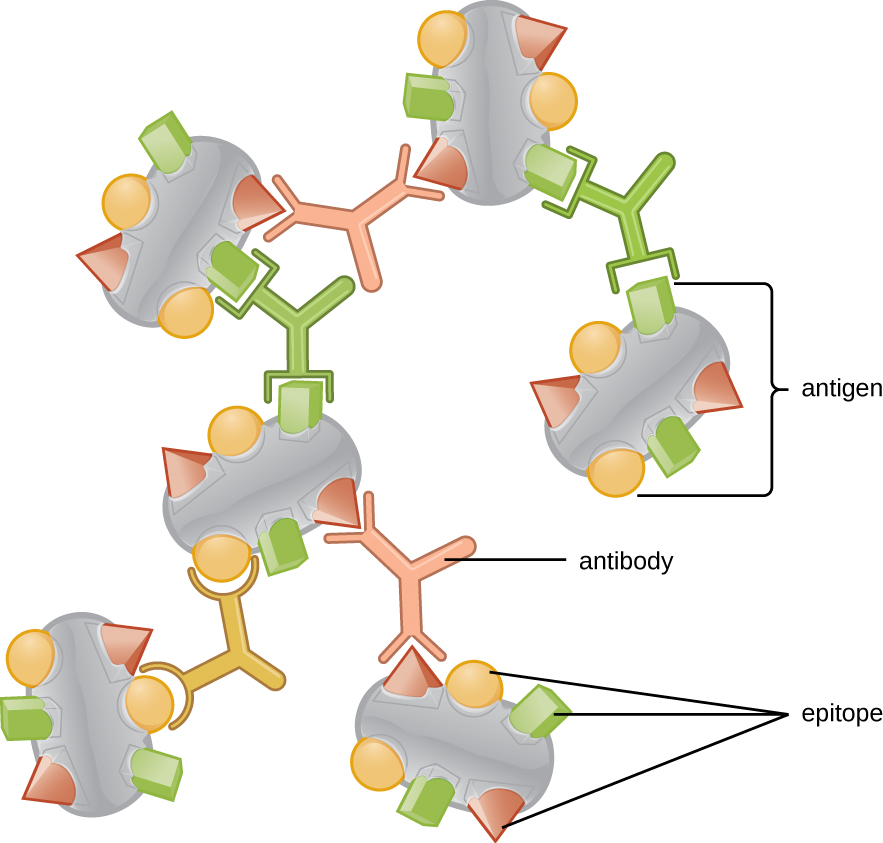
Uma razão pela qual a complexidade tridimensional dos antígenos é tão importante é que os anticorpos e as células T não reconhecem e interagem com um antígeno inteiro, mas com regiões menores expostas na superfície dos antígenos chamados epítopos. Um único antígeno pode possuir vários epítopos diferentes (Figura\(\PageIndex{2}\)), e anticorpos diferentes podem se ligar a diferentes epítopos no mesmo antígeno (Figura\(\PageIndex{3}\)). Por exemplo, o flagelo bacteriano é uma estrutura proteica grande e complexa que pode possuir centenas ou até milhares de epítopos com estruturas tridimensionais únicas. Além disso, flagelos de diferentes espécies bacterianas (ou mesmo cepas da mesma espécie) contêm epítopos únicos que só podem ser ligados por anticorpos específicos.
O tamanho de um antígeno é outro fator importante em seu potencial antigênico. Enquanto grandes estruturas antigênicas, como os flagelos, possuem vários epítopos, algumas moléculas são muito pequenas para serem antigênicas por si mesmas. Essas moléculas, chamadas haptenos, são essencialmente epítopos livres que não fazem parte da complexa estrutura tridimensional de um antígeno maior. Para que um hapteno se torne antigênico, ele deve primeiro se ligar a uma molécula transportadora maior (geralmente uma proteína) para produzir um antígeno conjugado. Os anticorpos específicos do hapteno produzidos em resposta ao antígeno conjugado são então capazes de interagir com moléculas de hapteno livre não conjugadas. Não se sabe que os haptenos estejam associados a nenhum patógeno específico, mas são responsáveis por algumas respostas alérgicas. Por exemplo, o hapteno urushiol, uma molécula encontrada no óleo das plantas que causa a hera venenosa, causa uma resposta imune que pode resultar em uma erupção cutânea grave (chamada dermatite de contato). Da mesma forma, a penicilina haptena pode causar reações alérgicas a medicamentos da classe da penicilina.
Exercício\(\PageIndex{3}\)
- Qual é a diferença entre um antígeno e um epítopo?
- Quais fatores afetam o potencial antigênico de um antígeno?
- Por que os haptenos normalmente não são antigênicos e como eles se tornam antigênicos?
Anticorpos
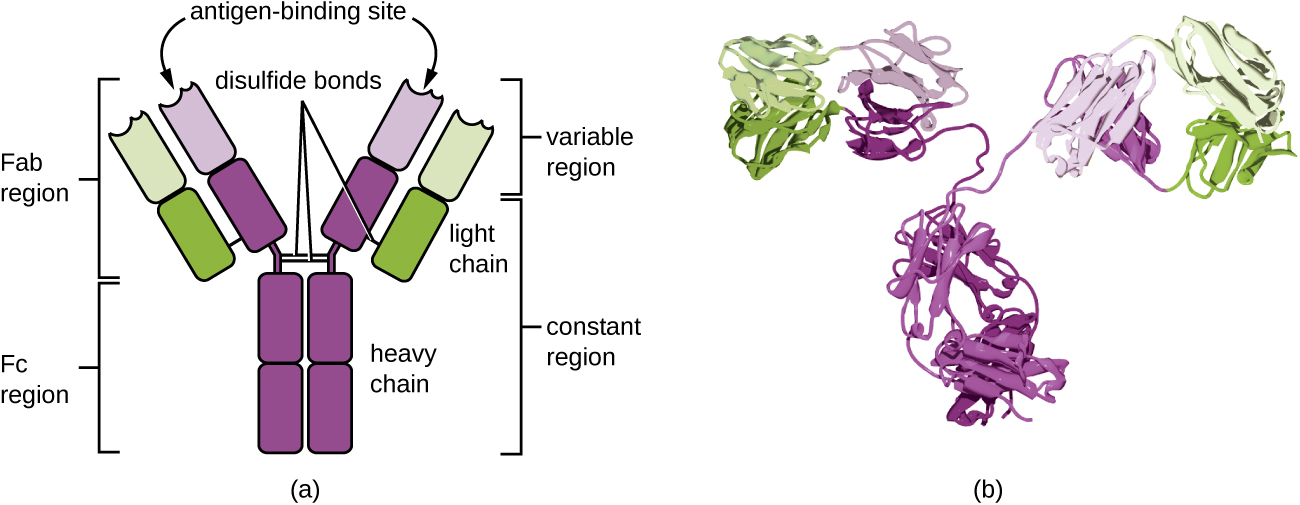
Os anticorpos (também chamados de imunoglobulinas) são glicoproteínas presentes no sangue e nos fluidos dos tecidos. A estrutura básica de um monômero de anticorpo consiste em quatro cadeias proteicas mantidas unidas por ligações dissulfeto (Figura\(\PageIndex{4}\)). Uma ligação dissulfeto é uma ligação covalente entre os grupos sulfidril R encontrados em dois aminoácidos de cisteína. As duas maiores cadeias são idênticas entre si e são chamadas de correntes pesadas. As duas cadeias menores também são idênticas entre si e são chamadas de cadeias leves. Juntas, as correntes pesadas e leves formam uma estrutura básica em forma de Y.
Os dois “braços” da molécula de anticorpo em forma de Y são conhecidos como região Fab, por “fragmento de ligação ao antígeno”. A extremidade mais distante da região Fab é a região variável, que serve como local de ligação ao antígeno. A sequência de aminoácidos na região variável dita a estrutura tridimensional e, portanto, o epítopo tridimensional específico ao qual a região Fab é capaz de se ligar. Embora a especificidade do epítopo das regiões Fab seja idêntica para cada braço de uma única molécula de anticorpo, essa região apresenta um alto grau de variabilidade entre anticorpos com diferentes especificidades de epítopo. A ligação à região de Fab é necessária para neutralização de patógenos, aglutinação ou agregação de patógenos e citotoxicidade mediada por células dependentes de anticorpos.
A região constante da molécula de anticorpo inclui o tronco do Y e a porção inferior de cada braço do Y. O tronco do Y também é chamado de região Fc, para “fragmento de cristalização”, e é o local de ligação e ligação do fator complemento às células fagocíticas durante a opsonização mediada por anticorpos.
Exercício\(\PageIndex{4}\)
Descreva as diferentes funções da região Fab e da região Fc.
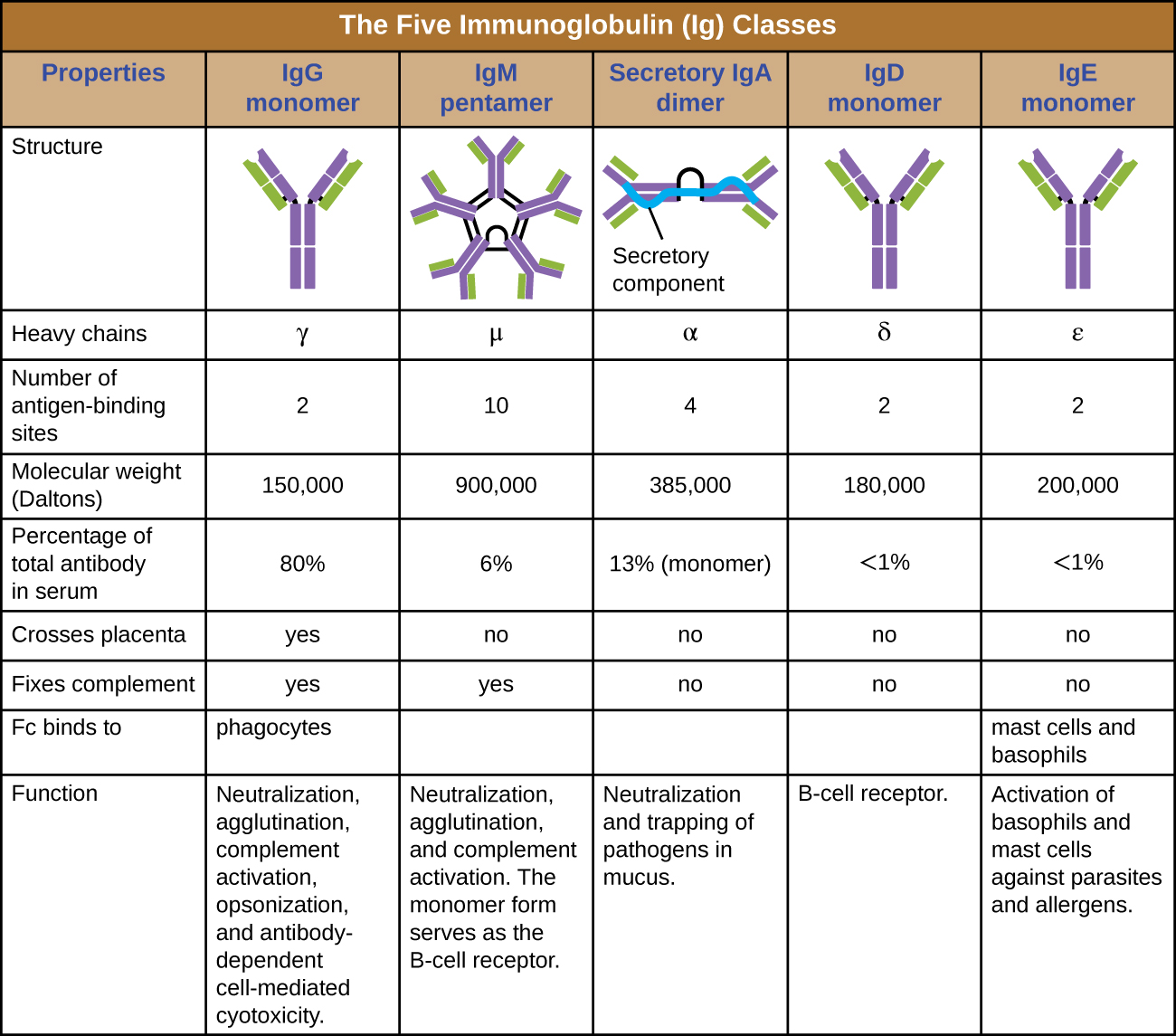
Classes de anticorpos
A região constante de uma molécula de anticorpo determina sua classe ou isótipo. As cinco classes de anticorpos são IgG, IgM, IgA, IgD e IgE. Cada classe possui cadeias pesadas únicas designadas pelas letras gregas γ, μ, α, δ e ε, respectivamente. As classes de anticorpos também apresentam diferenças importantes na abundância de soro, arranjo, locais de ação corporal, funções funcionais e tamanho (Figura\(\PageIndex{5}\)).
O IgG é um monômero que é de longe o anticorpo mais abundante no sangue humano, representando cerca de 80% do total de anticorpos séricos. A IgG penetra eficientemente nos espaços dos tecidos e é a única classe de anticorpos com a capacidade de atravessar a barreira placentária, fornecendo imunidade passiva ao feto em desenvolvimento durante a gravidez. O IgG também é a classe de anticorpos mais versátil em termos de seu papel na defesa do corpo contra patógenos.
O IgM é produzido inicialmente em uma forma monomérica ligada à membrana que serve como um receptor de ligação ao antígeno nas células B. A forma secretada de IgM se reúne em um pentâmero com cinco monômeros de IgM unidos por uma estrutura proteica chamada cadeia J. Embora a localização da cadeia J em relação às regiões Fc dos cinco monômeros impeça o IgM de realizar algumas das funções do IgG, os dez sítios Fab disponíveis associados a um IgM pentamérico o tornam um anticorpo importante no arsenal de defesas do corpo. O IgM é o primeiro anticorpo produzido e secretado pelas células B durante as respostas imunes primária e secundária, tornando a IgM específica do patógeno um marcador diagnóstico valioso durante infecções ativas ou recentes.
A IgA é responsável por cerca de 13% do total de anticorpos séricos, e a IgA secretora é a classe de anticorpos mais comum e abundante encontrada nas secreções de muco que protegem as membranas mucosas. A IgA também pode ser encontrada em outras secreções, como leite materno, lágrimas e saliva. A IgA secretora é reunida em uma forma dimérica com dois monômeros unidos por uma estrutura proteica chamada componente secretor. Uma das funções importantes da IgA secretora é capturar patógenos no muco para que eles possam ser posteriormente eliminados do corpo.
Semelhante ao IgM, o IgD é um monômero ligado à membrana encontrado na superfície das células B, onde serve como um receptor de ligação ao antígeno. No entanto, a IgD não é secretada pelas células B e apenas pequenas quantidades são detectadas no soro. Essas quantidades vestigiais provavelmente vêm da degradação de células B antigas e da liberação de moléculas de IgD de suas membranas citoplasmáticas.
A IgE é a classe de anticorpos menos abundante no soro. Como o IgG, ele é secretado como um monômero, mas seu papel na imunidade adaptativa é restrito às defesas antiparasitárias. A região Fc da IgE se liga aos basófilos e mastócitos. A região Fab da IgE ligada então interage com epítopos antígenos específicos, fazendo com que as células liberem mediadores pró-inflamatórios potentes. A reação inflamatória resultante da ativação de mastócitos e basófilos auxilia na defesa contra parasitas, mas essa reação também é fundamental para as reações alérgicas (veja Doenças do Sistema Imune).
Exercício\(\PageIndex{5}\)
- Que parte de uma molécula de anticorpo determina sua classe?
- Qual classe de anticorpo está envolvida na proteção contra parasitas?
- Descreva a diferença na estrutura entre IgM e IgG.
Interações antígeno-anticorpo
Diferentes classes de anticorpos desempenham papéis importantes na defesa do corpo contra patógenos. Essas funções incluem neutralização de patógenos, opsonização para fagocitose, aglutinação, ativação do complemento e citotoxicidade mediada por células dependentes de anticorpos. Para a maioria dessas funções, os anticorpos também fornecem uma ligação importante entre a imunidade específica adaptativa e a imunidade inata inespecífica.
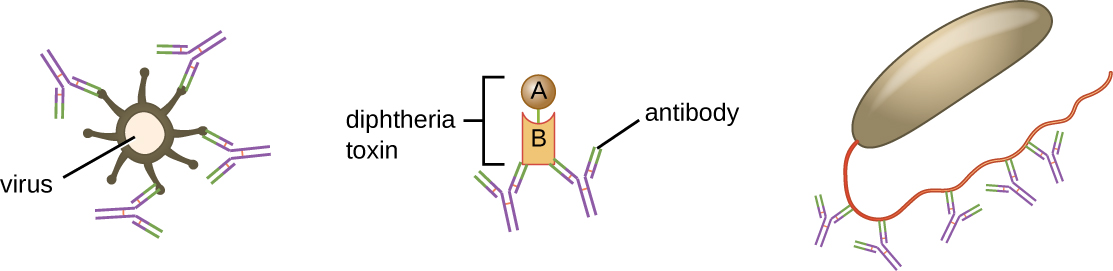
A neutralização envolve a ligação de certos anticorpos (IgG, IgM ou IgA) a epítopos na superfície de patógenos ou toxinas, impedindo sua ligação às células. Por exemplo, a IgA secretora pode se ligar a patógenos específicos e bloquear a ligação inicial às células da mucosa intestinal. Da mesma forma, anticorpos específicos podem se ligar a certas toxinas, impedindo que elas se liguem às células-alvo e, assim, neutralizando seus efeitos tóxicos. Os vírus podem ser neutralizados e evitados de infectar uma célula pelo mesmo mecanismo (Figura\(\PageIndex{6}\)).
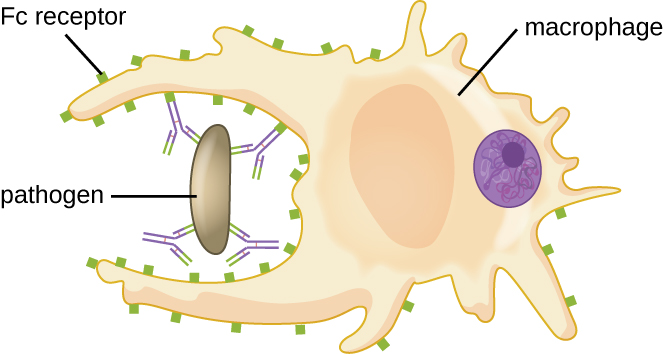
Conforme descrito em Defesas Químicas, a opsonização é o revestimento de um patógeno com moléculas, como fatores complementares, proteína C reativa e amilóide A sérica, para auxiliar na ligação dos fagócitos e facilitar a fagocitose. Os anticorpos IgG também servem como excelentes opsoninas, ligando seus sítios Fab a epítopos específicos na superfície de patógenos. Células fagocíticas, como macrófagos, células dendríticas e neutrófilos, têm receptores em suas superfícies que reconhecem e se ligam à porção Fc das moléculas de IgG; portanto, a IgG ajuda esses fagócitos a se ligarem e engolirem os patógenos que ligaram (Figura\(\PageIndex{7}\)).
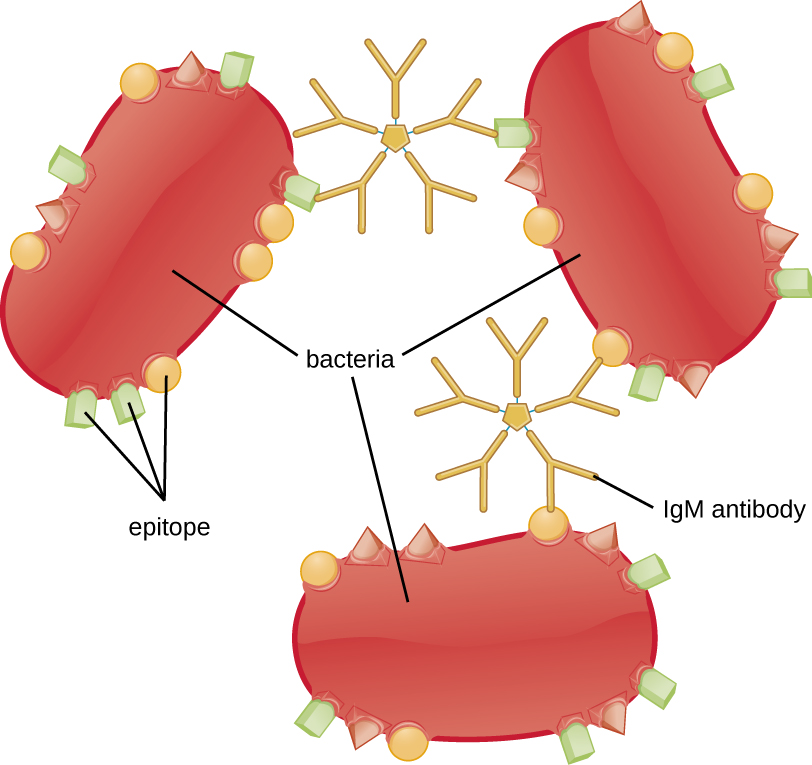
A aglutinação ou agregação envolve a reticulação de patógenos por anticorpos para criar grandes agregados (Figura\(\PageIndex{8}\)). A IgG tem dois sítios de ligação ao antígeno Fab, que podem se ligar a duas células patogênicas separadas, agrupando-as. Quando vários anticorpos IgG estão envolvidos, grandes agregados podem se desenvolver; esses agregados são mais fáceis de serem filtrados pelos rins e baço do sangue e mais fáceis de serem ingeridos pelos fagócitos para destruição. A estrutura pentamérica do IgM fornece dez sítios de ligação Fab por molécula, tornando-o o anticorpo mais eficiente para aglutinação.
Outra função importante dos anticorpos é a ativação da cascata do complemento. Conforme discutido no capítulo anterior, o sistema complemento é um componente importante das defesas inatas, promovendo a resposta inflamatória, recrutando fagócitos para o local da infecção, aumentando a fagocitose por opsonização e matando patógenos bacterianos gram-negativos com o complexo de ataque à membrana (MAC) ). A ativação do complemento pode ocorrer por meio de três vias diferentes (veja a Figura 17.2.2), mas a mais eficiente é a via clássica, que requer a ligação inicial de anticorpos IgG ou IgM à superfície de uma célula patogênica, permitindo o recrutamento e a ativação do complexo C1.
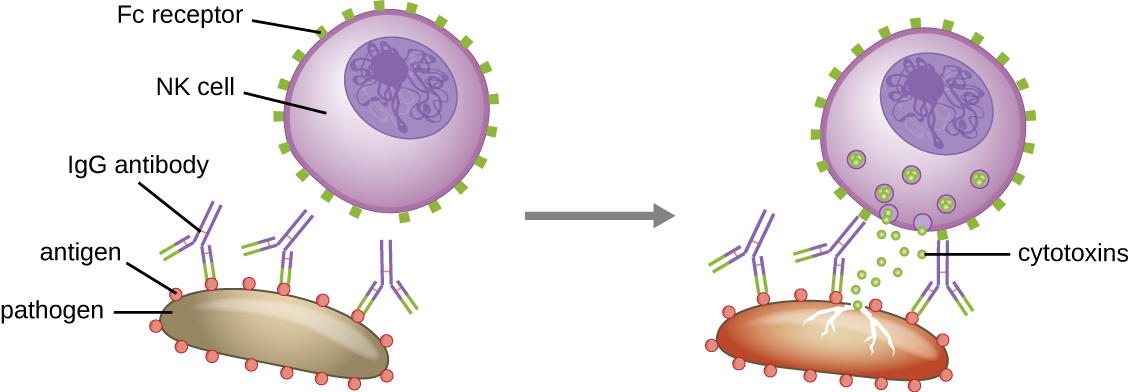
Outra função importante dos anticorpos é a citotoxicidade mediada por células dependente de anticorpos (ADCC), que aumenta a morte de patógenos que são grandes demais para serem fagocitados. Esse processo é melhor caracterizado para células assassinas naturais (células NK), conforme mostrado na Figura\(\PageIndex{9}\), mas também pode envolver macrófagos e eosinófilos. O ADCC ocorre quando a região Fab de um anticorpo IgG se liga a um grande patógeno; os receptores Fc nas células efetoras (por exemplo, células NK) então se ligam à região Fc do anticorpo, aproximando-os do patógeno alvo. A célula efetora então secreta citotoxinas poderosas (por exemplo, perforina e granzimas) que matam o patógeno.
Exercício\(\PageIndex{6}\)
- Onde a IgA é normalmente encontrada?
- Qual classe de anticorpo atravessa a placenta, protegendo o feto?
- Compare os mecanismos de opsonização e a citotoxicidade mediada por células dependentes de anticorpos.
Conceitos principais e resumo
- A imunidade adaptativa é uma defesa adquirida contra patógenos estranhos, caracterizada pela especificidade e memória. A primeira exposição a um antígeno estimula uma resposta primária, e as exposições subsequentes estimulam uma resposta secundária mais rápida e forte.
- A imunidade adaptativa é um sistema duplo que envolve imunidade humoral (anticorpos produzidos pelas células B) e imunidade celular (células T direcionadas contra patógenos intracelulares).
- Os antígenos, também chamados de imunógenos, são moléculas que ativam a imunidade adaptativa. Um único antígeno possui epítopos menores, cada um capaz de induzir uma resposta imune adaptativa específica.
- A capacidade de um antígeno de estimular uma resposta imune depende de vários fatores, incluindo sua classe molecular, complexidade molecular e tamanho.
- Anticorpos (imunoglobulinas) são glicoproteínas em forma de Y com dois sítios Fab para ligação de antígenos e uma porção de Fc envolvida na ativação e opsonização do complemento.
- As cinco classes de anticorpos são IgM, IgG, IgA, IgE e IgD, cada uma diferindo em tamanho, disposição, localização dentro do corpo e função. As cinco funções principais dos anticorpos são neutralização, opsonização, aglutinação, ativação do complemento e citotoxicidade mediada por células dependentes de anticorpos (ADCC).


