16.3: Como as doenças se espalham
- Page ID
- 181703
Objetivos de
- Descreva os diferentes tipos de reservatórios de doenças
- Compare os modos de transmissão de contato, vetor e veículo
- Identifique vetores importantes de doenças
- Explicar a prevalência de infecções hospitalares
Entender como os patógenos infecciosos se espalham é fundamental para prevenir doenças infecciosas. Muitos patógenos precisam de um hospedeiro vivo para sobreviver, enquanto outros podem persistir em um estado inativo fora de um hospedeiro vivo. Mas, tendo infectado um hospedeiro, todos os patógenos também devem ter um mecanismo de transferência de um hospedeiro para outro ou morrerão quando o hospedeiro morrer. Os patógenos geralmente têm adaptações elaboradas para explorar a biologia, o comportamento e a ecologia do hospedeiro para viver e se mover entre os hospedeiros. Os hospedeiros desenvolveram defesas contra patógenos, mas como suas taxas de evolução são normalmente mais lentas do que seus patógenos (porque seus tempos de geração são mais longos), os hospedeiros geralmente estão em desvantagem evolutiva. Esta seção explorará onde os patógenos sobrevivem — tanto dentro quanto fora dos hospedeiros — e algumas das muitas maneiras pelas quais eles se movem de um hospedeiro para outro.
Reservatórios e transportadores
Para que os patógenos persistam por longos períodos de tempo, eles precisam de reservatórios onde normalmente residem. Os reservatórios podem ser organismos vivos ou locais não vivos. Reservatórios não vivos podem incluir solo e água no meio ambiente. Eles podem abrigar naturalmente o organismo porque ele pode crescer nesse ambiente. Esses ambientes também podem ser contaminados com patógenos nas fezes humanas, patógenos eliminados por hospedeiros intermediários ou patógenos contidos nos restos de hospedeiros intermediários.
Os patógenos podem ter mecanismos de dormência ou resiliência que lhes permitem sobreviver (mas normalmente não se reproduzam) por vários períodos de tempo em ambientes não vivos. Por exemplo, o Clostridium tetani sobrevive no solo e na presença de oxigênio como um endosporo resistente. Embora muitos vírus sejam logo destruídos quando em contato com o ar, a água ou outras condições não fisiológicas, certos tipos são capazes de persistir fora de uma célula viva por vários períodos de tempo. Por exemplo, um estudo que analisou a capacidade dos vírus da gripe de infectar uma cultura celular após vários períodos de tempo em uma nota mostrou tempos de sobrevivência de 48 horas a 17 dias, dependendo de como foram depositados na nota. 1 Por outro lado, os rinovírus causadores de resfriados são um tanto frágeis, geralmente sobrevivendo menos de um dia fora dos fluidos fisiológicos.
Um ser humano atuando como reservatório de um patógeno pode ou não ser capaz de transmitir o patógeno, dependendo do estágio da infecção e do patógeno. Para ajudar a prevenir a propagação de doenças entre crianças em idade escolar, o CDC desenvolveu diretrizes com base no risco de transmissão durante o curso da doença. Por exemplo, crianças com catapora são consideradas contagiosas por cinco dias a partir do início da erupção cutânea, enquanto crianças com a maioria das doenças gastrointestinais devem ser mantidas em casa por 24 horas após o desaparecimento dos sintomas.
Um indivíduo capaz de transmitir um patógeno sem apresentar sintomas é chamado de portador. Um transportador passivo está contaminado com o patógeno e pode transmiti-lo mecanicamente para outro hospedeiro; no entanto, um portador passivo não está infectado. Por exemplo, um profissional de saúde que não lava as mãos depois de ver um paciente abrigando um agente infeccioso pode se tornar um portador passivo, transmitindo o patógeno para outro paciente infectado.
Por outro lado, um portador ativo é um indivíduo infectado que pode transmitir a doença a outras pessoas. Um portador ativo pode ou não apresentar sinais ou sintomas de infecção. Por exemplo, portadores ativos podem transmitir a doença durante o período de incubação (antes de apresentarem sinais e sintomas) ou o período de convalescença (após o desaparecimento dos sintomas). Portadores ativos que não apresentam sinais ou sintomas da doença apesar da infecção são chamados de portadores assintomáticos. Patógenos como o vírus da hepatite B, o vírus do herpes simplex e o HIV são frequentemente transmitidos por portadores assintomáticos. Mary Mallon, mais conhecida como Maria Tifoide, é um famoso exemplo histórico de portadora assintomática. Imigrante irlandês, Mallon trabalhou como cozinheiro para famílias na cidade de Nova York e arredores entre 1900 e 1915. Em cada domicílio, os moradores desenvolveram febre tifóide (causada pela Salmonella typhi) algumas semanas depois de Mallon começar a trabalhar. Investigações posteriores determinaram que Mallon foi responsável por pelo menos 122 casos de febre tifóide, cinco dos quais foram fatais. 2 Veja Eye on Ethics: Typhoid Mary para saber mais sobre o caso Mallon.
Um patógeno pode ter mais de um reservatório vivo. Nas doenças zoonóticas, os animais agem como reservatórios de doenças humanas e transmitem o agente infeccioso aos humanos por meio do contato direto ou indireto. Em alguns casos, a doença também afeta o animal, mas em outros casos o animal é assintomático.
Nas infecções parasitárias, o hospedeiro preferido do parasita é chamado de hospedeiro definitivo. Em parasitas com ciclos de vida complexos, o hospedeiro definitivo é o hospedeiro no qual o parasita atinge a maturidade sexual. Alguns parasitas também podem infectar um ou mais hospedeiros intermediários nos quais o parasita passa por vários estágios imaturos do ciclo de vida ou se reproduz assexuadamente.
George Soper, o engenheiro sanitário que rastreou o surto de febre tifóide até Mary Mallon, faz um relato de sua investigação, um exemplo de epidemiologia descritiva, em “The Curious Career of Typhoid Mary”.
Exercício\(\PageIndex{1}\)
- Liste alguns reservatórios não vivos para patógenos.
- Explique a diferença entre um portador passivo e um portador ativo.
Transmissão
Independentemente do reservatório, a transmissão deve ocorrer para que uma infecção se espalhe. Primeiro, a transmissão do reservatório para o indivíduo deve ocorrer. Em seguida, o indivíduo deve transmitir o agente infeccioso para outros indivíduos suscetíveis, direta ou indiretamente. Os microrganismos patogênicos empregam diversos mecanismos de transmissão.
Transmissão de contato
A transmissão por contato inclui contato direto ou contato indireto. A transmissão de pessoa para pessoa é uma forma de transmissão direta por contato. Aqui, o agente é transmitido pelo contato físico entre dois indivíduos (Figura\(\PageIndex{1}\)) por meio de ações como tocar, beijar, relações sexuais ou sprays de gotículas. O contato direto pode ser classificado como transmissão vertical, horizontal ou por gotículas. A transmissão vertical por contato direto ocorre quando os patógenos são transmitidos de mãe para filho durante a gravidez, parto ou amamentação. Outros tipos de transmissão por contato direto são chamados de transmissão de contato direto horizontal. Freqüentemente, o contato entre as membranas mucosas é necessário para a entrada do patógeno no novo hospedeiro, embora o contato pele a pele possa levar ao contato com a membrana mucosa se o novo hospedeiro posteriormente tocar uma membrana mucosa. A transmissão por contato também pode ser específica do local; por exemplo, algumas doenças podem ser transmitidas por contato sexual, mas não por outras formas de contato.
Quando um indivíduo tosse ou espirra, pequenas gotículas de muco que podem conter patógenos são ejetadas. Isso leva à transmissão direta de gotículas, que se refere à transmissão por gotículas de um patógeno para um novo hospedeiro em distâncias de um metro ou menos. Uma grande variedade de doenças é transmitida por gotículas, incluindo influenza e muitas formas de pneumonia. A transmissão em distâncias maiores que um metro é chamada de transmissão aérea.
A transmissão indireta por contato envolve objetos inanimados chamados fômitos que são contaminados por patógenos de um indivíduo ou reservatório infectado (Figura\(\PageIndex{2}\)). Por exemplo, uma pessoa com resfriado comum pode espirrar, fazendo com que gotículas caiam em uma fômite, como uma toalha de mesa ou carpete, ou a pessoa pode limpar o nariz e depois transferir muco para um fômite, como uma maçaneta ou toalha. A transmissão ocorre indiretamente quando um novo hospedeiro suscetível posteriormente toca o fômite e transfere o material contaminado para um portal de entrada suscetível. Os fômitos também podem incluir objetos usados em ambientes clínicos que não estão devidamente esterilizados, como seringas, agulhas, cateteres e equipamentos cirúrgicos. Os patógenos transmitidos indiretamente por esses fômitos são uma das principais causas de infecções associadas à saúde (consulte Controle do crescimento microbiano).


Transmissão de veículos
O termo transmissão veicular se refere à transmissão de patógenos por meio de veículos como água, comida e ar. A contaminação da água por meio de métodos inadequados de saneamento leva à transmissão de doenças pela água. As doenças transmitidas pela água continuam sendo um problema sério em muitas regiões do mundo. A Organização Mundial da Saúde (OMS) estima que a água potável contaminada é responsável por mais de 500.000 mortes a cada ano. 3 Da mesma forma, alimentos contaminados por meio de manuseio ou armazenamento inadequados podem levar à transmissão de doenças por alimentos (Figura\(\PageIndex{3}\)).
Poeira e partículas finas conhecidas como aerossóis, que podem flutuar no ar, podem transportar patógenos e facilitar a transmissão de doenças pelo ar. Por exemplo, partículas de poeira são o modo dominante de transmissão do hantavírus aos humanos. O hantavírus é encontrado nas fezes, urina e saliva de camundongos, mas quando essas substâncias secam, elas podem se desintegrar em partículas finas que podem se tornar transportadas pelo ar quando perturbadas; a inalação dessas partículas pode levar a uma infecção respiratória grave e às vezes fatal.
Embora a transmissão por gotículas em curtas distâncias seja considerada transmissão por contato, conforme discutido acima, a transmissão de gotículas por maior distância pelo ar é considerada transmissão veicular. Ao contrário das partículas maiores que caem rapidamente da coluna de ar, gotículas finas de muco produzidas pela tosse ou espirro podem permanecer suspensas por longos períodos de tempo, percorrendo distâncias consideráveis. Em certas condições, as gotículas se dessecam rapidamente para produzir um núcleo de gotículas capaz de transmitir patógenos; a temperatura e a umidade do ar podem ter um impacto na eficácia da transmissão aérea.
A tuberculose é frequentemente transmitida por via aérea quando o agente causador, Mycobacterium tuberculosis, é liberado em pequenas partículas com tosse. Como a tuberculose requer apenas 10 micróbios para iniciar uma nova infecção, os pacientes com tuberculose devem ser tratados em salas equipadas com ventilação especial, e qualquer pessoa que entre na sala deve usar uma máscara.

Foco clínico: Resolução
Depois de identificar a origem dos patos contaminados, o escritório de saúde pública da Flórida notificou o CDC, que solicitou uma inspeção rápida da instalação por inspetores estaduais. Os inspetores descobriram que uma máquina usada para processar o frango estava contaminada com Salmonella como resultado de protocolos de limpeza abaixo do padrão. Os inspetores também descobriram que o processo de recheio e embalagem dos perus antes da refrigeração permitiu que a carne permanecesse em temperaturas propícias ao crescimento bacteriano por muito tempo. A contaminação e o atraso na refrigeração levaram à transmissão veicular (alimentar) da bactéria em turduckens.
Com base nessas descobertas, a fábrica foi fechada para uma descontaminação completa e completa. Todos os turduckens produzidos na fábrica foram retirados e retirados das prateleiras das lojas antes da temporada de férias de dezembro, evitando novos surtos.
Transmissão vetorial
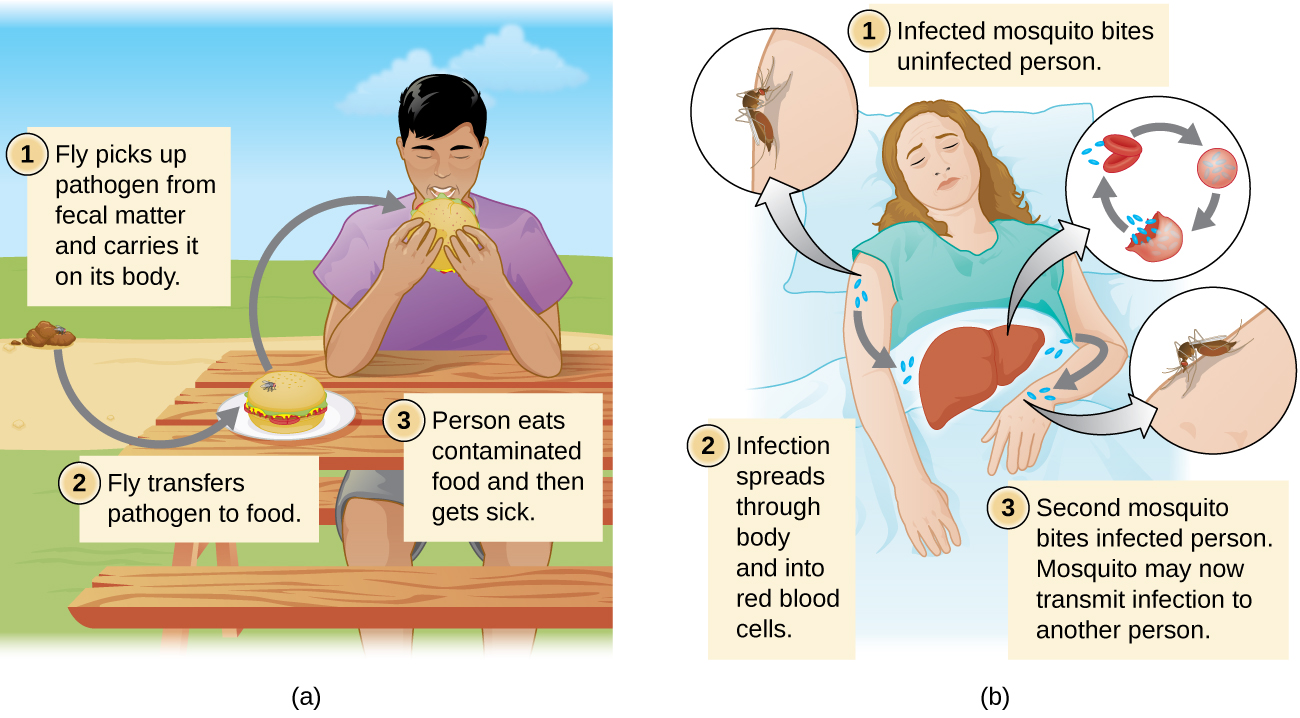
As doenças também podem ser transmitidas por um vetor mecânico ou biológico, um animal (normalmente um artrópode) que transporta a doença de um hospedeiro para outro. A transmissão mecânica é facilitada por um vetor mecânico, um animal que carrega um patógeno de um hospedeiro para outro sem ser infectado. Por exemplo, uma mosca pode pousar na matéria fecal e depois transmitir bactérias das fezes para os alimentos em que pousa; um humano que come a comida pode então ser infectado pela bactéria, resultando em um caso de diarreia ou disenteria (Figura\(\PageIndex{4}\)).
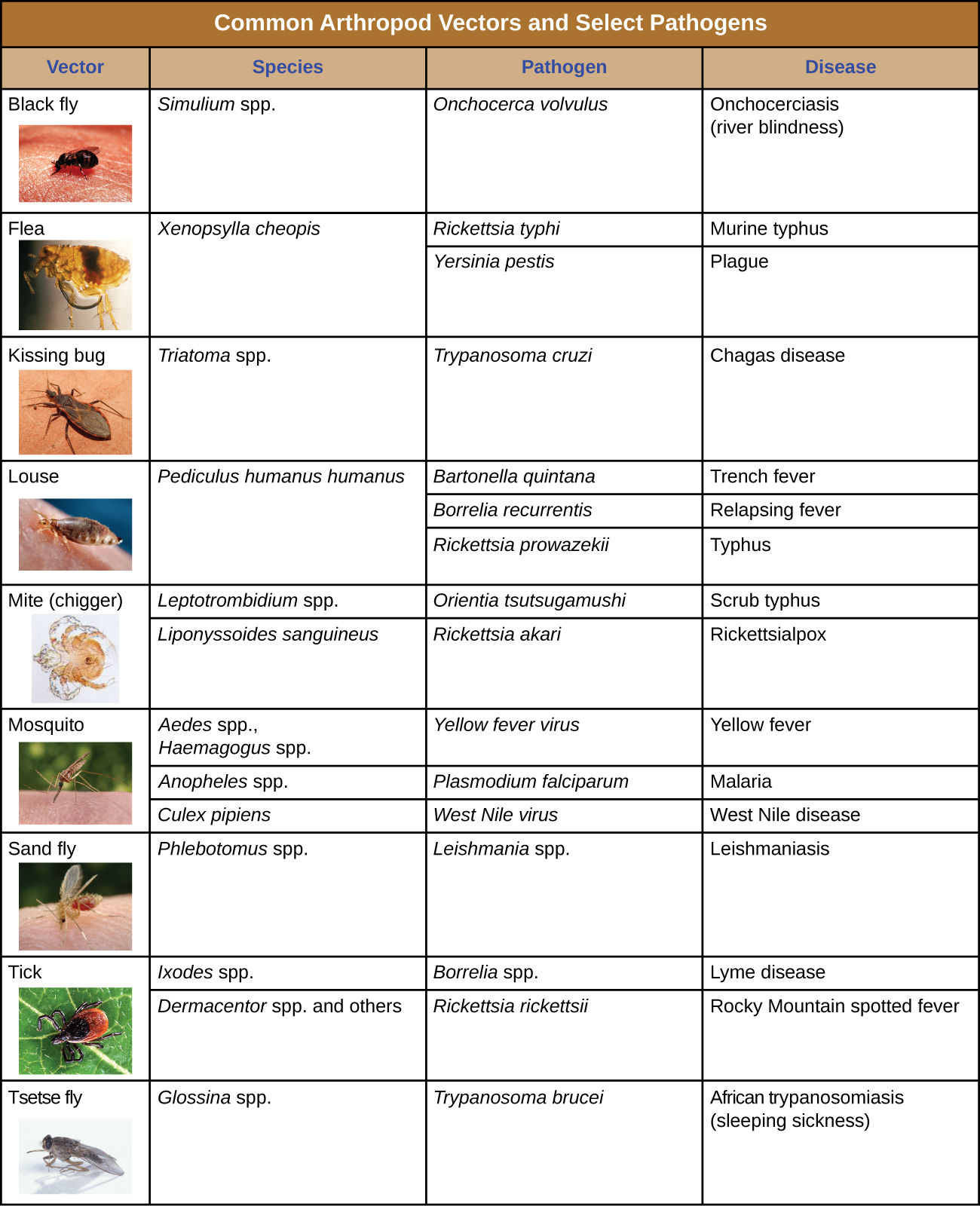
A transmissão biológica ocorre quando o patógeno se reproduz dentro de um vetor biológico que transmite o patógeno de um hospedeiro para outro (Figura\(\PageIndex{4}\)). Os artrópodes são os principais vetores responsáveis pela transmissão biológica (Figura\(\PageIndex{5}\)). A maioria dos vetores de artrópodes transmite o patógeno mordendo o hospedeiro, criando uma ferida que serve como porta de entrada. O patógeno pode passar por parte de seu ciclo reprodutivo no intestino ou nas glândulas salivares do artrópode para facilitar sua transmissão pela picada. Por exemplo, os hemípteros (chamados de “insetos beijadores” ou “insetos assassinos”) transmitem a doença de Chagas aos humanos defecando quando picam, após o qual o humano coça ou esfrega as fezes infectadas em uma membrana mucosa ou quebra na pele.
Os insetos vetores biológicos incluem mosquitos, que transmitem malária e outras doenças, e piolhos, que transmitem tifo. Outros vetores de artrópodes podem incluir aracnídeos, principalmente carrapatos, que transmitem a doença de Lyme e outras doenças, e ácaros, que transmitem tifo esfoliante e varíola rickettsial. A transmissão biológica, por envolver sobrevivência e reprodução dentro de um vetor parasitado, complica a biologia do patógeno e sua transmissão. Existem também importantes vetores de doenças não artrópodes, incluindo mamíferos e pássaros. Várias espécies de mamíferos podem transmitir a raiva aos humanos, geralmente por meio de uma picada que transmite o vírus da raiva. Galinhas e outras aves domésticas podem transmitir a gripe aviária aos humanos por meio do contato direto ou indireto com o vírus da gripe aviária A, disseminado na saliva, mucosas e fezes das aves.
Exercício\(\PageIndex{2}\)
- Descreva como as doenças podem ser transmitidas pelo ar.
- Explique a diferença entre um vetor mecânico e um vetor biológico.
Usando OGM para impedir a propagação do zika
Em 2016, uma epidemia do vírus Zika foi associada a uma alta incidência de defeitos congênitos na América do Sul e na América Central. Quando o inverno virou primavera no hemisfério norte, as autoridades de saúde previram corretamente que o vírus se espalharia para a América do Norte, coincidindo com a época de reprodução de seu principal vetor, o mosquito Aedes aegypti.
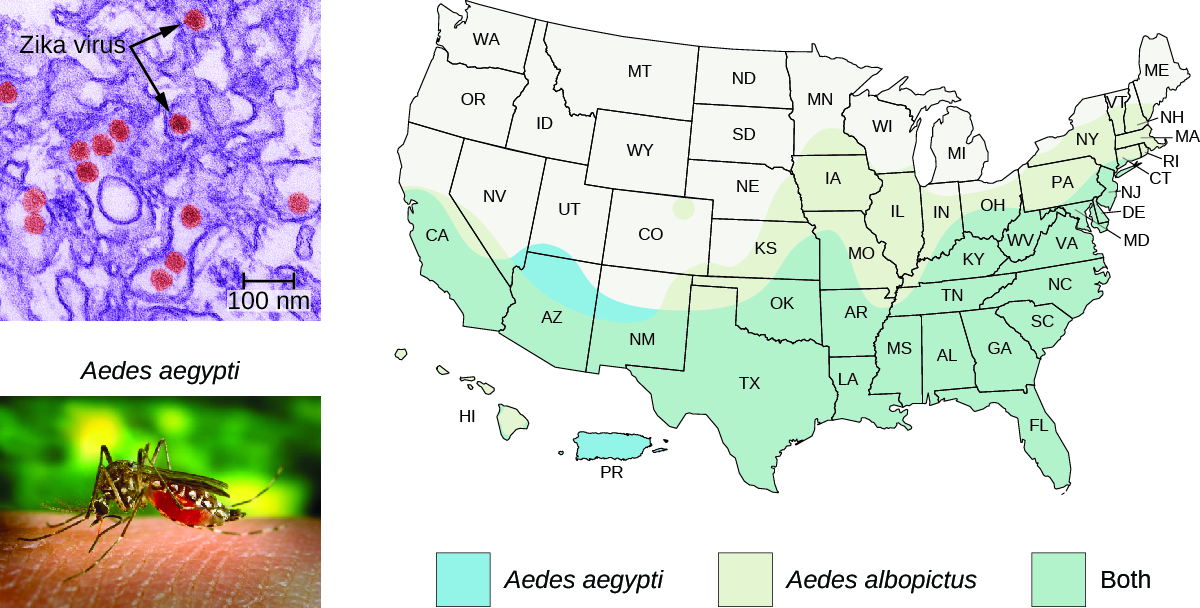
A distribuição do mosquito A. aegypti se estende até o sul dos Estados Unidos (Figura\(\PageIndex{6}\)). Como esses mesmos mosquitos servem como vetores para outras doenças problemáticas (dengue, febre amarela e outras), vários métodos de controle de mosquitos foram propostos como soluções. Pesticidas químicos foram usados com eficácia no passado e provavelmente serão usados novamente; mas como os pesticidas químicos podem ter impactos negativos no meio ambiente, alguns cientistas propuseram uma alternativa que envolve a engenharia genética do A. aegypti para que ele não possa se reproduzir. Esse método, no entanto, tem sido objeto de alguma controvérsia.
Um método que funcionou no passado para controlar pragas, com pouca desvantagem aparente, foi a introdução estéril de homens. Esse método controlava a praga da mosca do verme no sudoeste dos Estados Unidos e as pragas da mosca-das-frutas nas plantações de frutas. Nesse método, os machos da espécie-alvo são criados em laboratório, esterilizados com radiação e liberados no ambiente, onde se acasalam com fêmeas selvagens, que posteriormente não têm filhos vivos. Liberações repetidas diminuem a população de pragas.
Um método semelhante, aproveitando a tecnologia de DNA recombinante, 4 introduz um alelo letal dominante em mosquitos machos que é suprimido na presença de tetraciclina (um antibiótico) durante a criação em laboratório. Os machos são liberados no meio ambiente e acasalam com as fêmeas dos mosquitos. Ao contrário do método masculino estéril, esses acasalamentos produzem descendentes, mas eles morrem como larvas do gene letal na ausência de tetraciclina no ambiente. Em 2016, esse método ainda não havia sido implementado nos Estados Unidos, mas uma empresa britânica testou o método em Piracicaba, Brasil, e encontrou uma redução de 82% nas larvas selvagens de A. aegypti e uma redução de 91% nos casos de dengue na área tratada. 5 Em agosto de 2016, em meio a notícias de infecções por Zika em várias comunidades da Flórida, o FDA deu permissão à empresa britânica para testar esse mesmo método de controle de mosquitos em Key West, Flórida, aguardando a conformidade com as regulamentações locais e estaduais e um referendo nas comunidades afetadas.
O uso de organismos geneticamente modificados (OGM) para controlar um vetor de doenças tem tanto seus defensores quanto seus oponentes. Em teoria, o sistema poderia ser usado para extinguir o mosquito A. aegypti — um objetivo nobre, segundo alguns, devido aos danos que causam às populações humanas. 6 Mas os opositores da ideia temem que o gene possa escapar do limite de espécies de A. aegypti e causar problemas em outras espécies, levando a consequências ecológicas imprevistas. Os opositores também desconfiam do programa porque ele está sendo administrado por uma empresa com fins lucrativos, criando o potencial de conflitos de interesse que precisariam ser rigorosamente regulamentados; e não está claro como quaisquer consequências não intencionais do programa poderiam ser revertidas.
Também existem outras considerações epidemiológicas. Aparentemente, o Aedes aegypti não é o único vetor do vírus Zika. O Aedes albopictus, o mosquito tigre asiático, também é vetor do vírus Zika. 7 A. albopictus está agora espalhado por todo o planeta, incluindo grande parte dos Estados Unidos (Figura\(\PageIndex{6}\)). Descobriu-se que muitos outros mosquitos abrigam o vírus Zika, embora sua capacidade de agir como vetores seja desconhecida. 8 Cepas geneticamente modificadas de A. aegypti não controlarão as outras espécies de vetores. Finalmente, o vírus Zika aparentemente pode ser transmitido sexualmente entre hospedeiros humanos, de mãe para filho e, possivelmente, por meio de transfusão de sangue. Todos esses fatores devem ser considerados em qualquer abordagem para controlar a propagação do vírus.
Claramente, há riscos e incógnitas envolvidos na condução de um experimento em ambiente aberto de uma tecnologia ainda mal compreendida. Mas permitir que o vírus Zika se espalhe sem controle também é arriscado. A ameaça de uma epidemia de Zika justifica o risco ecológico de mosquitos geneticamente modificados? Os métodos atuais de controle de mosquitos são suficientemente ineficazes ou prejudiciais para que precisemos experimentar alternativas não testadas? Estas são as perguntas que estão sendo feitas às autoridades de saúde pública agora.
Quarentena
Indivíduos suspeitos ou conhecidos de terem sido expostos a certos patógenos contagiosos podem ser colocados em quarentena ou isolados para evitar a transmissão da doença a outras pessoas. Hospitais e outras unidades de saúde geralmente criam enfermarias especiais para isolar pacientes com doenças particularmente perigosas, como tuberculose ou Ebola (Figura\(\PageIndex{7}\)). Dependendo da configuração, essas enfermarias podem ser equipadas com métodos especiais de tratamento de ar, e o pessoal pode implementar protocolos especiais para limitar o risco de transmissão, como equipamento de proteção individual ou o uso de sprays desinfetantes químicos na entrada e saída da equipe médica.
A duração da quarentena depende de fatores como o período de incubação da doença e a evidência sugestiva de uma infecção. O paciente pode ser liberado se os sinais e sintomas não se materializarem quando esperado ou se o tratamento preventivo puder ser administrado para limitar o risco de transmissão. Se a infecção for confirmada, o paciente pode ser obrigado a permanecer isolado até que a doença não seja mais considerada contagiosa.
Nos Estados Unidos, as autoridades de saúde pública só podem colocar pacientes em quarentena para certas doenças, como cólera, difteria, tuberculose infecciosa e cepas de influenza capazes de causar uma pandemia. Indivíduos que entram nos Estados Unidos ou se deslocam entre estados podem ser colocados em quarentena pelo CDC se forem suspeitos de terem sido expostos a uma dessas doenças. Embora o CDC monitore rotineiramente os pontos de entrada nos Estados Unidos em busca de tripulantes ou passageiros com doenças, a quarentena raramente é implementada.

Infecções associadas à saúde (nosocomiais)
Hospitais, casas de repouso e prisões atraem a atenção dos epidemiologistas porque esses ambientes estão associados ao aumento da incidência de certas doenças. Taxas mais altas de transmissão podem ser causadas por características do próprio ambiente, características da população ou ambas. Consequentemente, esforços especiais devem ser feitos para limitar os riscos de infecção nesses ambientes.
As infecções adquiridas em estabelecimentos de saúde, incluindo hospitais, são chamadas de infecções nosocomiais ou infecções associadas à saúde (HAI). As IRAS são frequentemente associadas a cirurgias ou outros procedimentos invasivos que fornecem ao patógeno acesso ao portal da infecção. Para que uma infecção seja classificada como HAI, o paciente deve ter sido internado na unidade de saúde por um motivo diferente da infecção. Nesses contextos, pacientes que sofrem de doença primária geralmente sofrem de imunidade comprometida e são mais suscetíveis a infecções secundárias e patógenos oportunistas.
Em 2011, mais de 720.000 IRAS ocorreram em hospitais nos Estados Unidos, de acordo com o CDC. Cerca de 22% dessas IRAS ocorreram no local da cirurgia e os casos de pneumonia representaram outros 22%; as infecções do trato urinário representaram mais 13% e as infecções primárias da corrente sanguínea 10%. 9 Essas IRAS geralmente ocorrem quando patógenos são introduzidos no corpo dos pacientes por meio de equipamentos cirúrgicos ou médicos contaminados, como cateteres e ventiladores respiratórios. Os estabelecimentos de saúde buscam limitar as infecções hospitalares por meio de protocolos de treinamento e higiene, como os descritos em Controle do Crescimento Microbiano.
Exercício\(\PageIndex{3}\)
Dê alguns motivos pelos quais os HAIs ocorrem.
Conceitos principais e resumo
- Os reservatórios de doenças humanas podem incluir populações humanas e animais, solo, água e objetos ou materiais inanimados.
- A transmissão por contato pode ser direta ou indireta por meio do contato físico com um hospedeiro infectado (direto) ou do contato com um fômito com o qual um hospedeiro infectado tenha feito contato anteriormente (indireto).
- A transmissão vetorial ocorre quando um organismo vivo carrega um agente infeccioso em seu corpo (mecânico) ou como hospedeiro de infecção (biológico) para um novo hospedeiro.
- A transmissão veicular ocorre quando uma substância, como solo, água ou ar, transporta um agente infeccioso para um novo hospedeiro.
- As infecções associadas à saúde (HAI), ou infecções nosocomiais, são adquiridas em um ambiente clínico. A transmissão é facilitada por intervenções médicas e pela alta concentração de indivíduos suscetíveis e imunocomprometidos em ambientes clínicos.
Notas de pé
- 1 Yves Thomas, Guido Vogel, Werner Wunderli, Patricia Suter, Mark Witschi, Daniel Koch, Caroline Tapparel e Laurent Kaiser. “Sobrevivência do vírus da gripe nas notas”. Microbiologia Aplicada e Ambiental 74, nº 10 (2008): 3002—3007.
- 2 Filio Marineli, Gregory Tsoucalas, Marianna Karamanou e George Androutsos. “Mary Mallon (1869—1938) e a história da febre tifóide.” Anais da Gastroenterologia 26 (2013): 132—134. www.ncbi.nlm.nih.gov/pmc/arti... rol-26-132.pdf.
- 3 Organização Mundial da Saúde. Ficha informativa nº 391 — Água potável. Junho de 2005. www.who.int/mediacentre/factsheets/fs391/en.
- 4 Blandine Massonnet-Bruneel, Nicole Corre-Catelin, Renaud Lacroix, Rosemary S. Lees, Kim Phuc Hoang, Derric Nimmo, Luke Alphey e Paul Reiter. “Aptidão física de machos transgênicos do mosquito Aedes aegypti portadores de um sistema genético letal dominante.” PLOS ONE 8, nº 5 (2013): e62711.
- 5 Richard Levine. “Casos de dengue caem 91% devido a mosquitos geneticamente modificados.” Entomologia hoje. entomologytoday.org/2016/07/... e mosquitos.
- 6 Olivia Judson. “A morte de um inseto”. The New York Times, 25 de setembro de 2003. www.nytimes.com/2003/09/25/op... g-s-death.html.
- 7 Gilda Grard, Mélanie Caron, Illich Manfred Mombo, Dieudonné Nkoghe, Statiana Mboui Ondo, Davy Jiolle, Didier Fontenille, Christophe Paupy e Eric Maurice Leroy. “Vírus Zika no Gabão (África Central) —2007: uma nova ameaça do Aedes albopictus?” Doenças tropicais negligenciadas da PLOS 8, nº 2 (2014): e2681.
- 8 Constância F.J. Ayres. “Identificação de vetores do vírus Zika e implicações para o controle.” The Lancet Infectious Diseases 16, nº 3 (2016): 278—279.
- 9 Centros de Controle e Prevenção de Doenças. “Dados e estatísticas da HAI”. 2016. http://www.cdc.gov/hai/surveillance. Acessado em 2 de janeiro de 2016.


