15.2: Como os patógenos causam doenças
- Page ID
- 181370
Objetivos de
- Resuma os postulados de Koch e os postulados moleculares de Koch, respectivamente, e explique seu significado e limitações
- Explicar o conceito de patogenicidade (virulência) em termos de dose infecciosa e letal
- Faça a distinção entre patógenos primários e oportunistas e identifique exemplos específicos de cada um
- Resuma os estágios da patogênese
- Explique os papéis dos portais de entrada e saída na transmissão de doenças e identifique exemplos específicos desses portais
Para a maioria das doenças infecciosas, a capacidade de identificar com precisão o patógeno causador é uma etapa crítica para encontrar ou prescrever tratamentos eficazes. Os médicos, pacientes e pesquisadores de hoje têm uma dívida considerável com o médico Robert Koch (1843-1910), que desenvolveu uma abordagem sistemática para confirmar relações causais entre doenças e patógenos específicos.
Postulados de Koch
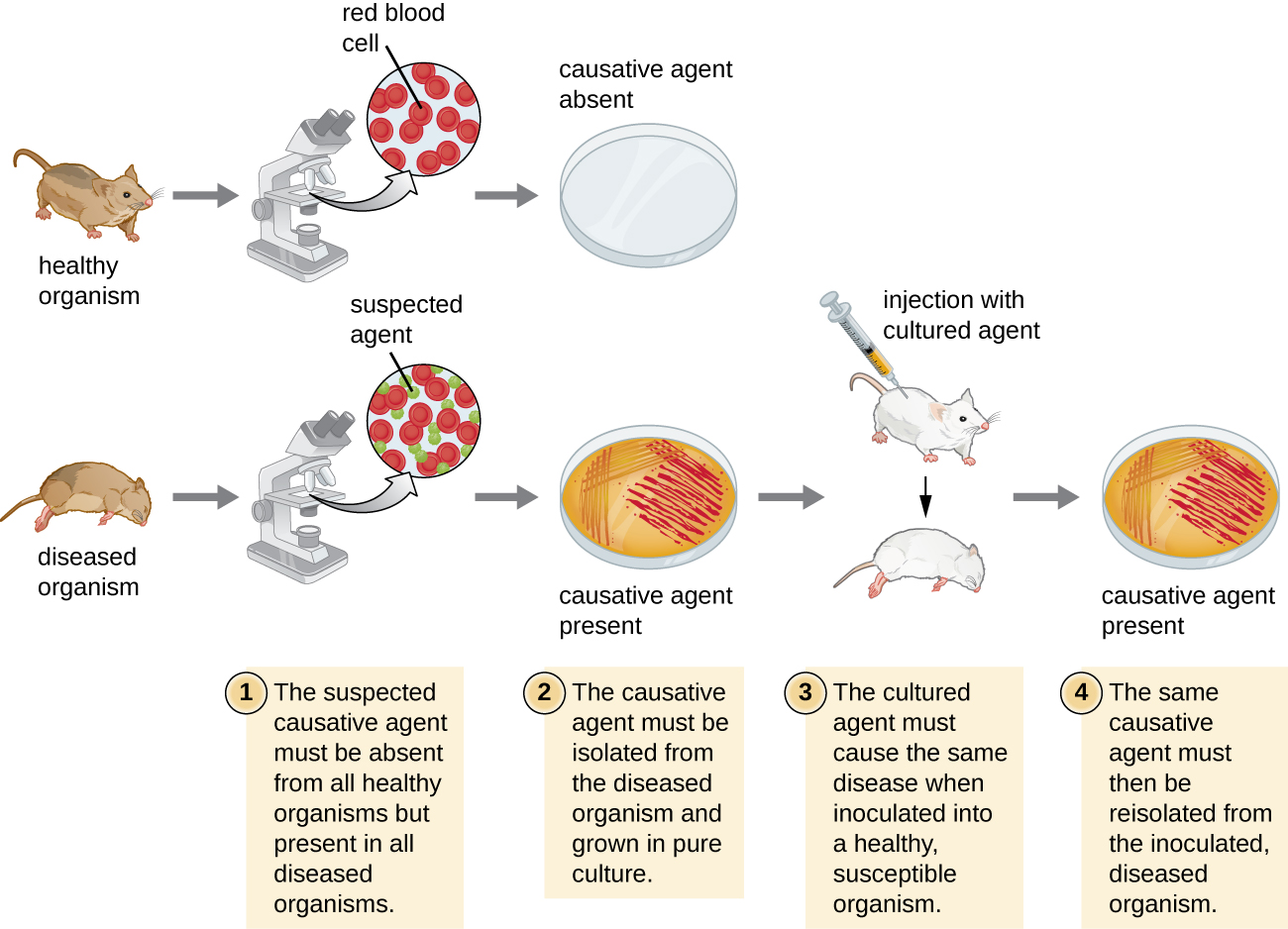
Em 1884, Koch publicou quatro postulados que resumiram seu método para determinar se um determinado microrganismo era a causa de uma determinada doença. Cada um dos postulados de Koch representa um critério que deve ser cumprido antes que uma doença possa ser associada positivamente a um patógeno. Para determinar se os critérios são atendidos, os testes são realizados em animais de laboratório e as culturas de animais saudáveis e doentes são comparadas (Figura\(\PageIndex{1}\)).
Postulados de Koch
- O patógeno suspeito deve ser encontrado em todos os casos da doença e não em indivíduos saudáveis.
- O patógeno suspeito pode ser isolado e cultivado em cultura pura.
- Uma cobaia saudável infectada com o patógeno suspeito deve desenvolver os mesmos sinais e sintomas da doença vistos no postulado.
- O patógeno deve ser re-isolado do novo hospedeiro e deve ser idêntico ao patógeno do postulado 2.
De muitas maneiras, os postulados de Koch ainda são fundamentais para nossa compreensão atual das causas da doença. No entanto, os avanços na microbiologia revelaram algumas limitações importantes nos critérios de Koch. Koch fez várias suposições que agora sabemos serem falsas em muitos casos. A primeira diz respeito ao postulado 1, que pressupõe que os patógenos só são encontrados em indivíduos doentes, não saudáveis. Isso não é verdade para muitos patógenos. Por exemplo, o H. pylori, descrito anteriormente neste capítulo como um patógeno causador de gastrite crônica, também faz parte da microbiota normal do estômago em muitos humanos saudáveis que nunca desenvolvem gastrite. Estima-se que mais de 50% da população humana adquira H. pylori no início da vida, com a maioria mantendo-a como parte da microbiota normal pelo resto da vida sem nunca desenvolver doenças.
A segunda suposição errada de Koch era que todas as cobaias saudáveis são igualmente suscetíveis a doenças. Agora sabemos que os indivíduos não são igualmente suscetíveis a doenças. Os indivíduos são únicos em termos de sua microbiota e do estado de seu sistema imunológico a qualquer momento. A composição da microbiota residente pode influenciar a suscetibilidade de um indivíduo a uma infecção. Membros da microbiota normal desempenham um papel importante na imunidade ao inibir o crescimento de patógenos transitórios. Em alguns casos, a microbiota pode impedir que um patógeno estabeleça uma infecção; em outros, pode não prevenir completamente uma infecção, mas pode influenciar a gravidade ou o tipo de sinais e sintomas. Como resultado, dois indivíduos com a mesma doença podem nem sempre apresentar os mesmos sinais e sintomas. Além disso, alguns indivíduos têm um sistema imunológico mais forte do que outros. Indivíduos com sistema imunológico enfraquecido pela idade ou por uma doença não relacionada são muito mais suscetíveis a certas infecções do que indivíduos com sistema imunológico forte.
Koch também assumiu que todos os patógenos são microrganismos que podem ser cultivados em cultura pura (postulado 2) e que os animais poderiam servir como modelos confiáveis para doenças humanas. No entanto, agora sabemos que nem todos os patógenos podem ser cultivados em cultura pura, e muitas doenças humanas não podem ser replicadas de forma confiável em animais hospedeiros. Vírus e certas bactérias, incluindo Rickettsia e Chlamydia, são patógenos intracelulares obrigatórios que só podem crescer dentro de uma célula hospedeira. Se um micróbio não pode ser cultivado, um pesquisador não pode superar o postulado 2. Da mesma forma, sem um hospedeiro não humano adequado, um pesquisador não pode avaliar o postulado 2 sem infectar deliberadamente humanos, o que apresenta preocupações éticas óbvias. A AIDS é um exemplo dessa doença porque o vírus da imunodeficiência humana (HIV) só causa doenças em humanos.
Exercício\(\PageIndex{1}\)
Resuma brevemente as limitações dos postulados de Koch.
Postulados de Koch Molecular
Em 1988, Stanley Falkow (1934—) propôs uma forma revisada dos postulados de Koch, conhecida como postulados moleculares de Koch. Eles estão listados na coluna esquerda da Tabela\(\PageIndex{1}\). A premissa dos postulados moleculares de Koch não está na capacidade de isolar um patógeno específico, mas sim de identificar um gene que pode fazer com que o organismo seja patogênico.
As modificações de Falkow nos postulados originais de Koch explicam não apenas as infecções causadas por patógenos intracelulares, mas também a existência de cepas patogênicas de organismos que geralmente não são patogênicos. Por exemplo, a forma predominante da bactéria Escherichia coli é membro da microbiota normal do intestino humano e geralmente é considerada inofensiva. No entanto, existem cepas patogênicas de E. coli, como E. coli enterotoxigênica (ETEC) e E. coli enterohemorrágica (O157:H7) (EHEC). Agora sabemos que a ETEC e a EHEC existem devido à aquisição de novos genes pela outrora inofensiva E. coli, que, na forma dessas cepas patogênicas, agora é capaz de produzir toxinas e causar doenças. As formas patogênicas resultaram de pequenas alterações genéticas. A coluna do lado direito da Tabela\(\PageIndex{1}\) ilustra como os postulados moleculares de Koch podem ser aplicados para identificar a EHEC como uma bactéria patogênica.
| Postulados de Koch Molecular | Aplicação ao EHEC |
|---|---|
| (1) O fenótipo (sinal ou sintoma da doença) deve ser associado apenas a cepas patogênicas de uma espécie. | O EHEC causa inflamação intestinal e diarreia, enquanto as cepas não patogênicas de E. coli não. |
| (2) A inativação do (s) gene (s) suspeito (s) associados à patogenicidade deve resultar em uma perda mensurável de patogenicidade. | Um dos genes do EHEC codifica a toxina Shiga, uma toxina bacteriana (veneno) que inibe a síntese de proteínas. A inativação desse gene reduz a capacidade da bactéria de causar doenças. |
| (3) A reversão do gene inativo deve restaurar o fenótipo da doença. | Ao adicionar o gene que codifica a toxina de volta ao genoma (por exemplo, com um fago ou plasmídeo), a capacidade do EHEC de causar doenças é restaurada. |
Assim como os postulados originais de Koch, os postulados moleculares de Koch têm limitações. Por exemplo, a manipulação genética de alguns patógenos não é possível usando os métodos atuais de genética molecular. Da mesma forma, algumas doenças não têm modelos animais adequados, o que limita a utilidade dos postulados originais e moleculares.
Exercício\(\PageIndex{2}\)
Explique as diferenças entre os postulados originais de Koch e os postulados moleculares de Koch.
Patogenicidade e virulência
A capacidade de um agente microbiano de causar doenças é chamada de patogenicidade, e o grau em que um organismo é patogênico é chamado de virulência. A virulência é um continuum. Em uma extremidade do espectro estão organismos que são avirulentos (não prejudiciais) e, na outra, organismos altamente virulentos. Patógenos altamente virulentos quase sempre levam a um estado de doença quando introduzidos no corpo, e alguns podem até causar falhas em vários órgãos e sistemas corporais em indivíduos saudáveis. Patógenos menos virulentos podem causar uma infecção inicial, mas nem sempre podem causar doenças graves. Patógenos com baixa virulência provavelmente resultariam em sinais e sintomas leves da doença, como febre baixa, dor de cabeça ou dores musculares. Alguns indivíduos podem até ser assintomáticos.
Um exemplo de microrganismo altamente virulento é o Bacillus anthracis, o patógeno responsável pelo antraz. B. anthracis pode produzir diferentes formas de doença, dependendo da via de transmissão (por exemplo, injeção cutânea, inalação, ingestão). A forma mais grave de antraz é o antraz por inalação. Depois que os esporos de B. anthracis são inalados, eles germinam. Uma infecção ativa se desenvolve e a bactéria libera toxinas potentes que causam edema (acúmulo de líquido nos tecidos), hipóxia (uma condição que impede que o oxigênio chegue aos tecidos) e necrose (morte celular e inflamação). Os sinais e sintomas da inalação de antraz incluem febre alta, dificuldade em respirar, vômitos e tosse com sangue e fortes dores no peito sugestivas de um ataque cardíaco. Com a inalação do antraz, as toxinas e bactérias entram na corrente sanguínea, o que pode levar à falência de vários órgãos e à morte do paciente. Se um gene (ou genes) envolvido na patogênese for inativado, a bactéria se torna menos virulenta ou não patogênica.
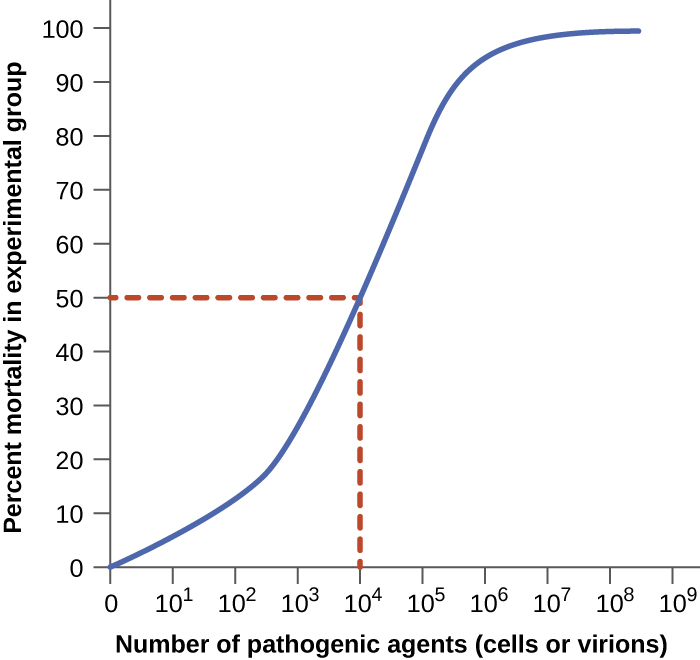
A virulência de um patógeno pode ser quantificada usando experimentos controlados com animais de laboratório. Dois indicadores importantes de virulência são a dose infecciosa mediana (ID 50) e a dose letal mediana (LD 50), ambas normalmente determinadas experimentalmente usando modelos animais. O ID 50 é o número de células ou viriões patogênicos necessários para causar infecção ativa em 50% dos animais inoculados. O LD 50 é o número de células patogênicas, viriões ou quantidade de toxina necessária para matar 50% dos animais infectados. Para calcular esses valores, cada grupo de animais é inoculado com uma variedade de números conhecidos de células ou viriões do patógeno. Em gráficos como o mostrado na Figura\(\PageIndex{2}\), a porcentagem de animais que foram infectados (para ID 50) ou mortos (para LD 50) é plotada em relação à concentração do patógeno inoculado. \(\PageIndex{2}\)A figura representa dados representados graficamente de um experimento hipotético que mede o LD 50 de um patógeno. A interpretação dos dados deste gráfico indica que o LD 50 do patógeno para os animais de teste é de 10 4 células ou viriões do patógeno (dependendo do patógeno estudado).
A tabela\(\PageIndex{2}\) lista patógenos alimentares selecionados e seus valores de ID 50 em humanos (conforme determinado a partir de dados epidemiológicos e estudos em voluntários humanos). Lembre-se de que esses são valores medianos. A dose infecciosa real de um indivíduo pode variar muito, dependendo de fatores como via de entrada; idade, saúde e estado imunológico do hospedeiro; e fatores ambientais e específicos do patógeno, como suscetibilidade ao pH ácido do estômago. Também é importante observar que a dose infecciosa de um patógeno não necessariamente se correlaciona com a gravidade da doença. Por exemplo, apenas uma única célula do sorotipo Typhimurium de Salmonella enterica pode resultar em uma infecção ativa. A doença resultante, gastroenterite por Salmonella ou salmonelose, pode causar náuseas, vômitos e diarreia, mas tem uma taxa de mortalidade inferior a 1% em adultos saudáveis. Em contraste, o sorotipo Typhi de S. enterica tem uma ID 50 muito maior, normalmente exigindo até 1.000 células para produzir infecção. No entanto, esse sorotipo causa febre tifóide, uma doença muito mais sistêmica e grave que tem uma taxa de mortalidade de até 10% em indivíduos não tratados.
| Patógeno | ID 50 |
|---|---|
| Vírus | |
| Vírus da hepatite A | 10—100 |
| Norovírus | 1—10 |
| Rotavírus | 10—100 |
| Bactérias | |
| Escherichia coli enterohemorrágica (EHEC, serotipo O157) | 10—100 |
| E. coli, enteroinvasiva (EIEC) | 200—5.000 |
| E. coli, enteropatogênica (EPEC) | 10.000.000 — 10.000.000.000 |
| E. coli, enterotoxigênica (ETEC) | 10.000.000 — 10.000.000.000 |
| Salmonella enterica sorovar Typhi | <1.000> |
| S. enterica sorovar Typhimurium | ≥1 |
| Shigella dysenteriae | 10—200 |
| Vibrio cholerae (sorotipos O139, O1) | 1.000.000 |
| V. parahemolyticus | 100.000.000 |
| Protozoários | |
| Giardia lamblia | 1 |
| Cryptosporidium parvum | 10—100 |
Exercício\(\PageIndex{3}\)
- Qual é a diferença entre a dose infecciosa de um patógeno e a dose letal?
- O que está mais intimamente relacionado à gravidade de uma doença?
Patógenos primários versus patógenos oportunistas
Os patógenos podem ser classificados como patógenos primários ou patógenos oportunistas. Um patógeno primário pode causar doenças em um hospedeiro, independentemente da microbiota residente do hospedeiro ou do sistema imunológico. Um patógeno oportunista, por outro lado, só pode causar doenças em situações que comprometam as defesas do hospedeiro, como as barreiras protetoras do corpo, o sistema imunológico ou a microbiota normal. Indivíduos suscetíveis a infecções oportunistas incluem pessoas muito jovens, idosos, mulheres grávidas, pacientes submetidos a quimioterapia, pessoas com imunodeficiências (como a síndrome da imunodeficiência adquirida [AIDS]), pacientes que estão se recuperando de uma cirurgia e aqueles que sofreram uma violação de barreiras de proteção (como uma ferida grave ou queimadura).
Um exemplo de patógeno primário é a E. coli enterohemorrágica (EHEC), que produz um fator de virulência conhecido como toxina Shiga. Essa toxina inibe a síntese protéica, levando a diarreia grave e sangrenta, inflamação e insuficiência renal, mesmo em pacientes com sistema imunológico saudável. O Staphylococcus epidermidis, por outro lado, é um patógeno oportunista que está entre as causas mais frequentes de doenças hospitalares. 2 S. epidermidis é um membro da microbiota normal da pele, onde geralmente é avirulento. No entanto, em hospitais, ele também pode crescer em biofilmes que se formam em cateteres, implantes ou outros dispositivos que são inseridos no corpo durante procedimentos cirúrgicos. Uma vez dentro do corpo, o S. epidermidis pode causar infecções graves, como endocardite, e produz fatores de virulência que promovem a persistência dessas infecções.
Outros membros da microbiota normal também podem causar infecções oportunistas sob certas condições. Isso geralmente ocorre quando micróbios que residem inofensivamente em um local do corpo acabam em um sistema corporal diferente, onde causam doenças. Por exemplo, a E. coli normalmente encontrada no intestino grosso pode causar uma infecção do trato urinário se entrar na bexiga. Esta é a principal causa de infecções do trato urinário entre as mulheres.
Membros da microbiota normal também podem causar doenças quando uma mudança no ambiente do corpo leva ao crescimento excessivo de um microrganismo específico. Por exemplo, a levedura Candida faz parte da microbiota normal da pele, boca, intestino e vagina, mas sua população é controlada por outros organismos da microbiota. Se um indivíduo estiver tomando medicamentos antibacterianos, no entanto, bactérias que normalmente inibiriam o crescimento de Candida podem ser eliminadas, levando a um crescimento repentino na população de Candida, que não é afetada por medicamentos antibacterianos porque é um fungo. O crescimento excessivo de Candida pode se manifestar como candidíase oral (crescimento na boca, garganta e língua), infecção vaginal por fungos ou candidíase cutânea. Outros cenários também podem oferecer oportunidades para infecções por Candida. O diabetes não tratado pode resultar em uma alta concentração de glicose na saliva, o que proporciona um ambiente ideal para o crescimento da Candida, resultando em aftas. Imunodeficiências, como as observadas em pacientes com HIV, AIDS e câncer, também levam a uma maior incidência de candidíase. As infecções vaginais por fungos podem resultar da diminuição dos níveis de estrogênio durante a menstruação ou a menopausa. A quantidade de glicogênio disponível para os lactobacilos na vagina é controlada pelos níveis de estrogênio; quando os níveis de estrogênio estão baixos, os lactobacilos produzem menos ácido lático. O aumento resultante no pH vaginal permite o crescimento excessivo de Candida na vagina.
Exercício\(\PageIndex{4}\)
- Explique a diferença entre um patógeno primário e um patógeno oportunista.
- Descreva algumas condições nas quais uma infecção oportunista pode ocorrer.
Estágios da patogênese
Para causar doenças, um patógeno deve atingir com sucesso quatro etapas ou estágios da patogênese: exposição (contato), adesão (colonização), invasão e infecção. O patógeno deve ser capaz de entrar no hospedeiro, viajar até o local onde possa estabelecer uma infecção, evitar ou superar a resposta imune do hospedeiro e causar danos (ou seja, doenças) ao hospedeiro. Em muitos casos, o ciclo é concluído quando o patógeno sai do hospedeiro e é transmitido para um novo hospedeiro.
Exposição
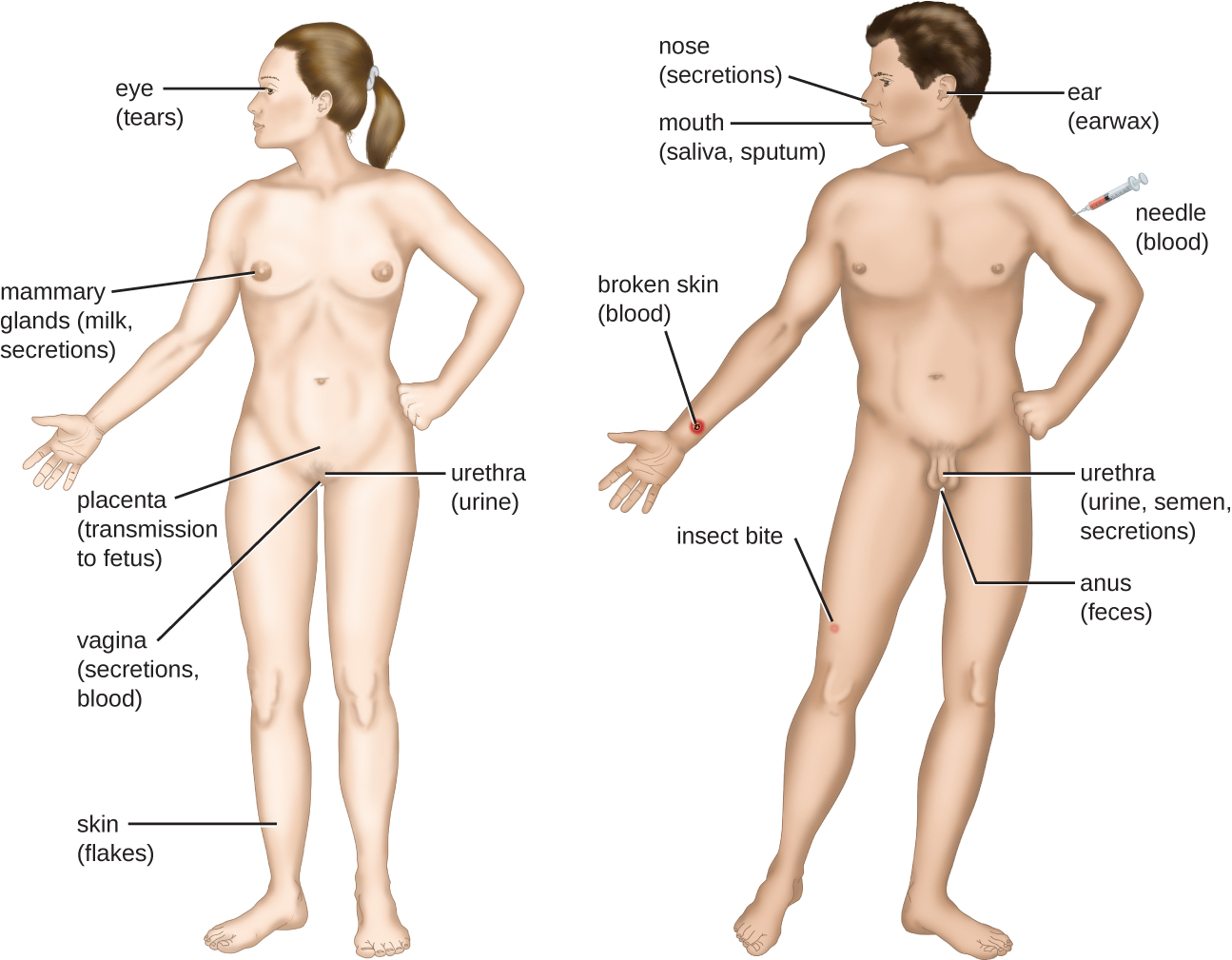
Um encontro com um patógeno em potencial é conhecido como exposição ou contato. A comida que comemos e os objetos que manipulamos são todas formas de entrarmos em contato com possíveis patógenos. No entanto, nem todos os contatos resultam em infecções e doenças. Para que um patógeno cause doenças, ele precisa ser capaz de obter acesso ao tecido hospedeiro. Um sítio anatômico pelo qual patógenos podem passar para o tecido hospedeiro é chamado de portal de entrada. Esses são locais onde as células hospedeiras estão em contato direto com o ambiente externo. Os principais portais de entrada estão identificados na Figura\(\PageIndex{3}\) e incluem a pele, as membranas mucosas e as vias parenterais.
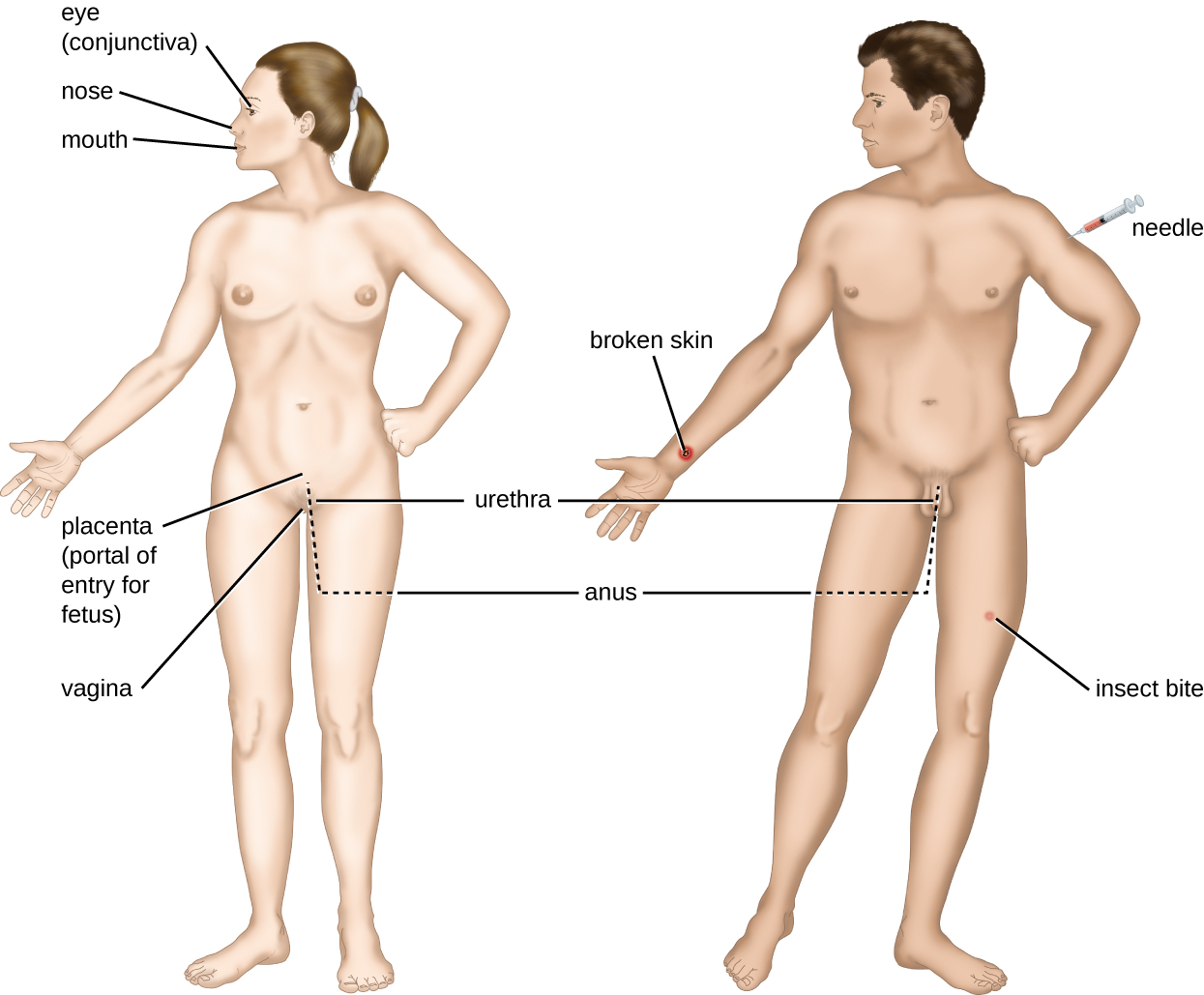
As superfícies mucosas são os portais de entrada mais importantes para micróbios; incluem as membranas mucosas do trato respiratório, o trato gastrointestinal e o trato geniturinário. Embora a maioria das superfícies mucosas esteja no interior do corpo, algumas são contíguas à pele externa em várias aberturas do corpo, incluindo olhos, nariz, boca, uretra e ânus.
A maioria dos patógenos é adequada para um portal de entrada específico. A especificidade portal de um patógeno é determinada pelas adaptações ambientais do organismo e pelas enzimas e toxinas que ele secreta. Os tratos respiratório e gastrointestinal são portais de entrada particularmente vulneráveis porque partículas que incluem microrganismos são constantemente inaladas ou ingeridas, respectivamente.
Os patógenos também podem entrar por meio de uma brecha nas barreiras protetoras da pele e das membranas mucosas. Diz-se que os patógenos que entram no corpo dessa maneira entram pela via parenteral. Por exemplo, a pele é uma boa barreira natural contra patógenos, mas rachaduras na pele (por exemplo, feridas, picadas de insetos, mordidas de animais, picadas de agulhas) podem fornecer um portal parenteral de entrada para microrganismos.
Em mulheres grávidas, a placenta normalmente impede que os microrganismos passem da mãe para o feto. No entanto, alguns patógenos são capazes de atravessar a barreira hematoplacentária. A bactéria gram-positiva Listeria monocytogenes, que causa a listeriose da doença alimentar, é um exemplo que representa um sério risco para o feto e às vezes pode levar ao aborto espontâneo. Outros patógenos que podem passar pela barreira placentária para infectar o feto são conhecidos coletivamente pela sigla TORCH (Tabela\(\PageIndex{3}\)).
A transmissão de doenças infecciosas da mãe para o bebê também é uma preocupação no momento do nascimento, quando o bebê passa pelo canal do parto. Bebês cujas mães têm infecções ativas por clamídia ou gonorréia podem ser expostos aos patógenos causadores da vagina, o que pode resultar em infecções oculares que levam à cegueira. Para evitar isso, é prática padrão administrar gotas de antibióticos nos olhos dos bebês logo após o nascimento.
| Doença | Patógeno | |
|---|---|---|
| T | Toxoplasmose | Toxoplasma gondii (protozoário) |
| OU 3 |
Sífilis Varicela Hepatite B HIV Quinta doença (eritema infeccioso) |
Treponema pallidum (bactéria) Vírus da varicela-zoster (herpesvírus humano 3) Vírus da hepatite B (hepadnavírus) Retrovírus Parvovírus B19 |
| R | Rubéola (sarampo alemão) | Togavírus |
| C | Citomegalovírus | Herpesvírus humano 5 |
| H | Herpes | Vírus herpes simplex (HSV) 1 e 2 |
Foco clínico: Parte 2
Na clínica, um médico anota o histórico médico de Michael e pergunta sobre suas atividades e dieta na semana passada. Ao saber que Michael ficou doente no dia seguinte à festa, o médico pede um exame de sangue para verificar a presença de patógenos associados a doenças transmitidas por alimentos. Depois que os testes confirmam a presença de um bastonete gram-positivo no sangue de Michael, ele recebe uma injeção de um antibiótico de amplo espectro e é enviado para um hospital próximo, onde é internado como paciente. Lá, ele receberá antibioticoterapia e fluidos intravenosos adicionais.
Exercício\(\PageIndex{5}\)
- Essa bactéria no sangue de Michael faz parte da microbiota normal?
- Qual portal de entrada a bactéria usou para causar essa infecção?
Adesão
Após a exposição inicial, o patógeno adere no portal de entrada. O termo adesão se refere à capacidade dos micróbios patogênicos de se fixarem às células do corpo por meio de fatores de adesão, e diferentes patógenos usam vários mecanismos para aderir às células dos tecidos hospedeiros.
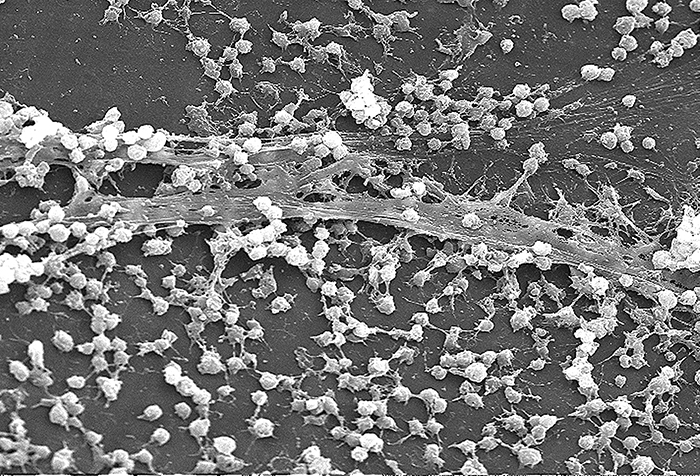
Moléculas (proteínas ou carboidratos) chamadas adesinas são encontradas na superfície de certos patógenos e se ligam a receptores específicos (glicoproteínas) nas células hospedeiras. As adesinas estão presentes nas fímbrias e nos flagelos das bactérias, nos cílios dos protozoários e nos capsídeos ou membranas dos vírus. Os protozoários também podem usar ganchos e farpas para adesão; proteínas de pico nos vírus também aumentam a adesão viral. A produção de glicocálicos (camadas e cápsulas de limo) (Figura\(\PageIndex{4}\)), com seu alto teor de açúcar e proteína, também pode permitir que certos patógenos bacterianos se fixem às células.
O crescimento do biofilme também pode atuar como um fator de adesão. Um biofilme é uma comunidade de bactérias que produz um glicocálix, conhecido como substância extrapolimérica (EPS), que permite que o biofilme se fixe em uma superfície. Infecções persistentes por Pseudomonas aeruginosa são comuns em pacientes que sofrem de fibrose cística, queimaduras e infecções do ouvido médio (otite média) porque a P. aeruginosa produz um biofilme. O EPS permite que a bactéria adira às células hospedeiras e dificulta a remoção física do patógeno pelo hospedeiro. O EPS não só permite a fixação, mas fornece proteção contra o sistema imunológico e tratamentos com antibióticos, evitando que os antibióticos cheguem às células bacterianas dentro do biofilme. Além disso, nem todas as bactérias em um biofilme estão crescendo rapidamente; algumas estão em fase estacionária. Como os antibióticos são mais eficazes contra bactérias de crescimento rápido, porções de bactérias em um biofilme são protegidas contra antibióticos. 4
Invasão
Uma vez que a adesão seja bem-sucedida, a invasão pode prosseguir. A invasão envolve a disseminação de um patógeno pelos tecidos locais ou pelo corpo. Os patógenos podem produzir exoenzimas ou toxinas, que servem como fatores de virulência que lhes permitem colonizar e danificar os tecidos do hospedeiro à medida que se espalham mais profundamente no corpo. Os patógenos também podem produzir fatores de virulência que os protegem contra as defesas do sistema imunológico. Os fatores de virulência específicos de um patógeno determinam o grau de dano tecidual que ocorre. A figura\(\PageIndex{5}\) mostra a invasão do H. pylori nos tecidos do estômago, causando danos à medida que progride.
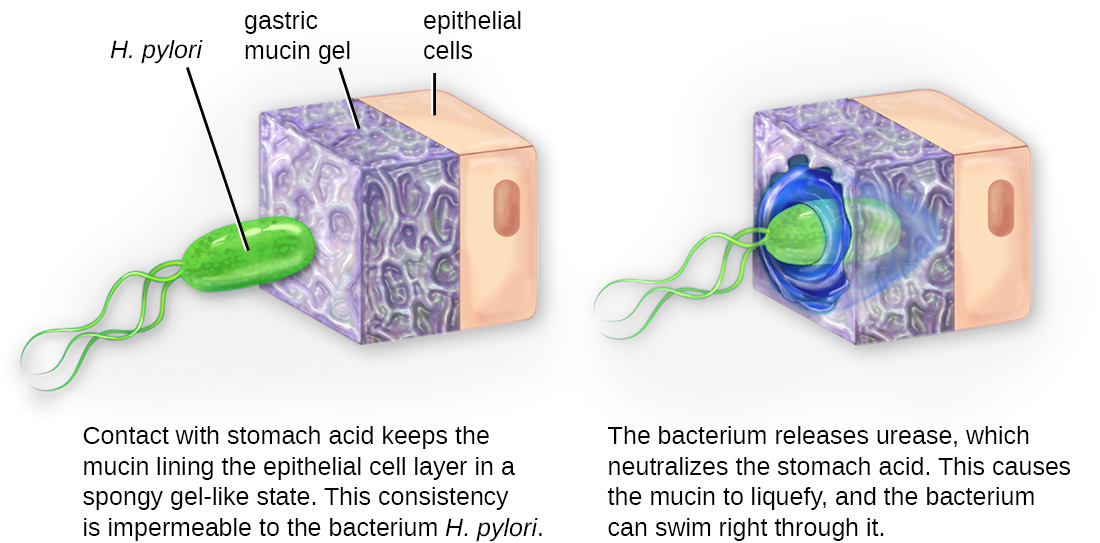
Os patógenos intracelulares atingem a invasão entrando nas células do hospedeiro e se reproduzindo. Alguns são patógenos intracelulares obrigatórios (o que significa que eles só podem se reproduzir dentro das células hospedeiras) e outros são patógenos intracelulares facultativos (o que significa que eles podem se reproduzir dentro ou fora das células hospedeiras). Ao entrar nas células hospedeiras, os patógenos intracelulares são capazes de evitar alguns mecanismos do sistema imunológico e, ao mesmo tempo, explorar os nutrientes da célula hospedeira.
A entrada em uma célula pode ocorrer por endocitose. Para a maioria dos tipos de células hospedeiras, os patógenos usam um dos dois mecanismos diferentes de endocitose e entrada. Um mecanismo depende de proteínas efetoras secretadas pelo patógeno; essas proteínas efetoras desencadeiam a entrada na célula hospedeira. Esse é o método que Salmonella e Shigella usam ao invadir as células epiteliais intestinais. Quando esses patógenos entram em contato com as células epiteliais do intestino, eles secretam moléculas efetoras que causam protrusões de babados de membrana que trazem a célula bacteriana para dentro. Esse processo é chamado de ruffling de membrana. O segundo mecanismo depende de proteínas de superfície expressas no patógeno que se ligam aos receptores na célula hospedeira, resultando na entrada. Por exemplo, a Yersinia pseudotuberculosis produz uma proteína de superfície conhecida como invasina que se liga às integrinas beta-1 expressas na superfície das células hospedeiras.
Algumas células hospedeiras, como glóbulos brancos e outros fagócitos do sistema imunológico, endocitam ativamente os patógenos em um processo chamado fagocitose. Embora a fagocitose permita que o patógeno entre na célula hospedeira, na maioria dos casos, a célula hospedeira mata e degrada o patógeno usando enzimas digestivas. Normalmente, quando um patógeno é ingerido por um fagócito, ele é encerrado em um fagossomo no citoplasma; o fagossomo se funde com um lisossomo para formar um fagolisossomo, onde as enzimas digestivas matam o patógeno (veja Reconhecimento de Patógenos e Fagocitose). No entanto, alguns patógenos intracelulares têm a capacidade de sobreviver e se multiplicar dentro dos fagócitos. Exemplos incluem Listeria monocytogenes e Shigella; essas bactérias produzem proteínas que lisam o fagossomo antes que ele se funda com o lisossomo, permitindo que a bactéria escape para o citoplasma do fagócito, onde pode se multiplicar. Bactérias como Mycobacterium tuberculosis, Legionella pneumophila e espécies de Salmonella usam um mecanismo ligeiramente diferente para evitar serem digeridas pelo fagócito. Essas bactérias impedem a fusão do fagossomo com o lisossomo, permanecendo vivas e se dividindo dentro do fagossomo.
Infecção
Após a invasão, a multiplicação bem-sucedida do patógeno leva à infecção. As infecções podem ser descritas como locais, focais ou sistêmicas, dependendo da extensão da infecção. Uma infecção local está confinada a uma pequena área do corpo, normalmente perto do portal de entrada. Por exemplo, um folículo piloso infectado pela infecção por Staphylococcus aureus pode resultar em um furúnculo ao redor do local da infecção, mas a bactéria está amplamente contida nesse pequeno local. Outros exemplos de infecções locais que envolvem um envolvimento tecidual mais extenso incluem infecções do trato urinário confinadas à bexiga ou pneumonia confinada aos pulmões.
Em uma infecção focal, um patógeno localizado, ou as toxinas que ele produz, podem se espalhar para um local secundário. Por exemplo, um higienista dental cortando a gengiva com uma ferramenta afiada pode causar uma infecção local na gengiva pela bactéria Streptococcus da microbiota oral normal. Esses Streptococcus spp. podem então obter acesso à corrente sanguínea e chegar a outros locais do corpo, resultando em uma infecção secundária.
Quando uma infecção se dissemina por todo o corpo, nós a chamamos de infecção sistêmica. Por exemplo, a infecção pelo vírus varicela-zoster normalmente entra por uma membrana mucosa do sistema respiratório superior. Em seguida, ele se espalha por todo o corpo, resultando nas clássicas lesões cutâneas vermelhas associadas à varicela. Como essas lesões não são locais de infecção inicial, são sinais de infecção sistêmica.
Às vezes, uma infecção primária, a infecção inicial causada por um patógeno, pode levar a uma infecção secundária por outro patógeno. Por exemplo, o sistema imunológico de um paciente com infecção primária pelo HIV fica comprometido, tornando o paciente mais suscetível a doenças secundárias, como candidíase oral e outras causadas por patógenos oportunistas. Da mesma forma, uma infecção primária pelo Influenzavirus danifica e diminui os mecanismos de defesa dos pulmões, tornando os pacientes mais suscetíveis a uma pneumonia secundária por um patógeno bacteriano como Haemophilus influenzae ou Streptococcus pneumoniae. Algumas infecções secundárias podem até se desenvolver como resultado do tratamento de uma infecção primária. A antibioticoterapia direcionada ao patógeno primário pode causar danos colaterais à microbiota normal, criando uma abertura para patógenos oportunistas (veja Caso em questão: Uma infecção secundária por levedura abaixo).
Uma infecção secundária por fungos
Anita, 36 anos, mãe de três filhos, vai a um centro de atendimento de urgência com queixa de pressão pélvica, micção frequente e dolorosa, cólicas abdominais e, ocasionalmente, urina tingida de sangue. Suspeitando de uma infecção do trato urinário (ITU), o médico solicita uma amostra de urina e a envia ao laboratório para um exame de urina. Como serão necessárias aproximadamente 24 horas para obter os resultados da cultura, o médico imediatamente inicia Anita com o antibiótico ciprofloxacina. No dia seguinte, o laboratório de microbiologia confirma a presença de E. coli na urina de Anita, o que é consistente com o diagnóstico presuntivo. No entanto, o teste de suscetibilidade antimicrobiana indica que a ciprofloxacina não trataria eficazmente a ITU de Anita, então o médico prescreve um antibiótico diferente.
Depois de tomar seus antibióticos por 1 semana, Anita retorna à clínica reclamando que a receita não está funcionando. Embora a dor ao urinar tenha diminuído, ela agora está sentindo coceira, queimação e corrimento vaginais. Após um breve exame, o médico explica a Anita que os antibióticos provavelmente tiveram sucesso em matar a E. coli responsável por sua ITU; no entanto, no processo, eles também eliminaram muitas das bactérias “boas” da microbiota normal de Anita. Os novos sintomas relatados por Anita são consistentes com uma infecção secundária por leveduras por Candida albicans, um fungo oportunista que normalmente reside na vagina, mas é inibido pelas bactérias que normalmente residem no mesmo ambiente.
Para confirmar esse diagnóstico, uma lâmina microscópica de um esfregaço vaginal direto é preparada a partir do corrimento para verificar a presença de fermento. Uma amostra da secreção acompanha este slide até o laboratório de microbiologia para determinar se houve um aumento na população de leveduras causadoras de vaginite. Depois que o laboratório de microbiologia confirma o diagnóstico, o médico prescreve um medicamento antifúngico para Anita usar para eliminar sua infecção secundária por fungos.
Exercício\(\PageIndex{6}\)
- Por que a Candida não foi morta pelos antibióticos prescritos para a UTI?
- Liste três condições que podem levar a uma infecção secundária.
Transmissão da doença
Para que um patógeno persista, ele deve se colocar em posição de ser transmitido a um novo hospedeiro, deixando o hospedeiro infectado por um portal de saída (Figura\(\PageIndex{6}\)). Assim como nos portais de entrada, muitos patógenos são adaptados para usar um portal de saída específico. Semelhantes aos portais de entrada, os portais de saída mais comuns incluem a pele e os tratos respiratório, urogenital e gastrointestinal. Tossir e espirrar podem expulsar patógenos do trato respiratório. Um único espirro pode enviar milhares de partículas de vírus para o ar. As secreções e excreções podem transportar patógenos para fora de outros portais de saída. Fezes, urina, sêmen, secreções vaginais, lágrimas, suor e células da pele eliminadas podem servir como veículos para um patógeno deixar o corpo. Patógenos que dependem de insetos vetores para transmissão saem do corpo pelo sangue extraído por um inseto picador. Da mesma forma, alguns patógenos saem do corpo no sangue extraído por agulhas.
Conceitos principais e resumo
- Os postulados de Koch são usados para determinar se um determinado microrganismo é um patógeno. Os postulados moleculares de Koch são usados para determinar quais genes contribuem para a capacidade do patógeno de causar doenças.
- A virulência, o grau em que um patógeno pode causar doenças, pode ser quantificada calculando o ID 50 ou o LD 50 de um patógeno em uma determinada população.
- Os patógenos primários são capazes de causar alterações patológicas associadas à doença em um indivíduo saudável, enquanto os patógenos oportunistas só podem causar doenças quando o indivíduo é comprometido por uma quebra nas barreiras de proteção ou imunossupressão.
- Infecções e doenças podem ser causadas por patógenos no meio ambiente ou micróbios na microbiota residente de um indivíduo.
- As infecções podem ser classificadas como locais, focais ou sistêmicas, dependendo da extensão em que o patógeno se espalha no corpo.
- Às vezes, uma infecção secundária pode ocorrer depois que as defesas do hospedeiro ou a microbiota normal são comprometidas por uma infecção primária ou tratamento com antibióticos.
- Os patógenos entram no corpo pelos portais de entrada e saem pelos portais de saída. Os estágios da patogênese incluem exposição, adesão, invasão, infecção e transmissão.
Notas de pé
- 1 Administração de Alimentos e Medicamentos. “Livro de insetos ruins, microrganismos patogênicos transmitidos por alimentos e toxinas naturais”. 2ª ed. Silver Spring, MD: Administração de Alimentos e Medicamentos dos EUA; 2012.
- 2 Sr. Otto. “Staphylococcus epidermidis — O patógeno 'acidental'.” Nature Reviews Microbiology 7 no. 8 (2009) :555—567.
- 3 O O em TORCH significa “outro”.
- 4 D. Davies. “Compreendendo a resistência do biofilme a agentes antibacterianos”. Nature Reviews Drug Discovery 2 (2003) :114—122.


